抗-CD33和抗-CD7组合治疗的制作方法
本发明涉及在恶性血液肿瘤的治疗中将细胞抑制剂双重靶向细胞表面受体cd7和cd33。
背景技术:
急性骨髓性白血病或急性髓性白血病(aml)是涉及骨髓和外周血中的成髓细胞的克隆扩增的异质性恶性血液肿瘤。aml占成人急性白血病病例的>90%并且依然是具有暴发性临床过程的主要侵略性疾病。虽然在治疗方案和当前对成功的造血干细胞移植(hsct)的理解方面有进展,患有aml的患者的死亡率仍较高。在所有被诊断患有aml的成人中,平均仅四分之一将存活5年以上。在年龄超过65岁的人中,预期进一步降低至仅12%存活超过5年(www.cancerresearchuk.org)。这极大地低于在过去数十年接收到高得多的投资的许多其他高发病癌症,如乳腺癌、前列腺癌和肠癌,其中5年存活率现在分别为87%、85%、59%(www.cancerresearchuk.org)。这凸显了在aml中未满足的需求的程度以及将更多投资投资到新疗法中的迫切动机。
目前的指南推荐aml的加强治疗由以下组成:诱导化疗(包括蒽环霉素与阿糖孢苷的组合),在患者达到临床和血液学缓解后继之以巩固治疗。诱导疗法的支柱由‘7+3’或类似的‘10+3’方案组成,其结合了7或10天的连续输注阿糖孢苷及3天的蒽环霉素。其通常在中等至有利的预后及治疗相关致死率低的情况下被提供给患者。不幸的是,在完全缓解(cr)中最低残存疾病通常持续存在,并且如果停止治疗则复发几乎是不可避免的。因此,任何对诱导疗法具有有利应答的患者应当接受第二诱导方案或继续接受巩固疗法以实现持续的缓解。
蒽环霉素和阿糖孢苷属于抗代谢类的强效细胞毒性药物并且常被用于化疗方案中因为其通过抑制dna复制靶向具有高的增殖指数(pi)的细胞。致衰性副作用是这些药物的常见现象,因为它们对恶性肿瘤细胞的选择性不足,因此对同样具有很高pi的健康组织显示出明显伤害。常见的副作用包括与高风险的危及生命的感染相关的骨髓抑制、恶心和呕吐、脱发、瘀伤和出血并发症以及肿瘤溶解综合征(www.macmillan.org.uk)。与这些药物相关的毒性程度需要在地区专科医院的感染控制病房内住院治疗。患者必须平均住院4-5周,直到在一个治疗周期后骨髓完全恢复。许多患者,甚至是年轻的患者,都无法在第一个强化治疗疗程中存活下来。
异体造血干细胞移植(hsct),虽然目前是这种疾病背景下唯一的治愈选择,但仍被认为是许多疾病适应症的最后手段,因为与这种治疗相关的死亡和发病风险高,与治疗有关的死亡率往往高达40%。这种治疗选择依赖于可获得合适的供体,在那些找到供体并挺过手术的患者中,30%-45%的患者将继续复发,许多患者需要再次移植。
>60岁的老年患者群体的治疗选择很少,最佳方法尚未确定。细胞遗传学不利的老年患者响应化疗的可能性较小,并且通常更容易出现治疗相关的毒性。低甲基化药物,如阿扎胞苷,最初用于治疗骨髓增生异常综合征(mds),最近显示出对老年患者有一定的益处,包括将他们衔接到诱导化疗中以达到cr(dekouchkovsky,&abdul-hay,m.(2016)‘acutemyeloidleukemia:acomprehensivereviewand2016update’.bloodcancerjournal,61-10)。
aml是一种难以治疗的疾病,因为许多拟用于靶向治疗的肿瘤抗原对恶性细胞群是非特异性的。aml中所指的传统治疗方法旨在靶向成白血病细胞表面表达的单一抗原。虽然这些治疗方法被认为是“靶向疗法”,但它们所靶向的抗原在健康的免疫系统所必需的一系列健康的造血细胞上也以高水平表达。这些疗法显示的对健康细胞的这种程度的中靶组织外毒性(on-targetoff-tissuetoxicity),大大限制了其在疾病背景下的效用。这往往导致临床医生别无选择,而只能对患者施用次优剂量,且相当多的患者仅因治疗而死亡。
cd33是一种在此背景下已经被广泛研究的aml抗原并且是一种成熟的、经过验证的aml靶点,其还是许多现有的和新型疗法的抗原选项。此外,cd33也已被证明是一个经过验证的adc靶抗原,显示出足够的抗原密度和内化。这一点通过2000年推出的adc上市治疗药物mylotarg可以看出,这种adc靶向aml中的cd33抗原。
虽然cd33因此抗原在aml细胞上的广泛表达及在早期cd34+造血干细胞上的被感知的表达减少而成为许多aml药物开发者的优选靶点,但cd33抗原也是健康细胞群中普遍存在的骨髓标志物。因此,正如任何cd33靶向治疗所预期的那样,靶向该抗原的疗法也会对健康细胞群产生许多脱靶效应,导致任何藏有该抗原的骨髓细胞的显著消耗。这些细胞是健康的免疫系统所需要的,因此消耗使患者需要在专门的感染控制室住院治疗,极易发生危及生命的感染。与此相相符的是,著名的adc制药公司seattlegenetics,在2017年6月宣布,在三期试验中看到与安慰剂相比较高的患者死亡率(包括致命的感染)后,他们已经停止了所有涉及其临床候选药物sgn-cd33a(一种靶向cd33的adc)的试验(fiercebiotech.com)。
cd7是一种通常与胸腺细胞和成熟t细胞相关的抗原并被认为在早期淋巴细胞发育中在t细胞相互作用和t/b细胞相互作用中起重要作用。这种抗原目前并不代表治疗开发中常见的靶向抗原,可能是由于此抗原在健康t细胞群上大量表达。
自20世纪80年代末以来,很明显,某些aml细胞群以这种疾病特异性方式表达cd7,一种另外的淋巴限制性抗原。若干团队已经报道了这种抗原在aml中的表达,并提出在10%-38%的aml病例中发现这种抗原在aml中的表达(poeta,g.d.等(1995)cd7expressioninacutemyeloidleukemia.leuk.lymphoma,17,111-119;rohrs,s.等(2010)cd7inacutemyeloidleukemia:correlationwithlossofwild-typecebpa,consequenceofepigeneticregulation,journalofhematology&oncology,31-7;rausei-mills,v.等(2008)aberrantexpressionofcd7inmyeloblastsishighlyassociatedwithdenovoacutemyeloidleukemiaswithflt3/itdmutation,amjclinpathol,129624-629;shimamoto,t.等(1994)clinicalandbiologicalcharacteristicofcd7+acutemyeloidleukaemia,cancergenetcytogenet7369-74;reading,c.l.等(1993)expressionofunusualimmunophenotypecombinationsinacutemyelogenousleukemia,blood813083-3090;ossenkoppele,g.j.,etal(2011)reviewoftherelevanceofaberrantantigenexpressionbyflowcytometryinmyeloidneoplasmsbritishjournalofhaematology;lococo,f.等(1989)cd7positiveacutemyeloidleukaemia:asubtypeassociatedwithcellimmaturity,britishjournalofhaematology73480-485;kita,k.等(1983)clinicalimportanceofcd7expressioninacutemyelocyticleukemia,blood81,2399-2405;eto,t.等(1992)biologicalcharacteristicsofcd7positiveacutemyelogenousleukaemia,britishlournalolhaernatology82508-511;chang,h.(2004)prognosticrelevanceofimmunophenotypingin379patientswithacutemyeloidleukemia,leukemiaresearch2843–48)并且这种抗原在aml中的表达与较差的结果相关联。
aml的cd7+亚型与提高的白细胞增多、化疗反应差、总体和无病生存率低有关(kahl,c.等(2001)cd7+andcd56+acutemyelogenousleukemiaisadistinctbiologicandclinicaldiseaseentity.haematologyandbloodtransfusion,40112-119)。临床上,cd7+aml患者年龄较小,男性较多,中枢神经系统受累的发生率较高,且常与分化较差的aml亚型相关,与较差的结果进一步相关(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。cd7+aml细胞的不成熟性进一步得到了cd34在该群体中高表达的支持。poeta等人1995年的一项研究发现,cd7+白血病患者的cr明显低于cd7-表型的患者(32%对74%),这说明对于标准护理下该亚型的复发和/或难治性的程度(poeta,g.d.等(1995)cd7expressioninacutemyeloidleukemia.leuk.lymphoma,17,111-119)。
cd7与flt3-itd+aml亚组密切相关,并被认为是flt3-itd+aml亚组的标志。由于发出信号下调凋亡蛋白的翻译的flt3酪氨酸激酶受体的失调,该亚型与较差的临床结果相关。因此,该受体的失调诱导aml细胞群对化疗诱导的细胞死亡的产生抗性(rausei-mills,v.等(2008)aberrantexpressionofcd7inmyeloblastsishighlyassociatedwithdenovoacutemyeloidleukemiaswithflt3/itdmutation,amjclinpathol,129624-629)。作为aml中预后特别差的亚型,flt3aml亚组是新药研发者所针对的理想的疾病类别,许多新的治疗药物,包括激酶抑制剂和单特异性adc都特异性针对该群体。
已经描述了几种机制来解释cd7在aml中的异常表达。这些包括白血病细胞中疾病特异性的不规律基因表达(谱系失真)、能够进行淋巴和骨髓分化或增殖的多能祖细胞的恶性转化,以及在正常细胞分化过程中可能瞬时表达不同细胞系标志物的罕见祖细胞的成熟停止(谱系混杂)(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。
据报道,在早期祖细胞的一个亚组中,瞬时cd7表达能够产生骨髓和淋巴来源的细胞,但在成熟的骨髓转化过程中消失(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。与此相符的是,一项研究发现已在某些健康造血干细胞的亚组上鉴定出这两种抗原的最小和瞬时共表达,所述亚组包括多能干细胞(cd33低/cd7+/-),一些髓性祖细胞(cd33高/cd7+/-)和一些t淋巴祖细胞(cd33+/-/cd7中),而共表达在发育过程中丧失(barcena,a.等(1994)tracingtheexpressionofcd7andotherantigensduringt-andmyeloid-celldifferentiationinthehumanfetalliverandthymus,leukaemiaandlymphoma171-11)。因此看似可能的是,这种共表达模式可能是祖细胞的某亚组的克隆扩张的结果,在发育的特定阶段被捕获由此使这两种抗原瞬时出现在一起,并且在恶性转化过程中共表达被放大。
虽然在某些祖细胞亚组中这两种抗原的一定程度的瞬时共表达可能是明显的,但显然每种抗原的表达程度皆为低至阴性。cd33和cd7在早期造血发育的任何阶段都没有表现出高水平的共表达,在早期祖细胞的选定的小亚群上的表达受限,这没有在整个祖细胞池中反映出来。
因此,仍然需要特异性提高的用于治疗包括aml在内的恶性血液肿瘤的更有效的疗法。
技术实现要素:
在第一方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的结合cd33的细胞抑制剂,其中:所述结合cd33的细胞抑制剂用于与结合cd7的细胞抑制剂组合施用;或其中所述结合cd33的细胞抑制剂还结合cd7。
在一个相关方面,本发明提供治疗有此需要的个体的cd7+cd33+恶性血液肿瘤的方法,其中所述方法包括向个体施用结合cd33的细胞抑制剂,其中:所述结合cd33的细胞抑制剂用于与结合cd7的细胞抑制剂组合施用;或其中所述结合cd33的细胞抑制剂还结合cd7。优选的是所述细胞抑制剂是人工生产的。
在另一个相关方面,本发明提供结合cd33的细胞抑制剂,其用于制备用于治疗cd7+cd33+恶性血液肿瘤的药物,其中:所述结合cd33的细胞抑制剂用于与结合cd7的细胞抑制剂组合施用;或其中所述结合cd33的细胞抑制剂还结合cd7。
在一个实施方案中,所述结合cd33的细胞抑制剂能够诱导cd33受体介导的所述第一细胞抑制剂到cd33+细胞中的内化,任选地其中所述cd33+细胞是aml细胞。
所述结合cd33的细胞抑制剂可以特异性结合cd33。
在一个实施方案中,所述细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd33抗体或其抗原结合部分。如果所述细胞抑制剂是抗-cd33抗体,则此种抗体可以是全长抗体。
在一个实施方案中,所述细胞抑制剂是抗-cd33car-t。所述细胞抑制剂可以包含免疫效应细胞。所述免疫效应细胞可以包含t细胞和/或nk细胞。所述免疫效应细胞是t细胞。所述t细胞可以包含cd33+t细胞。
在一个实施方案中,所述细胞抑制剂包含细胞杀伤部分和cd33结合部分。任选地,所述cd33结合部分包含抗体或其抗原结合片段。任选地所述细胞杀伤部分是细胞毒素。所述细胞毒素可以选自:i)肽毒素或ii)化学毒素。任选地,所述细胞抑制剂还包含连接部分。所述连接部分将优选地在细胞杀伤部分和cd33结合部分之间。
在另一个方面,本发明提供结合cd7的细胞抑制剂,其用于治疗cd7+cd33+恶性血液肿瘤,其中:所述结合cd7的细胞抑制剂用于与特异性结合cd33的细胞抑制剂组合施用;或其中所述结合cd7的抑制剂还结合cd33。
在一个相关方面,本发明提供治疗有此治疗需要的个体的cd7+cd33+恶性血液肿瘤的方法,其中所述方法包括施用:结合cd7的细胞抑制剂用于与特异性结合cd33的细胞抑制剂组合施用;或结合cd7的细胞抑制剂还结合cd33。优选的是所述细胞抑制剂是人工生产的。
在另一个相关方面,本发明提供结合cd7的细胞抑制剂,其用于制备用于治疗cd7+cd33+恶性血液肿瘤的药物,其中:所述结合cd7的细胞抑制剂用于与特异性结合cd33的细胞抑制剂组合施用;或其中所述结合cd7的抑制剂还结合cd33。
在一个实施方案中,所述结合cd7的细胞抑制剂能够诱导cd7受体介导的所述第一细胞抑制剂到cd7+细胞中的内化,任选地其中所述cd7+细胞是aml细胞。
所述结合cd7的细胞抑制剂可以特异性结合cd7。
在一个实施方案中,所述细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd7抗体或其抗原结合部分。如果所述细胞抑制剂是抗-cd7抗体,则此种抗体可以是全长抗体。
在一个实施方案中,所述细胞抑制剂是抗-cd7car-t。所述细胞抑制剂可以包含免疫效应细胞。所述免疫效应细胞可以包含t细胞和/或nk细胞。所述免疫效应细胞是t细胞。所述t细胞可以包含cd7+t细胞。
在一个实施方案中,所述细胞抑制剂包含细胞杀伤部分和cd7结合部分。任选地,所述cd7结合部分包含抗体或其抗原结合片段。任选地,所述细胞杀伤部分是细胞毒素。所述细胞毒素可以选自:i)肽毒素或ii)化学毒素。任选地,所述细胞抑制剂还包含连接部分.所述连接部分将优选地在细胞杀伤部分和cd7结合部分之间。
在另一个方面,本发明提供结合cd33的细胞抑制剂和结合cd7的细胞抑制剂的组合,其用于治疗cd7+cd33+恶性血液肿瘤。
在一个相关方面,本发明提供在治疗有此治疗需要的个体的cd7+cd33+恶性血液肿瘤的方法,所述方法包括施用结合cd33的细胞抑制剂和结合cd7的细胞抑制剂的组合。优选的是所述细胞抑制剂是人工生产的。
在另一个相关方面,本发明提供结合cd33的细胞抑制剂和结合cd7的细胞抑制剂的组合,其用于制备用于治疗cd7+cd33+恶性血液肿瘤的药物。
在一个实施方案中,所述结合cd33的细胞抑制剂能够诱导cd33受体介导的所述第一细胞抑制剂到cd33+细胞中的内化,任选地其中所述cd33+细胞是aml细胞。
在所述组合中,所述结合cd33的细胞抑制剂可以特异性结合cd33。
在一个实施方案中,所述结合cd33的细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd33抗体或其抗原结合部分。如果所述细胞抑制剂是抗-cd33抗体,则此种抗体可以是全长抗体。
在一个实施方案中,所述结合cd33的细胞抑制剂是抗-cd33car-t。所述细胞抑制剂可以包含免疫效应细胞。所述免疫效应细胞可以包含t细胞和/或nk细胞。所述免疫效应细胞是t细胞。所述t细胞可以包含cd33+t细胞。
在一个实施方案中,所述结合cd33的细胞抑制剂包含细胞杀伤部分和cd33结合部分。任选地,所述cd33结合部分包含抗体或其抗原结合片段。任选地,所述细胞杀伤部分是细胞毒素。所述细胞毒素可以选自:i)肽毒素或ii)化学毒素。任选地,所述细胞抑制剂还包含连接部分.所述连接部分可以在细胞杀伤部分和cd33结合部分之间。
在一个实施方案中,所述结合cd7的细胞抑制剂能够诱导cd7受体介导的所述第一细胞抑制剂到cd7+细胞中的内化,任选地所述cd7+细胞是aml细胞。
所述结合cd7的细胞抑制剂可以特异性结合cd7。
在一个实施方案中,所述结合cd7的细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd7抗体或其抗原结合部分。
在一个实施方案中,所述结合cd7的细胞抑制剂是抗-cd7car-t。所述细胞抑制剂可以包含免疫效应细胞。所述免疫效应细胞可以包含t细胞和/或nk细胞。所述免疫效应细胞是t细胞。所述t细胞可以包含cd7+t细胞。
在一个实施方案中,所述结合cd7的细胞抑制剂包含细胞杀伤部分和cd7结合部分.任选地,所述cd7结合部分包含抗体或其抗原结合片段。任选地,所述细胞杀伤部分是细胞毒素。所述细胞毒素可以选自:i)肽毒素或ii)化学毒素。任选地,所述结合cd7的细胞抑制剂还包含连接部分。所述连接部分将优选地在细胞杀伤部分和cd7结合部分之间。
在另一个方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的双特异性结合cd33和cd7的细胞抑制剂。
在一个相关方面,本发明提供治疗有此需要的个体的cd7+cd33+恶性血液肿瘤的方法,所述方法包括施用双特异性结合cd33和cd7的细胞抑制剂。优选的是所述细胞抑制剂是人工生产的。
在另一个相关方面,本发明提供双特异性结合cd33和cd7的细胞抑制剂,其用于制备用于治疗cd7+cd33+恶性血液肿瘤的药物。
在一个实施方案中,所述细胞抑制剂能够诱导cd33和cd7受体介导的所述细胞抑制剂到cd33+和cd7+细胞中的内化,任选地其中所述cd33+和cd7+细胞是aml细胞。
在一个实施方案中,所述细胞抑制剂是双特异性抗体或其抗原结合部分,任选地其中所述双特异性抗体或其抗原结合部分能够介导抗体依赖性细胞介导的细胞毒性。如果所述细胞抑制剂是双特异性抗体,则此种抗体可以是全长抗体。
在一个实施方案中,所述细胞抑制剂是双特异性抗-cd33抗-cd7car-t。所述细胞抑制剂可以包含免疫效应细胞。所述免疫效应细胞可以包含t细胞和/或nk细胞。所述免疫效应细胞是t细胞。所述t细胞可以包含cd33+t细胞,cd7+t细胞,或其组合。
在一个实施方案中,所述细胞抑制剂包含:i)细胞杀伤部分;ii)cd7结合部分和ii)cd33结合部分。任选地所述cd33结合部分包含抗体的抗原结合片段及/或所述cd7结合部分包含抗体的抗原结合片段。任选地所述细胞杀伤部分是细胞毒素。所述细胞毒素可以选自:i)肽毒素或ii)化学毒素。任选地,所述细胞抑制剂还包含连接部分.所述连接部分将优选地在细胞杀伤部分和cd33和/或cd7结合部分之间。
与本发明的特定方面、实施方案或实施例一起描述的特质、整数、特征、结合部分或基团应理解为适用于本文描述的任何其他方面、实施方案或实施例,除非与之不相容。本说明书(包括任何随附的权利要求书、摘要和附图)中公开的所有特征,和/或如此公开的任何方法或过程的所有步骤,可以任意组合,但至少一些此类特征和/或步骤是相互排斥的组合除外。本发明不限于任何上述实施方案的细节。本发明扩展到本说明书(包括任何随附的权利要求书、摘要和附图)所公开的特征的任何新颖的一个或任何新颖的组合,或者扩展到如此公开的任何方法或过程的步骤的任何新颖的一个或任何新颖的组合。
附图说明
下文中参照附图对本发明的实施方案进行进一步描述,其中:
图1是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd33的细胞毒性特征的图;
图2是显示在抗-cd33和αmfc-cl-mmae处理的情况下kasumi-3的百分比生存力的图;
图3是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd7的细胞毒性特征的图;
图4是显示在抗-cd7和αmfc-cl-mmae处理的情况下kasumi-3的百分比生存力的图;
图5是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd13的细胞毒性特征的图;
图6是显示在抗-cd13的情况下存在αmfc-cl-mmae处理时kasumi-3的百分比生存力的图;
图7是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd33+抗-cd7的细胞毒性特征的图;
图8是显示在抗-cd33+抗-cd7的情况下存在αmfc-cl-mmae处理时kasumi-3的百分比生存力的图;
图9是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd33+抗-cd13的细胞毒性特征的图;
图10是显示在抗-cd33+抗-cd13的情况下存在αmfc-cl-mmae处理时kasumi-3的百分比生存力的图;
图11是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd33的细胞毒性特征的图;
图12是显示在抗-cd33和αmfc-cl-mmae处理的情况下hel92.1.7的百分比生存力的图;
图13是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd56的细胞毒性特征的图;
图14是显示在抗-cd56和αmfc-cl-mmae处理的情况下hel92.1.7的百分比生存力的图;
图15是显示表示为rlu的在αmfc-cl-mmae存在下抗-cd33+抗-cd56组合的细胞毒性特征的图;
图16是显示在抗-cd33+抗-cd56组合的情况下存在αmfc-cl-mmae处理时hel92.1.7的百分比生存力的图;
图17是显示在2x104个细胞kasumi-3细胞/孔上使用野生型bifab和抗-人fab-mmae对浓度为每孔6nm的mmae的5点剂量响应进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理72小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。ic50为~0.1169nm。误差条表示一式三份重复样的标准差;
图18是显示在2x104kasumi-3细胞/孔上使用直接缀合的bifab-mmae的8点剂量响应进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理72小时。在孵育后,添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。ic50为0.3211nm。误差条表示一式两份重复样的标准偏差;
图19是显示在13.2nm抗-鼠fc-mmae抗体存在下,在用cd7和cd33抗体中的每种的5点剂量响应处理的kasumi-3细胞上进行的细胞杀伤测定的结果的图。包括没有抗体或mmae缀合抗体的对照孔。将平板在37℃,5%co2孵育96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式三份重复样的标准差a)抗-cd7ab213014。ic50为0.4485nm。b)抗-cd33ab00283-1.1。ic50为0.323nm。c)抗-cd7+抗-cd33。ic50为0.3661nm。
图20是显示在13.2nm抗-鼠fc-mmae存在下,在用cd7和cd33抗体中每种的5点剂量响应处理的set-2细胞上进行的细胞杀伤测定的结果的图。包括没有抗体或mmae缀合抗体的对照孔。将平板在37℃,5%co2孵育96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式三份重复样的标准差;a)抗-cd7ab213014。ic50为0.4817nm。b)抗-cd33ab00283-1.1。ic50不可计算。c)抗-cd7+抗-cd33。ic50为0.206nm。
图21是显示研究当被bi-fab一起靶向时与单独地被分别的fab靶向相比cd7和cd33之间的协同性结合的荧光活化细胞分选(facs)实验的结果的图。将双抗原阳性细胞系,kasumi-3和set-2,用1nmcd7/cd33bifab、cd7fab、cd33fab或cd7fab+cd33两者在0℃处理一小时。添加第二抗-fabpe抗体,与细胞在冰上孵育45分钟并将过量的除去。还包括细胞仅与第二抗体孵育的对照样品(空白)。使用facscalibur,bdbiosciences检测细胞上的pe标记。误差条显示一式两份重复样的标准偏差;
图22是表示比较wtcd7/cd33bifab及其组分cd7和cd33fab在一系列白血病细胞系上的结合的facs分析的图。将细胞与1nmcd7/cd33bifab、cd7fab或cd33fab在0℃孵育1小时。将第二小鼠抗-fabpe抗体用于检测bi-fab和fab结合。还包括细胞仅与第二抗体孵育的对照样品(空白)。使用facscalibur、bdbiosciences检测细胞上的pe标记。误差条显示一式两份重复样的标准偏差;
图23是显示在用bifab-mmae、cd7-mmae、cd33-mmae和cd7+cd33-mmae的滴定液处理的a)kasumi-3细胞和b)set-2细胞上进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式两份重复样的标准偏差;bifab-mmae的ic50值为:a)0.3211nmb)1.453nm。
图24是显示在用bifab-mmae或gemtuzumab-mmae的滴定液处理的kasumi-3细胞上进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式两份重复样的标准偏差;bifab-mmae的ic50为0.3211nm并且gemtuzumab-mmae的ic50为0.8781nm。
图25是显示在用10μl的bifab-mmae和gemtuzumab-mmae处理的set-2细胞上进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理96小时。在孵育后每孔中用移液器加入celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式两份重复样的标准偏差;bifab-mmae的ic50为1.453nm并且gemtuzumab-mmae的ic50是不可计算的。
图26是显示cd7/cd33双阳性亚群的特异性细胞杀伤测定的结果的图,将都含有cd33+/cd7+细胞的亚群的hel-92和molm-16细胞系与0nm、0.03nm、0.1nm和0.3nm的wtbifab-mmae的滴定液在37℃,5%co2孵育72小时。在孵育后收获细胞并将样品分别在冰上与抗-人fab-pe、抗-cd7-pe,抗-cd33fitc,抗-cd7-pe+抗-cd33fitc孵育1小时或不与第二抗体孵育。除去过量的第二抗体并使用facscalibur,bdbiosciences检测荧光。针对代表仅cd33抗原细胞和cd7/cd33双抗原细胞的2个区域中的事件来分析样品;
图27是显示在用bifab-mmae的滴定液处理的hnt-34细胞上进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式两份重复样的标准偏差。bifab-mmae的ic50为0.45nm。
图28是显示在用bifab-mmae的滴定液处理的uoc-m1细胞上进行的细胞杀伤测定的结果的图。将细胞在37℃,5%co2处理96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图。误差条表示一式两份重复样的标准偏差。bifab-mmae的ic50为2.7nm。
具体实施方式
发明人令人惊奇地证明cd7和cd33在aml细胞上的双重靶向提供协同性治疗效果。发明人证明该双重靶向在诱导aml细胞死亡方面提供显著的协同作用。具体地,发明人令人惊奇地确定cd7和cd33在aml疾病细胞系中的双重靶向导致在癌细胞死亡方面与单一靶向相比20倍的增加。
发明人进行了一系列细胞生存力测定(promega
该测定证明cd7和cd33抗原都具有adc治疗剂所需的品质。两种抗原,在与抗体结合时,内化并将抗体引向溶酶体以进行有效载荷释放,从而导致细胞死亡。
当被单独靶向时,cd7和cd33抗体引起的对抗原阳性细胞的细胞毒性都较差,ic50分别为158.2nm和163.6nm。然而,当组合孵育时,记录到效力增加20倍(8.2nm)。这表明协力地靶向两种受体驱动快速内化,导致在给定剂量下更大程度的有效载荷到达溶酶体。这在测试的备选组合中是不明显的。
cd7是在t和b淋巴细胞、自然杀伤细胞和树突细胞的祖细胞上表达的泛白细胞受体(hao,2001;sempowki,1999),其在t细胞激活中起辅助作用(lazarovits,1994;stillwell,2011)并且在成熟cd4<+>细胞的表面上存留(cotta,2006;lobac,1985)。cd7已经作为用于递送白血病和淋巴瘤治疗的细胞毒性分子的靶标被广泛研究(peipp,2002;bremmer,2006;franker,1997;vallera,1996;waurzyniak,1997)。
cd33是67kda质膜蛋白,其结合唾液酸并且是结合唾液酸的ig相关凝集素(siglec)蛋白家族的成员。已知cd33在骨髓细胞上表达。也已报道了在多种恶性细胞上的cd33表达。
作为常见的髓性抗原,cd33在大部分aml细胞上表达(depropris,m.s.等(2011)highcd33expressionlevelsinacutemyeloidleukemiacellscarryingthenucleophosmin(npm1)mutation,haematological,961548-1551;ehninger,a.等(2014)distributionandlevelsofcellsurfaceexpressionofcd33andcd123inacutemyeloidleukemia,bloodcancerjournal,41-10),作为常见的t和nk细胞标志物,cd7在赋予较差的预后表型的aml细胞的化疗耐药性亚群(占大约22%)上异常表达(poeta,g.d.等(1995)cd7expressioninacutemyeloidleukemia.leuk.lymphoma,17,111-119;rohrs,s.等(2010)cd7inacutemyeloidleukemia:correlationwithlossofwild-typecebpa,consequenceofepigeneticregulation,journalofhematology&oncology,31-7;rausei-mills,v.等(2008)aberrantexpressionofcd7inmyeloblastsishighlyassociatedwithdenovoacutemyeloidleukemiaswithflt3/itdmutation,amjclinpathol,129624-629;shimamoto,t.等(1994)clinicalandbiologicalcharacteristicofcd7+acutemyeloidleukaemia,cancergenetcytogenet7369-74;reading,c.l.等(1993)expressionofunusualimmunophenotypecombinationsinacutemyelogenousleukemia,blood813083-3090;ossenkoppele,g.j.,etal(2011)reviewoftherelevanceofaberrantantigenexpressionbyflowcytometryinmyeloidneoplasmsbritishjournalofhaematology153421–436;lococo,f.等(1989)cd7positiveacutemyeloidleukaemia:asubtypeassociatedwithcellimmaturity,britishjournalofhaematology73480-485;kita,k.等(1983)clinicalimportanceofcd7expressioninacutemyelocyticleukemia,blood81,2399-2405;eto,t.等(1992)biologicalcharacteristicsofcd7positiveacutemyelogenousleukaemia,britishlournalolhaernatology82508-511;chang,h.(2004)prognosticrelevanceofimmunophenotypingin379patientswithacutemyeloidleukemia,leukemiaresearch2843–48)。
aml的cd7+亚型与提高的白细胞增多、化疗反应差、总体和无病生存率低有关(kahl,c.等(2001)cd7+andcd56+acutemyelogenousleukemiaisadistinctbiologicandclinicaldiseaseentity.haematologyandbloodtransfusion,40112-119)。临床上,cd7+aml患者年龄较小,男性较多,中枢神经系统受累的发生率较高,且常与分化较差的aml亚型相关,与较差的结果进一步相关(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。cd7+aml细胞的不成熟性进一步得到了cd34在该群体中高表达的支持。poeta等人1995年的一项研究发现,cd7+白血病患者的cr明显低于cd7-表型的患者(32%对74%),这说明对于标准护理下该亚型的复发和/或难治性的程度(poeta,g.d.等(1995)cd7expressioninacutemyeloidleukemia.leuk.lymphoma,17,111-119)。
cd7与flt3-itd+aml亚组密切相关,并被认为是flt3-itd+aml亚组的标志。由于发出信号下调凋亡蛋白的翻译的flt3酪氨酸激酶受体的失调,该亚型与较差的临床结果相关,并且因此,诱导aml细胞群对化疗诱导的细胞死亡产生抗性(rausei-mills,v.等(2008)aberrantexpressionofcd7inmyeloblastsishighlyassociatedwithdenovoacutemyeloidleukemiaswithflt3/itdmutation,amjclinpathol,129624-629)。作为aml中预后特别差的亚型,flt3aml亚组是新药研发者所针对的理想的疾病类别,许多新的治疗药物,包括激酶抑制剂和单特异性adc都特异性针对该群体。
已经描述了几种机制来解释cd7在aml中的异常表达。这些包括白血病细胞中疾病特异性的不规律基因表达(谱系失真)、能够进行淋巴和骨髓分化或增殖的多能祖细胞的恶性转化,以及在正常细胞分化过程中可能瞬时表达不同细胞系标志物的罕见祖细胞的成熟停止(谱系混杂)(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。
据报道,在早期祖细胞的一个亚组中,瞬时cd7表达能够产生骨髓和淋巴来源的细胞,但在成熟的骨髓和淋巴转化过程中消失(tien,h.和wang,c.(1998)cd7positivehematopoieticprogenitorsandacutemyeloidleukemiaandotherminimallydifferentiatedleukemia,leukemiaandlymphoma,393-98)。与此一致的是,一项研究发现已在某些健康造血细胞的亚组上鉴定出这两种抗原的低水平的共表达,所述亚组包括多能干细胞(cd33低/cd7+/-),一些髓性祖细胞(cd33高/cd7+/-)和一些t淋巴祖细胞(cd33+/-/cd7中),而共表达在发育过程中丧失(barcena,a.等(1994)tracingtheexpressionofcd7andotherantigensduringt-andmyeloid-celldifferentiationinthehumanfetalliverandthymus,leukaemiaandlymphoma171-11)。因此看似可能的是,这种共表达模式可能是祖细胞的某亚组的克隆扩张的结果,在发育的特定阶段被捕获由此使这两种抗原瞬时出现在一起,并且在恶性转化过程中该表达被放大。
有利的是,虽然在某些祖细胞亚组中这两种抗原的一定程度的瞬时共表达可能是明显的,但显然每种抗原的表达程度皆为低至阴性。cd33和cd7在早期造血发育的任何阶段都没有表现出高水平的共表达,在早期祖细胞的选定的小亚群上的表达受限,这没有在整个祖细胞池中反映出来。
该抗原组合是基于成白血病细胞的共表达模式的保真度从一系列潜在的aml组合中选择的。双重靶向的协同作用完全是非预期的并且无法被预测。
本发明提供双重靶向治疗方法,其同时靶向aml细胞群专有的两种细胞表面抗原cd7和cd33的疾病特异性共表达,避免了在可能只表达两种抗原之一的健康细胞上的脱靶效应。因此,与其他aml疗法相比,提议的双特异性adc将具有提高的选择性。该选择性将使在延长的持续时间内递送更高、更有效剂量的治疗剂成为可能。
因此,本发明提供特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂及其治疗组合物,其可以在用于治疗cd7+cd33+恶性血液肿瘤的双重靶向疗法中同时、分别或顺序施用。
在另一个方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂的组合及其治疗组合物。
本发明还提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd33和cd7的细胞抑制剂。
在第一方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd33的细胞抑制剂,其中所述特异性结合cd33的细胞抑制剂被制备成用于与特异性结合cd7的细胞抑制剂组合施用。
在另一个方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd7的细胞抑制剂,其中所述特异性结合cd7的细胞抑制剂被制备成用于与特异性结合cd33的细胞抑制剂组合施用。
在另一个方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂的组合。
在另一个方面,本发明提供用于治疗cd7+cd33+恶性血液肿瘤的特异性结合cd33和cd7的细胞抑制剂。
在另一个方面,本发明提供可以在用于预防或延迟cd7+cd33+恶性血液肿瘤复发的双重靶向疗法中同时、分别或顺序施用的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂及其治疗组合物。在另一个方面,本发明提供用于预防或延迟cd7+cd33+恶性血液肿瘤复发的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂的组合及其治疗组合物。在另一个方面,本发明提供用于预防或延迟cd7+cd33+恶性血液肿瘤复发的特异性结合cd33和cd7的细胞抑制剂及其治疗组合物。
本文中描述的所述细胞抑制剂及其治疗组合物可以用于制备药物。如本文中使用的,“药物”是指用于医学治疗的物质(即,药)。药物可以例如是用于细胞过继转移的t细胞产品。
本文中描述的所述细胞抑制剂及其治疗组合物可以用于治疗有此需要的对象的cd7+cd33+恶性血液肿瘤或预防或延迟有此需要的对象的cd7+cd33+恶性血液肿瘤复发的方法。
因此,一种用于治疗有此需要的对象的cd7+cd33+恶性血液肿瘤的方法,包括:
i)向所述对象施用有效量的特异性结合cd33的细胞抑制剂,
ii)向所述对象施用特异性结合cd7的细胞抑制剂,
其中步骤i)和ii)是分开的,同时的或顺序的,并且是以任何次序。
如本文中使用的,cd7优选为人cd7并且cd33优选为人cd33。在某些实施方案中,所述细胞抑制剂特异性结合细胞表面表达的cd7和cd33。如本文中使用的,表述“细胞表面表达的”是指一种或多种cd7和/或cd33蛋白在体外或在体内在细胞表面上表达,以致至少部分的cd7和/或cd33蛋白暴露于细胞膜的胞外侧并且易接近本发明的细胞抑制剂。
术语"cd7+cd33+恶性血液肿瘤"是指以在恶性细胞表面上表达cd7和cd33两者为特征的恶性血液肿瘤(例如,在其细胞表面过表达cd33和/或cd7和/或以对于利用特异性结合cd33的细胞抑制剂、特异性结合cd7的细胞抑制剂或特异性结合cd7和cd33的细胞抑制剂的疗法来说被认为是可接受的水平表达cd33和/或cd7的恶性血液肿瘤)。
cd7+cd33+恶性血液肿瘤包括但不限于急性髓性白血病(aml)、骨髓增生异常综合征、t-细胞急性成淋巴细胞白血病以及母细胞性浆细胞样树突细胞肿瘤(bpdcn)。
在优选的实施方案中,cd7+cd33+恶性血液肿瘤是aml。
可以将本发明的细胞抑制剂静脉内或皮下施用于患者。
在另一个方面,本发明提供可以在用于预防或延迟cd7+cd33+恶性血液肿瘤复发的双重靶向疗法中同时、分别或顺序施用的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂及其治疗组合物。在另一个方面,本发明提供用于预防或延迟cd7+cd33+恶性血液肿瘤复发的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂的组合及其治疗组合物。在另一个方面,本发明提供用于预防或延迟cd7+cd33+恶性血液肿瘤复发的特异性结合cd33和cd7的细胞抑制剂及其治疗组合物。
如本文中使用的,术语“治疗”被用来涵盖意在防止疾病或症状发展或改变疾病或症状的病理学而进行的干预。因此,“治疗”是指救治性治疗和预防性或防范措施,其中目的是防止或减缓(减轻)目标疾病或症状。因此,术语“治疗”包括治疗和/或预防疾病或症状的发展。如本文中使用的,“疗法”是指疾病或病症的预防或治疗。疗法可以是预防性的或救治性的。
在此方面,本发明的细胞抑制剂被施用至处于恶性血液肿瘤缓解期的患者,导致预防或延迟潜在的恶性血液肿瘤的复发。
如本文中使用的,“患者”通常是正经历治疗的人,或已被诊断为患有恶性血液肿瘤(优选地cd7+cd33+恶性血液肿瘤)的人。在一些实施方案中,将所述细胞抑制剂施用至处于cd7+cd33+恶性血液肿瘤缓解期的患者,由此防止或延迟恶性血液肿瘤的复发。在一些实施方案中,所述患者缺少可检测的恶性血液肿瘤细胞。如本文中使用的,“缺少可检测的细胞”是通过标准诊断或预后方法确定的。处于aml缓解期的患者通常显示异常临床特征的解决,血液计数和骨髓的造血作用恢复正常,<5%母细胞,中性粒细胞计数>1.000-1,500,血小板计数>100,000,并且白血病克隆消失。参见,例如,merck手册,sec.11,ch.138(第17版,1997):estey,2001,cancer92(5):1059-1073。
在一些实施方案中,处于cd7+cd33+恶性血液肿瘤缓解期的患者未进行骨髓移植。在其他实施方案中,处于cd7+cd33+恶性血液肿瘤缓解期的患者进行了骨髓移植。骨髓移植可以是自体的或是同种异体骨髓移植。
在实施方案中,治疗cd7+cd33+恶性血液肿瘤(例如aml)和防止或延迟cd7+cd33+恶性血液肿瘤(例如aml)复发涉及诱导aml癌细胞死亡和/或抑制aml癌细胞生长。
细胞抑制剂可以是组合物(例如治疗组合物)的部分,所述组合物包含所述化合物(即所述细胞抑制剂)和一种或多种其他组分。组合物可以是包含所述细胞抑制剂和药学上可接受的赋形剂、佐剂、稀释剂和/或载体的治疗组合物。治疗组合物可以常规地含有药学上可接受浓度的盐,缓冲剂,防腐剂,可相容的载体,补充性免疫增效剂如佐剂和细胞因子和任选地其他治疗剂或化合物。
如本文中使用的,“药学上可接受”是指不是生物学上或在其他方面不良的物质,即,所述物质可以与所选的化合物一起施用于个体而不引起任何非所需的生物学作用或以有害的方式与包含其的药物组合物的任何其他组分相互作用。
赋形剂是与活性成分(例如疫苗、细胞周期抑制剂、免疫抑制机制调节剂或免疫检查点抑制剂(如果需要))配制在一起的天然的或合成的物质,包含赋形剂的目的是使制剂具有一定体积或在最终剂型中在活性成分上赋予治疗增强作用,如促进药物吸收或溶解。赋形剂也可在制备过程中是有用的,以有助于处理目的活性物质,如通过促进粉末流动性或不粘性质,此外还有助于体外稳定性如防止在预期货架寿命内的变性。药学上可接受的赋形剂是本领域中已知的。因此,合适的赋形剂是本领域技术人员可容易确定的。例如,合适的药学上可接受的赋形剂包括水、盐水、葡萄糖水溶液、甘油、乙醇等。
佐剂是改良制剂中其他试剂的效果的药理学和/或免疫学试剂。药学上可接受的佐剂是本领域中已知的。因此合适的佐剂是本领域技术人员可容易确定的。
稀释剂是稀释性试剂。药学上可接受的稀释剂是本领域中已知的。因此合适的稀释剂是本领域技术人员可容易确定的。
载体在所用剂量和浓度对于受体是无毒性的并且与制剂的其他成分相容。术语“载体”是指与活性成分组合以促进应用的天然的或合成的有机或无机成分。药学上可接受的载体是本领域中已知的。因此合适的载体是本领域技术人员可容易确定的。
如本文中使用的,术语“有效量”和“治疗有效量”是指足以产生所需的治疗反应而没有过度的不利副作用如毒性、刺激性或变态反应的活性治疗剂的量。显然,具体的“有效量”将随各种因素而变化,所述因素如治疗的特定病症,患者的生理状况,治疗的动物的类型,治疗的持续时间,并存疗法(如果有的话)的性质,以及所用的具体制剂和化合物或其衍生物的结构。在此情况中,如果某个量导致(不限于)以下中的一种或多种则其将被认为是治疗有效的:(a)抑制癌细胞生长(例如aml细胞);以及(b)杀死癌细胞(例如aml细胞)。
施用给患者的细胞抑制剂及其治疗组合物的剂量可以根据患者的年龄和尺寸、目标疾病、状态、施用途径等而不同。优选剂量通常根据体重或体表面积来计算。
细胞抑制剂及其治疗组合物的施用方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜及口服途径。细胞抑制剂及其治疗组合物可以通过任何常规途径施用,例如通过输注或团注,通过上皮或粘膜衬里(例如,口腔黏膜、直肠和小肠粘膜等)吸收,并且可以与其他生物活性剂一起施用。施用可以是全身的或局部的。
优选地,本文所述的双重靶向疗法将为有此需要的对象的cd7+cd33+恶性血液肿瘤的治疗提供益处。例如,所述双重靶向疗法可以对有此需要的对象的aml治疗具有加成作用或协同作用。如果在治疗上的效果优于以常规剂量施用双重靶向疗法中的一种或其他组分可实现的效果,如通过例如响应的程度(例如凋亡或细胞生存力)、响应速率、疾病进展所需时间或存活期测量的,则双重靶向疗法被限定为提供“加成作用”、“协同作用”或“协同治疗”。例如,如果双重靶向疗法的治疗效果优于利用单独的特异性结合cd33的细胞抑制剂或单独的特异性结合cd7的细胞抑制剂所能实现的效果,则此种效果是加成的。例如,如果所述组合治疗的效果胜于单独的治疗加在一起的效果,则所述组合治疗的效果可以是协同性的。此外,如果在对单独的特异性结合cd33的细胞抑制剂或单独的特异性结合cd7的细胞抑制剂没有响应(或响应不良)的对象组中获得有益效果,则所述组合的效果是有益的(例如加成的或协同性的)。此外,如果所述组分之一以其常规剂量用药而另一组分以减小的剂量用药且如通过例如响应的程度、响应速率、疾病进展所需时间或存活期测量的治疗效果等于或优于所述组合治疗的组分中的任一种的常规用药量所能实现的效果,则所述组合治疗的效果被定义为提供益处(例如加成作用或协同作用)。特别地,如果可以在不有损响应的程度、响应速率、疾病进展所需时间或存活期测量中的一项或多项(特别是不有损响应持续时间)而恼人的副作用比使用各组分的常规剂量时发生的副作用更少和/或较少的情况下减小特异性结合cd33的细胞抑制剂或特异性结合cd7的细胞抑制剂的常规剂量,则认为存在益处。
特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂可以任何次序以适合于顺序(连续)、分别(之前或之后)和/或同时(并发)施用于对象的方式提供。例如,特异性结合cd33的细胞抑制剂可按适合与特异性结合cd7的细胞抑制剂顺序、分别和/或同时施用的方式提供(反之亦然)。
在特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂被同时施用的情况下,被同时施用的特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂可以作为单独的组合物被同时施用,也可以作为包含两者的组合的组合物被施用。
特异性结合cd33的细胞抑制剂可以允许所述细胞抑制剂在特异性结合cd7的细胞抑制剂与对象的cd33+cd7+aml细胞接触的同一点与对象的cd33+cd7+aml细胞接触的任何方式施用。本领域技术人员能够确定合适的施用方案。
当特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂的施用是顺序的或分别的时,施用第二制剂的延迟不应当导致损失组合疗法的有益效果。
在本发明的语境中,“靶向”和“双重靶向”在本文中用于指示特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂用来将其自身优先定位在需要其出现的至少一个组织位点。在本发明中,所述细胞抑制剂特异性结合cd33,cd7或cd33和cd7并且由此提供高于平均的向对象体内的至少一个所需位点的定位,从而允许施用于所述对象。此种情况中的靶向部分将被选择为特异性结合细胞表面受体cd33。当在具有某些疾病状态(如例如aml)的细胞中表达和/或过表达cd33和cd7时,特异性结合cd33的细胞抑制剂和特异性结合cd7的细胞抑制剂可以用来将所述复合物靶向此种受疾病影响的细胞。
如本文中使用的,术语“细胞抑制剂”是指引起靶细胞的细胞杀伤或抑制靶细胞的细胞生长的任何试剂。如本文中使用的,“靶细胞的杀伤”涉及抑制蛋白质合成,例如使得细胞生存力减弱,或引起凋亡从而导致靶细胞的消除或死亡。用于确定细胞杀伤和凋亡的测定是本领域中已知的。细胞毒性测定评估在用药理学物质处理后群体中存活的和死亡的细胞的数目(例如ldh细胞毒性测定,或存活-死亡细胞测定)。凋亡测定通过测量在细胞死亡后被激活的标志物来评估细胞如何死亡(例如ps暴露测定、半胱天冬酶激活测定、dna片段化测定,gsh/gssg测定、ldh细胞毒性测定、存活-死亡细胞测定、或非半胱天冬酶蛋白酶激活测定)。
如本文中使用的,“抑制细胞生长”(例如,关于靶细胞)是指与根据本发明的细胞抑制剂接触的靶细胞与未与根据本公开的细胞抑制剂接触的相同的细胞相比在生长或增殖方面任何可测量的下降,例如,抑制至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或100%的细胞生长。用于确定细胞生存力或增殖的测定是本领域中已知的。细胞生存力测定通过测量细胞活性标志物来(例如atp和adp确定测定、细胞周期测定、细胞增殖测定、细胞生存力测定、lhd细胞毒性测定、或存活-死亡细胞测定)评估细胞的健康程度。细胞增殖测定评估细胞群体的生长速率或检测生长的群体中的子细胞(例如细胞周期测定、细胞增殖测定、细胞生存力测定、或老化测定)。
如本文中使用的,“表达cd33的细胞”和“cd33+细胞”是指具有cd33作为表面抗原的细胞。如本文中使用的,“表达cd7的细胞”和“cd7+细胞”是指具有cd7作为表面抗原的细胞。如本文中使用的,“表达cd33和cd7的细胞”和“cd33+cd7+细胞”是指具有cd33和cd7作为表面抗原的细胞。
如本文中使用的,“靶细胞”是指以表达或过表达靶分子cd7和cd33为特征的细胞或细胞类型。任何类型的表达cd7和cd33的细胞都可以预期作为利用本发明的细胞抑制剂来进行治疗的靶细胞。在某些实施方案中,所述细胞是肿瘤细胞,例如来源于恶性血液肿瘤的肿瘤细胞,如aml细胞。
在某些实施方案中,本文所述的细胞抑制剂能够诱导cd33受体介导的所述细胞抑制剂到cd33+细胞中的内化,和/或cd7受体介导的所述细胞抑制剂到cd7+细胞中的内化。在某些实施方案中,所述细胞抑制剂是特异性结合cd33和cd7两者并且能够在结合细胞表面上的cd7和cd33后诱导所述试剂到cd7+cd33+细胞中的内化的细胞抑制剂。
如本文中使用的,“cd33受体介导的内化”是指在与细胞表面上的cd33结合后被cd33+细胞摄入(即,进入所述细胞)。对于治疗性应用,体内内化是被预期的。如本文中使用的,“cd7受体介导的内化”是指在与细胞表面上的cd7结合后被cd7+细胞摄入(即,进入所述细胞)。对于治疗性应用,体内内化是被预期的。
对于治疗性应用,内化的细胞抑制剂的数量将足以杀死cd33+cd7+细胞,特别是cd7+cd33+血液癌细胞,如aml细胞。取决于细胞抑制剂的效力,在一些情况中,摄取单一分子到细胞中足以杀死试剂所结合的靶细胞。细胞抑制剂是否引起cd33和/或cd7受体介导的内化可以通过本领域中已知的多种测定来确定。对于体外内化,可以在存在或不存在添加到培养基的相关细胞抑制剂的情况下将细胞在组织培养皿中孵育并且处理以在所需的时间点进行显微分析。内化的带标记的细胞抑制剂在细胞中的存在可以直接通过显微术或放射自显影术(如果使用放射性标记的细胞抑制剂)可视化。备选地,在量化生化测定中,将包含cd33+cd7+细胞的细胞群体与放射性标记的测试细胞抑制剂在体外或体内接触并将所述细胞(如果是体内接触,则之后在合适的时间后将细胞分离)用蛋白酶处理或进行酸洗以除去细胞表面上未内化的细胞抑制剂。将细胞碾碎并通过使匀浆通过闪烁计数器来测量抵抗的蛋白酶的量,即与各批次细胞相关的每分钟放射性计数(cpm)。基于已知的放射性标记的细胞抑制剂的比活,可以由碾碎的细胞的闪烁计数得出每个细胞内化的细胞抑制分子的数量。将细胞与细胞抑制剂在体外优选地以溶液形式“接触”,如通过将细胞添加到培养皿或培养瓶中的细胞培养基并将抗体与培养基充分混合以保证细胞对细胞抑制剂的均匀暴露。作为添加到培养基的备选,可以将细胞与在试管中的测试细胞抑制剂的等渗溶液(如pbs)接触达所需的时间。在体内,在施用于患者时,通过任何合适的施用测试的细胞抑制剂的方法(如以下描述的施用方法)将细胞与细胞抑制剂接触。
在某些实施方案中,本发明的细胞抑制剂可以为,但不限于,抗体及其片段、adc’s、小分子药物缀合物(smdc)、免疫毒素、肽和非肽缀合物、显像剂、治疗性疫苗、纳米颗粒。在特定的实施方案中,所述细胞抑制剂是抗体及其片段。
如本文中使用的术语“抗体”是指结合已知抗原的分子或分子的活性片段,特别是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即含有免疫特异性结合抗原(即cd7或cd33)的结合位点的分子。根据本发明的免疫球蛋白可以是任何类型(igg、igm、igd、ige、iga和igy)或亚类(例如igg1、igg2、igg3、igg4、iga1和iga2)或免疫球蛋白分子的亚类(同种型)(例如igg1、igg2、igg3和igg4中的igg、或iga1和iga2中的iga)。
在本发明的范围内,术语“抗体”包括单克隆、多克隆、嵌合、单链、双特异性、人和人源化抗体及其活性片段。结合已知抗原的分子的活性片段的实例包括fab、f(ab’)、f(ab′)2、scfv和fv片段,包括fab免疫球蛋白表达文库的产物和以上提及的任何抗体和片段的表位结合片段。
如本文中使用的,术语“单克隆抗体”是指在实验室中由单个克隆大规模制备的并且仅识别一种抗原的抗体。单克隆抗体典型地通过将通常短命的抗体生产b细胞与快速生长的细胞如癌细胞(有时被称为“永生”细胞)融合来制备。所得的杂交细胞或杂交瘤增殖迅速,产生生产大量抗体的克隆。对于本发明来说,“单克隆抗体”也被理解为包括由未实现完全的单克隆性的母克隆产生的抗体。
如本文中使用的,术语“嵌合抗体”是指通常通过重组dna技术制备的、包含来自小鼠的可变区(即结合区)和来源于不同来源或物种的恒定区的至少部分的单克隆抗体。包含小鼠可变区和人恒定区的嵌合抗体是示例性实施方案。此种小鼠/人嵌合抗体是表达的包含编码小鼠免疫球蛋白可变区的dna片段和编码人免疫球蛋白恒定区的dna片段的免疫球蛋白基因的产物。本公开所涵盖的“嵌合抗体”的其他形式是类型或亚类已由原本抗体的类型或亚类改变或变更的那些。此种“嵌合”抗体也被称为“类型转变抗体”。用于制备嵌合抗体的方法包括本领域中现在熟知的常规重组dna和基因转染技术。参见,例如,morrison,s.l.等,proc.natl.acadsci.usa81(1984)6851-6855;美国专利号5,202,238和美国专利号5,204,244。
如本文中使用的,术语“人源化抗体”或“人源化版本的抗体”是指与亲本免疫球蛋白相比对框架或“互补决定区”(cdr)进行了修饰以包含不同特异性的免疫球蛋白的cdr的抗体。在一些示例性实施方案中,vh和vl的cdr被移植到人抗体的框架区中以制备“人源化抗体”。参见例如riechmann,l.,等,nature332(1988)323-327;和neuberger,m.s.,等,nature314(1985)268-270。重链和轻链可变框架区可来源于相同或不同的人抗体序列。所述人抗体序列可以是天然存在的人抗体的序列。人重链和轻链可变框架区列于例如lefranc,m.-p.,currentprotocolsinimmunology(2000)—appendix1pa.1p.1-a.1p.37并且可例如经由imgt(internationalimmunogeneticsinformation
如本文中使用的,术语“人抗体”意在包括具有来源于人种系免疫球蛋白序列的可变区和恒定区的抗体。人抗体是现有技术中已知的(vandijk,m.a.和vandewinkel,j.g.,curr.opin.chem.biol.5(2001)368-374)。也可以在免疫后能够在不存在内源性免疫球蛋白生产的情况下生产人抗体的完整储库或选集的转基因动物(例如,小鼠)中生产人抗体。在此种种系突变小鼠中转移人种系免疫球蛋白基因阵列导致在抗原挑战后产生人抗体(参见,例如,jakobovits,a.,等,proc.natl.acad.sci.usa90(1993)2551-2555;jakobovits,a.,等,nature362(1993)255-258;brueggemann,m.d.,等,yearimmunol.7(1993)33-40)。也可以在噬菌体展示文库中制备人抗体(hoogenboom,h.r.和winter,g.,j.mol.biol.227(1992)381-388;marks,j.d.,等,j.mol.biol.222(1991)581-597)。cole,a.等和boerner,p.等的技术也可用于制备人单克隆抗体(cole,a.,等,monoclonalantibodiesandcancertherapy,liss,a.r.(1985)p.77;以及boerner,p.,等,j.immunol.147(1991)86-95)。如已经提及的,根据本公开,如本文中使用的术语“人抗体”还包含这样的抗体,其恒定区进行了修饰从而产生根据本公开的性质,尤其是关于c1q结合和/或fcr结合,例如通过“类型转换”即fc部分的改变或突变(例如从igg1到igg4和/或igg1/igg4突变)。
如本文中使用的,“单链抗体”是指单链fv分子(scfv),其中vh结构域和vl结构域通过允许两个结构域结合以形成抗原结合位点的肽接头来连接(bird等,1988,science242:423-426,huston等,1988,proc.natl.acad.sci.u.s.a.85:5879-5883或双特异性单链fv(wo03/11161)。
如本文中使用的,术语“抗体片段”是指全长抗体的部分,术语“抗原结合片段”是指其可变结构域,或至少其抗原结合位点,例如cdr。抗体片段的实例包括双抗体、单链抗体分子、和由抗体片段形成的多特异性抗体。scfv抗体被例如描述于huston,j.s.,methodsinenzymol.203(1991)46-88。抗体片段可以通过多种本领域已知的技术来源于本发明的抗体。例如,纯化的单克隆抗体可以用酶(如胃蛋白酶)切割并且进行hplc凝胶过滤。然后可以收集含fab片段的合适的级分并且通过膜过滤等浓缩。对于用于分离抗体活性片段的通用技术的进一步描述,参见例如,khaw,b.a.等j.nucl.med.23:1011-1019(1982);rousseaux等methodsenzymology,121:663-69,academicpress,1986。
如本文中使用的,术语“双特异性抗体”是指结合两个(以上)不同抗原的抗体。双特异性抗体典型地包含至少两个不同的可变结构域,其中每个可变结构域能够特异性结合单独的抗原。在某些方面,本发明的双特异性抗体是人抗体。如本文中使用的,表述“双特异性抗原结合分子”表示包含至少第一抗原结合结构域和第二抗原结合结构域的蛋白质、多肽或分子复合物。双特异性抗原结合分子内的每个抗原结合结构域包含至少一个cdr,其单独地或与一种或多种另外的cdr组合,特异性结合特定抗原。在本发明的语境中,第一抗原结合结构域特异性结合第一抗原(例如,cd7),并且第二抗原结合结构域特异性结合不同的第二抗原(例如,cd33)。在某些方面,双特异性分子能够同时结合人cd7和人cd33。
在某些实施方案中,特异性结合cd7和cd33的细胞抑制剂是双特异性抗体,此种抗体可以被称为“抗-cd7xcd33”或“抗-cd7/抗-cd33”等等。
任何双特异性抗体形式或技术都可以用于制备本发明的双特异性抗原结合分子。可在本发明的语境中使用的具体的示例性双特异性形式包括但不限于,例如,基于scfv的或双体双特异性形式、igg-scfv融合物,、双可变结构域(dvd)-lg、quadroma、杵臼(knobs-into-holes)、常见轻链(例如,具有杵臼等的常见轻链)、crossmab、crossfab、(seed)body、亮氨酸拉链、duobody、lgg1/lgg2、双重作用fab(daf)-lgg、mab2双特异性形式(前述形式的综述参见,例如,klein等2012,imabs4:6,1-11,及其中引用的文献)和基于fab的双特异性形式。在某些实施方案中,所述双特异性抗体是基于fab的抗-cd7xcd33双特异性抗体。
如本文中使用的,术语“特异性的”和“特异性地”被可互换地用于指示除cd7或cd33以外的生物分子(或者所述生物分子是双特异性分子cd7和cd33)不显著结合所述抗体。在一些实施方案中,除cd7或cd33以外的生物分子的结合水平通过elisa或亲和力测定是可忽略的(例如,检测不到)。
“可忽略的结合”表示,相比与cd7或cd33的结合小至少约85%,特别地至少约90%,更特别地至少约95%,甚至更特别地至少约98%,而尤其是至少约99%和达100%。
抗体对肽或表位的结合亲和力可以利用标准结合测定,如表面等离子共振技术(
在一个实施方案中,本发明的细胞抑制剂能够介导抗体依赖性细胞介导的细胞毒性。优选地在此种实施方案中,所述细胞抑制剂是抗体,例如完全人,人源化或嵌合抗体,或双特异性抗体。抗体依赖性细胞介导的细胞毒性(adcc)是免疫效应细胞介导的机制,其可以有助于单克隆抗体的抗肿瘤活性(weinergj.monoclonalantibodymechanismsofactionincancer.immunolres.2007,39(l-3):271-8)。adcc针对抗肿瘤效力的相关性已在临床前模型(例如在小鼠肿瘤模型)中被证实(例如clynesra,towerstl,prestalg,ravetchjv.inhibitoryfcreceptorsmodulateinvivocytoxicityagainsttumortargets.natmed.2000apr;6(4):443-6)。来自临床试验的数据支持adcc针对治疗性抗体的临床效力的相关性(例如wengwk,levyrtwoimmunoglobulingfragmentcreceptorpolymorphismsindependentlypredictresponsetorituximabinpatientswithfollicularlymphoma.jclinoncol.2003novl;21(21):3940-7.epub2003sep15)。单克隆抗体与免疫细胞上的fc受体的相互作用有助于adcc。可对抗体的fc进行修饰以展示增强的对fc受体的亲和力(例如prestalgengineeringoftherapeuticantibodiestominimizeimmunogenicityandoptimizefunction.advdrugdelivrev.2006aug7;58(5-6):640-56.epub2006may23)。此种增强的对fc受体的亲和力导致增加的adcc活性,其可以在患者中导致增强的抗肿瘤效力。
在备选的实施方案中,本发明的细胞抑制剂是表达嵌合抗原t细胞受体蛋白(car)的免疫响应细胞,其中所述嵌合t细胞受体蛋白特异性结合cd7或cd33。在一个实施方案中,免疫响应细胞是双特异性的并且嵌合抗原t细胞受体蛋白(car),其中所述嵌合t细胞受体蛋白特异性结合cd7和嵌合抗原t细胞受体蛋白(car),其中所述嵌合t细胞受体蛋白特异性结合cd33。表达car的免疫响应细胞可以选自由以下各项组成的组:t细胞,造血干细胞,天然杀伤细胞,天然杀伤t细胞,b细胞和单核细胞系的细胞。在特别的实施方案中,免疫响应细胞是t细胞。
在一些实施方案中,免疫响应细胞是对象自体的。在另一个实施方案中,免疫响应细胞不是对象自体的。在特别的实施方案中,免疫响应细胞是t细胞并且是待治疗的对象自体的。
在一些实施方案中,细胞抑制剂(例如特异性结合cd33的细胞抑制剂、和/或特异性结合cd7的细胞抑制剂、或特异性结合cd7和cd33的细胞抑制剂)包含结合部分(即cd33结合部分、cd7结合部分、或cd7和cd33结合部分)和细胞杀伤部分。在某些实施方案中,细胞结合部分是抗体或其抗原结合片段、适配体、肽或非肽小分子。在特别的实施方案中,细胞结合部分是抗体或其抗原结合片段。在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd7抗体或其结合部分。在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd33抗体或其结合部分。在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd7抗-cd33双特异性抗体或其结合部分。
在一些实施方案中,细胞抑制剂包含细胞毒性或细胞生长抑制剂,即杀死或抑制肿瘤细胞的化合物。此种试剂可以通过包括微管蛋白结合、dna结合、蛋白酶体和/或拓扑异构酶抑制在内的机制给予其细胞毒性和细胞生长抑制作用。
细胞毒性或细胞生长抑制剂可以是,例如,肽毒素、小分子毒素或放射性同位素。
在一个实施方案中,细胞毒性或细胞生长抑制剂可以是微管蛋白抑制剂;或dna相互作用剂。微管蛋白抑制剂调节微管蛋白聚合。dna相互作用剂靶向细胞dna。
在一个实施方案中,细胞毒性或细胞生长抑制剂是微管蛋白抑制剂。在一个实施方案中,微管蛋白抑制剂选自由以下组成的组:(a)奥利斯他汀(auristatin);和(b)美登素(maytansine)衍生物。在一个实施方案中,细胞毒性或细胞生长抑制剂是奥利斯他汀。奥利斯他汀包括天然存在的化合物尾海兔素-10(dolastatin-10)的合成的衍生物。奥利斯他汀是抗肿瘤/细胞生长抑制伪肽家族。尾海兔素由于结合有在天然生物合成产物中鉴定出的4种非天然氨基酸(dolavaine,dolaisoleuine,dolaproine和dolaphenine)而在结构上是独特的。此外,该类天然产物具有通过由pettit等人(us4,978,744)的总合成研究定义的许多不对称中心。从结构活性关系看,dolaisoleuine和dolaproine残基对于抗肿瘤活性似乎为必需的(us5,635,483和us5,780,588)。在一个实施方案中,奥利斯他汀选自由以下各项组成的组:奥利斯他汀e(ae);单甲基奥利斯他汀e(mmae);奥利斯他汀f(mmaf);vcmmae;和vcmmaf。在一个实施方案中,细胞毒性或细胞生长抑制剂是美登素或美登素的结构类似物。在一个实施方案中,细胞毒性或细胞生长抑制剂是美登素。美登素包括结构复杂的抗有丝分裂多肽。美登素是微管蛋白装配的强效抑制剂,导致肿瘤细胞凋亡。在一个实施方案中,美登素选自由以下各项组成的组:mertansine(dm1);和美登素的结构类似物如dm3或dm4。优选地,所述药物是mertansine(dm1)。
在一个实施方案中,细胞毒性或细胞生长抑制剂是dna相互作用剂。在一个实施方案中,dna相互作用剂选自由以下各项组成的组:(a)加利车霉素(calicheamicin),(b)倍癌霉素(duocarmycin)和(c)吡咯并苯二氮卓类(pyrrolobenzodiazepine;pbd)。在一个实施方案中,细胞毒性或细胞生长抑制剂是加利车霉素。加利车霉素是强效细胞毒性剂,其导致双链dna破裂,从而导致细胞死亡。加利车霉素是天然存在的烯二炔抗生素(a.l.smithetal,j.med.chem.,1996,39,11,2103-2117)。在土壤微生物棘孢小单胞菌(micromonosporaechinospora)中发现加利车霉素。在一个实施方案中,加利车霉素是加利车霉素γ1。在一个实施方案中,所述药物是倍癌霉素。倍癌霉素为有效的抗肿瘤抗生素,其通过选择性地在dna双链体的小沟中结合序列并将腺嘌呤的n3烷基化而发挥其生物作用(d.boger,pure&appl.chem.,1994,66,4,837-844)。在一个实施方案中,倍癌霉素选自由以下各项组成的组:倍癌霉素a;倍癌霉素b1;倍癌霉素b2;倍癌霉素c1;倍癌霉素c2;倍癌霉素d;倍癌霉素sa;环丙基苯并吲哚(cyclopropylbenzoindole,cbi)倍癌霉素;centanamycin;瑞秋霉素(rachelmycin)(cc-1065);阿多来新(adozelesin);比折来新(bizelesin);和卡折来新(carzelesin)。在一个实施方案中,细胞毒性或细胞生长抑制剂是吡咯并苯二氮卓类。吡咯并苯二氮卓类(pbd)为一类天然存在的抗肿瘤抗生素。吡咯并苯二氮卓类发现于链霉菌(streptomyces)中。pbd通过在小沟中具体地在嘌呤-鸟嘌呤-嘌呤单元处与dna特异性地共价结合来发挥其抗肿瘤活性。它们经由氨基键插入到鸟嘌呤的n2上,并且由于它们的形状,其引起对dna螺旋的最小破坏。据信dna-pbd加合物的形成抑制核酸合成并引起dna螺旋中的切除依赖性单链和双链断裂。作为合成衍生物,两个pbd单元经由柔性聚亚甲基系链(polymethylenetether)连接在一起允许pbd二聚体与相对的dna链交联,产生高度致死性损伤。在一个实施方案中,细胞毒性或细胞生长抑制剂为经由柔性聚亚甲基系链连接在一起的两个吡咯并苯二氮卓类单元的合成衍生物。在一个实施方案中,吡咯并苯二氮卓类选自由以下各项组成的组:氨茴霉素(anthramycin)(及其二聚体);甲基氨茴霉素(mazethramycin)(及其二聚体);茅屋霉素(tomaymycin)(及其二聚体);prothracarcin(及其二聚体);芝加霉素(chicamycin)(及其二聚体);新丝拉霉素a(neothramycina)(及其二聚体);新丝拉霉素b(及其二聚体);dc-81(及其二聚体);西伯利亚霉素(sibiromycin)(及其二聚体);porothramycina(及其二聚体);porothramycinb(及其二聚体);西巴霉素(sibanomycin)(及其二聚体);abbeymycin(及其二聚体);sg2000;和sg2285。
在一个实施方案中,细胞毒性或细胞生长抑制剂为通过烷基化靶向dna链间交联的药物。通过烷基化靶向dna链间交联的药物选自:dna靶向氮芥(dnatargetedmustard);鸟嘌呤特异性烷化剂;和腺嘌呤特异性烷化剂。在一个实施方案中,细胞毒性或细胞生长抑制剂为dna靶向氮芥。例如,dna靶向氮芥可以选自由以下组成的组:寡聚吡咯;寡咪唑(oligoimidazole);双-(苯并咪唑)(bis-(benzimidazole))载体;聚苯甲酰胺(polybenzamide)载体;和9-苯胺基吖啶-4-甲酰胺(9-anilinoacridine-4-carboxamide)载体。
在一个实施方案中,细胞毒性或细胞生长抑制剂选自由以下各项组成的组:纺锤菌素(netropsin);偏端霉素(distamycin);lexitropsin;他莫司汀(tallimustine);二溴他莫司汀(dibromotallimustine);pnu157977;和men10710。
在一个实施方案中,细胞毒性或细胞生长抑制剂为双-(苯并咪唑)载体。优选地,药物为hoechst33258。
鸟嘌呤特异性烷化剂为在特定核苷位置反应的高度区域特异性烷化剂。在一个实施方案中,细胞毒性或细胞生长抑制剂为选自由以下组成的组的鸟嘌呤特异性烷化剂:g-n2烷化剂(alkylator);a-n3烷化剂;丝裂霉素;carmethizole类似物;海鞘素类似物。在一个实施方案中,丝裂霉素选自:丝裂霉素a;丝裂霉素c;紫菜霉素(porfiromycin);和kw-2149。在一个实施方案中,carmethizole类似物选自:双-(羟甲基)双吡咯烷(bis-(hydroxymethyl)pyrrolizidine);和nsc602668。在一个实施方案中,海鞘素类似物为海鞘素743。
腺嘌呤特异性烷化剂为在多聚嘧啶(polypyrimidine)序列中腺嘌呤的n3处反应的区域特异性和序列特异性小沟烷化剂。
cyclopropaindolone和倍癌霉素可以被定义为腺嘌呤特异性烷化剂。在一个实施方案中,细胞毒性或细胞生长抑制剂为cyclopropaindolone类似物。优选地,药物选自:阿多来新(adozelesin);和卡折来新(carzelesin)。
在一个实施方案中,细胞毒性或细胞生长抑制剂为苯基吲哚酮(benz[e]indolone)。优选地,细胞毒性或细胞生长抑制剂选自:cbi-tmi;和iso-cbi。
在一个实施方案中,细胞毒性或细胞生长抑制剂是比折来新(bizelesin)。
在一个实施方案中,细胞毒性或细胞生长抑制剂为海洋抗肿瘤药物(marineantitumordrug)。海洋抗肿瘤药物一直为抗肿瘤药物开发领域的发展领域(i.bhatnagar等,mar.drugs2010,8,p2702-2720和t.l.simmons等,mol.cancerther.2005,4(2),p333-342)。已经对包括海绵、海绵-微生物共生群丛(association)、柳珊瑚(gorgonian)、放线菌和软珊瑚的海洋生物广泛研究以用于潜在的抗癌剂。
在一个实施方案中,细胞毒性或细胞生长抑制剂选自:阿糖胞苷(cytarabine),ara-c;曲贝替定(trabectedin)(et-743);和甲磺酸艾日布林(eribulinmesylate)。在一个实施方案中,甲磺酸艾日布林选自:(e7389);soblidotin(tzt1027);乳酸角鲨胺(squalaminelactate);cemadotinplinabulin(npi-2358);plitidepsin;elisidepsin;zalypsis;tasidotin、synthadotin;(ilx-651);圆皮海绵内酯(discodermolide);ht1286;laf389;kahalalidef;krn7000;苔藓抑素1(bryostatin1);hemiasterlin(e7974);marizomib;salinosporamidea;npi-0052);ly355703;crypto52;缩酚酸肽(depsipeptide)(nsc630176);海鞘素743;synthadotin;kahalalidef;角鲨胺(squalamine);脱氢膜海鞘素b(dehydrodidemninb);膜海鞘素b(didemninb);西马多丁(cemadotin);soblidotin;e7389;nvp-laq824;圆皮海绵内酯;hti-286;laf-389;krn-7000(agelasphin衍生物);curacina;dmmc;salinosporamidea;laulimalide;vitilevuamide;含氯环肽(diazonamide);五加素(eleutherobin);匍枝珊瑚醇(sarcodictyin);pelorusidea;salicylihalimidesa和b;噻可拉林(thiocoraline);ascididemin;variolins;片螺素d(lamellarind);dictyodendrins;es-285(spisulosine);和软海绵素b(halichondrinb)。
本发明也涵盖以下细胞毒性或细胞生长抑制剂:鹅膏菌属(amanita)的担子菌(basidiomycetes)产生的鹅膏毒蕈肽(α-鹅膏毒环肽)-二环八肽(bicyclicoctapeptides),例如青鬼尾鹅膏菌(greendeathcapmushroom);tubulysins;细胞溶素;dolabellanins;埃博霉素a、b、c、d、e、f。埃博霉素-构成一类非紫杉烷微管蛋白聚合剂,并通过粘细菌(myxobacterium)sorangiumcellulosum的天然发酵获得。这些部分具有有效的细胞毒活性,这与微管的稳定有关,并导致在g2/m转换期的有丝分裂停滞。埃博霉素已经在一组癌细胞系上表现出有效的细胞毒性,并且通常表现出比紫杉醇(paclitaxel)更高的效力(x.:pivot等,europeanoncology,2008;4(2),p42-45)。在一个实施方案中,药物为鹅膏毒蕈肽。在一个实施方案中,药物为微管溶素(tubulysin)。在一个实施方案中,药物为细胞溶素。在一个实施方案中,药物为dolabellanin。在一个实施方案中,药物为埃博霉素。
本发明还涵盖以下细胞毒性或细胞生长抑制剂。在一个实施方案中,该药物选自:多柔比星(doxorubicin);表柔比星(epirubicin);依索比星(esorubicin);地托比星(detorubicin);吗啉代-多柔比星(morpholino-doxorubicin);氨甲喋呤(methotrexate);甲氨喋呤(methopterin);博莱霉素(bleomycin);二氯甲氨喋呤(dichloromethotrexate);5-氟尿嘧啶;胞嘧啶-β-d-阿拉伯呋喃糖苷(cytosine-β-d-arabinofuranoside);紫杉酚(taxol);蛇形菌素(anguidine);美法仑(melphalan);长春花碱(vinblastine);拟茎点霉毒素a(phomopsina);核糖体失活蛋白(rip);柔红霉素(daunorubicin);长春花生物碱(vincaalkaloids);伊达比星(idarubicin);美法仑;顺铂;蓖麻毒蛋白(ricin);肥皂草毒蛋白(saporin);蒽环类抗生素(anthracyclines);吲哚-苯二氮卓类(indolino-benzodiazepines);6-巯基嘌呤(6-mercaptopurine);放线菌素;环氧长春碱(leurosine);异长春碱(leurosideine);洋红霉素(carminomycin);氨基喋呤(aminopterin);他利霉素(tallysomycin);足叶草毒素(podophyllotoxin);依托泊苷(etoposide);发夹聚酰胺(hairpinpolyamide);磷酸依托泊苷;长春花碱;长春花新碱(vincristine);脱乙酰长春花碱(vindesine);泰索帝视黄酸(taxotereretinoicacid);n8-乙酰基亚精胺(n8-acetylspermidine);喜树碱;埃斯培拉霉素(esperamicin);和烯二炔类(ene-diynes)。
在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd7抗体或其结合部分并且其中所述细胞杀伤部分是肽毒素,例如奥利斯他汀如mmae。在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd33抗体或其结合部分并且其中所述细胞杀伤部分是肽毒素,例如奥利斯他汀如mmae。在一个实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,其中结合部分是抗-cd7抗-cd33双特异性抗体或其结合部分并且其中所述细胞杀伤部分是肽毒素,例如奥利斯他汀如mmae。
在某些实施方案中,细胞抑制剂包含与细胞杀伤部分缀合的结合部分。此种缀合物可以通过本领域技术人员已知的体外方法制备。用于将细胞毒性或细胞生长抑制剂与蛋白质并且特别是与抗体缀合的技术是已知的。(参见,例如,alley等,currentopinioninchemicalbiology201014:1-9;senter,cancerj.,2008,14(3):154-169.)
在某些实施方案中,使用连接基团来使结合部分与细胞杀伤部分缀合。
接头可以是在胞内条件下可裂解的,以使得在胞内环境中接头的裂解使细胞杀伤部分自结合部分释放。可裂解的接头可以是,例如,由胞内的肽酶或蛋白酶(包括溶酶体或内体蛋白酶)裂解的肽基接头。裂解剂可以包括组织蛋白酶b和d以及胞浆素(参见,例如,dubowchik和walker,pharm.therapeutics83:67-123,1999)。最典型的是可被存在于表达ntb-a的细胞中的酶裂解的肽基接头。例如,可以使用可被在癌组织中高度表达的硫醇依赖性蛋白酶组织蛋白酶-b裂解的肽基接头(例如,包含phe-leu或val-cit肽的接头)。
可裂解的接头可以是ph敏感性的,即,在特定ph值对水解敏感。典型地,ph敏感性接头是在酸性条件下可水解的。例如,可以使用可在溶酶体中水解的酸不稳定性接头(例如,腙、半卡巴腙、胺苯硫脲、顺式-乌头酰胺、原酸酯、乙缩醛、缩酮等)。
其他接头是在还原条件下可裂解的(例如,二硫键接头)。可裂解的接头还可以是丙二酸接头(johnson等,anticancerres.15:1387-93,1995)、马来酰亚胺苯甲酰接头(lau等,bioorg-med-chem.3:1299-1304,1995)、或3'-n-酰胺类似物(lau等,bioorg-med-chem.3:1305-12,1995)。
在一些实施方案中,所述接头可以是蛋白酶可裂解接头,例如缬氨酸-瓜氨酸,其可以被溶酶体中的组织蛋白酶b裂解。
所述接头还可以是不可裂解的接头,如马来酰亚胺-烯烃-或马来酰亚胺-芳基接头,所述接头与治疗剂直接相连并且通过结合部分的蛋白水解分解释放。
在某些实施方案中,细胞抑制剂包含结合部分和细胞杀伤部分,所述结合部分和细胞杀伤部分被分开施用并且在体内结合以共同形成所述细胞抑制剂。例如,首先施用细胞结合部分并且同时或优选地随后施用细胞抑制剂,其在体内结合所述细胞结合部分。适用于提供相互具有亲和力的细胞结合部分和细胞抑制剂的具体的结合对是本领域中已知的(例如生物素与亲和素或链霉亲和素,抗体结合结构域与抗原)。
在本申请的说明书和权利要求书中,词语“包含”和“含有”及其变体表示“包括但不限于”,并且其不意在(并且不)排除其他部分、添加剂、组分、整数或步骤。在本申请的说明书和权利要求书中,单数形式涵盖复数形式,除非上下文另有要求。特别地,当使用不定冠词时,说明书要被理解为预期复数以及单数,除非上下文另有要求。
结合本发明的特别的方面、实施方案或实施例描述的特性、整数、特征,化合物、化学部分或基团要被理解为可应用于本文所述的任何其他方面、实施方案或实施例,除非其不相容。本文(包括任何随附的权利要求,摘要和附图)中公开的所有特征,和/或如此公开的任何方法或过程的所有步骤,可以任意组合结合,例外是其中此种特征和/或步骤中的至少一些相互排斥的组合。本发明不受限于任何前述实施方案的细节。本发明延伸至本文(包括任何随附的权利要求,摘要和附图)中公开的特征中的一个,或任意新的组合,或延伸至如此公开的任何方法或过程的步骤的任意新的一个,或任意新的组合。
读者的注意被引导到与本说明书同时提交或在此之前提交的与本申请有关的、并且向公众开放供查阅的所有论文和文献,并且所有此类论文和文献的内容通过引用并入本文。
实施例
实施例1:确定5种单克隆抗体(单独地及组合地)在kasumi-3细胞系中的ic50
实验条件
表a:测试的实验条件的概览.
注:cd(a)=cd33;cd(b)=cd7;cd(c)=cd13
测试样品数目
5种抗体或组合*8个浓度*1种细胞系*3(一式三份)=120
阴性对照(与mmae连接的抗-fc)*1个浓度*1种细胞系*3(一式三份)=3
3种阳性对照(第一抗体)*1个浓度*1种细胞系*3(一式三份)=9
对照(未进行抗体处理的细胞)*1种细胞系*3(一式三份)=3
总计=135次测试
2.材料:
i.kasumi-3:
ii.rpmi-1640培养基:
iii.胎牛血清(fbs):
iv.dulbecco's磷酸盐缓存盐水(dpbs):gibcotm
v.单克隆抗体:o抗-cd33抗体o抗-cd7抗体o抗-cd13抗体
vi.第二抗体
-具有可裂解接头的抗-小鼠iggfc-mmae抗体(αmfc-cl-mmae):moradec
vii.非粘附培养瓶
viii.
ix.96孔板(组织级-白)
3.方法:
3.1细胞培养
利用完全生长培养基(具有20%fbs的rpmi-1640)在37℃在5%co2培养箱中将kasumi-3细胞保持悬浮。将细胞密度保持在3x105至3x106细胞/ml,以2-3天的间隔换培养基。
3.2使用
i.以在100μl培养基中的20,000细胞/孔的密度将新鲜分离的kasumi-3细胞接种到白色96孔板中的培养基中。
ii.将第一单克隆抗体(cd33、cd7和cd13)稀释在培养基中并添加至所述平板以获得所需的浓度范围(0.0001nm至1000nm)。
iii.然后在第一抗体存在下将细胞孵育5至10分钟。
iv.同时,将第二抗体(αmfc-cl-mmae)稀释在培养基中。在与第一抗体孵育后,将αmfc-cl-mmae加入至所述孔中以获得13.2nm/孔。
v.将条件如空白、对照、阴性对照和阳性对照同样包括在各测定平板中。kasumi-3与抗-cd33、抗-cd7、抗-cd13、抗-cd33+抗-cd7组合和抗-cd33+抗-cd13组合的平板布置分别参看表1-5。
·空白=仅培养基
·对照=没有处理的细胞
·阴性对照=用13.2nmαmfc-cl-mmae处理的细胞
·阳性对照=用0.1nm第一抗体处理的细胞
vi.将平板孵育72小时。
vii.在孵育72小时后,将100μl的celltiter-glo试剂加入各孔。
viii.在定轨摇床上将内容物混合2分钟以引起细胞溶解并且在室温孵育10分钟。
ix.使用promega
3.3数据分析
从所有其他的读数中减去空白的平均读数。空白仅含有培养基并且代表测定平板的背景。然后对数据进行统计分析(单向anova,继之以事后dunnett多重比较检验)并且使用graphpadprism7.02软件作图。发光强度以y轴上的相对发光单位(rlu)表示而不同条件和第一抗体浓度表示在x轴上。
计算细胞的百分比生存力(生存力%),取对照(未处理的)作为100%存活。将其他细胞的生存力百分比相对对照归一化。在graphpadprism7.02软件中使用非线性回归曲线对数据作图。ic50被定义为在第二抗体药物缀合物(αmfc-cl-mmae)存在下引起50%细胞毒性作用的相关第一抗体的浓度。这是使用非线性回归曲线拟合分析出的生存力%曲线计算出的。
4.结果
4.1抗-cd33抗体对kasumi-3细胞的细胞毒性特征
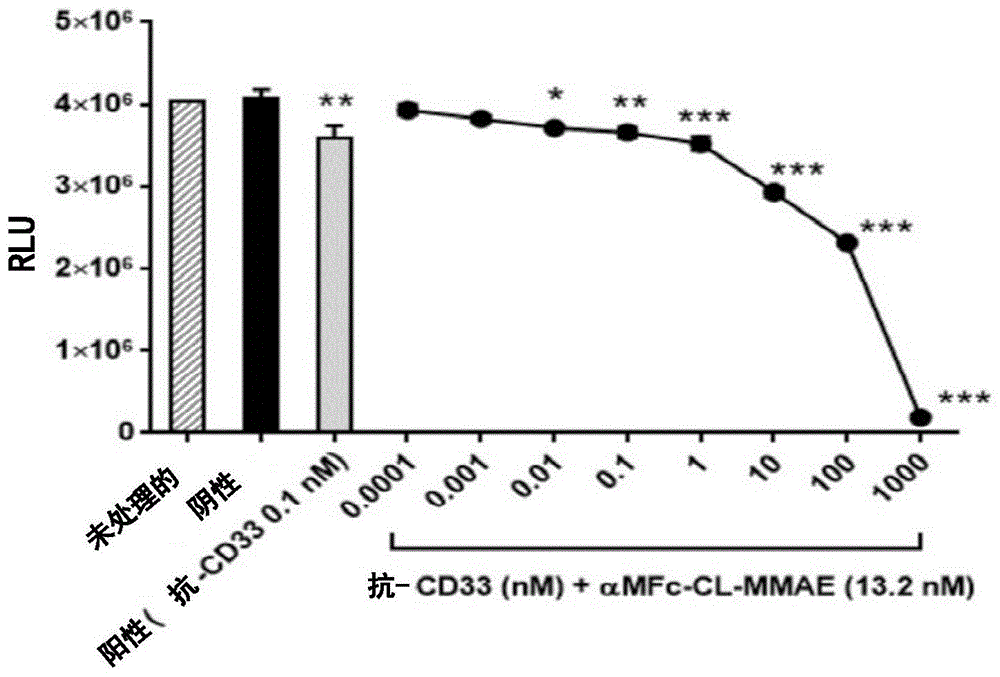
-抗-cd33处理的发光强度的原始数据和减去空白后的数据分别在表6和7中给出。表7的图形表示在图1中给出。图1显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在0.01nm抗-cd33抗体以上的浓度观察到kasumi-3细胞生存力的统计学上显著的减小(*p<0.02;**p<0.005;***p<0.0003,<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-单向anova继之以事后dunnett多重比较检验在表7数据上进行。当与未处理细胞相比时,在αmfc-cl-mmae存在下在0.01nm、0.1nm、1nm、10nm、100nm和1000nm抗-cd33抗体的情况下观察到kasumi-3生存力的统计学上显著的减小(*p<0.02;**p<0.005;***p<0.001)。
-生存力%的数据在表8中给出并且在图2中用图形表示。图2显示抗-cd33和αmfc-cl-mmae治疗的非线性回归曲线。观察到ic50=163.6nm。
-由非线性回归曲线获得163.6nm的ic50。
4.2抗-cd7抗体对kasumi-3细胞的细胞毒性特征
-抗-cd7处理的发光强度的原始数据和减去空白后的数据分别自表9和10中给出。表12的图形表示在图3中给出。图3显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在10nm、100nm和1000nm抗-cd7抗体的情况下观察到kasumi-3细胞生存力的统计学上显著的减小(***p<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对表10数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在10nm、100nm和1000nm抗-cd7抗体的情况下观察到kasumi-3生存力的统计学上显著的减小(***p<0.0001)。
-生存力%的数据在表11中给出并且在图4中用图形表示。
-由非线性回归曲线获得ic50为158.2nm。
4.3抗-cd13抗体对kasumi-3细胞的细胞毒性特征
-抗-cd13处理的发光强度的原始数据和减去空白后的数据分别在表12和13中给出。表13的图形表示在图5中给出。图5显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在抗-cd13抗体的所有浓度都观察到kasumi-3细胞生存力的统计学上显著的减小(***p<0.0006;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对表13数据上进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在抗-cd13抗体的所有浓度(0.0001nm-1000nm)都观察到kasumi-3生存力的统计学上显著的减小(***p<0.0006)。
-生存力%的数据在表14中给出并且在图6中用图形表示。图6显示抗-cd13处理的非线性回归曲线。观察到ic50=1.356nm。
-由非线性回归曲线获得ic50为1.356nm。
4.4抗-cd33+抗-cd7抗体对kasumi-3细胞的细胞毒性特征
-抗-cd33+抗-cd7组合处理的发光强度的原始数据和减去空白后的数据分别在表15和16中给出。表16的图形表示在图7中给出。图7显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在1nm、10nm、100nm和1000nm抗-cd33+抗-cd7组合的情况下观察到kasumi-3细胞生存力的统计学上显著的减小(***p<0.0007;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对图22数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在1nm以上浓度的抗-cd33+抗-cd7组合的情况下观察到kasumi-3生存力的统计学上显著的减小(***p<0.0007)。
-生存力%的数据在表17中给出并且在图8中用图形表示。图8显示抗-cd33+抗-cd7处理的非线性回归曲线。观察到ic50=8.196nm。
-由非线性回归曲线获得ic50为8.196nm。
4.5抗-cd33+抗-cd13抗体对kasumi-3细胞的细胞毒性特征
-抗-cd33+抗-cd13处理的发光强度的原始数据和减去空白后的数据分别在表18和19中给出。表19的图形表示在图9中给出。图9显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在抗-cd33+抗-cd13组合的所有浓度都观察到kasumi-3细胞生存力的统计学上显著的减小(***p<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对表19数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在抗-cd33+抗-cd13组合的所有浓度都观察到kasumi-3生存力的统计学上显著的减小(***p<0.0001)。
-生存力%的数据在表20中给出并且在图10中用图形表示。图10显示抗-cd33+抗-cd13处理的非线性回归曲线。观察到ic50=9.378nm。
-由非线性回归曲线获得ic50为9.378nm。
5.结论:
-当在αmfc-cl-mmae存在下用0.01nm、0.1nm、1nm、10nm、100nm和1000nm浓度的抗-cd33抗体处理时,kasumi-3细胞显示细胞生存力的统计学上显著的减小(*<0.02;**p<0.005;***<0.001)。由生存力%曲线计算得到ic50=163.6nm。
-当在αmfc-cl-mmae存在下用10nm、100nm和1000nm浓度的抗-cd7抗体处理时,kasumi-3细胞显示细胞生存力的统计学上显著的减小(***p<0.0001)。由生存力%曲线计算得到ic50=158.2nm。
-当在αmfc-cl-mmae存在下用所有浓度的抗-cd13抗体处理时,kasumi-3细胞显示细胞生存力的统计学上显著的减小(***p<0.0006)。由生存力%曲线计算得到ic50=1.356nm。
-当在αmfc-cl-mmae存在下用1nm、10nm、100nm和1000nm浓度的抗-cd33和抗-cd7抗体的组合进行处理时,kasumi-3细胞显示细胞生存力的统计学上显著的减小(***p<0.0007)。由生存力%曲线计算得到ic50=8.196nm。
-当在αmfc-cl-mmae存在下用所有浓度的抗-cd33和抗-cd13抗体的组合进行处理时,kasumi-3细胞显示细胞生存力的统计学上显著的减小(***p<0.0001)。由生存力%曲线计算得到ic50=9.378nm。
这些结果概述在下表b中:
6.概要:
-当用单独的第二抗体-药物缀合物αmfc-cl-mmae(阴性对照)处理时,kasumi-3细胞显示最小毒性。
-第一抗体(抗-cd7)在0.1nm的浓度对kasumi-3细胞不显示毒性。选择0.1nm的中等浓度的第一抗体来作为阳性对照进行测试。
-然而,在不存在αmfc-cl-mmae的情况下,抗-cd33和抗-cd13抗体在0.1nm浓度对kasumi-3细胞显示显著的毒性。
-当在抗-cd33、抗-cd7、抗-cd13及组合存在下用αmfc-cl-mmae处理kasumi-3细胞时,观察到细胞生存力的剂量依赖性下降。这显示第一抗体结合过表达的细胞表面标志物的特异性。
-当在抗-cd7和抗-cd33抗体存在下用αmfc-cl-mmae处理kasumi-3细胞时,观察到细胞生存力的非预期的协同性下降。
实施例2:在双抗原细胞系hel92.1.7中测定3种单克隆抗体(单独及组合)的ic50
实验条件
表c:测试的实验条件的概览
注:cd(a)=cd33;1;cd(d)=cd56
测试样品数目
-3种抗体或组合*8个浓度*1种细胞系*3(一式三份)=72
-阴性对照(与mmae连接的抗-fc)*1个浓度*1种细胞系*3(一式三份)=3
-2种阳性对照(第一抗体)*1个浓度*1种细胞系*3(一式三份)=6
-对照(未进行抗体处理的细胞)*1种细胞系*3(一式三份)=3
总计=84次测试
2.材料:
i.hel92.1.7:
ii.rpmi-1640培养基:
iii.胎牛血清(fbs):
iv.dulbecco磷酸盐缓存盐水(dpbs):gibcotm
v.单克隆抗体:
-抗-cd33抗体
-抗-cd56抗体
vi.第二抗体
具有可裂解接头的抗-小鼠iggfc-mmae抗体(αmfc-cl-mmae):moradec
vii.非粘附培养瓶
viii.
ix.96孔板(组织级-白)
3.方法:
3.1细胞培养
利用完全生长培养基(具有10%fbs的rpmi-1640)在37℃在5%co2培养箱中将hel92.1.7细胞保持悬浮。将细胞密度保持在1x105细胞/ml至1x106细胞/ml,以2-3天的间隔更换培养基。
3.2使用
i.以在100μl培养基中的5,000细胞/孔的密度将新鲜分离的hel92.1.7细胞接种到白色96孔板中的培养基中。
ii.将第一单克隆抗体(cd33,cd56)稀释在培养基中并添加至所述平板以获得所需的浓度范围(0.0001nm至1000nm)。
iii.然后在第一抗体存在下将细胞孵育5至10分钟。
iv.同时,将第二抗体(αmfc-cl-mmae)稀释在培养基中。在与第一抗体孵育后,将αmfc-cl-mmae加入至所述孔中以获得13.2nm/孔。
v.将条件如空白、对照、阴性对照和阳性对照同样包括在各测定平板中。hel92.1.7与抗-cd33、抗-cd56和抗-cd33+抗-cd56组合的平板布置分别参看表21、22和23。
·空白=仅培养基
·对照=没有处理的细胞
·阴性对照=用13.2nmαmfc-cl-mmae处理的细胞
·阳性对照=用0.1nm第一抗体处理的细胞
vi.将平板孵育72小时。
vii.在孵育72小时后,将100μl的celltiter-glo试剂加入各孔。
viii.在定轨摇床上将内容物混合2分钟以引起细胞溶解并且在室温孵育10分钟。
ix.使用promega
3.3数据分析
-从所有其他的读数中减去空白的平均读数。空白仅含有培养基并且代表测定平板的背景。然后对数据进行统计分析(单向anova,继之以事后dunnett多重比较检验)并且使用graphpadprism7.02软件作图。发光强度以y轴上的相对发光单位(rlu)表示而不同条件和第一抗体浓度表示在x轴上。
-计算细胞的百分比生存力(生存力%),取对照(未处理的)作为100%存活。将其他细胞的生存力百分比相对对照归一化。在graphpadprism7.02软件中使用非线性回归曲线对数据作图。ic50被定义为在第二抗体药物缀合物(αmfc-cl-mmae)存在下引起50%细胞毒性作用的相关第一抗体(单独的cd33,cd56或cd33+cd56的组合)的浓度。这是使用非线性回归曲线拟合分析出的生存力%曲线计算出的。
4.结果:
4.1抗-cd33抗体对hel92.1.7的细胞毒性特征
-抗-cd33处理的发光强度的原始数据和减去空白后的数据分别在表24和25中给出。表25的图形表示在图11中给出。图11显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在10nm、100nm和1000nm抗-cd33抗体的情况下观察到hel92.1.7细胞生存力的统计学上显著的减小(*p<0.05;**p<0.01;****p<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对表25数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在10nm、100nm和1000nm抗-cd33抗体的情况下观察到hel92.1.7生存力的统计学上显著的减小(*p<0.05;**p<0.01;****p<0.0001)。
-生存力%的数据在表26中给出并且在图12中用图形表示。图12显示抗-cd33和αmfc-cl-mmae治疗的非线性回归曲线。观察到ic50=915.7nm。
-由非线性回归曲线获得ic50为915.7nm。
4.2抗-cd56抗体对hel92.1.7的细胞毒性特征
-抗-cd56处理的发光强度的原始数据和减去空白后的数据分别在表27和28中给出。表28的图形表示在图13中给出。图13显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在0.1nm、1nm、10nm、100nm和1000nm抗-cd33抗体的情况下观察到hel92.1.7细胞生存力的统计学上显著的减小(*p<0.05;****p<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对图40数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在0.1nm、1nm、10nm、100nm和1000nm抗-cd56抗体的情况下观察到hel92.1.7生存力的统计学上显著的减小(*p<0.05;****p<0.0001)。
-生存力%的数据在表29中给出并且在图14中用图形表示。图14显示抗-cd56和αmfc-cl-mmae治疗的非线性回归曲线。观察到ic50=15.82nm。
-由非线性回归曲线获得ic50为15.82nm。
4.3抗-cd33和抗-cd56抗体的组合对hel92.1.7的细胞毒性特征
-抗-cd33和抗-cd56组合处理的发光强度的原始数据和减去空白后的数据分别在表30和31中给出。表31的图形表示在图15中给出。图15显示当使用单向anova并继之以dunnett事后多重比较检验进行分析时,在13.2nmαmfc-cl-mmae存在下,在1nm、10nm、100nm和1000nm抗-cd33+抗-cd56抗体组合的情况下观察到hel92.1.7细胞生存力的统计学上显著的减小(*p<0.05;***p<0.001;****p<0.0001;±sem)。量化被表示为平均值(±标准差平均值[sem])。
-对表31数据进行单向anova继之以事后dunnett多重比较检验。当与未处理细胞比较时,在αmfc-cl-mmae存在下,在1nm、10nm、100nm和1000nm抗-cd56抗体的情况下观察到hel92.1.7生存力的统计学上显著的减小(*p<0.05;***p<0.001;****p<0.0001)。
-生存力%的数据在表32中给出并且在图16中用图形表示。图16显示抗-cd33+抗-cd56组合处理的非线性回归曲线。观察到ic50=16.95nm。
-由非线性回归曲线获得ic50为16.95nm。
5.结论:
-当在αmfc-cl-mmae存在下用10nm、100nm和1000nm浓度的抗-cd33抗体处理时,hel92.1.7细胞显示细胞生存力的统计学上显著的减小(*p<0.05;**p<0.01;****p<0.0001)。由生存力%曲线计算得到ic50=915.7nm。
-当在αmfc-cl-mmae存在下用0.1nm、1nm、10nm、100nm和1000nm浓度的抗-cd56抗体处理时,hel92.1.7细胞显示细胞生存力的统计学上显著的减小(*p<0.05;****p<0.0001)。由生存力%曲线计算得到ic50=15.82nm。
-当在αmfc-cl-mmae存在下用1nm、10nm、100nm和1000nm浓度的抗-cd33和抗-cd56抗体的组合处理时,hel92.1.7细胞显示细胞生存力的统计学上显著的减小(*p<0.05;***p<0.001;****p<0.0001)。由生存力%曲线计算得到ic50=16.95nm。
这些结果概述于下表d中:
6.概要:
-当用单独的第二抗体-药物缀合物αmfc-cl-mmae处理时(阴性对照),hel92.1.7细胞显示最小毒性。
-第一抗体(抗-cd33,抗-cd56和组合)在0.1nm的浓度对hel92.1.7细胞不显示毒性。选择0.1nm的中等浓度的第一抗体作为阳性对照进行测试。
-当在抗-cd33、抗-cd56和组合第一抗体存在下用αmfc-cl-mmae处理hel92.1.7细胞时,观察到细胞生存力的剂量依赖性下降。这显示第一抗体结合过表达的细胞表面标志物的特异性。
-当与抗-cd33(915.7nm)和组合(16.95nm)处理相比时,当在αmfc-cl-mmae存在下用抗-cd56抗体处理时hel92.1.7细胞系显示更低的ic50(15.82nm)。这可能是由于与cd33标志物相比cd56标志物在hel92.1.7的细胞表面上的表达更高。
实施例3:使用bifab针对kasumi-3重复第二细胞杀伤测定
使用bifab针对kasumi-3细胞系进行实验以重复第二细胞杀伤测定。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
方法
收获kasumi-3细胞,计数并以2x104个细胞/孔接种到96孔板的100μl生长培养基中。以50倍测定终浓度在生长培养基中准备wtbifab的5点剂量响应。将2μl的wtbifab滴定液移液到接种的细胞上,各浓度在一式三份的孔上进行测定。将细胞在室温孵育10分钟以使bifab结合。同时,将抗-人iggfab-mmae抗体在生长培养基中稀释以提供6nmmmae/孔的测定终浓度,如生产商说明书中所述。每孔中移入2μl稀释的mmae抗体。包括没有bifab或mmae缀合的抗体的对照孔。将平板在37℃,5%co2孵育72小时。72小时后,添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图并显示在图17中。
结果
在图17中作图的od492nm–690nm是用bi-fab/抗-人fab-mmae复合物处理细胞96小时后残留的活kasumi-3细胞的量度。增加的bi-fab浓度导致表现为活细胞减少的细胞杀伤增加。在不存在cd7/cd33bi-fab的情况下用抗-人fab-mmae处理kasumi-3细胞不引起细胞杀伤。
结论
cd7/cd33bi-fab/抗-人fab-mmae复合物与cd7/cd33双抗原阳性细胞的结合导致复合物的内化和随后的表现为活细胞数量减少的细胞杀伤。
实施例4:使用直接缀合的bifab重复细胞杀伤测定
使用直接缀合的bifab进行实验以重复细胞杀伤测定。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
1%青霉素-链霉素
方法
收获kasumi-3细胞,计数并以2x104细胞/90μl生长培养基重悬。以10倍测定终浓度在生长培养基中制备bifab-mmae的8点剂量响应。将10μl的wtbifab-mmae滴定液移入96孔板中,并且各浓度在一式两份的孔中测试。将90μl的细胞移入孔中并将平板在37℃,5%co2孵育96小时。在孵育后,添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图并显示在图18中。
结果
在图18中作图的od492nm–690nm是用抗cd7/cd33bi-fab-mmae缀合物处理细胞96小时后残余的活kasumi-3细胞的量度。增加的bi-fab-mmae浓度导致表现为活细胞减少的细胞杀伤增加。
结论
cd7/cd33bi-fab-mmae与cd7/cd33双抗原阳性细胞的结合导致复合物的内化和随后的表现为活细胞数量减少的细胞杀伤。
实施例5:使用商业化抗体和抗-小鼠fc-mmae重复细胞杀伤测定
使用商业化抗体和抗-小鼠fc-mmae进行实验以重复细胞杀伤测定。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
方法
收获kasumi-3细胞(图19)和set-2细胞(图20),计数并将各细胞系以2x104细胞/80μl生长培养基重悬。以10倍测定终浓度在生长培养基中制备cd7和cd33抗体中每种的5点剂量响应。将10μl抗体滴定液和10μl生长培养基移入96孔板中,并在一式三份的孔中测试cd7或cd33抗体的各浓度。对于抗体组合,将10μl的相同浓度的cd7抗体和cd33抗体添加到孔中。将80μl细胞移入孔中并将平板和细胞在室温孵育10分钟以使抗体结合。将抗-鼠fc-mmae抗体在生长培养基中稀释以提供13.2nmmmae/孔的测定终浓度,如生产商说明书中所述。每孔中移入2μl稀释的mmae抗体。包括没有抗体或mmae缀合抗体的对照孔。将平板在37℃,5%co2孵育96小时。96小时后,添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图并显示在图19和20中。
结果
在图19和20中作图的od492nm–690nm是在用与抗-小鼠fc-mmae缀合的单独的抗-cd7、单独的抗-cd33或抗-cd7+抗-cd33抗体处理细胞96小时后残余的活kasumi-3细胞(图19)和set-2(图20)的量度。在抗-cd7和抗-cd33/抗-小鼠fc-mmae复合物浓度增加的情况下观察到增加的细胞杀伤。单独的抗-小鼠fc-mmae不引起任何细胞杀伤。
结论
与抗-小鼠fc-mmae形成复合物的抗-cd7和抗-cd33抗体与双抗原阳性细胞的结合通过抗原内化导致细胞杀伤。在kasumi-3和set-2细胞中,添加抗-cd7和抗-cd33抗体导致比添加单独的抗-cd7抗体更强效的细胞杀伤。
实施例6:确认在结合测定中靶向cd7和cd33之间是否存在协同作用
进行实验以确认在结合测定中靶向cd7和cd33之间是否存在协同作用。
试剂
方法
收获kasumi-3、set-2、molm-16、all-sil、jurkat、hel-92、shi-1、mv4-11、thp-1、dnd-39和ramos细胞并计数。将各细胞系的3x106个细胞通过以1000rpm离心5分钟进行沉淀。将上清倒出并将细胞重悬在10ml的pbs中。将1ml细胞悬液的等分试样转移到5mlfacs管中。给所述管加盖并通过在4℃以1000rpm离心5分钟使细胞再次沉淀。将上清倒出并将细胞重悬于在冰冷的pbs/1%bsa中制备的100μl的1nmwtcd7/cd33bifab、cd7monofab或cd33monofab或各1nm的cd7和cd33monofab的组合中。以一式两份测试各抗体条件。还包括其中细胞仅与第二抗体孵育的对照样品。将细胞在冰上孵育一小时以使fab结合。在孵育后通过向各facs管添加4ml冰冷的pbs去除未结合的fab。通过在4℃以1000rpm离心5分钟使细胞沉淀。将上清倒出并通过将管子在纸巾上倒转尽可能地除去pbs。同时,在pbs/1%bsa中制备第二小鼠抗-fabpe抗体以提供6.6μg的终浓度,如生产商说明书中所述。将细胞在冰上再孵育45分钟。通过用pbs洗涤细胞并如上所述进行离心将过量的第二抗体除去。将上清倒出并将细胞沉淀重悬在300μlpbs中。在fl2中使用bdbiosciences的facscalibur检测细胞上的pe标记。将各fab条件的几何平均值作图并显示在图21和22中。
结果
使用第二抗-人fab-pe抗体,利用facs分析来检测cd7/cd33bi-fab、cd7fab、cd33fab或cd7+cd33fab与白血病细胞系的结合。图21和22中的图形显示测量的与细胞结合的1nm的各fab臂的荧光的几何平均值。
结论
图21中的facs分析显示对于双抗原阳性细胞系kasumi-3和set-2,当单独或组合孵育时,相比于个体fab臂,更多的bi-fab结合所述细胞。与之相比,图22中绘制的facs数据指示当细胞仅表达一种抗原时,bi-fab结合的程度与cd7+ve/cd33-ve细胞中的cd7fab和cd7-ve/cd33+ve细胞系中的cd33fab类似。例外是molm-16和hel-92细胞系,其随后被证明含有仅cd33和cd7/cd33双阳性细胞的亚群。
实施例7:细胞杀伤测定:用cd7、cd33、cd7+cd33和bifab处理的双抗原阳性细胞系
进行细胞杀伤实验以评估用cd7、cd33、cd7+cd33和bifab处理的双抗原阳性细胞系。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
1%青霉素-链霉素
方法
收获kasumi-3细胞和set-2细胞,计数并将各细胞系以2x104细胞/90μl生长培养基重悬。以10倍测定终浓度在生长培养基中制备各bifab-mmae、cd7-mmae、cd33-mmae、cd7-mmae+cd33-mmae或gemtuzumab-mmae的7点剂量响应。将10μl的各滴定液分别移入96孔板中并且在一式两份的孔中测试各浓度。将90μl细胞移入孔中并将平板在37℃,5%co2孵育96小时。在孵育后添加celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图并显示在图23至25中。
结果
图23-25中绘制的od492nm–690nm是在用指定的bi-fab、fab或抗体mmae缀合物处理细胞96小时后残余的活kasumi-3(图23a和24)和set-2(图23b和25)细胞的量度。细胞生存力的下降反映了mmae缀合物的内化及其引起的细胞杀伤。kasumi-3细胞的结果显示虽然cd7/cd33bifab-mmae和gemtuzumab-mmae导致有效细胞杀伤,然而在个体fab-mmae缀合物的情况下在测试浓度没有观察到细胞杀伤。set-2细胞的结果显示仅利用bi-fab-mmae缀合物的处理导致细胞杀伤。
结论
虽然之前的数据指出个体cd7和cd33fab能够结合kasumi-3和set-2细胞,然而在这些fab的mmae缀合物的情况下没有观察到细胞杀伤。相反,cd7/cd33bi-fab在kasumi-3和set-2细胞两者中都引起有效细胞杀伤。
实施例7:cd7/cd33双阳性亚群的特异性细胞杀伤
进行细胞杀伤实验以评估cd7/cd33双阳性亚群。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
1%青霉素-链霉素
方法
收获hel-92和molm-16细胞并以300,000细胞/孔接种在24孔板的1.5mlrpmi生长培养基中。以10x测定终浓度在生长培养基中制备wtbi-fab滴定液,最高终浓度为0.3nm。每孔移入150μl的bi-fab滴定以致用各浓度的bi-fab测试两种细胞系。将细胞在37℃,5%co2孵育72小时。在孵育后收获各测试孔的细胞并在4℃以1000rpm沉淀5分钟。将细胞重悬在300μl冰冷的pbs/1%bsa中。
然后将各样品分成6个等量样品,每个样品约50,000个细胞,分析所述样品的抗-人fab-pe、抗-cd7-pe、抗-cd33fitc、抗-cd7-pe+抗-cd33fitc或无第二抗体的结合。将50μl样品移入v底96孔板的孔中用于第二抗体孵育并且在冰上孵育1小时。将细胞在冰冷的pbs中洗涤1次,沉淀并重悬于在facs管中的300μl的pbs中并使用bdbiosciences的facscalibur分析荧光。
针对在代表仅有cd33抗原的细胞和cd7/cd33双抗原细胞的2个区域中的事件对样品进行分析。将wtbi-fab-mmae对各区域中多种事件的作用作图并显示在图26中。
结果
抗-cd7-pe和抗-cd33-fitc抗体结合hel-92和molm-16细胞系的facs分析指示亚群存在于这些表达cd7和cd33或仅表达cd33的细胞系内。随后将用递增浓度的bi-fab-mmae处理的细胞系的样品用抗-cd7-pe和抗-cd33fitc处理。将仅有cd33的细胞亚群和cd7/cd33细胞亚群进行门控分选并且通过facs记录各样品的各门控分选区域内的细胞的数目。计算在bi-fab-mmae浓度递增的情况下细胞的百分比损失并将数据作图,如图26中所示。
结论
在用cd7/cd33-bifab-mmae处理细胞样品后这些亚群的facs分析指示bi-fab-mmae仅能够特异性杀伤cd7/cd33亚群。
实施例8:wtbi-fab-mmae在进一步的cd7/cd33双阳性aml细胞系上的细胞杀伤分析
进行实验以分析wtbi-fab-mmae在进一步的cd7/cd33双阳性aml细胞系中的细胞杀伤。
试剂
生长培养基
rpmi-1640培养基
10%胎牛血清
1%glutamax补充物
1%青霉素-链霉素
方法
收获uoc-m1和hnt-34细胞,计数并以2x104细胞/90μl生长培养基重悬。以10倍测定终浓度在生长培养基中制备bifab-mmae的8点剂量响应。将10μl的wtbifab-mmae滴定液移入96孔板以在一式两份的孔中测试各浓度。将90μl细胞移入孔中并将平板在37℃,5%co2孵育96小时。
在96小时孵育后,每孔移入10μl的celltiter96aqueousonesolution并将平板在37℃,5%co2再孵育3小时。读取492nm和690nm吸光度。从od492nm减去od690nm并使用graphpadprism软件将数据作图并显示在图27和28中。
结果
图18中绘制的od492nm–690nm是在用抗cd7/cd33bi-fab-mmae缀合物处理细胞96小时后残余的活hnt-34(图27)和uoc-m1(图28)细胞的量度。递增浓度的bi-fab-mmae导致表现为活细胞减少的细胞杀伤增加。
结论
cd7/cd33bi-fab-mmae与cd7/cd33双抗原阳性细胞的结合导致复合物的内化和随后的表现为活细胞数量减少的细胞杀伤。
前述实施方案不意在限制权利要求的保护范围,而是意在描述如何实施本发明的实例。
数据表
表1显示在αmfc-cl-mmae存在下用抗-cd33处理的kasumi-3细胞系的平板布置。
表2显示在αmfc-cl-mmae存在下用抗-cd7处理的kasumi-3细胞系的平板布置。
表3显示在αmfc-cl-mmae存在下用抗-cd13处理的kasumi-3细胞系的平板布置。
表4显示在αmfc-cl-mmae存在下用抗-cd33+抗-cd7组合处理的kasumi-3细胞系的平板布置。
表5显示在αmfc-cl-mmae存在下用抗-cd33+抗-cd13组合处理的kasumi-3细胞系的平板布置。
表6显示来自在αmfc-cl-mmae存在下抗-cd33抗体对kasumi-3的细胞毒性特征的原始数据的结果。
表7显示在αmfc-cl-mmae存在下抗-cd33抗体对kasumi-3的细胞毒性特征的减去空白后的数据。
表8显示存在αmfc-cl-mmae处理时在抗-cd33抗体的情况下kasumi-3生存力的百分比。
表9显示在αmfc-cl-mmae存在下抗-cd7抗体对kasumi-3的细胞毒性特征的原始数据。
表10显示在αmfc-cl-mmae存在下抗-cd7抗体对kasumi-3的细胞毒性特征的减去空白后的数据。
表11显示存在αmfc-cl-mmae处理时在抗-cd7抗体的情况下kasumi-3生存力的百分比。
表12显示在αmfc-cl-mmae存在下抗-cd13抗体对kasumi-3的细胞毒性特征的原始数据。
表13显示在αmfc-cl-mmae存在下抗-cd13抗体对kasumi-3的细胞毒性特征的减去空白后的数据。
表14显示存在αmfc-cl-mmae处理时在抗-cd13抗体的情况下kasumi-3生存力的百分比。
表15显示在αmfc-cl-mmae存在下抗-cd33+抗-cd7抗体对kasumi-3的细胞毒性特征的原始数据。
表16显示在αmfc-cl-mmae存在下抗-cd33+抗-cd7抗体对kasumi-3的细胞毒性特征的减去空白后的数据。
表17显示存在αmfc-cl-mmae处理时在抗-cd33+抗-cd7抗体的情况下kasumi-3生存力的百分比。
表18显示在αmfc-cl-mmae存在下抗-cd33+抗-cd13抗体对kasumi-3的细胞毒性特征的原始数据。
表19显示在αmfc-cl-mmae存在下抗-cd33+抗-cd13抗体对kasumi-3的细胞毒性特征的减去空白后的数据。
表20显示存在αmfc-cl-mmae处理时在抗-cd33+抗-cd13抗体的情况下kasumi-3生存力的百分比。
表21显示存在αmfc-cl-mmae时用抗-cd33处理的hel92.1.7细胞系的平板布置。
表22显示在αmfc-cl-mmae存在下用抗-cd56处理的hel92.1.7细胞系的平板布置。
表23显示在αmfc-cl-mmae存在下用抗-cd33+抗-cd56组合处理的hel92.1.7细胞系的平板布置。
表24显示在αmfc-cl-mmae存在下抗-cd33抗体对hel92.1.7的细胞毒性特征的原始数据。
表25显示在αmfc-cl-mmae存在下抗-cd33抗体对hel92.1.7的细胞毒性特征的减去空白后的数据。
表26显示在存在αmfc-cl-mmae处理时在抗-cd33抗体的情况下hel92.1.7生存力的百分比。
表27显示在αmfc-cl-mmae存在下抗-cd56抗体对hel92.1.7的细胞毒性特征的原始数据。
表28显示在αmfc-cl-mmae存在下抗-cd56抗体对hel92.1.7的细胞毒性特征的减去空白后的数据。
表29显示在存在αmfc-cl-mmae处理时在抗-cd56抗体的情况下hel92.1.7生存力的百分比。
表30显示在αmfc-cl-mmae存在下抗-cd33+抗-cd56抗体对hel92.1.7的细胞毒性特征的原始数据。
表31显示在αmfc-cl-mmae存在下抗-cd33+抗-cd56抗体对hel92.1.7的细胞毒性特征的减去空白后的数据。
表32显示在存在αmfc-cl-mmae处理时在抗-cd33+抗-cd56抗体的情况下hel92.1.7生存力的百分比。
权利要求书(按照条约第19条的修改)
1.用于治疗cd7+cd33+恶性血液肿瘤的用途的结合cd33的细胞抑制剂,其中:所述结合cd33的细胞抑制剂用于与结合cd7的细胞抑制剂组合施用;或其中所述结合cd33的细胞抑制剂还结合cd7。
2.用于根据权利要求1所述的用途的结合cd33的细胞抑制剂,其特征在于,所述结合cd33的细胞抑制剂能够诱导cd33受体介导的所述第一细胞抑制剂到cd33+细胞中的内化。
3.用于根据权利要求1或权利要求2所述的用途的结合cd33的细胞抑制剂,其特征在于,所述cd33+细胞是aml细胞。
4.用于根据权利要求1至3中任一项所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd33抗体或其抗原结合部分。
5.用于根据权利要求1至3中任一项所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞抑制剂包含免疫效应细胞。
6.用于根据权利要求5所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞抑制剂包含t细胞和/或nk细胞。
7.用于根据权利要求6所述的用途的结合cd33的细胞抑制剂,其特征在于,所述免疫效应细胞是t细胞。
8.用于根据权利要求7所述的用途的结合cd33的细胞抑制剂,其特征在于,所述免疫效应细胞是抗-cd33car-t。
9.用于根据权利要求8所述的用途的结合cd33的细胞抑制剂,其特征在于,所述t细胞包含cd33+t细胞。
10.用于根据权利要求1至3中任一项所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞抑制剂包含细胞杀伤部分和cd33结合部分。
11.用于根据权利要求10所述的用途的结合cd33的细胞抑制剂,其特征在于,所述cd33结合部分包含抗体或其抗原结合片段。
12.用于根据权利要求10或权利要求7所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞杀伤部分是细胞毒素。
13.用于根据权利要求12所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞毒素选自:i)肽毒素或ii)化学毒素。
14.用于根据权利要求10至13中任一项所述的用途的结合cd33的细胞抑制剂,其特征在于,所述细胞抑制剂还包含在所述细胞杀伤部分和cd33结合部分之间的连接部分。
15.用于治疗cd7+cd33+恶性血液肿瘤的用途的结合cd7的细胞抑制剂,其中:所述结合cd7的细胞抑制剂用于与结合cd33的细胞抑制剂组合施用;或其中所述结合cd7的抑制剂还结合cd33。
16.用于根据权利要求15所述的用途的结合cd7的细胞抑制剂,其特征在于,所述结合cd7的细胞抑制剂能够诱导cd7受体介导的所述第一细胞抑制剂到cd7+细胞中的内化。
17.用于根据权利要求15或权利要求16所述的用途的结合cd7的细胞抑制剂,其特征在于,所述cd7+细胞是aml细胞。
18.用于根据权利要求15至17中任一项所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd7抗体或其抗原结合部分。
19.用于根据权利要求15至17中任一项所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含免疫效应细胞。
20.用于根据权利要求19所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含t细胞和/或nk细胞。
21.用于根据权利要求20所述的用途的结合cd7的细胞抑制剂,其特征在于,所述免疫效应细胞是t细胞。
22.用于根据权利要求21所述的用途的结合cd7的细胞抑制剂,其特征在于,所述免疫效应细胞是抗-cd7car-t。
23.用于根据权利要求22所述的用途的结合cd7的细胞抑制剂,其特征在于,所述t细胞包含cd7+t细胞。
24.用于根据权利要求15至17中任一项所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含细胞杀伤部分和cd7结合部分。
25.用于根据权利要求24所述的用途的结合cd7的细胞抑制剂,其特征在于,所述cd7结合部分包含抗体或其抗原结合片段。
26.用于根据权利要求24或权利要求25所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞杀伤部分是细胞毒素。
27.用于根据权利要求26所述的用途的结合cd7的细胞抑制剂,其特征在于,所述细胞毒素选自:i)肽毒素或ii)化学毒素。
28.用于根据权利要求24至27中任一项所述的用途的特异性结合cd7的细胞抑制剂,其特征在于,所述细胞抑制剂还包含在所述细胞杀伤部分和cd7结合部分之间的连接部分。
29.用于治疗cd7+cd33+恶性血液肿瘤的用途的结合cd33的细胞抑制剂和结合cd7的细胞抑制剂的组合。
30.用于根据权利要求29所述的用途的组合,其特征在于,所述结合cd33的细胞抑制剂能够诱导cd33受体介导的所述第一细胞抑制剂到cd33+细胞中的内化。
31.用于根据权利要求29或权利要求30所述的用途的组合,其特征在于,所述cd33+细胞是aml细胞。
32.用于根据权利要求29至31中任一项所述的用途的组合,其特征在于,所述结合cd33的细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd33抗体或其抗原结合部分。
33.用于根据权利要求29至32中任一项所述的用途的组合,其特征在于,所述结合cd33的细胞抑制剂包含免疫效应细胞。
34.用于根据权利要求33所述的用途的组合,其特征在于,所述细胞抑制剂包含t细胞和/或nk细胞。
35.用于根据权利要求34所述的用途的组合,其特征在于,所述免疫效应细胞是t细胞。
36.用于根据权利要求35所述的用途的组合,其特征在于,所述免疫效应细胞是抗-cd33car-t。
37.用于根据权利要求36所述的用途的组合,其特征在于,所述t细胞包含cd33+t细胞。
38.用于根据权利要求29至31中任一项所述的用途的组合,其特征在于,所述结合cd33的细胞抑制剂包含细胞杀伤部分和cd33结合部分。
39.用于根据权利要求38所述的用途的组合,其特征在于,所述cd33结合部分包含抗体或其抗原结合片段。
40.用于根据权利要求38或权利要求39所述的用途的组合,其特征在于,所述细胞杀伤部分是细胞毒素。
41.用于根据权利要求40所述的用途的组合,其特征在于,所述细胞毒素选自:i)肽毒素或ii)化学毒素。
42.用于根据权利要求38至41中任一项所述的用途的组合,其特征在于,所述细胞抑制剂还包含在所述细胞杀伤部分和cd33结合部分之间的连接部分。
43.用于根据权利要求29至42中任一项所述的用途的组合,其特征在于,所述特异性结合cd7的细胞抑制剂能够诱导cd7受体介导的所述第一细胞抑制剂到cd7+细胞中的内化。
44.用于根据权利要求43所述的用途的组合,其特征在于,所述cd7+细胞是aml细胞。
45.用于根据权利要求29至44中任一项所述的用途的组合,其特征在于,所述特异性结合cd7的细胞抑制剂是能够介导抗体依赖性细胞介导的细胞毒性的抗-cd7抗体或其抗原结合部分。
46.用于根据权利要求29至44中任一项所述的用途的组合,其特征在于,所述特异性结合cd7的细胞抑制剂是抗-cd7car-t。
47.用于根据权利要求46所述的用途的组合,其特征在于,所述细胞抑制剂包含免疫效应细胞。
48.用于根据权利要求47所述的用途的组合,其特征在于,所述免疫效应细胞包含t细胞和/或nk细胞。
49.用于根据权利要求48所述的用途的组合,其特征在于,所述免疫效应细胞是t细胞。
50.用于根据权利要求49所述的用途的组合,其特征在于,所述t细胞包含cd7+t细胞。
51.用于根据权利要求29至44中任一项所述的用途的组合,其特征在于,所述特异性结合cd7的细胞抑制剂包含细胞杀伤部分和cd7结合部分。
52.用于根据权利要求51所述的用途的组合,其特征在于,所述cd7结合部分包含抗体或其抗原结合片段。
53.用于根据权利要求51或权利要求52所述的用途的组合,其特征在于,所述细胞杀伤部分是细胞毒素。
54.用于根据权利要求53所述的用途的组合,其特征在于,所述细胞毒素选自:i)肽毒素或ii)化学毒素。
55.用于根据权利要求51至54中任一项所述的用途的组合,其特征在于,所述结合cd7的细胞抑制剂还包含在所述细胞杀伤部分和cd7结合部分之间的连接部分。
56.用于治疗cd7+cd33+恶性血液肿瘤的用途的双特异性结合cd33和cd7的细胞抑制剂。
57.用于根据权利要求56所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂能够诱导cd33和/或cd7受体介导的所述细胞抑制剂到cd33+和/或cd7+细胞中的内化。
58.用于根据权利要求56或权利要求57所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述cd33+和cd7+细胞是aml细胞。
59.用于根据权利要求56至58中任一项所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂是双特异性抗体或其抗原结合部分,任选地其中所述双特异性抗体或其抗原结合部分能够介导抗体依赖性细胞介导的细胞毒性。
60.用于根据权利要求56至58中任一项所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含免疫效应细胞。
61.用于根据权利要求60所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含t细胞和/或nk细胞。
62.用于根据权利要求61所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制细胞是t细胞。
63.用于根据权利要求62所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述免疫效应细胞是双特异性抗-cd33抗-cd7car-t。
64.用于根据权利要求63所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述t细胞包含cd33+t细胞,cd7+t细胞,或其组合。
65.用于根据权利要求56至58中任一项所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂包含:i)细胞杀伤部分;ii)cd7结合部分和iii)cd33结合部分。
66.用于根据权利要求65所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述cd33结合部分包含抗体的抗原结合片段。
67.用于根据权利要求65或权利要求66所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述cd7结合部分包含抗体的抗原结合片段。
68.用于根据权利要求65至67中任一项所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞杀伤部分是细胞毒素。
69.用于根据权利要求68所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞毒素选自:i)肽毒素或ii)化学毒素。
70.用于根据权利要求65至69中任一项所述的用途的双特异性结合cd33和cd7的细胞抑制剂,其特征在于,所述细胞抑制剂还包含连接部分。
- 还没有人留言评论。精彩留言会获得点赞!