一种细菌漆酶传感器及在检测高浓度酚类底物的应用的制作方法
本发明涉及生物传感领域,更具体是一种细菌漆酶传感器及在检测高浓度酚类底物的应用。
背景技术:
酚类底物广泛存在于工业废水中,对环境和人类健康造成极大危害。例如,对苯二酚是一种广泛使用的化学品,即使很低的浓度也会对人类和动植物健康造成巨大危害。目前,漆酶制备的电化学生物传感器由于其对酚类底物的催化氧化特性,精确的检测能力以及没有副产物如过氧化氢等物质产生等优点被广泛应用对苯二酚的检测中。
而普通制备的漆酶传感器电极的稳定性较差,不能在极端环境中使用和寿命较短一直是其最难以解决的问题。细菌漆酶相较于真菌漆酶来说,细菌漆酶比酶活和氧化还原电势普遍偏低,限制了其作为酶分子元件的传感电极的检测性能。因此,构建针对酚类底物检测的细菌漆酶传感器具有实际应用意义。
因此,本领域有待开发出一款新型的细菌漆酶传感器,具有高稳定性,测定的浓度范围宽,能够实现在极端情况下对高浓度酚类物质浓度精确的测定。
技术实现要素:
为了解决上述问题,本发明提供了一种细菌漆酶传感器的制备方法,其特征在于,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:细菌漆酶传感电极的构建。
作为一种优选的技术方案,所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用预处理和浓缩手段对a3所得到的细菌漆酶基因进行纯化,获得目的蛋白纯蛋白。
作为一种优选的技术方案,所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于修饰电极混合液中进行表面修饰。
作为一种优选的技术方案,所述细菌漆酶选自bacillussubtilis168。
作为一种优选的技术方案,所述出发载体为ppic9k,所述表达载体为ppic9k-cota。
作为一种优选的技术方案,所述宿主菌为p.pastorisgs115,所述基因工程菌为pastorisgs115/cota。
作为一种优选的技术方案,所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有abts、g418的平板,培养,挑取阳性转化子,保存。
作为一种优选的技术方案,所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液。
作为一种优选的技术方案,所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在醋酸溶液中溶解,得到壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加abts,搅拌均匀,过夜进行负载,得到多壁碳纳米管-壳聚糖-abts溶液。
为了解决上述技术问题,本发明还提供了细菌漆酶传感器的制备方法在高浓度酚类检测中的应用。所述的酚类底物包括多苯二酚,邻苯二酚、间苯二酚及2,6-二甲氧基苯酚等。
本发明的有益效果是:
本发明提供了一种细菌漆酶传感器,稳定性高,对与高浓度范围的酚类物质具有极高的准确性,此外,本发明还能够克服现有技术对于低浓度下检测性能不佳的缺陷,并且能够简化目的蛋白的获取,大大的提升了在现实应用中的可操作性。
附图说明
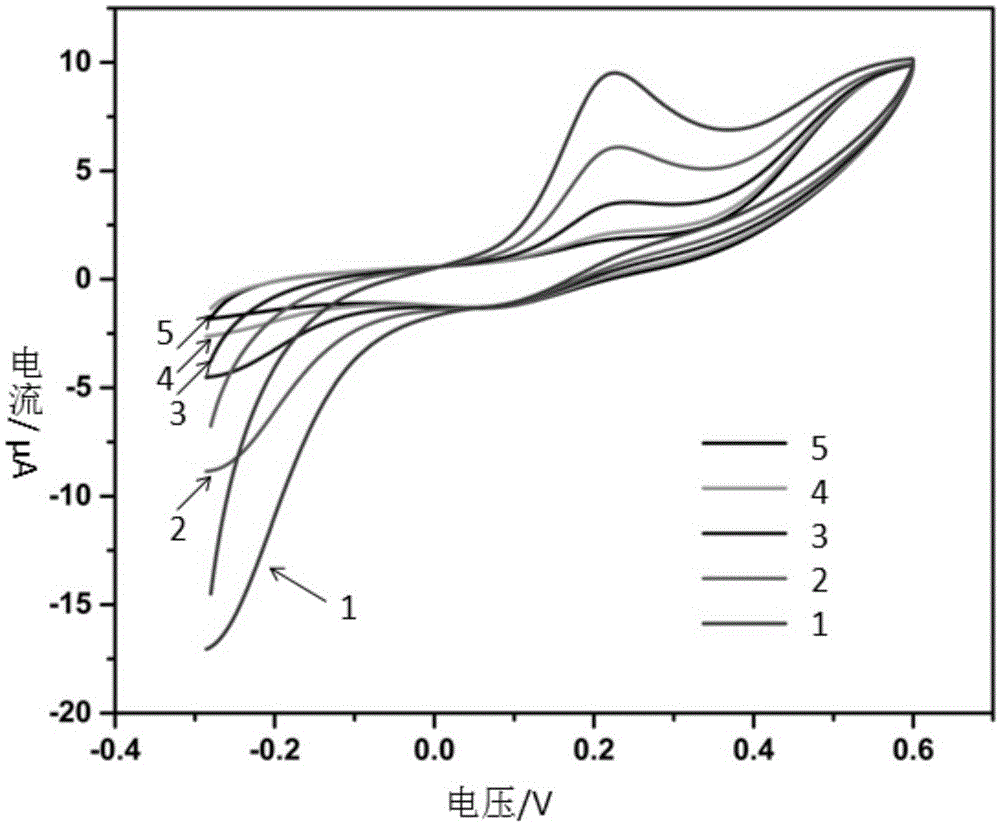
图1是修饰电极对对不同浓度的对苯二酚循环伏安曲线;其中,1代表0.8mmol,2代表0.4mmol,3代表0.2mmol,4代表0.1mmol,5代表0。
图2是构建的传感电极对不同浓度的对苯二酚电流—浓度响应曲线;其中,1代表0.25mmol,2代表0.5mmol,3代表1mmol,4代表2mmol。
图3是构建的传感电极对不同浓度的对苯二酚电流—浓度响应曲线。
图4是构建的细菌漆酶传感电极与真菌漆酶电极稳定性性能比较,其中圆点代表tvlc/abts/mwcnts/cs/gce,方点代表cota/abts/mwcnts/cs/gce。
具体实施方式
为了下面的详细描述的目的,应当理解,本发明可采用各种替代的变化和步骤顺序,除非明确规定相反。此外,除了在任何操作实例中,或者以其他方式指出的情况下,表示例如说明书和权利要求中使用的成分的量的所有数字应被理解为在所有情况下被术语“约”修饰。因此,除非相反指出,否则在以下说明书和所附权利要求中阐述的数值参数是根据本发明所要获得的期望性能而变化的近似值。至少并不是试图将等同原则的适用限制在权利要求的范围内,每个数值参数至少应该根据报告的有效数字的个数并通过应用普通舍入技术来解释。
尽管阐述本发明的广泛范围的数值范围和参数是近似值,但是具体实例中列出的数值尽可能精确地报告。然而,任何数值固有地包含由其各自测试测量中发现的标准偏差必然产生的某些误差。
此外,应当理解,本文所述的任何数值范围旨在包括归入其中的所有子范围。例如,“1至10”的范围旨在包括介于(并包括)所述最小值1和所述最大值10之间的所有子范围,即具有等于或大于1的最小值和等于或小于10的最大值。
说明书中一些缩写的意义如下:
mwcnts:多壁碳纳米管;
cs:壳聚糖;
gc:玻碳电极;
abts:2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸。
为了解决上述技术问题,本发明提供了一种细菌漆酶传感器的制备方法,其特征在于,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:细菌漆酶传感电极的构建。
在具体的实施方式中,所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用预处理和浓缩手段对a3所得到的细菌漆酶基因进行纯化,获得目的蛋白纯蛋白。
所述a1中,引物的设计采用的是本领域常规技术手段。pcr技术是指对特定基因进行体外合成,并用于以检测dna/rna为目的的各种基因。所述预处理和浓缩手段为本领域常规技术手段,在这里不做赘述。
在具体的实施方式中,对bacillussubtilis168进行全基因提取,pcr扩增产物纯化回收,酶切产物纯化回收和质粒提取均按照所使用试剂盒的说明书进行。具体方法按以下步骤进行。
细菌漆酶cota基因在p.pastorisgs115中的高效表达:
(1)细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300),
使用引物设计软件primerpremier设计了扩增cota的引物cota-9k-f(ctgaagcttacgtagaattcatgacacttgaaaaatttgtgga)和cota-9k-r
(gcggccgccctagggaattcgtggtggtggtggtggtgtttatggggatcagttata)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
在优选的实施方式中,对bacillussubtilis168进行全基因提取,pcr扩增产物纯化回收,酶切产物纯化回收和质粒提取均按照所使用试剂盒的说明书进行。具体方法按以下步骤进行。
细菌漆酶cota基因在p.pastorisgs115中的高效表达:
(1)细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300),
使用引物设计软件primerpremier设计了扩增cota的引物cota-9k-f(ctgaagcttacgtagaattcatgacacttgaaaaatttgtgga)和cota-9k-r
(gcggccgccctagggaattcgtggtggtggtggtggtgtttatggggatcagttata)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
在具体的实施方式中,所述细菌漆酶选自bacillussubtilis168。
在具体的实施方式中,所述出发载体为ppic9k,所述表达载体为ppic9k-cota。
在具体的实施方式中,所述宿主菌为p.pastorisgs115,所述基因工程菌为pastorisgs115/cota。
在具体的实施方式中,所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于修饰电极混合液中进行表面修饰。
电化学测试采用三电极测试体系:修饰电极采用直径为3mm的玻碳电极,对电极为铂丝电极,参比电极采用ag/agcl电极。
修饰电极构建步骤为首先将清洗好的玻碳电极在湿润的麂皮上al2o3粉末进行抛光处理,置于含有0.1mol/lkno3的0.5mmol的铁氰化钾/亚铁氰化钾溶液中进行电化学测试。只有当该实验条件下循环伏安峰电位差小于80mv时电极才能使用,否则需要冲洗打磨至符合要求。之后使用蒸馏水冲洗干净,再分别依次放入二次蒸馏水、无水乙醇、丙酮、二次蒸馏水中进行超声处理20min,置于室温,用氮气吹干。
在具体的实施方式中,所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有abts、g418的平板,培养,挑取阳性转化子,保存。
在优选的实施方式中,所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有200mg/labts、50mg/lg418的平板,30-34℃培养60-80h后,挑取有蓝绿色晕圈的阳性转化子,挑取阳性转化子,保存。
在进一步优选的实施方式中,所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有200mg/labts、50mg/lg418的平板,32℃培养72h后,挑取有蓝绿色晕圈的阳性转化子,挑取阳性转化子,保存。
在具体的实施方式中,所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液。
在具体的实施方式中,所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在醋酸溶液中溶解,得到壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加abts,搅拌均匀,过夜进行负载,得到多壁碳纳米管-壳聚糖-abts溶液。
所述多壁碳纳米管粉末购买自东莞市金耐新材料有限公司。所述abts是一种介体物质,可用于测定漆酶酶活性的大小,中文名为2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸,其cas号为30931-67-0。
在优选的实施方式中,所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。细菌漆酶溶液的浓度不做具体限制,根据具体所需要的量决定。
在具体的实施方式中,为实现多壁碳纳米管在溶液中更好的分散,首先需要将多壁碳纳米管羧基化。具体步骤为将1g多壁碳纳米管与配比为3:1的浓硫酸和硝酸溶液中,搅拌混匀,放置4h使多壁碳纳米管带有羧基。过滤后收集粉末用超纯水洗至中性。
在具体的实施方式中,所述重组质粒ppic9k-cota的构建
ppic9k质粒用限制性内切酶ecorⅰ进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
(3)重组菌株p.pastorisgs115/cota的构建
将鉴定构建成功重组质粒少量提取后使用salⅰ酶切线性化。具体体系为:
感受态细胞的制备:
细胞准备:
1)培养毕赤酵母于5mlypd中,置于30℃过夜
2)取0.2ml左右体积的过夜培养物,接种至含500ml新鲜培养基的2l摇瓶,培养至od600=1.3-1.5
3)在4℃,2000g条件下离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞
4)如上离心,用250ml预冷的灭菌水悬浮细胞
5)如上离心,用20ml预冷的1m山梨醇悬浮细胞
6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml
毕赤酵母电转化:
1)取80ul上述细胞与10μg左右线性化dna混合,转入预冷的0.2cm电转杯中。
2)在冰上放置5min
3)根据所使用装置推荐的酿酒酵母参数进行电击,设置参数为(2.0kv,25μf,250ω和0.2cmcuvette。
4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中
5)分成200-600ul等份,涂于md或rdb平板上
6)在30度孵育平板至克隆产生
(4)重组细菌漆酶cota的诱导表达及纯化:
将筛选得到的酵母菌株在含有100μg/mlg418的ypd培养基中30℃、200rpm条件下活化培养。以1%的接种量转接到25mlbmgy培养基中在30℃,200rpm中培养24h。当菌体od600达到2.0-6.0之后,将培养基使用3000×g,4℃,5min条件下离心收集菌体。再转接到含0.2mmcuso4的bmm培养基中,使菌液培养至od600=1.0。其中每24h加入终浓度为0.5%的甲醇进行诱导培养,表达情况经sds-page鉴定。
将发酵液至于离心管中使用3000×g,10min离心收集上清液。利用ge公司hitrapdesaltingcolumn脱盐柱和
所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液;
所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。
在优选的实施方式中,所述重组质粒ppic9k-cota的构建
ppic9k质粒用限制性内切酶ecorⅰ进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
(3)重组菌株p.pastorisgs115/cota的构建
将鉴定构建成功重组质粒少量提取后使用salⅰ酶切线性化。具体体系为:
感受态细胞的制备:
细胞准备:
1)培养毕赤酵母于5mlypd中,置于30℃过夜
2)取0.2ml左右体积的过夜培养物,接种至含500ml新鲜培养基的2l摇瓶,培养至od600=1.3-1.5
3)在4℃,2000g条件下离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞
4)如上离心,用250ml预冷的灭菌水悬浮细胞
5)如上离心,用20ml预冷的1m山梨醇悬浮细胞
6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml
毕赤酵母电转化:
1)取80ul上述细胞与10μg左右线性化dna混合,转入预冷的0.2cm电转杯中。
2)在冰上放置5min
3)根据所使用装置推荐的酿酒酵母参数进行电击,设置参数为(2.0kv,25μf,250ω和0.2cmcuvette。
4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中
5)分成200-600ul等份,涂于md或rdb平板上
6)在30度孵育平板至克隆产生
(4)重组细菌漆酶cota的诱导表达及纯化:
将筛选得到的酵母菌株在含有100μg/mlg418的ypd培养基中30℃、200rpm条件下活化培养。以1%的接种量转接到25mlbmgy培养基中在30℃,200rpm中培养24h。当菌体od600达到2.0-6.0之后,将培养基使用3000×g,4℃,5min条件下离心收集菌体。再转接到含0.2mmcuso4的bmm培养基中,使菌液培养至od600=1.0。其中每24h加入终浓度为0.5%的甲醇进行诱导培养,表达情况经sds-page鉴定。
将发酵液至于离心管中使用3000×g,10min离心收集上清液。利用ge公司hitrapdesaltingcolumn脱盐柱和
所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液;
所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。
为了解决上述技术问题,本发明还提供了一种用于酚类物质检测的细菌漆酶传感器,由上述制备方法制备得到。所述的酚类底物包括多苯二酚,邻苯二酚、间苯二酚及2,6-二甲氧基苯酚等。
本发明所采用的方法,能够将目的蛋白表达至胞外细胞液中,从而能够有效的避免细胞破碎,从而达到简化蛋白获取的有益效果。
实施例
实施例1
实施例1提供了一种细菌漆酶传感器的制备方法,其特征在于,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:细菌漆酶传感电极的构建。
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用预处理和浓缩手段对a3所得到的细菌漆酶基因进行纯化,获得目的蛋白纯蛋白;所述细菌漆酶选自bacillussubtilis168;所述宿主菌为p.pastorisgs115,所述基因工程菌为pastorisgs115/cota;
对bacillussubtilis168进行全基因提取,pcr扩增产物纯化回收,酶切产物纯化回收和质粒提取均按照所使用试剂盒的说明书进行。具体方法按以下步骤进行。
细菌漆酶cota基因在p.pastorisgs115中的高效表达:
(1)细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300),
使用引物设计软件primerpremier设计了扩增cota的引物cota-9k-f(ctgaagcttacgtagaattcatgacacttgaaaaatttgtgga)和cota-9k-r(gcggccgccctagggaattcgtggtggtggtggtggtgtttatggggatcagttata)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有200mg/labts、50mg/lg418的平板,32℃培养72h后,挑取有蓝绿色晕圈的阳性转化子,挑取阳性转化子,保存;
重组质粒ppic9k-cota的构建
ppic9k质粒用限制性内切酶ecorⅰ进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
(3)重组菌株p.pastorisgs115/cota的构建
将鉴定构建成功重组质粒少量提取后使用salⅰ酶切线性化。具体体系为:
感受态细胞的制备:
细胞准备:
1)培养毕赤酵母于5mlypd中,置于30℃过夜
2)取0.2ml左右体积的过夜培养物,接种至含500ml新鲜培养基的2l摇瓶,培养至od600=1.3-1.5
3)在4℃,2000g条件下离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞
4)如上离心,用250ml预冷的灭菌水悬浮细胞
5)如上离心,用20ml预冷的1m山梨醇悬浮细胞
6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml
毕赤酵母电转化:
1)取80ul上述细胞与10μg左右线性化dna混合,转入预冷的0.2cm电转杯中。
2)在冰上放置5min
3)根据所使用装置推荐的酿酒酵母参数进行电击,设置参数为(2.0kv,25μf,250ω和0.2cmcuvette。
4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中
5)分成200-600ul等份,涂于md或rdb平板上
6)在30度孵育平板至克隆产生
(4)重组细菌漆酶cota的诱导表达及纯化:
将筛选得到的酵母菌株在含有100μg/mlg418的ypd培养基中30℃、200rpm条件下活化培养。以1%的接种量转接到25mlbmgy培养基中在30℃,200rpm中培养24h。当菌体od600达到2.0-6.0之后,将培养基使用3000×g,4℃,5min条件下离心收集菌体。再转接到含0.2mmcuso4的bmm培养基中,使菌液培养至od600=1.0。其中每24h加入终浓度为0.5%的甲醇进行诱导培养,表达情况经sds-page鉴定。
将发酵液至于离心管中使用3000×g,10min离心收集上清液。利用ge公司hitrapdesaltingcolumn脱盐柱和
所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液;
所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于修饰电极混合液中进行表面修饰;
实施例2
实施例2提供了一种细菌漆酶传感器的制备方法,其特征在于,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:细菌漆酶传感电极的构建。
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用预处理和浓缩手段对a3所得到的细菌漆酶基因进行纯化,获得目的蛋白纯蛋白;所述细菌漆酶选自bacillussubtilis168;所述宿主菌为p.pastorisgs115,所述基因工程菌为pastorisgs115/cota;
对bacillussubtilis168进行全基因提取,pcr扩增产物纯化回收,酶切产物纯化回收和质粒提取均按照所使用试剂盒的说明书进行。具体方法按以下步骤进行。
细菌漆酶cota基因在p.pastorisgs115中的高效表达:
(1)细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300),
使用引物设计软件primerpremier设计了扩增cota的引物cota-9k-f(ctgaagcttacgtagaattcatgacacttgaaaaatttgtgga)和cota-9k-r(gcggccgccctagggaattcgtggtggtggtggtggtgtttatggggatcagttata)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于修饰电极混合液中进行表面修饰;
所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有200mg/labts、50mg/lg418的平板,32℃培养72h后,挑取有蓝绿色晕圈的阳性转化子,挑取阳性转化子,保存;
重组质粒ppic9k-cota的构建
ppic9k质粒用限制性内切酶ecorⅰ进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
(3)重组菌株p.pastorisgs115/cota的构建
将鉴定构建成功重组质粒少量提取后使用salⅰ酶切线性化。具体体系为:
感受态细胞的制备:
细胞准备:
1)培养毕赤酵母于5mlypd中,置于30℃过夜
2)取0.2ml左右体积的过夜培养物,接种至含500ml新鲜培养基的2l摇瓶,培养至od600=1.3-1.5
3)在4℃,2000g条件下离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞
4)如上离心,用250ml预冷的灭菌水悬浮细胞
5)如上离心,用20ml预冷的1m山梨醇悬浮细胞
6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml
毕赤酵母电转化:
1)取80ul上述细胞与10μg左右线性化dna混合,转入预冷的0.2cm电转杯中。
2)在冰上放置5min
3)根据所使用装置推荐的酿酒酵母参数进行电击,设置参数为(2.0kv,25μf,250ω和0.2cmcuvette。
4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中
5)分成200-600ul等份,涂于md或rdb平板上
6)在30度孵育平板至克隆产生
(4)重组细菌漆酶cota的诱导表达及纯化:
将筛选得到的酵母菌株在含有100μg/mlg418的ypd培养基中30℃、200rpm条件下活化培养。以1%的接种量转接到25mlbmgy培养基中在30℃,200rpm中培养24h。当菌体od600达到2.0-6.0之后,将培养基使用3000×g,4℃,5min条件下离心收集菌体。再转接到含0.2mmcuso4的bmm培养基中,使菌液培养至od600=1.0。其中每24h加入终浓度为0.5%的甲醇进行诱导培养,表达情况经sds-page鉴定。
将发酵液至于离心管中使用3000×g,10min离心收集上清液。利用ge公司hitrapdesaltingcolumn脱盐柱和
所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液;
所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。
实施例3
实施例3提供了一种细菌漆酶传感器的制备方法,其特征在于,包含如下步骤:
s1:细菌漆酶cota的表达获取;
s2:细菌漆酶传感电极的构建。
所述细菌漆酶cota的表达获取,包含如下步骤:
a1:对细菌漆酶进行全基因提取,利用设计引物对目的基因cota的pcr扩增获得目的基因序列;
a2:利用一部克隆方法对a1所获得的目的基因与出发载体连接构建表达载体;
a3:用宿主菌构建含有cota基因的基因工程菌,高效表达细菌漆酶基因;
a4:采用预处理和浓缩手段对a3所得到的细菌漆酶基因进行纯化,获得目的蛋白纯蛋白;所述细菌漆酶选自bacillussubtilis168;所述宿主菌为p.pastorisgs115,所述基因工程菌为pastorisgs115/cota;
对bacillussubtilis168进行全基因提取,pcr扩增产物纯化回收,酶切产物纯化回收和质粒提取均按照所使用试剂盒的说明书进行。具体方法按以下步骤进行。
细菌漆酶cota基因在p.pastorisgs115中的高效表达:
(1)细菌漆酶cota基因的pcr扩增:
根据ncbi公布的bacillussubtilis168中cota的基因序列(对应的genbankaccessionno.为bsu_06300),
使用引物设计软件primerpremier设计了扩增cota的引物cota-9k-f(ctgaagcttacgtagaattcatgacacttgaaaaatttgtgga)和cota-9k-r(gcggccgccctagggaattcgtggtggtggtggtggtgtttatggggatcagttata)。以bacillussubtilis168全基因组为模板,扩增cota基因,pcr反应条件:
利用琼脂糖凝胶电泳鉴定pcr产物的正确性,鉴定完成后用胶纯化试剂盒进行纯化回收,置于-20℃储存备用。
所述直接电化学型细菌漆酶传感电极的构建,包含如下步骤:
b1:将金电极进行预处理,进行电化学测试。达到电化学实验要求后,将金电极进行清洗;
b2:将b1所得到的金电极置于修饰电极混合液中进行表面修饰;
所述pastorisgs115/cota的构建方法,包含如下步骤:
c1:将含细菌漆酶cota基因的ppic9k-cota重组质粒转化到表达宿主菌p.pastorisgs115获得重组微生物pastorisgs115/cota;
c2:将c1所获得的重组微生物转接到含有200mg/labts、50mg/lg418的平板,32℃培养72h后,挑取有蓝绿色晕圈的阳性转化子,挑取阳性转化子,保存;
重组质粒ppic9k-cota的构建
ppic9k质粒用限制性内切酶ecorⅰ进行酶切,鉴定其总长。酶切反应体系(20μl)如下:
反应条件为37℃酶切4h,在体系中加入10×loadingbuffer终止液后利用1.0%琼脂糖凝胶电泳分离,紫外快速切胶纯化并参照北京庄盟公司提供的胶回收试剂盒说明书回收目的片段。
将(1)中得到的pcr产物为cota基因全长,需要在pcr产物的两端加上质粒片段用于一步克隆与质粒连接,构建原理为图1。连接条件为:
(3)重组菌株p.pastorisgs115/cota的构建
将鉴定构建成功重组质粒少量提取后使用salⅰ酶切线性化。具体体系为:
感受态细胞的制备:
细胞准备:
1)培养毕赤酵母于5mlypd中,置于30℃过夜
2)取0.2ml左右体积的过夜培养物,接种至含500ml新鲜培养基的2l摇瓶,培养至od600=1.3-1.5
3)在4℃,2000g条件下离心5min收集细胞,用500ml预冷的灭菌水悬浮细胞
4)如上离心,用250ml预冷的灭菌水悬浮细胞
5)如上离心,用20ml预冷的1m山梨醇悬浮细胞
6)如上离心,用1ml预冷的1m山梨醇悬浮细胞,至终体积约1.5ml
毕赤酵母电转化:
1)取80ul上述细胞与10μg左右线性化dna混合,转入预冷的0.2cm电转杯中。
2)在冰上放置5min
3)根据所使用装置推荐的酿酒酵母参数进行电击,设置参数为(2.0kv,25μf,250ω和0.2cmcuvette。
4)立即加入1ml预冷的1m山梨醇至杯中,将内容物转移至灭菌离心管中
5)分成200-600ul等份,涂于md或rdb平板上
6)在30度孵育平板至克隆产生
(4)重组细菌漆酶cota的诱导表达及纯化:
将筛选得到的酵母菌株在含有100μg/mlg418的ypd培养基中30℃、200rpm条件下活化培养。以1%的接种量转接到25mlbmgy培养基中在30℃,200rpm中培养24h。当菌体od600达到2.0-6.0之后,将培养基使用3000×g,4℃,5min条件下离心收集菌体。再转接到含0.2mmcuso4的bmm培养基中,使菌液培养至od600=1.0。其中每24h加入终浓度为0.5%的甲醇进行诱导培养,表达情况经sds-page鉴定。
将发酵液至于离心管中使用3000×g,10min离心收集上清液。利用ge公司hitrapdesaltingcolumn脱盐柱和
所述修饰电极混合液为多壁碳纳米管-壳聚糖-abts溶液;
所述多壁碳纳米管-壳聚糖-abts溶液的制备方法,包含如下步骤:
d1:将壳聚糖在2wt%醋酸溶液中磁力搅拌1h溶解,得到1wt%壳聚糖溶液;
d2:加入纯化后的多壁碳纳米管粉末,搅拌均匀,得到多壁碳纳米管-壳聚糖溶液;
d3:在d2得到的多壁碳纳米管-壳聚糖溶液中添加20mmol/l的abts,搅拌均匀,过夜进行负载,再加入细菌漆酶溶液制备得到多壁碳纳米管-壳聚糖-abts溶液。
对比例1
对比例1提供了现有技术的真菌漆酶传感电极。
性能评价测试
1)细菌漆酶传感电极的对对苯二酚的响应性能表征:
采用循环伏安法研究实施例1所制备得到的漆酶生物传感器对对苯二酚的电催化行为。由图1可看出,abts于电压为0.25v处由于在电极表面氧化,形成了明显的氧化峰电流,并且随着高浓度底物的添加也相应增加。而电极的还原电流因为有醌类物质生成在电极表面产生还原也相应增加,这与一般真菌漆酶电极对醌类反应现象类似。
2)细菌漆酶传感电极在碱性条件下对对苯二酚的检测性能评测:
图2和图3分别显示了采用计时安培法进一步研究cota/abts/mwcnts/cs/gce电极对对苯二酚的生物传感性能。在50molpbs缓冲液(ph=6.0)中滴加不同量的对苯二酚溶液并记录电流的变化。如图2所示,随着对苯二酚溶液的逐渐滴加,响应电流呈现阶梯式正增长。其中,该传感器对对苯二酚的响应迅速,响应时间仅为3s(到达下一次稳态电流95%以上时间),比多数报道漆酶电极短。这可能得益于多壁碳纳米管松散的网状立体结构能够使底物在其中迅速扩散,获得较为快速的响应时间。图3为该电极的响应电流值对对苯二酚的浓度线性校准曲线,可以看到,响应电流值随着底物浓度的增加随之增长。且该电极呈现出高低两个浓度检测曲线范围,0.25mmol到1mmol和1.5mol到10mol,其中针对较高浓度线性范围的线性方程为i(ua)=5.4662c+3.8983相关系数r2=0.9905。灵敏度经计算为5.4μa/mmol,这个值要小于大多数碳纳米管的真菌漆酶电极,说明此种电极虽有检测高浓度对苯二酚的能力,但响应灵敏度不高,性能相较真菌漆酶电极弱。检测限参考文献计算方法,为0.05mmol(信噪比s/n=3)。而更低浓度的对苯二酚虽有响应,但电极产生的干扰太大,已经不具备检测准确性,这可能是由于细菌漆酶本身的酶活力相对低下,不能对低浓度对苯二酚有稳定的氧化性能。
3)细菌漆酶传感电极与真菌漆酶传感电极的稳定性性能比较:
实施例1所制备得到的电极和对比例1所制备得到的真菌漆酶电极的贮藏稳定性性能比较。图4分别测定了cota/abts/mwcnts/cs/gce与tvlc/abts/mwcnts/cs/gce在60天内的贮藏稳定。从结果可看出,细菌漆酶传感电极显示出了较好的稳定性,60天后还能保持85%以上的初始检测性能,这可能是由于细菌漆酶cota的分子结构较真菌漆酶tvlc简单,本身又属于抗性功能蛋白,耐受性和稳定性都强于真菌来源漆酶。虽然检测灵敏度不如真菌漆酶电极,但更为稳定的特性是细菌漆酶传感电极优势之一。结果表明细菌漆酶具有制备高稳定漆酶电极的潜力,并且以此制备的生物电极有望在今后应用到诸如在线检测等对检测环境条件要求较高的领域中。
- 还没有人留言评论。精彩留言会获得点赞!