一种腺病毒快速纯化方法与流程
本发明属于病毒制备技术领域,具体涉及一种腺病毒的小规模(2ml-10ml)包括微量病毒原液(200微升)的快速纯化方法。
背景技术:
病毒载体在基因治疗方面发挥日益重要的作用,尤其是腺病毒载体,是产生病毒疫苗和基因治疗载体的最合适平台,在基因治疗方面得到了广泛应用。腺病毒颗粒大小适中(90~100nm),无包膜,二十面体的核衣壳内包裹着一条36kb大小的线性双链dna,具有感染宿主广泛、载体容量大的优点,是一种理想的新型病毒疗法候选者。重组腺病毒载体在基因治疗方面的应用要求其不仅要纯度高,而且能够保持较高的感染活性,因此腺病毒颗粒的纯化工艺尤为重要。
目前,在病毒纯化方面最为成熟的技术是氯化铯密度梯度离心法,该方法可以获得纯度较高的病毒颗粒,但此法对于设备的要求极其高,需要超高速离心机,成本高,而且纯化所需时间长,操作不方便。另一类应用广泛的纯化方法是层析纯化,例如体积排阻层析,粒子交换层析,亲和层析等,这些方法共同的特点是纯化周期长,步骤繁琐。这两类方法都不适用于实验室小规模快速纯化腺病毒颗粒。因此,需要探索一种更有效的小规模快速纯化腺病毒方法,以期获得理想的病毒回收量,以满足科研需求。
腺病毒颗粒纯化的目的是获得纯净的腺病毒载体,便于后续的科研或临床治疗工作。腺病毒纯化的关键在于去除或破坏宿主细胞dna,通常借助核酸酶进行去除,适宜的核酸酶有benzonase,pulmozyme以及其他任何在本领域内常用的dna酶或rna酶。添加核酸酶消化宿主细胞dna后,会有部分核酸酶残留在病毒液中。就benzonase核酸酶为例,其属于混合型核酸内切酶,可以消化所有结构的dna和rna,所以纯化的腺病毒颗粒中必须不能含有benzonase核酸酶以防腺病毒基因组被消化。因此,腺病毒纯化的关键一步是将病毒液中残留的核酸酶去除。目前市售的相关腺病毒纯化试剂盒具有一定的去除核酸酶的作用,但是最终的病毒回收量和纯度不理想,会影响后续的分子克隆操作,难以满足腺病毒载体构建需求。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种腺病毒快速纯化方法。本发明的技术方案是采用切向流超滤系统降低病毒液中的污染性核酸酶浓度。
所述的污染性核酸酶是指病毒液中残留的核酸酶,具体是指为了消化宿主细胞dna而添加在宿主细胞裂解液中的核酸酶,例如benzonase,pulmozyme以及其他任何在本领域内常用的dna酶或rna酶。该核酸酶用于去除宿主细胞dna,但病毒液中残留的核酸酶可能会引起病毒基因组核酸被破坏,造成病毒粒子失去感染活性或感染效率降低,所以对于纯化病毒获得病毒基因组,消化后去除残余的核酸酶是至关重要的。
在一个优选的实施方式中,所述的切向流超滤系统为sartorius公司的vivaspin超滤离心管。
sartorius公司的vivaspin超滤离心管为带有内层柱管的离心管,内层柱管上具有垂直方向的超滤膜,根据要求该柱管具有不同体体积,超滤膜也具有不同的分子量规格。将适量病毒液放入离心管的上层柱管内,放入离心机进行离心分离,可以使病毒粒子和核酸酶及其他杂质分离,病毒粒子留在上层柱管内,核酸酶及其他杂质进入下层柱管。该切向流超滤系统所需设备相对简单,不需要大型超速离心机,且滤膜方向垂直于离心力方向,分离效率更高。
作为优选,所述方法还包括采用vivaspin超滤离心管浓缩病毒液的步骤。
此病毒液为宿主细胞裂解液经离心分离所得,在一个优选的实施方式中,宿主细胞裂解液经3200g/min离心30min,收集上清液得到病毒液,大量的宿主细胞碎片及宿主蛋白沉淀被离心去除。在一个优选的实施方式中,采用vivaspin超滤离心管对所得的病毒液进行浓缩,浓缩的目的在于进一步去除细胞培养基中的相关物质,去除小部分宿主dna,并可降低酶处理阶段核酸酶的使用量。相对于其他方法,使用vivaspin超滤离心管不需要专门购买一套超滤设备,只需要普通离心机,也比较适用于少量液体的高效回收。具有成本低,适应小规模提取的科研需要的优点。
作为优选,本发明所述腺病毒纯化方法的具体步骤如下:
(1)采用vivaspin超滤离心管浓缩病毒液;
(2)添加核酸酶消化宿主细胞dna;
(3)将核酸酶处理后的病毒液置于vivaspin超滤离心管上层柱管中,加入ffb缓冲液,将vivaspin超滤离心管置于离心机中,1200g/min离心30~40min,弃去下层柱管中的液体;
(4)向上层柱管中补充ffb缓冲液,1200g/min离心30~40min,弃去下层柱管中的液体;
(5)重复步骤(4),直至上下柱管中的液体均呈无色透明状态。
作为优选,所述核酸酶为benzonase。
作为优选,所述vivaspin超滤离心管滤膜的截流分子量为100-1000k。
作为优选,所述vivaspin超滤离心管滤膜的截流分子量为300k。
vivaspin超滤离心管滤膜的截流分子量可根据病毒粒子大小及核酸酶大小进行调整。
本发明的另一方面在于提供一种sartorius公司的vivaspin超滤离心管在用于降低病毒液中的污染性核酸酶浓度的新用途。
本发明小组发现,采用vivaspin超滤离心管能够方便、高效的去除病毒液中的污染性核酸酶,以防止病毒基因组被消化。
作为优选,所述污染性核酸酶为benzonase。
作为优选,所述vivaspin超滤离心管滤膜的截流分子量为300k。
有益效果:(1)本发明所述方法经过有限次数的超离能够有效去除病毒液中的核酸酶,使得所得到的是没有宿主dna污染的病毒dna,并且通过核酸电泳,可以看出回收的病毒dna没有被核酸酶降解,可以直接用于高精度的分子克隆操作;(2)本发明的方法获得了足够量的纯化的病毒颗粒,比市售试剂盒回收率提高了10倍左右;(3)本发明的方法使用设备简单,不需要大型超速离心机;(4)实验周期短,只需要1天时间即可完成纯化。
附图说明
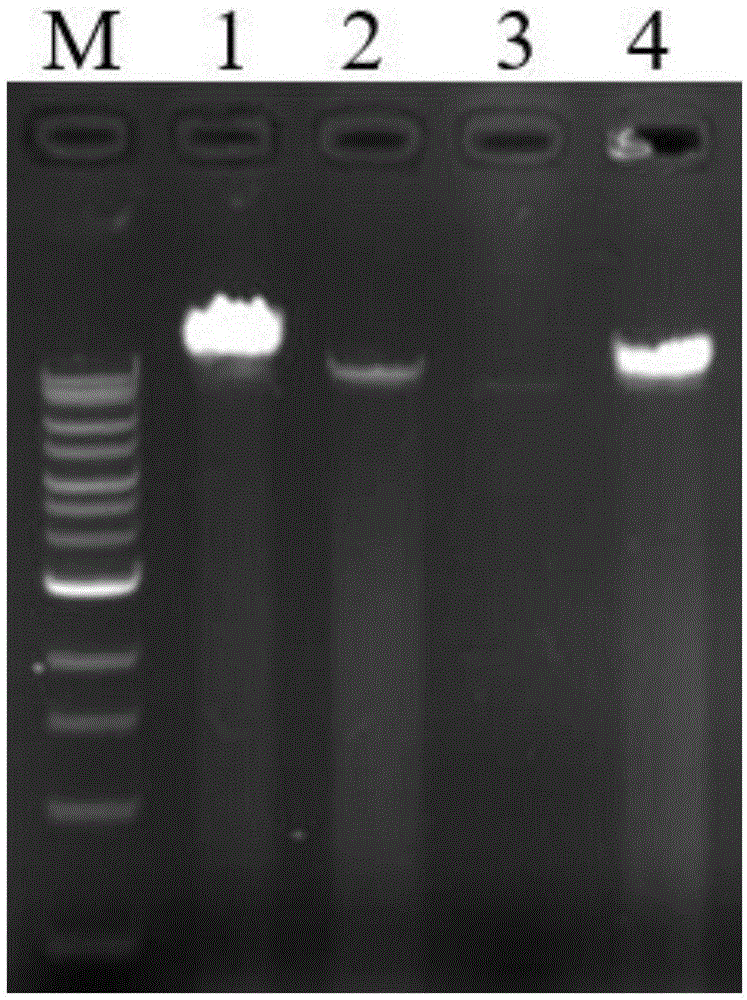
图1是dna琼脂糖凝胶电泳检测图,其中,泳道1代表quick-load1kbextenddnaladder,泳道2代表本发明所述方法纯化的ad26腺病毒,泳道3代表adenopack20试剂盒纯化的ad26腺病毒,泳道3代表本发明所述方法纯化的ad28腺病毒,泳道4代表adenopack20试剂盒纯化的ad28腺病毒.
具体实施方式
下面结合实施例,以腺病毒的ad26型和ad28型纯化为例更具体地说明本发明的内容。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
在本发明中,所有的设备和原料等均可从市场购得或是本行业常用的。若无特别指明,实施例采用的方法为本领域通用技术。
本发明所使用的所使用的宿主细胞a549购自atcc,所使用的vivaspin20离心管及adenopack20腺病毒纯化试剂盒为商业购买,购买自赛多利斯公司。
实施例1病毒液的制备
1、宿主细胞的培养
从液氮罐中取出冻存的a549细胞,立即放入37℃水浴箱中使其复苏。待其完全融化后加入5mlf-12k完全培养基(f-12k+8%fbs+1%gln)充分混匀,1000rpm离心5min,弃去上清,沉淀用5mlf-12k完全培养基充分混匀,转移到t-25cm2的细胞培养瓶中,37℃,5%co2培养箱中过夜培养;接着,待上述细胞生长到90%融合度时,弃去培养基,加入pbs,轻微摇匀,弃去pbs,加入1ml0.25%胰酶,37℃放置2min,待其细胞完全从瓶壁上脱落下来,加入5mlf-12k完全培养基吹打瓶壁上的细胞,充分吹打混匀,转移至t-75cm2的细胞培养瓶中,再加入10mlf-12k完全培养基,充分吹打混匀,37℃,5%co2培养箱中过夜培养。以此类推,传代到t-175cm2的细胞培养瓶中,待用。
2、病毒接种
病毒液作100倍稀释,先将8ml稀释液(维持液)置于50ml离心管中,取80μl病毒悬液加入离心管中,充分吹打混匀后为10-2。然后将t-175cm2细胞培养瓶中的培养液倒掉,利用8ml1×pbs冲洗两次细胞培养瓶,将残留在细胞瓶中的血清洗掉。最后将100倍稀释的病毒液加入细胞培养瓶中,接种完成后放入37℃培养箱中吸附1小时。吸附完毕后每瓶细胞中加入32mlf-12k完全培养基(f-12k+4%fbs+1%gln),置37℃培养箱中培养,72小时后回收病毒。
3、裂解
宿主细胞裂解可以采用本领用的常规方法,例如高渗/低渗裂解,去污剂裂解,利用液体剪力,超声波,高压推挤裂解等。本实施例采用采用冻融法裂解宿主细胞以释放腺病毒,具体操作如下:
将回收的细胞悬液反复冻融3次,经3200g/min低速离心30min,收集上清,测定其od260值计算病毒颗粒数。
实施例2病毒液的浓缩、酶解及纯化
1、病毒液的浓缩
取10ml病毒液,利用300mwco的vivaspin20将上清浓缩至3.5ml,测定其od260值。
2、核酸酶处理浓缩病毒液
加入7.5u/mlbenzonase,37℃水浴反应30min。
3、利用vivaspin20纯化病毒液
(1)向浓缩处理后的病毒液中加入6.5ml的ffb缓冲液(缓冲液组成为:10mmtrisph7.8,75mmnacl,5%蔗糖),经1200g/min离心30min,弃去下层柱管中的液体;(2)向上层柱管中补充ffb缓冲液至20ml,经1200g/min离心40min,弃去下层柱管中的液体;(3)重复步骤(2)3~5次,使得上下柱管中的液体均呈无色透明状态,上层柱管中的液体即为纯化后的病毒液。弃去下层柱管中的液体,将上层柱管中的液体吸出至新的15ml离心管中,补充ffb缓冲液至3.5ml,测定其od260值,并计算回收的病毒颗粒数,病毒液于4℃保存备用。以市售adenopack20腺病毒纯化试剂盒作为对照组进行病毒液纯化,实验操作根据试剂盒说明书进行,结果如下表所示。od260是核酸吸收的最高峰,病毒回收率=纯化后od260/纯化前od260×100%
表1纯化实验结果
上述结果表明:本发明方法的病毒回收率远高于一般市售腺病毒纯化试剂盒,能有效回收腺病毒。
实施例3腺病毒基因组检测
采用hirtvirualdnaextract方法提取腺病毒基因组,如下步骤:
(1)向纯化后的3.5ml病毒浓缩液中加入87.5μl的20%的sds,吹打混匀。
(2)向步骤(1)中混合液中加入87.5μl的20mg/ml的蛋白酶k。
(3)置于55℃水浴中孵育4小时。4小时后,加入1ml的5mnacl,55℃水浴孵育2小时。
(4)孵育后放入-20度冰箱中过夜,待用。
(5)第二天,将步骤4中冻存的病毒液放入37℃水浴锅中溶解,直至所有液体都溶解。
(6)向混合液中加入4ml酚氯仿异戊醇,翻转混匀,经3200g/min在4℃离心10min。吸取上清至新的15ml离心管中。
(7)重复步骤(6)。
(8)向步骤(7)收获的上清中加入0.8倍体积的异丙醇,吹打混匀。然后,将混合液于4℃下12000g/min离心10min。
(9)缓慢弃掉上清,然后加入1ml70%的乙醇,混匀,在4℃下12000g/min离心10min。
(10)缓慢弃掉上清,自然风干残留的酒精,然后加入50μl左右的elutionbuffer溶解dna。进行dna的浓度、260/280值以及dna总量的测定,结果如下所示。溶解后的dna经琼脂糖凝胶电泳,结果如图1所示。
表2腺病毒基因组检测结果
上述结果表明:od260是核酸吸收的最高峰,当od260/280处于1.8-2.0时,核酸的纯度较高。本发明方法的od260/280更接近标准值1.8,说明本方法所得到的腺病毒dna结构完整,纯度高,质量稳定,能够满足腺病毒载体构建需要。琼脂糖凝胶电泳图谱清晰,条带无拖尾现象,说明本发明纯化方法提取的dna质量高、无降解。
以上是对本发明较佳实施方式的具体说明,但本发明并不仅限于所述实施例,熟悉本领域的技术人员在不违背本发明精神的前提下还可做出种种的等同变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!