5-杂环取代吡啶-2-甲酰甘氨酸化合物、其制法和医药用途的制作方法
本发明涉及药物化学领域。具体涉及一类5-杂环取代吡啶-2-甲酰甘氨酸化合物以及含有这类化合物的药物组合物、其制备方法以及作为脯氨酰羟化酶抑制剂在贫血症、缺血性疾病等方面的医药用途。
背景技术:
贫血症是一种以循环系统中血细胞或血红蛋白含量减少为特征的血液病,慢性肾病、肿瘤、炎症、营养不良、家族遗传病以及一些药物都能引起贫血。营养不良引起的贫血多见于女性、儿童和老人,一般采用补充铁剂和维生素的方式治疗。地中海贫血为最常见的家族遗传性贫血,通常采用输血或铁螯合剂的方式治疗(amjhematol.88(2013)409–415)。慢性肾脏病、化疗和炎症性疾病会阻碍促红细胞生成素(epo)的合成,其中慢性肾脏病(ckd)贫血的常规指导用药为epo类似物或红细胞生成刺激剂(esa)。但是临床研究显示esa一方面存在低反应性或耐药性的弊端,另一方面存在引发心血管疾病或者加速恶性肿瘤进展的风险(j.med.chem.61(2018)6964-6982)。esa的低反应性与多种因素相关,例如缺铁,慢性甲状旁腺机能亢进,血清白蛋白水平低下,铝水平升高,营养不良,次优条件下的透析,药物治疗(血管紧张素转化酶抑制剂,血管紧张素受体阻断剂,他汀类药物)等。其中缺铁是维持性血透患者esa低反应性最常见的原因(bloodpurif.33(2012)238-244)。尽管静脉给予铁剂能够提高esa反应性,随之带来的感染风险也是不可避免的。因此,亟需开发一种安全有效的替代疗法。
epo主要由肾脏合成,是缺氧应答与红细胞生成过程中最重要的激素之一。肾epo合成细胞(repc)存在于肾皮质和外髓质部位。epo与红系集落形成单位(cfu-e)、原红细胞、早幼红细胞上的epo受体(epor)结合,促使epor被酪氨酸激酶jak2磷酸化,激活下游信号通路,从而抑制红系祖细胞的凋亡(bloodrev.27(2013)41–53)。红祖细胞表面膜蛋白cd95的表达水平是调控其凋亡的关键因素,epo能够降低cd95的表达水平,从而促进红祖细胞的分化与成熟(natrevnephrol.11(2015)394–410)。缺氧诱导因子(hif)是低氧分压状态下诱导细胞适应的关键转录因子,共有3个亚型,其中hif-1主要调节代谢应答,而hif-2与epo的生成直接相关。hif-2由两个亚基组成,位于胞质的hif-2α入核与hif-2β形成同源二聚体,进而与dna上的缺氧反应元件(hre)结合,刺激epo基因的表达(expertopinthertargets.20(2016)287–301)。hif的浓度水平依赖脯氨酰羟化酶(phd)调节,phd能够羟基化hif并启动泛素化蛋白酶体途径,在cop9信号复合体、泛素样蛋白nedd8的协同作用下激活e3scf泛素连接酶,降解hif(natrevdrugdiscov.13(2014)852–869)。常氧条件下,phd的活性较高,hif不能稳定存在。抑制phd的催化活性能够模拟缺氧状态下的应激反应,促进红细胞的生成。
hif通路在调节epo合成的同时,还参与体内的铁代谢。hif-2能够上调二价金属离子转运体1(dmt1)与十二指肠细胞色素b(dcytb)的转录水平,促进铁在肠道的吸收。同时提高转铁蛋白、转铁蛋白受体(tfr1)、血浆铜蓝蛋白、细胞血红素氧合酶-1(ho-1)、膜铁转运蛋白(fpn)的转录水平,促进铁离子的转运。成红细胞受到epo刺激后,增加红细胞促铁素(erythroferrone,erfr)的表达,从而抑制肝脏铁调素的合成,稳定fpn的水平(expcellres.356(2017)160–165)。所以phd抑制剂通过影响转录水平复杂的信号传导通路,达到刺激红细胞生成的效果,相比于直接给予重组人epo或esa而言副作用更小,且不用额外补充铁剂(medhypotheses.82(2014)547-550)。
技术实现要素:
本发明公开了一类结构新颖且具有脯氨酰羟化酶抑制作用的5-杂环取代吡啶-2-甲酰甘氨酸化合物及其可药用盐。结构式(i)如下:
其中a代表五元到七元,含有1-2个氮原子的饱和氮杂单环,上述氮杂单环构成的螺环,或上述氮杂单环构成的桥环;
ar代表由六个环原子构成的单环芳基;
l代表位于a和ar之间长度为1-4个原子长度的连接链,该连接链主链原子选自碳、氮、氧或硫原子,且其中至少含有一个碳原子,其中连接链上的碳原子可被羰基替换;
r代表位于芳环上任意取代的一个或多个取代基,取代基选自c1-c3烷基、c1-c3烷氧基、c1-c3烷胺基、c1-c3烷酰基、c1-c3卤代烷基、卤素、氰基、羟基或氨基。
a优选代表
l优选代表
本发明同时包括通式ⅰ化合物的药学上可接受的盐,及其溶剂化物,都与通式ⅰ化合物具有同样的药理功效。
通式ⅰ所示化合物药学上可接受的盐有两种形式:一种是与酸形成的盐;另一种是与碱金属形成的盐。与通式ⅰ所示化合物形成药学上可接受的盐的酸包括无机酸和有机酸。合适的无机酸包括:盐酸、硫酸和磷酸。合适的有机酸包括甲酸、乙酸、丙酸、琥珀酸、乳酸、酒石酸、柠檬酸、反丁烯二酸等。与通式ⅰ所示化合物形成药学上可接受的盐的碱金属包括锂、钠、钾、镁、钙、铝、锌等;与通式ⅰ所示化合物形成药学上可接受的盐的碱包括胆碱、二乙醇胺、吗啉等。
本发明还公开了一种药物组合物,其包含通式ⅰ及其可药用盐,或溶剂化物,及其一种或多种可药用载体、稀释剂和赋形剂。
本发明还提供通式ⅰ化合物和/或其可药用盐或溶剂合物在制备用于抑制脯氨酰羟化酶来治疗该酶介导的疾病的药物中的用途,其可通过抑制脯氨酰羟化酶达到治疗效果。
本发明还提供通式ⅰ化合物和/或其可药用盐或溶剂合物用于制备治疗贫血症或缺血性疾病的药物的用途。其中贫血症包括由肾炎、肾损伤、类风湿性关节炎、风湿热、炎症性肠道疾病以及肿瘤化疗引起的贫血症。缺血性疾病包括缺血性脑卒中或心肌缺血相关疾病。
本发明的通式ⅰ化合物可用以下方法制备:
其中a,ar,l,r的定义如前。
原料ⅱ与含氮侧链在碱和催化剂的条件下偶联,其中碱选自六甲基二硅基胺基锂,碳酸铯,叔丁醇钠,优选叔丁醇钠,催化剂可选择钯与配体不同的组合,优选醋酸钯和1,1'-联萘-2,2'-双二苯膦;中间体ⅲ在三氟化硼乙醚的作用下脱去苄基保护基的到中间体ⅳ;最后,中间体ⅳ经酯水解得通式ⅰ。
药效学试验证明,本发明化合物具有强效的脯氨酰羟化酶抑制活性,能有效地稳定hif-α,从而达到促进epo生成和分泌的作用。
本发明部分化合物的药理学实验及结果如下:
一、荧光偏振实验
本发明将脯氨酰羟化酶蛋白与异硫氰酸荧光素(fitc)标记的hif肽段(hif-1α556-574),不同浓度的化合物溶液共同孵育,考察化合物与蛋白竞争性结合的能力。化合物能够占据关键辅因子2-og的位点,导致hif无法与蛋白结合,未结合脯氨酰羟化酶的hif在溶液中旋转速度快,荧光偏振值低。依据这一特点,本发明通过测定化合物的荧光偏振值间接反映其脯氨酰羟化酶抑制活性。化合物三倍稀释成12个浓度梯度,取20ul加入384孔板(型号corning#3575),再依次加入等体积的蛋白和肽段,使终浓度分别为250nm和3nm。4℃摇床孵育1h,采用spectramaxi3x多功能酶标仪检测,激发波长485nm,发射波长535nm,测试结果用graphpadprism6分析。代表性化合物的测试结果见表1。测试中采用的空白对照为20ulhif肽段+40ul缓冲液,阴性对照为20ulhif肽段+20ul蛋白+20ul缓冲液,阳性对照为上市药物fg-4592(roxadustat)。缓冲液配方为10mmhepes,150mmnacl,10μmmncl2,20μm2-og,0.05%tween-20,ph7.4。
表1本发明化合物的脯氨酰羟化酶抑制活性
由表1可见,本发明的化合物具有较强的脯氨酰羟化酶2抑制活性,14个化合物ic50小于1μm,其中3个化合物活性优于阳性药fg-4592。
二、荧光素酶报告基因实验
hif-α作为转录因子能够调控下游epo基因的表达,为验证实施例化合物能够稳定hif-α从而刺激epo的生成,本发明设计了缺氧反应元件(hre)调控的双荧光素酶报告基因实验。实验在hre下游插入荧光素酶报告基因的质粒。当hif-α稳定存在并入核后,能够激活hre启动子活性,调控下游荧光素酶的表达。加入荧光素底物后,可在所表达的荧光素酶的作用下发光。发光强度可间接反映稳定存在的hif-α的量。代表性化合物的测试结果见表2。
表2本发明化合物提高细胞hif-α水平的情况
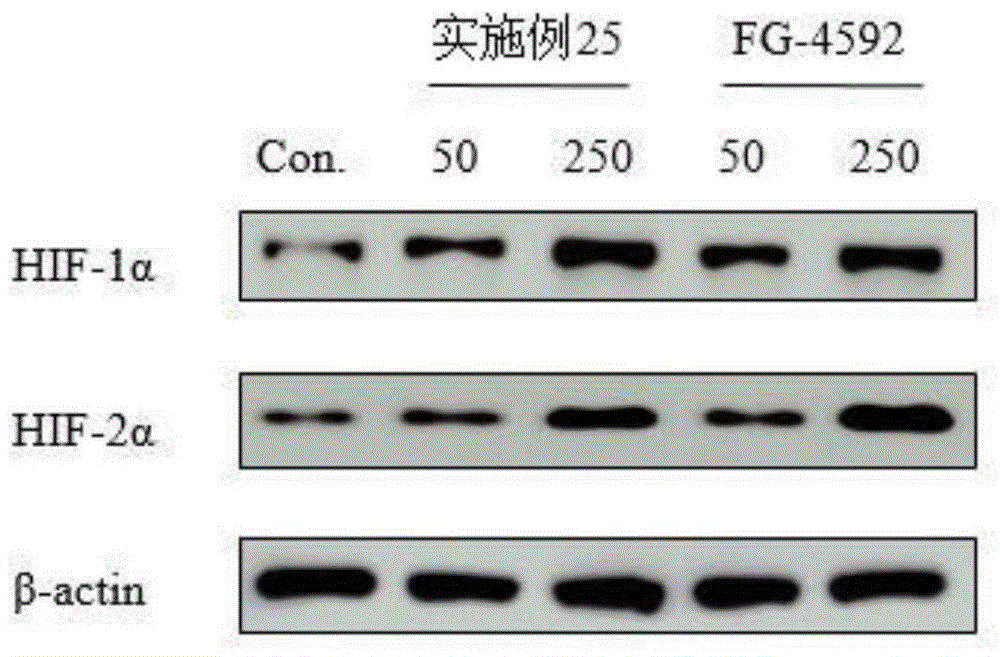
三、免疫印迹实验(westernblot)
本发明采用蛋白免疫印迹法对hif-1α及hif-2α的表达量进行检测。我们选择了荧光偏振实验和双荧光素酶报告基因实验中均表现出较好活性的实施例25,以fg-4592为阳性对照,使用人肝癌细胞hep3b,给予50μm、250μm两种浓度剂量的化合物,孵育过夜后检测hif-1α与hif-2α的表达量。实验结果如图1所示,实施例25能够显著稳定hif-α。
附图说明
图1是本发明化合物对hep3b细胞内hif-1α及hif-2α水平的上调作用。
具体实施方式
实施例1
(3-苄氧基-5-(4-(4-氯苄基)哌嗪-1-基)吡啶-2-甲酰基)甘氨酸甲酯
(3-苄氧基-5-溴吡啶-2-甲酰基)甘氨酸甲酯(400mg,1.05mmol)溶于10ml丙酮,加入1-(4-氯苄基)哌嗪(265mg,1.26mmol),碳酸钾(435mg,3.15mmol),升温至70℃,氮气氛下回流5h,反应完全。反应结束后,抽滤除去碳酸钾,减压蒸馏后,粗品采用硅胶柱层析分离纯化(二氯甲烷:甲醇=20:1),得280mg淡黄色油状物,收率52.4%。m.p.200.9-202.3℃.1hnmr(500mhz,chloroform-d)δ8.88(d,j=1.4hz,1h),8.29(t,j=9.7hz,1h),7.42(ddq,j=6.9,1.8,1.0hz,2h),7.39–7.27(m,7h),7.03(d,j=1.4hz,1h),5.22(t,j=1.0hz,2h),4.16(d,j=9.7hz,2h),3.68–3.62(m,4h),3.33(t,j=7.1hz,4h),3.01(t,j=7.1hz,2h),2.92(t,j=7.1hz,2h);ei-msm/z509[m+h]+。
(5-(4-(4-氯苄基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯
(3-苄氧基-5-(4-(4-氯苄基)哌嗪-1-基)吡啶-2-甲酰基)甘氨酸甲酯(280mg,0.55mmol)溶于10ml二氯甲烷,加入三氟化硼乙醚溶液(1ml,8.04mmol),加热至45℃,氮气氛下回流4h,反应完全。反应结束后,加入5ml饱和氯化铵溶液淬灭,分液,分别用水(2×5ml),饱和食盐水(1×5ml)依次洗涤,无水硫酸钠干燥,得215mg黄色油状物,收率93.5%。m.p.172.1-174.5℃.1hnmr(500mhz,chloroform-d)δ8.33–8.25(m,1h),7.78(d,j=1.4hz,1h),7.37–7.28(m,4h),7.01(d,j=1.4hz,1h),4.13(d,j=9.8hz,2h),3.71(s,2h),3.60(t,j=0.9hz,2h),3.35(t,j=7.1hz,4h),3.05(t,j=7.1hz,2h),2.90(t,j=7.1hz,2h);ei-msm/z419[m+h]+。
(5-(4-(4-氯苄基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(4-氯苄基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.24mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(60mg,1.44mmol),室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物64mg,收率66.3%。m.p.195.7-197.3℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.33(t,j=10.2hz,1h),7.37–7.28(m,4h),7.03(d,j=1.4hz,1h),4.07(d,j=10.1hz,2h),3.64(dt,j=12.4,0.9hz,1h),3.56(dt,j=12.5,1.0hz,1h),3.34(t,j=7.1hz,4h),3.05(t,j=7.1hz,2h),2.90(t,j=7.0hz,2h);ei-msm/z405[m+h]+。
实施例2
(5-(4-(4-氯苯乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(4-氯苯乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol),室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至黄色固体析出,抽滤并干燥后得产物72mg,收率74.4%。m.p.179.9-181.5℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.37–7.31(m,2h),7.19(dt,j=7.5,1.0hz,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.1hz,2h),3.33(t,j=7.1hz,4h),2.85–2.78(m,2h),2.75–2.68(m,6h);ei-msm/z419[m+h]+。
实施例3
(5-(4-(3-(4-氯苯基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-(4-氯苯基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物68mg,收率70.2%。m.p.192.0-194.2℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.5hz,1h),7.30–7.25(m,2h),7.10(dt,j=7.4,1.0hz,2h),7.01(d,j=1.5hz,1h),4.07(d,j=10.3hz,2h),3.33(t,j=7.1hz,4h),2.71(t,j=7.1hz,6h),2.53(t,j=7.1hz,2h),1.84(p,j=7.1hz,2h);ei-msm/z433[m+h]+。
实施例4
(5-(4-(2-(4-氯苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氯苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物65mg,收率67.1%。m.p.158.2-160.6℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.29–7.23(m,2h),7.01(d,j=1.5hz,1h),6.98–6.93(m,2h),4.12–4.04(m,4h),3.33(t,j=7.1hz,4h),2.80(t,j=7.1hz,2h),2.75(t,j=7.1hz,4h);ei-msm/z435[m+h]+。
实施例5
(5-(4-(3-(4-氯苯氧基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-(4-氯苯氧基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物80mg,收率82.5%。m.p.163.5-165.0℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.38–8.31(m,1h),7.28–7.23(m,2h),7.01(d,j=1.4hz,1h),6.97–6.92(m,2h),4.07(d,j=10.2hz,2h),4.01(t,j=7.1hz,2h),3.31(t,j=7.0hz,4h),2.76(t,j=7.1hz,2h),2.70(t,j=7.1hz,2h),2.65(t,j=7.0hz,2h),1.88(p,j=7.1hz,2h);ei-msm/z449[m+h]+。
实施例6
(5-(4-(2-((4-氯苯基)氨基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-((4-氯苯基)氨基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物76mg,收率78.4%。m.p.208.6-210.4℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.14–7.08(m,2h),7.01(d,j=1.4hz,1h),6.67–6.61(m,2h),5.92(t,j=5.8hz,1h),4.07(d,j=10.3hz,2h),3.56(td,j=7.1,5.6hz,2h),3.34(t,j=7.1hz,4h),2.78(t,j=7.1hz,2h),2.71(t,j=7.1hz,4h);ei-msm/z434[m+h]+。
实施例7
(5-(4-(3-((4-氯苯基)氨基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-((4-氯苯基)氨基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物58mg,收率59.8%。m.p.199.7-201.3℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.38–8.31(m,1h),7.17–7.11(m,2h),7.01(d,j=1.4hz,1h),6.69–6.63(m,2h),6.38(t,j=5.8hz,1h),4.07(d,j=10.3hz,2h),3.31(t,j=7.1hz,4h),3.19(td,j=7.0,5.7hz,2h),2.72(t,j=7.1hz,4h),2.54(t,j=7.1hz,2h),2.07(p,j=7.1hz,2h);ei-ms448[m+h]+。
实施例8
(5-(4-(2-((4-氯苯基)硫代)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-((4-氯苯基)硫代)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至灰色固体析出,抽滤并干燥后得产物77mg,收率79.4%。m.p.182.0-184.1℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.32(t,j=10.2hz,1h),7.36–7.30(m,2h),7.30–7.24(m,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.3hz,2h),3.33(t,j=7.1hz,4h),3.08(t,j=7.0hz,2h),2.76(t,j=7.0hz,4h),2.66(t,j=7.1hz,2h);ei-ms451[m+h]+。
实施例9
(5-(4-(3-((4-氯苯基)硫代)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-((4-氯苯基)硫代)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.21mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(53mg,1.26mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至灰色固体析出,抽滤并干燥后得产物65mg,收率66.9%。m.p.171.9-174.0℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.32(t,j=9.7hz,1h),7.38–7.32(m,2h),7.30–7.24(m,2h),7.00(d,j=1.6hz,1h),4.15(d,j=9.7hz,2h),3.66(s,2h),3.31(t,j=7.1hz,4h),2.93(t,j=7.1hz,2h),2.70(t,j=7.1hz,4h),2.60(t,j=7.1hz,2h),1.73(p,j=7.1hz,2h);ei-ms465[m+h]+。
实施例10
(5-(4-(2-((4-氯苯基)磺酰基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-((4-氯苯基)磺酰基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.20mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(50mg,1.20mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物81mg,收率83.3%。m.p.158.8-160.3℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.34(t,j=10.2hz,1h),7.93–7.88(m,2h),7.61–7.55(m,2h),7.00(d,j=1.6hz,1h),4.07(d,j=10.1hz,2h),3.52(t,j=7.1hz,2h),3.30(t,j=7.0hz,4h),2.92(t,j=7.0hz,2h),2.78(t,j=7.1hz,4h);ei-ms483[m+h]+。
实施例11
(5-(4-(3-((4-氯苯基)磺酰基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-((4-氯苯基)磺酰基)丙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.20mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(50mg,1.20mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物74mg,收率76.1%。m.p.164.2-166.9℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.32(t,j=10.2hz,1h),7.88–7.82(m,2h),7.61–7.55(m,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.3hz,2h),3.29(dt,j=20.9,7.1hz,6h),2.72(t,j=7.0hz,4h),2.62(t,j=7.0hz,2h),1.96(p,j=7.1hz,2h);ei-ms497[m+h]+。
实施例12
(5-(4-(4-氯苯甲酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(4-氯苯甲酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物60mg,收率62.0%。m.p.155.9-157.4℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.53–7.48(m,2h),7.48–7.43(m,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.1hz,2h),3.65(t,j=7.1hz,4h),3.21(t,j=7.1hz,4h);ei-ms419[m+h]+。
实施例13
(5-(4-(2-(4-氯苯基)乙酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氯苯基)乙酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物75mg,收率77.4%。m.p.179.1-181.5℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.40–7.34(m,2h),7.29(dt,j=7.5,1.1hz,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.3hz,2h),3.67(t,j=1.0hz,2h),3.58(t,j=7.0hz,4h),3.29(t,j=7.1hz,2h),3.16(t,j=7.1hz,2h);ei-ms433[m+h]+。
实施例14
(5-(4-(3-(4-氯苯基)丙酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(3-(4-氯苯基)丙酰基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物69mg,收率71.1%。m.p.165.5-167.2℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.38–8.31(m,1h),7.33–7.28(m,2h),7.15(dt,j=7.5,1.1hz,2h),7.01(d,j=1.4hz,1h),4.07(d,j=10.3hz,2h),3.69(t,j=7.1hz,4h),3.31(t,j=7.0hz,2h),3.16(t,j=7.0hz,2h),2.91(tt,j=7.1,1.1hz,2h),2.68(t,j=7.0hz,2h);ei-ms447[m+h]+。
实施例15
(5-(3-(2-(4-氯苯氧基)乙基)咪唑烷-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(3-(2-(4-氯苯氧基)乙基)咪唑烷-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物53mg,收率54.8%。m.p.202.8-204.4℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.5hz,1h),7.29–7.23(m,2h),7.03–6.95(m,3h),4.32(d,j=0.7hz,2h),4.12(t,j=7.1hz,2h),4.07(d,j=10.1hz,2h),3.64(t,j=7.0hz,1h),3.58(t,j=7.0hz,1h),2.91(dt,j=23.7,7.1hz,4h);ei-ms421[m+h]+。
实施例16
(5-(4-(2-(4-氯苯氧基)乙基)-1,4-二氮杂环庚烷-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氯苯氧基)乙基)-1,4-二氮杂环庚烷-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物61mg,收率62.9%。m.p.207.6-209.5℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.4hz,1h),8.38–8.31(m,1h),7.29–7.23(m,2h),7.00(d,j=1.6hz,1h),6.98–6.93(m,2h),4.13–4.04(m,4h),3.50(dt,j=12.3,7.1hz,1h),3.47–3.38(m,3h),2.82(t,j=7.1hz,2h),2.62(td,j=7.1,5.5hz,4h),1.79(p,j=7.2hz,2h);ei-ms449[m+h]+。
实施例17
(5-(4-(2-(4-氯苯氧基)乙基)哌啶-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氯苯氧基)乙基)哌啶-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物77mg,收率79.5%。m.p.169.2-171.8℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.2hz,1h),7.76(d,j=1.5hz,1h),7.28–7.23(m,2h),7.01(d,j=1.6hz,1h),7.00–6.94(m,2h),4.07(d,j=10.2hz,2h),4.01(t,j=7.1hz,2h),3.54–3.44(m,2h),3.47–3.37(m,2h),1.82–1.66(m,8h);ei-ms434[m+h]+。
实施例18
(5-(7-(2-(4-氯苯氧基)乙基)-2,7-二氮杂螺[4.4]壬-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(7-(2-(4-氯苯氧基)乙基)-2,7-二氮杂螺[4.4]壬-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.20mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(50mg,1.20mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物57mg,收率58.8%。m.p.184.4-186.0℃.1hnmr(500mhz,chloroform-d)δ8.85(d,j=1.5hz,1h),8.34(t,j=10.2hz,1h),7.29–7.23(m,2h),7.00(d,j=1.5hz,1h),6.98–6.93(m,2h),4.18–4.04(m,3h),4.04–3.96(m,1h),3.60–3.54(m,1h),3.51–3.36(m,3h),2.97(td,j=7.1,2.1hz,2h),2.82–2.76(m,1h),2.71–2.60(m,2h),2.50(dt,j=12.4,7.3hz,1h),1.83–1.67(m,4h);ei-ms475[m+h]+。
实施例19
(5-(9-(2-(4-氯苯氧基)乙基)-3,9-二氮杂螺[5.5]十一烷-3-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(9-(2-(4-氯苯氧基)乙基)-3,9-二氮杂螺[5.5]十一烷-3-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.19mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(48mg,1.14mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物55mg,收率56.5%。m.p.196.1-198.3℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.34(t,j=10.2hz,1h),7.29–7.23(m,2h),7.01(d,j=1.6hz,1h),7.00–6.94(m,2h),4.15–4.07(m,3h),4.06(s,1h),3.52(t,j=7.1hz,4h),2.97(t,j=7.1hz,2h),2.55(t,j=7.1hz,4h),1.78(t,j=7.1hz,4h),1.64(t,j=7.1hz,4h);ei-ms503[m+h]+。
实施例20
(5-(5-(2-(4-氯苯氧基)乙基)-2,5-二氮杂双环[2.2.1]庚-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(5-(2-(4-氯苯氧基)乙基)-2,5-二氮杂双环[2.2.1]庚-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至棕色固体析出,抽滤并干燥后得产物70mg,收率72.2%。m.p.212.5-214.8℃.1hnmr(500mhz,chloroform-d)δ8.83(d,j=1.5hz,1h),8.35(t,j=10.2hz,1h),7.29–7.23(m,2h),7.04(d,j=1.5hz,1h),6.98–6.93(m,2h),4.18–4.09(m,2h),4.06(dt,j=12.5,7.1hz,1h),4.00(dd,j=12.4,10.2hz,1h),3.83(p,j=7.0hz,1h),3.33(dd,j=12.4,7.0hz,1h),3.24(ddd,j=22.9,12.4,6.9hz,2h),3.07(dt,j=12.5,7.1hz,1h),2.98(dt,j=12.5,7.1hz,1h),2.91–2.81(m,2h),2.05–1.92(m,2h);ei-ms447[m+h]+。
实施例21
(5-(5-(2-(4-氯苯氧基)乙基)-2,5-二氮杂双环[2.2.2]辛-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(5-(2-(4-氯苯氧基)乙基)-2,5-二氮杂双环[2.2.2]辛-2-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.21mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(53mg,1.26mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至棕色固体析出,抽滤并干燥后得产物65mg,收率67.0%。m.p.206.8-208.3℃.1hnmr(500mhz,chloroform-d)δ8.88(d,j=1.5hz,1h),8.34(t,j=10.2hz,1h),7.29–7.23(m,2h),7.04(d,j=1.5hz,1h),6.98–6.93(m,2h),4.18–4.08(m,2h),4.07(dt,j=12.5,7.1hz,1h),4.00(dd,j=12.4,10.2hz,1h),3.78(p,j=7.0hz,1h),3.37–3.15(m,4h),3.09–2.98(m,2h),3.00–2.92(m,1h),1.98–1.74(m,5h);ei-ms461[m+h]+。
实施例22
(5-(4-(2-苯氧基乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-苯氧基乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.24mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(60mg,1.44mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物85mg,收率88.0%。m.p.167.7-169.2℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.32–7.24(m,2h),7.03(d,j=1.4hz,1h),6.94(tt,j=7.5,1.5hz,1h),6.93–6.87(m,2h),4.10–4.04(m,4h),3.33(t,j=7.1hz,4h),2.79(dd,j=14.0,7.1hz,5h),2.76(s,1h);ei-ms401[m+h]+。
实施例23
(5-(4-(2-(对甲苯基氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(对甲苯基氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物80mg,收率82.7%。m.p.163.1-165.8℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.5hz,1h),7.06–6.99(m,3h),6.87–6.81(m,2h),4.11–4.04(m,4h),3.34(t,j=7.0hz,4h),2.83–2.76(m,5h),2.76(s,1h),2.30(d,j=0.9hz,3h);ei-ms415[m+h]+。
实施例24
(5-(4-(2-(4-甲氧基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-甲氧基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.22mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(55mg,1.32mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物77mg,收率79.5%。m.p.172.6-174.9℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.2hz,1h),7.78(d,j=1.4hz,1h),7.01(d,j=1.5hz,1h),6.85(s,4h),4.12–4.04(m,4h),3.77(s,2h),3.33(t,j=7.1hz,4h),2.79(dt,j=13.1,7.1hz,6h);ei-ms431[m+h]+。
实施例25
(5-(4-(2-(4-(三氟甲基)苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-(三氟甲基)苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.21mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(53mg,1.26mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物64mg,收率65.9%。m.p.153.2-155.0℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.34(t,j=10.2hz,1h),7.63–7.57(m,2h),7.02–6.96(m,3h),4.10–4.03(m,4h),3.34(t,j=7.1hz,4h),2.80(t,j=7.1hz,2h),2.75(t,j=7.1hz,4h);ei-ms469[m+h]+。
实施例26
(5-(4-(2-(4-氟苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氟苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至黄色固体析出,抽滤并干燥后得产物75mg,收率77.5%。m.p.161.4-163.9℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.03–6.90(m,5h),4.12–4.04(m,4h),3.34(t,j=7.0hz,4h),2.79(dt,j=12.5,7.1hz,6h);ei-ms419[m+h]+。
实施例27
(5-(4-(2-(4-溴苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-溴苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.20mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(50mg,1.20mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物59mg,收率60.7%。m.p.166.6-168.5℃.1hnmr(500mhz,chloroform-d)δ8.87(d,j=1.4hz,1h),8.32(t,j=10.2hz,1h),7.41–7.35(m,2h),7.00(d,j=1.6hz,1h),6.96–6.90(m,2h),4.13–4.05(m,4h),3.32(t,j=7.0hz,4h),2.78(dt,j=20.2,7.1hz,6h);ei-ms479[m+h]+。
实施例28
(5-(4-(2-(4-氰基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氰基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物70mg,收率72.3%。m.p.158.1-160.3℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.2hz,1h),7.78(d,j=1.5hz,1h),7.67–7.62(m,2h),7.06–6.99(m,3h),4.10–4.04(m,4h),3.33(t,j=7.1hz,4h),2.79(dt,j=12.7,7.1hz,6h);ei-ms426[m+h]+。
实施例29
(5-(4-(2-(4-氨基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸
(5-(4-(2-(4-氨基苯氧基)乙基)哌嗪-1-基)-3-羟基吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至淡黄色固体析出,抽滤并干燥后得产物62mg,收率64.1%。m.p.179.2-181.7℃.1hnmr(500mhz,chloroform-d)δ8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.01(d,j=1.4hz,1h),6.75–6.69(m,2h),6.52–6.46(m,2h),5.10(d,j=5.7hz,1h),4.92(d,j=5.7hz,1h),4.10–4.03(m,4h),3.34(t,j=7.0hz,4h),2.79(dt,j=12.2,7.1hz,6h);ei-ms416[m+h]+。
实施例30
(3-羟基-5-(4-(2-(4-羟基苯氧基)乙基)哌嗪-1-基)吡啶-2-甲酰基)甘氨酸
(3-羟基-5-(4-(2-(4-羟基苯氧基)乙基)哌嗪-1-基)吡啶-2-甲酰基)甘氨酸甲酯(100mg,0.23mmol)溶于2ml四氢呋喃,加入1ml水,一水合氢氧化锂(58mg,1.38mmol)、室温搅拌30min。反应结束后,减压蒸馏除去反应液中的四氢呋喃,加入6mmol/l盐酸至白色固体析出,抽滤并干燥后得产物67mg,收率69.3%。m.p.167.9-169.4℃.1hnmr(500mhz,chloroform-d)δ8.81(s,1h),8.32(t,j=10.3hz,1h),7.78(d,j=1.4hz,1h),7.01(d,j=1.4hz,1h),6.87–6.80(m,4h),4.12–4.04(m,4h),3.34(t,j=7.0hz,4h),2.79(dt,j=12.5,7.1hz,6h);ei-ms417[m+h]+。
- 还没有人留言评论。精彩留言会获得点赞!