一种从破壁纳豆芽孢杆菌菌体中提取纯化维生素K2的方法与流程
本发明涉及一种从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法,属于生物工程和生物分离工程领域。
背景技术:
维生素k2是一系列含有2-甲基-1,4-萘醌母核及c3位带有数目不等的异戊二烯结构单元的萜烯侧链化合物的统称,根据萜烯侧链上碳元素的数目,可分为k2(10)、k2(20)、k2(35)、k2(40)等。维生素k2是一种脂溶性维生素,具有叶绿醌生物活性的萘醌基团的衍生物,是人体中不可缺少的重要维生素之一。随着对其功能的研究,现已证明,维生素k2具有预防骨质疏松、心血管、帕金森、肝癌等疾病的作用。因此,功能性食品、医疗品、化妆品等领域对维生素k2的需求日益增加,市场前景良好。
维生素k2具有手性结构,反式维生素k2具有生物活性,顺式维生素k2不具有生物活性。化学合成法制得的维生素k2同时含有顺式和反式;相比之下,微生物发酵法,可以得到全反式维生素k2。因此,国际上已规定,用于功能食品中的维生素k2必须来源于微生物发酵。目前,纳豆芽孢杆菌发酵制备维生素k2是普遍使用的一种微生物发酵生产维生素k2的方法。
纳豆芽孢杆菌发酵制备维生素k2中,纳豆芽孢杆菌的代谢产物较多,同时由于其细胞自溶,会产生多种杂质,如杂蛋白、核酸、油脂等,导致获取高纯化维生素k2的难度较大。
目前,广泛使用有机溶剂从纳豆芽孢杆菌发酵液中提取维生素k2,该方法需要进行菌体粉碎、脱水干燥等预处理操作,后续的纯化方法还需要进行大孔树脂和反相硅胶等处理,整体工艺复杂,成本昂贵,提取率较低。提取纯化技术,已成为纳豆芽孢杆菌发酵制备维生素k2的瓶颈问题。
技术实现要素:
本发明的目的在于提供从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法。
为实现上述目的及其他相关目的,本发明提供的技术方案是:从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法,包括下列步骤:
步骤1:将纳豆芽孢杆菌发酵液用孔径为5nm-10um的陶瓷膜进行过滤,得到的浓缩液以5000-18000rpm的转速离心8-20min,弃去上清液,收集的沉淀物质即为纳豆芽孢杆菌的新鲜菌体;
步骤2:将纳豆芽孢杆菌的新鲜菌体置入离子束设备中,用氮离子束轰击菌体,所用离子的能量为15kev-35kev,注入的离子量为1×1015-5×1019n+/cm2,注入10s,停止注入5s,反复操作30-60min,得到破壁后的纳豆芽孢杆菌菌体;
步骤3:包括第一次浸提和第二次浸提;
第一次浸提:将破壁后的纳豆芽孢杆菌菌体置入其质量5-25倍的无水乙醇中,在温度15-25℃下浸提10min~40min;浸提完成后,以3000-8000rpm的转速离心5-10min,分别收集上清液和沉淀物;
第二次浸提:将第一次浸提得到的沉淀物置入其质量5-25倍的无水乙醇中,在温度25-50℃下浸提10min~40min;浸提完成后,以3000-8000rpm的转速离心5-10min,收集上清液;
步骤4:合并第一次浸提后得到的上清液和第二次浸提后得到的上清液,进行减压浓缩后得到浓缩后的物质;
步骤5:用正己烷溶解减压浓缩后的物质后得到正己烷溶液,该正己烷溶液的维生素k2的浓度范围为60-200mg/l,然后,将正己烷溶液装入萃取柱中进行柱萃取;
所述萃取柱包括一容器,该容器的底部设有滤膜,所述容器的出液口设有开关;
所述萃取柱中正己烷溶液的装入量为33.3-50.0%容器的体积,正己烷溶液装入容器后,首先,向容器中加入超纯水以萃取除去强极性杂质,超纯水的用量为正己烷溶液的1-3倍,时间为8-25min;然后,向容器柱中加入10%~95%的乙醇溶液以萃取除去弱极性杂质;
步骤6:对步骤5得到的柱萃取后的正己烷溶液进行减压浓缩处理得到浓缩液,然后向浓缩液中加入乙醇溶液,使浓缩的匀浆物质全部溶解为止,然后放置于-30~-0℃环境中静置24-48h,收集产生的黄色晶体。
优选的技术方案为:所述纳豆芽孢杆菌发酵液的菌体含量为8-15g/l、残糖含量为0.01-2g/l、残氮含量为3-8g/l,表面张力为18-24mn/m。
优选的技术方案为:所述陶瓷膜的设备运行过程中,用泵出水压0.01-0.3mpa的循环水散热,所述陶瓷膜的运行温度为15-60℃,所述陶瓷膜的通量为40-80l/m2·h。
优选的技术方案为:步骤4中,用旋转蒸发仪进行减压浓缩处理,控制压力为0.01-0.05mpa,旋转速度为40-90rpm/min。
优选的技术方案为:所述萃取柱的高径比为7.5-40.0。
优选的技术方案为:所述10%~95%的乙醇溶液以梯度浓度减小的方式加入容器中。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
本发明针对现有纳豆芽孢杆菌发酵制备维生素k2中的提取纯化技术的不足,提供了一种从破壁纳豆芽孢杆菌菌体中萃取纯化维生素k2的方法,该方法将新鲜的纳豆芽孢杆菌菌体进行离子束破壁处理,然后直接利用柱式萃取获取高纯度维生素k2。本发明方法,具有菌体破壁效率高、工艺简单、维生素k2提取率高等优点。
附图说明
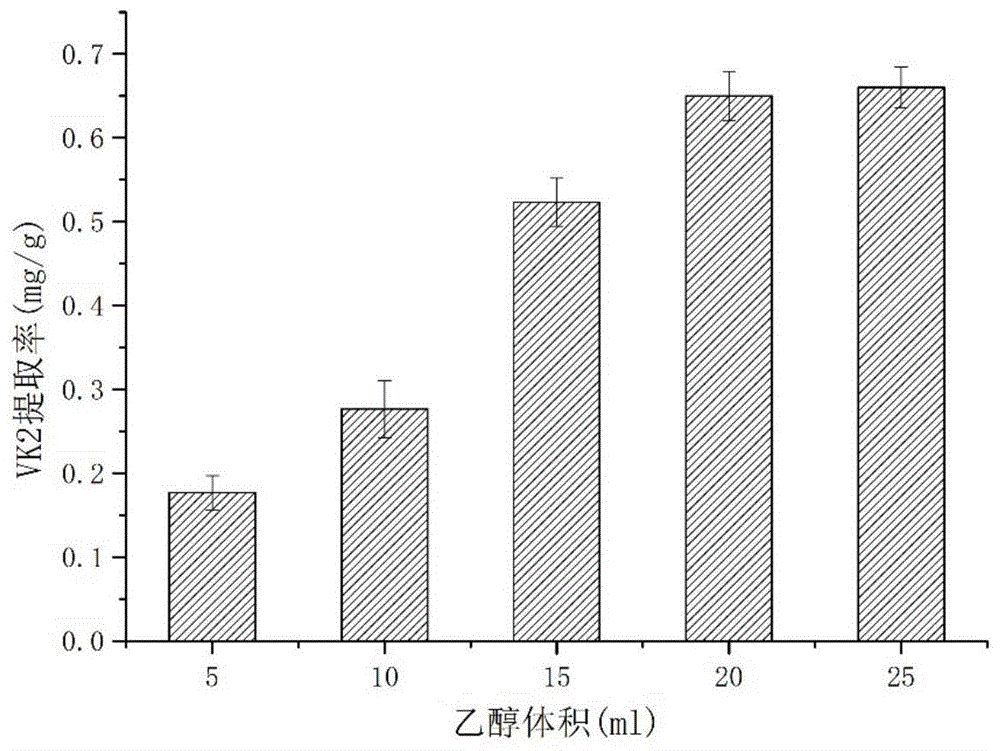
图1为第一次浸提乙醇体积优化。
图2为第二次浸提乙醇体积优化。
图3为湿提取的温度和搅拌方式的优化。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
请参阅图1-图3。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
实施例1:一种从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法
本发明的实施例中所用的高效液相色谱分析仪购买自日本岛津公司,装配有紫外检测器和反相c18柱(4.6mmi.d×250mm),流动相:甲醇/二氯甲烷=4:1,检测波长:248nm,柱温:35℃,进样量:20ul,流速:1ml/min。
本发明的实施例中所使用的试剂,除了高效液相色谱的为色谱纯,其余都为分析纯。
本实施例所处理的发酵液是纳豆芽孢杆菌在由甘油69.6g/l,葡萄糖34.5g/l,k2hpo44.0g/l,蛋白胨20g/l,酵母浸出液25g/l所组成的培养基中,在250rpm,37℃下培养五天所获得。
将发酵液加入到超滤膜设备中,打开各阀门,启动电源,开始浓缩,当所加入的物料经过循环泵全部以浓缩液流出即完成浓缩,即获得了富含纳豆芽孢杆菌菌体的浓缩液。超滤膜设备的滤膜为陶瓷膜。本实施例使用的陶瓷膜的孔径为1微米。
将上述浓缩液在4℃下离心,其转速为11000rpm,离心的时间为14min,离心结束后将液体倒掉,获得湿菌体。
取3支50ml的离心管,每支离心管中装入上述湿菌体1g,将溶菌酶配置成1mg/ml的溶液,向湿菌体中加入800ul-1ml的溶菌酶溶液,破壁30min,之后离心,向菌体中加入20ml乙醇,提取时间半小时,离心过滤后取上清进行高效液相色谱检测。每组平行试验三组。
取3支50ml的离心管,每支离心管中装入上述湿菌体1g,在-70℃的冰箱中冷冻10min后,快速放入70℃的水浴中解冻10min,如此反复三次。冻融之后向菌体中加入20ml乙醇,提取时间半小时,离心过滤后取上清进行高效液相色谱检测。每组平行试验三组。
取3支50ml的离心管,每支离心管中装入上述湿菌体1g,加入5-10ml的水,超声350w下超声15-30min(每超声5s,暂停3s)。将超声破壁的菌体离心后,向沉淀中中加入20ml乙醇,提取时间半小时,离心过滤后取上清进行高效液相色谱检测。每组平行试验三组。
用有机试剂进行破壁,取6支50ml的离心管,每支离心管中装入上述湿菌体1g,向其中分别加入5-10ml的甲醇或乙醇,搅拌均匀后,25℃下反应30min,进行破壁。之后离心,将有机相倒出,向破壁的菌体中加入20ml乙醇,提取时间半小时,离心过滤后取上清进行高效液相色谱检测。每组平行试验三组。
取未经过上述步骤处理的湿菌体1g平铺于培养皿中,放入离子束辐照装置的注入靶室中,注入靶室的真空度为10-3pa。用离子束对纳豆芽孢杆菌进行破壁处理。其中所用离子的能量为25kev,注入量为1×1017n+/cm2。向上述经过离子束破壁处理的纳豆芽孢杆菌中加入20ml乙醇,搅拌均匀后,提取30min,离心过滤后取上清进行高效液相色谱检测。每组平行试验三组。
实验结果如表一所示,离子束不仅能够使细胞破碎,而且与其他常见的破壁方法相比,用离子束破壁效果最好,破壁效果提高了30%,达到了0.65mg/g。
表1:不同破壁方式的效果
向经过离子束辐照处理后的菌体中分别加入5ml,10ml,15ml,20ml,25ml的无水乙醇,搅拌均匀,25℃提取30min后,15000rpm离心10min,取上清,高效液相色谱(hplc)检测计算提取量。
如图1所示,随着无水乙醇量的增加,提取的效果越来越好,当所用体积为20ml与25ml时相差较少,为了减少有机试剂的使用,因此选择20ml作为我们破壁的体积。
按照上述实施方法,向经过离子束破壁处理后湿菌体中加入20ml的无水乙醇提取后,离心,收集上清,向沉淀中的湿菌体中再加入5-20m无水乙醇以提取出更多胞内的vk2后,25℃静止浸提30min后,15000rpm离心10min,收集上清,高效液相色谱(hplc)检测计算提取量。重复试验三组。优化浸提所用的有机试剂。
如图2所示,当所用的乙醇体积为10ml时提取量就能更达到0.85mg/g,随着加入无水乙醇的增加,提取量无明显变化,因此选择10ml的乙醇作为我们第二步浸提的体积。
将得到的湿菌体,并取三支离心管湿菌体,冷冻干燥,得到干菌体,向干菌体中分别加入10ml甲醇萃取1h,15000rpm离心10min,收集有机相,重复上述步骤三次,将三次提取液收集,液相检测,平行试验三组。作为对照组。
将经过离子束破壁之后的湿菌体中加入20ml乙醇进行提取30min,之后离心,收集上清。向沉淀中再加入10ml无水乙醇;
将上述加入无水乙醇的样品分别在25℃,30℃,40℃,50℃条件下静止30min,离心,测定提取率;
在提取率最高的温度下,将样品进行搅拌处理30min,离心之后收集上清液;
将上述不同条件下无水乙醇的提取液收集,高效液相色谱检测。平行试验三组。与上述干菌体提取液对比。
如图3所示,随着温度的升高,提取率也升高,当温度达到40℃时,温度对提取率的影响不再改变。因此,在40℃下将样品搅拌处理,由图可以看出,搅拌处理的提取率得到很大提高,这与在搅拌的情况下固液接触面积更大有关。并且与用甲醇提取干菌体相比,提取率提高了26%。
将乙醇提取液和无水乙醇浸提液收集减压浓缩,加入正己烷溶解,获得维生素k2浓度在60mg/l-200mg/l的高浓度溶液。向直径为1cm-3.5cm,高度为25cm-40cm的玻璃柱的底部加入滤膜,并向其中加入三分之一柱体积的正己烷溶液,分别缓慢加入不同体积的超纯水进行萃取,速度控制在1ml/min。其目的是除去母液中强极性的杂质,随着所用超纯水体积的增加,萃取出的杂质也随着增高,但当增大到一定体积时,萃取效果增加不明显,因此,用2.5倍的超纯水进行萃取,除去强极性的杂质。
向萃余相中以1ml/min的速度依次加入95%~10%的乙醇,移除不同极性的杂质。其依次为:95%乙醇以2bv萃取,70%乙醇以2bv萃取,30%乙醇以2bv萃取,10%乙醇以1bv萃取,柱萃取之后的萃余相纯度达到85.6%。在实验过程中我们发现萃取过程没有乳化现象,这与我们萃取的速度缓慢有关,整个过程的回收率很高。
将萃余相收集,减压浓缩除去正己烷,获得匀浆,向匀浆中加入少量的95%乙醇,获得饱和溶液,将饱和溶液-20℃冷冻24h获得晶体,将上清吸出,晶体加入乙醇重溶,纯度达到95%。
表二:各步骤的纯度
实施例2:一种从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法
一种从破壁纳豆芽孢杆菌发酵产物中萃取纯化维生素k2的方法,包括下列步骤:
步骤1:将纳豆芽孢杆菌发酵液用具有孔径为5nm的陶瓷膜的超滤膜设备进行过滤,得到的浓缩液以5000rpm的转速离心20min,弃去上清液,收集的沉淀物质即为纳豆芽孢杆菌的新鲜菌体;
步骤2:将纳豆芽孢杆菌的新鲜菌体置入离子束设备中,用氮离子束轰击菌体,所用离子的能量为15kev,注入的离子量为1×1015n+/cm2,注入10s,停止注入5s,反复操作60min,得到破壁后的纳豆芽孢杆菌菌体;
步骤3:包括第一次浸提和第二次浸提;
第一次浸提:将破壁后的纳豆芽孢杆菌菌体置入其质量5倍的无水乙醇中,在温度25℃下浸提40min;浸提完成后,以3000rpm的转速离心10min,分别收集上清液和沉淀物;
第二次浸提:将第一次浸提得到的沉淀物置入其质量5倍的无水乙醇中,在温度50℃下浸提40min;浸提完成后,以8000rpm的转速离心10min,收集上清液;
步骤4:合并第一次浸提后得到的上清液和第二次浸提后得到的上清液,进行减压浓缩后得到浓缩后的物质;
步骤5:用正己烷溶解减压浓缩后的物质后得到正己烷溶液,该正己烷溶液的维生素k2的浓度范围为200mg/l,然后,将正己烷溶液装入萃取柱中进行柱萃取;
所述萃取柱包括一容器,该容器的底部设有滤膜,所述容器的出液口设有开关;
所述萃取柱中正己烷溶液的装入量为33.3%容器的体积,正己烷溶液装入容器后,首先,向容器中加入超纯水以萃取除去强极性杂质,超纯水的用量为正己烷溶液的1倍,时间为8min;然后,向容器柱中加入10%的乙醇溶液以萃取除去弱极性杂质;
步骤6:对步骤5得到的柱萃取后的正己烷溶液进行减压浓缩处理得到浓缩液,然后向浓缩液中加入乙醇溶液,使浓缩的匀浆物质全部溶解为止,然后放置于-30℃环境中静置24h,收集产生的黄色晶体。
优选的实施方式为:所述纳豆芽孢杆菌发酵液的菌体含量为8g/l、残糖含量为0.01g/l、残氮含量为3g/l,表面张力为18mn/m。
优选的实施方式为:所述陶瓷膜的设备运行过程中,用泵出水压0.01mpa的循环水散热,所述陶瓷膜的运行温度为15℃,所述陶瓷膜的通量为40l/m2·h。
优选的实施方式为:步骤4中,用旋转蒸发仪进行减压浓缩处理,控制压力为0.01mpa,旋转速度为40rpm/min。
优选的实施方式为:所述萃取柱的高径比为7.5。
优选的实施方式为:所述10%的乙醇溶液以梯度浓度减小的方式加入容器中。
实施例3:一种从破壁纳豆芽孢杆菌菌体中提取纯化维生素k2的方法
一种从破壁纳豆芽孢杆菌发酵产物中萃取纯化维生素k2的方法,包括下列步骤:
步骤1:将纳豆芽孢杆菌发酵液用孔径为10um的陶瓷膜进行过滤,得到的液以18000rpm的转速离心20min,弃去上清液,收集的沉淀物质即为纳豆芽孢杆菌的新鲜菌体;
步骤2:将纳豆芽孢杆菌的新鲜菌体置入离子束设备中,用氮离子束轰击菌体,所用离子的能量为35kev,注入的离子量为5×1019n+/cm2,注入10s,停止注入5s,反复操作30min,得到破壁后的纳豆芽孢杆菌菌体;
步骤3:包括第一次浸提和第二次浸提;
第一次浸提:将破壁后的纳豆芽孢杆菌菌体置入其质量25倍的无水乙醇中,在温度15℃下浸提10minmin;浸提完成后,以3000rpm的转速离心5min,分别收集上清液和沉淀物;
第二次浸提:将第一次浸提得到的沉淀物置入其质量25倍的无水乙醇中,在温度25℃下浸提10minmin;浸提完成后,以3000rpm的转速离心5min,收集上清液;
步骤4:合并第一次浸提后得到的上清液和第二次浸提后得到的上清液,进行减压浓缩后得到浓缩后的物质;
步骤5:用正己烷溶解减压浓缩后的物质后得到正己烷溶液,该正己烷溶液的维生素k2的浓度范围为200mg/l,然后,将正己烷溶液装入萃取柱中进行柱萃取;
所述萃取柱包括一容器,该容器的底部设有滤膜,所述容器的出液口设有开关;
所述萃取柱中正己烷溶液的装入量为50.0%容器的体积,正己烷溶液装入容器后,首先,向容器中加入超纯水以萃取除去强极性杂质,超纯水的用量为正己烷溶液的3倍,时间为25min;然后,向容器柱中加入95%的乙醇溶液以萃取除去弱极性杂质;
步骤6:对步骤5得到的柱萃取后的正己烷溶液进行减压浓缩处理得到浓缩液,然后向浓缩液中加入乙醇溶液,使浓缩的匀浆物质全部溶解为止,然后放置于-30℃环境中静置48h,收集产生的黄色晶体。
优选的实施方式为:所述纳豆芽孢杆菌发酵液的菌体含量为15g/l、残糖含量为2g/l、残氮含量为8g/l,表面张力为24mn/m。
优选的实施方式为:所述陶瓷膜的设备运行过程中,用泵出水压0.3mpa的循环水散热,所述陶瓷膜的运行温度为60℃,所述陶瓷膜的通量为80l/m2·h。
优选的实施方式为:步骤4中,用旋转蒸发仪进行减压浓缩处理,控制压力为0.05mpa,旋转速度为90rpm/min。
优选的实施方式为:所述萃取柱的高径比为40.0。
优选的实施方式为:所述95%的乙醇溶液以梯度浓度减小的方式加入容器中。
以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
- 还没有人留言评论。精彩留言会获得点赞!