自驱动微流控芯片及其使用方法与流程
本发明涉及微流控芯片领域,特别涉及一种自驱动微流控芯片及其使用方法。
背景技术:
近20年来,我国每年新发癌症病例超过220万,同时,新发病例仍在以每年3%-5%的速度在增加,癌症已经成为影响我国人民生命健康的第一死因。癌症的发生,先后需经历基因突变、癌细胞产生、形成肿瘤到最后的转移扩散几个步骤。目前的癌症诊断方法主要有病理检查、影像学检查等,要等到肿瘤生长到一定大小,癌症发展到中后期才能够得到较为准确的检测结果,往往错过了患者的最佳治疗时间。如果能够在癌细胞分裂增值的过程中即可实现对突变基因的检测,将诊断时间提前,则可以提高很多患者的存活率。一种高灵敏度高准确性的核酸检测方法急需被提出。
目前,常规的核酸检测方法是将目标核酸分子扩增,实现信号放大。主要有聚合酶链式反应(polymerasechainreaction,pcr)、环介导等温扩增(loop-mediatedisothermalamplification,lamp)以及重组酶聚合酶扩增(recombinasepolymeraseamplification,rpa)等,其中应用最为广泛的是实时荧光定量pcr技术。而在pcr方法中,第三代数字pcr方法则检测灵敏度更高,该方法预先将待测dna分子分散至成千上万个反应单元中,通过统计每一个反应单元pcr扩增前后的荧光强度变化,即可得到初始样本的dna浓度,能够实现超低浓度核酸样本的定量检测。相对比传统的核酸检测技术而言,数字pcr检测灵敏度更高,可检测的动态范围也更广,在癌症标志物分析、产前无创检测、环境监测、食品安全监测等多种领域都能够得到更加准确的检测结果。
微流控芯片技术是将传统的生化分析集成到一块几平方厘米甚至更小的芯片上,在芯片内的微纳尺度通道以及微腔室中完成检测分析。更适合与单核酸分子检测方法联合使用,实现高灵敏度,低试剂量的检测。在微流控芯片的相关操控中,通常会用到注射器或气泵电泵等设备驱动试剂在芯片中流动,这就使得芯片操作复杂,且需要配备相应的仪器才能够实现功能。
技术实现要素:
有鉴于此,本发明旨在提出一种无需外部驱动设备,能够实现自驱动上样的自驱动微流控芯片。
为达到上述目的,本发明的技术方案是这样实现的:
一种自驱动微流控芯片,用于容纳待测样本溶液,所述自驱动微流控芯片包括基底及封装片,所述基底和封装片至少之一为无色透明材料;所述封装片贴合并固定连接于所述基底的一表面上,所述基底与封装片之间形成有进样口、出样口、多个反应腔及一条或多条主通道;所述进样口及出样口可与外界连通,所述主通道与所述进样口及出样口连通,每个所述反应腔与一条所述主通道之间设置有进液通道及出液通道;
所述主通道、反应腔、进液通道及出液通道的位于所述基底和/或封装片的内表面为亲水表面,且所述进液通道的横截面积小于所述出液通道的横截面积,在所述主通道内的液流方向上,所述进液通道位于出液通道的前侧,以使由进样口进入的所述待测样本溶液能够在毛细力驱动下进入所述反应腔内;
并且,所述待测样本溶液进入所述反应腔后,所述主通道内能够通入油相试剂以封闭所述进液通道和出液通道。
进一步的,所述基底由基片构成,或者所述基底由基片及贴合于所述基片上的反应层构成。
进一步的,所述基片及所述反应层为硅片,所述封装片为玻璃片。
进一步的,所述进样口、出样口、主通道、反应腔、进液通道及出液通道通过刻蚀方法形成于所述基底上。
进一步的,所述主通道的宽度为5μm~5mm,高度为5μm~3mm。
进一步的,所述进液通道的宽度为5μm~3mm,高度为5μm~3mm;所述出液通道的宽度为5μm~3mm,高度为5μm~3mm。
进一步的,所述进液通道、所述出液通道、所述主通道的横截面积依次增大。
进一步的,所述油相试剂为矿物油、硅油、氟油或石蜡油中的一种或多种的混合物。
进一步的,所述主通道设置为多条,且多条所述主通道与所述出样口之间设置有废液池。
相对于现有技术,本发明具有以下优势:
本发明所述的自驱动微流控芯片,进样口进入的待测样本溶液在通道的毛细力作用下,从进样口向前流动,在到达进液通道时,会在该进液通道的毛细力作用下进入反应腔内,因为进液通道和出液通道的前后布置位置关系以及横截面积不同的关系,待测样本溶液在进液通道内受到的毛细力更大,因而能够从进液通道进入对应反应腔内,并推动反应腔内的空气从出液通道流向主通道内。持续加入待测样本溶液后,所有的反应腔均可以被填满。由此可实现待测样本溶液的自驱动流动上样,并无需在外界设置外部驱动设备,同时其还能进一步防止环境中的杂质污染检测样本,进而亦可以避免扩增后的样本对于环境产生的污染。
本发明也提出了如上的自驱动微流控芯片的使用方法,其包括如下步骤:
a、将待测样本的dna或rna与带有荧光探针或荧光染料的核酸扩增反应试剂混合,得到待测样本溶液;
b、将待测样本溶液加在自驱动微流控芯片的进样口处,使得溶液在毛细力的驱动下首先流入主通道,最后依次流入进液通道、反应腔、出液通道,直到充满所有通道和反应腔;
c、在进样口加入与水不相容的油相试剂,通过压力驱动使油相试剂沿主通道流向废液池,且使主通道中的待测样本溶液被油相试剂驱动而流向废液池,直至主通道中充满油相试剂,反应腔均被单独隔离;
d、封闭进样口与出样口;
e、将芯片置于实时荧光定量pcr系统中,进行实时荧光采集检测,并得到荧光信号变化曲线;或者,将芯片置于原位pcr系统中,进行数字pcr扩增反应,反应结束后,使用荧光采集系统,对反应腔区域进行荧光成像,采集每一个反应腔的荧光强度信号,并设置一个荧光强度阈值,且超过该阈值的反应腔室为阳性,统计阳性反应腔室的个数,利用泊松分布推导计算,得到检测样本的原始拷贝数,而实现绝对定量。
本发明的自驱动微流控芯片的使用方法,能够实现实时荧光定量pcr检测或数字式pcr检测,且其无需设置微阀微泵等结构,实验成本较低,同时其反应腔四周为密封状态,也具有防蒸发、防融合效果好等优点。
附图说明
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1为本发明实施例一所述的自驱动微流控芯片的示意图;
图2为本发明实施例二所述的自驱动微流控芯片的示意图;
图3为图2中i处的局部放大图。
附图标记说明:
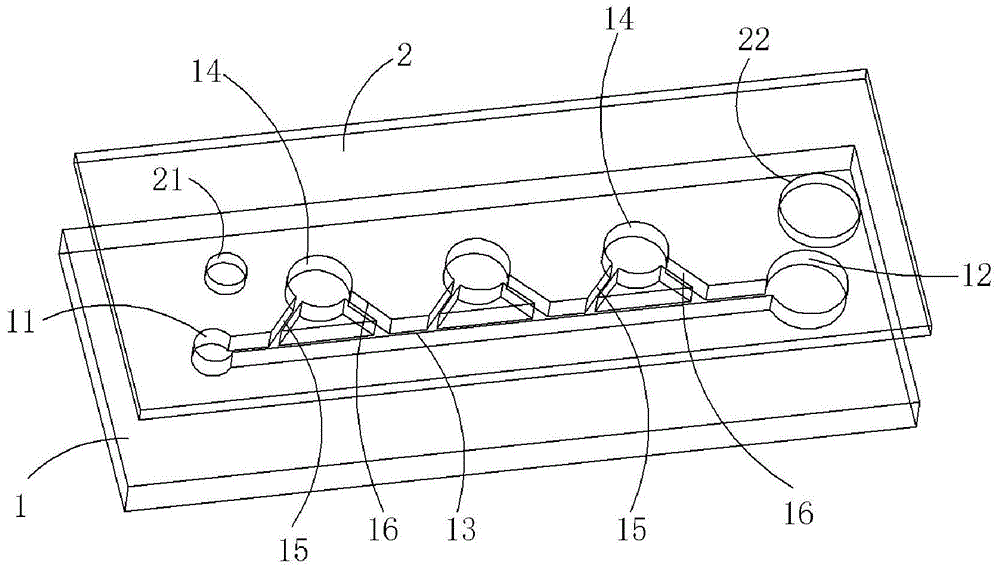
1-基底,11-进样口,12-出样口,13-主通道,14-反应腔,15-进液通道,16-出液通道,17-废液池,2-封装片,21-进样通孔,22-出样通孔。
具体实施例
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
下面将参考附图并结合实施例来详细说明本发明。
实施例一
本实施涉及一种自驱动微流控芯片,其用于容纳待测样本溶液,以便对待测样本溶液进行实时荧光定量pcr检测或者数字式pcr检测等各种检测作业。如图1中所示的,该自驱动微流控芯片包括基底1及封装片2,基底1和封装片2中至少其中之一为无色透明材料,同时该无色透明材料也应是自身低荧光的,且本实施例该低荧光特性一般为在pcr试剂所用荧光探针如fam、hex、vic、cy3、tamra、rox、cy5等的激发光波长照射下,材料被激发的荧光强度小于浓度为10e-8mol/l的荧光素的荧光强度。由该低荧光特性可以使得待测样本溶液的荧光可被检测仪器接收。
基底1的材料优选的为采用具有良好生物相容性、不易吸附核酸等物质的材料,并也优选采用导热效果好的材料。具体在本实施例中,该封装片2采用的是可以透光的玻璃片,而基底1则选用的是硅片。当然,在本发明其他实施例中,该基底1和封装片2可以同时选用玻璃片等透明材料,或者基底1和封装片2也可为满足本实施例微流控芯片设置要求的其它材料。
在图1中,为了清楚显示封装片2与基底1的结构,将该封装片2与基底1分开了一定的距离。而在实际应用中,该封装片2贴合并固定连接在基底1的一表面上,且在连接封装片2与基底1时,根据选用材料的不同,可以采用热压法、激光焊接、超声焊接、低温键合、静电键合、粘合剂粘接等方式。
仍由图1示出的,在基底1与封装片2之间形成有进样口11、出样口12、多个反应腔14以及一条主通道13。具体地,该进样口11、出样口12、多个反应腔14以及一条主通道13是通过刻蚀的方法成形在基底1的表面上的。在封装片2上设置有分别与进样口11和出样口12上下对齐的进样通孔21和出样通孔22,使得进样口11及出样口12能够与外界连通。主通道13的两端分别与该进样口11和出样口12连通,待检测样本溶液从进样通孔21滴入该进样口11后,可以经过主通道13流向出样口12,并从出样口12流出来。在每个反应腔14与主通道13之间设置有进液通道15和出液通道16。
本实施例的进样口11优选的可为圆形,且其直径优选的可以为0.5mm、1mm、1.2mm、1.5mm或2mm,高度可以为0.1mm、0.2mm或0.3mm。出样口12同样优选的也可为圆形,且直径较佳可以为0.5mm、1mm、2mm、3mm、4mm或5mm,高度则可以为0.1mm、0.2mm或0.3mm。
应当注意的是,该进样口11、出样口12、多个反应腔14、主通道13、进液通道15和出液通道16除了可以设置在基底1上之外,也可以设置在封装片2上,或者同时加工在基底1和封装片2上。将封装片2贴合并固定在基底1的表面上之后,进样口11、出样口12、多个反应腔14、主通道13、进液通道15和出液通道16这些结构即位于了基底1和封装片2之间,此时反应腔14、主通道13、进液通道15和出液通道16封闭于基底1和封装片2之间,并只能通过进样口11和出样口12与外界大气连通。
此外,本实施例中还应说明的是,对于基底1而言,该基底1可为仅由一基片构成,且此时由该基片和封装片2构成的微流控芯片的结构可参见上文中所描述的。或者,本实施例的基底也可由一基片以及贴合于该基片上的反应层构成,且此时可以在反应层上刻蚀镂空的通道及反应腔等结构,对应于反应层基片便作为了底层,封装片则作为了上层,以此使得微流控芯片形成三层结构,这是不同于基底1仅由基片构成时的二层结构的。基片和反应层优选的仍可为采用硅片。
本实施例在主通道13、反应腔14、进液通道15及出液通道16的位于基底1和/或封装片2的内表面为亲水表面,且进液通道15的横截面积小于出液通道16的横截面积,在主通道13内的液流方向上,进液通道15位于出液通道16的前侧,也就是说,当主通道13内的液体流动时,会首先接触到进液通道15,然后才接触出液通道16。前述的亲水表面可由二氧化硅层组成。
通过上述的设置,进样口11进入的待测样本溶液在主通道13的毛细力作用下,从进样口11向前流动,在到达进液通道15时,会在该进液通道15的毛细力作用下进入反应腔14内,因为进液通道15和出液通道16的前后布置位置关系以及横截面积不同的关系,待测样本溶液在进液通道15内受到的毛细力更大,因而能够从进液通道15进入对应反应腔14内,并推动反应腔14内的空气从出液通道16流向主通道13内。持续加入待测样本溶液后,所有的反应腔14均可以被填满。如此一来,本实施例的自驱动微流控芯片便实现了待测样本溶液的自驱动流动上样,无需在外界设置外部驱动设备。
本实施例中,沿着主通道13内的液流方向,该进液通道15与主通道13的夹角小于90°,出液通道16与主通道13的夹角则大于或等于90°,如此一来,待测样本溶液能够更加顺畅低进入到进液通道15中。另外,本实施例中进液通道15、出液通道16以及主通道13的横截面积也依次增大设置,由于在同等条件下,通道的横截面积越小,其内部毛细力越大,因此进液通道15横截面积小于出液通道16,可保证进液通道15内的毛细力比出液通道16内的毛细力高,待测样本溶液能够源源不断地从进液通道15进入到反应腔14内,并将反应腔14内的空气从出液通道16排出,且进液通道15内的单位时间内液流量不会低于出液通道16。
本实施例进液通道15和出液通道16与主通道13相交之处的间隔布置,这样当待测样本溶液沿着主通道13流动时,可使足够多的溶液首先进入到进液通道15中,并将反应腔14中的空气压入出液通道16,这些空气能够阻止待测样本溶液进入到出液通道16,因而更容易将反应腔14充满。
本实施例中,主通道13的宽度为5μm–5mm,高度为5μm–3mm,且优选的,主通道13的宽度可为10μm–500μm,例如20μm、50μm、100μm、200μm、250μm、300μm、400μm,主通道13的高度可为10μm-500μm,例如20μm、50μm、100μm、200μm、250μm、300μm、400μm。
进液通道15的宽度为5μm–3mm,高度为5μm–3mm,且优选的,进液通道15的宽度可为5μm–500μm,例如10μm、20μm、50μm、100μm、200μm、250μm、300μm、400μm,进液通道15的高度可为5μm–500μm,例如10μm、20μm、50μm、100μm、200μm、250μm、300μm、400μm。
出液通道16的宽度为5μm–3mm,高度为5μm–3mm,且优选的,出液通道16的宽度可为5μm–500μm,例如10μm、20μm、50μm、100μm、200μm、250μm、300μm、400μm,出液通道16的高度可为5μm–500μm,例如10μm、20μm、50μm、100μm、200μm、250μm、300μm、400μm。
本实施例中,当待测样本溶液进入到反应腔14后,可以向主通道13内通入油相试剂,该油相试剂种类不限,例如可为矿物油、硅油、氟油或石蜡油中的一种,或者也可是几种的混合物。由于在反应腔14、进液通道15及出液通道16内已经填充了待测样本溶液,而待测样本溶液为水性,与油不相容,因此油相试剂不会进入进液通道15和出液通道16,这样就可以通过油相试剂使待测样本溶液保持分散在各个反应腔并被封闭起来的状态。加样结束后,使用透明度高、耐高温的胶带贴在芯片表面,封闭进样口11和出样口12。
本实施例的自驱动微流控芯片依靠结构的设计以及材料表面张力即可实现无驱动进样,无需外接驱动泵及其他驱动设备,加样过程简单便捷,为在常规实验环境以及各种特殊复杂试验环境种检测核酸提供了更加方便的操作方式,还可以大大减少检测成本。同时,采用本方法制作的芯片进样快速,能够提高检测速度,大大缩短等待时间。
此外,本实施例的自驱动微流控芯片所需待测样本溶液的上样量为微升级,对于样本以及试剂的需求量小,可以减少被测者样本采集的困难,同时也可以减少试剂使用量,降低成本。而待测样本溶液的进样与分散均在密闭的芯片中,随后扩增与结果检测也无需再次将样本取出,全部过程均不与外接环境接触,能够有效防止环境中的杂质污染检测样本,同时也可以避免扩增后的样本对于环境产生的污染。
而与传统实时荧光定量pcr等核酸检测芯片相比,本实施例的自驱动微流控芯片具有试剂分散功能,不仅能够实现传统的核酸检测,还能够实现数字核酸检测。数字核酸检测方法能够实现更高灵敏度以及更高准确性的核酸绝对定量检测,理论上可实现单分子核酸检测。在癌症早期筛查、癌症伴随诊断、无创产前筛查、器官移植配型等对于检测灵敏性以及准确性要求较高的领域均可以有较广泛的应用空间。
另外,与目前已有的数字pcr平台相比,本实施例的自驱动微流控芯片无需配备进样仪器,也无需在芯片上制作微阀微泵等结构,可以大大降低芯片的制作成本。同时,由于反应腔四周均为密封状态,仅与主通道部分相连,相比液滴以及微槽型的数字pcr芯片而言,防蒸发、防融合效果更好。同时,其反应腔的体积固定,均一性也更高,检测的灵敏度与准确度也更好。
实施例二
本实施涉及一种自驱动微流控芯片,其与实施例一中的自驱动微流控芯片有大致相同的结构,不同之处在于结合图2和图3中所示的,在本实施例中,主通道13设置为多条,且这些主通道13与出样口12之间设置有废液池17,反应腔14的结构为方形。各个主通道13中的待检测溶液或者油相试剂能够进入废液池17中,再流向出样口12。
此外,本实施例的自驱动微流控芯片在使用,以进行实时荧光定量pcr检测或者数字pcr核酸检测时,其具体的使用方法包括如下步骤,且下文中的待测样本溶液可为商业化的hbvdna片段。而实施例一的自驱动微流控芯片在使用时亦可参考如下所述的步骤。
详细来说,本实施例的自驱动微流控芯片的使用方法包括:
步骤a、将待测样本的dna或rna与带有荧光探针或荧光染料的核酸扩增反应试剂混合,得到待测样本溶液;
步骤b、将待测样本溶液加在自驱动微流控芯片的进样口处,使得溶液在毛细力的驱动下首先流入主通道,最后依次流入进液通道、反应腔、出液通道,直到充满所有通道和反应腔;
步骤c、在进样口加入与水不相容的油相试剂,通过压力驱动使油相试剂沿主通道流向废液池,且使主通道中的待测样本溶液被油相试剂驱动而流向废液池,直至主通道中充满油相试剂,反应腔均被单独隔离;
步骤d、封闭进样口与出样口;
步骤e、将芯片置于实时荧光定量pcr系统中,进行实时荧光采集检测,并得到荧光信号变化曲线。或者,将芯片置于原位pcr系统中,进行数字pcr扩增反应,反应结束后,使用荧光采集系统,对反应腔区域进行荧光成像,采集每一个反应腔的荧光强度信号,并设置一个荧光强度阈值,且超过该阈值的反应腔室为阳性,统计阳性反应腔室的个数,利用泊松分布推导计算,得到检测样本的原始拷贝数,而实现绝对定量。
本实施例的自驱动微流控芯片,能够实现实时荧光定量pcr检测或数字式pcr检测,无需设置微阀微泵等结构,实验成本低,反应腔四周为密封状态,防蒸发、防融合效果好。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!