一种固定化赖氨酸脱羧酶生产戊二胺的方法与流程
本发明属于生物技术领域,涉及一种固定化赖氨酸脱羧酶生产戊二胺的方法。
背景技术:
聚酰胺(pa),又称尼龙,是一种可广泛应用于纺织、汽车、电子电器、医用材料等领域的重要聚合物。目前,全球聚酰胺(尼龙,pa)产品的每年消耗量大约为3000万吨,预计到2020年交易额可达437亿美元。其中,应用最为广泛的聚酰胺材料主要为聚己内酰胺(pa6)以及聚己二酰己二胺(pa66),两者的消费量占聚酰胺总消费量的九成左右。pa66的聚合所需要的单体之一,己二胺是一种来源于化石燃料的重要化合物,过度依赖与石油资源的合成方式势必导致一系列问题,如环境污染,油价上涨,气候变化等。随着化石资源的枯竭以及人们环保意识的加强,以生物质为原料的环境友好型材料开始得到更多重视,使得寻找一种可再生资源替代石油生产尼龙变得迫在眉睫,以此,以1,5-戊二胺为单体的生物基聚酰胺5x系列得到了极大的关注和发展。
1,5-戊二胺是一种广泛存在于自然界中,具有多种生物活性的多胺,可由蛋白质腐败时经赖氨酸脱羧酶转化得到。作为一种重要的合成中间体,它被广泛应用于多种新型材料和聚合物的合成。例如用戊二胺参与合成的尼龙5.4、尼龙5.6、尼龙5.12等,基于戊二胺的尼龙材料展现出了优异的材料特性,其中很多重要的物料性质已经超过了传统尼龙材料。因此,与衍生自石油的传统尼龙材料相比,生物基聚酰胺的生产可以有效缓解石油资源的消耗及环境问题,具有战略性的发展前景。
目前生产戊二胺的方法大致分为工程菌直接发酵产戊二胺和生物转化法。第一种是通过对微生物(如大肠杆菌,谷氨酸棒杆菌)的代谢途径的改造,一步发酵得到1,5-戊二胺。生物转化法是通过赖氨酸脱羧酶作用于底物l-赖氨酸,在辅酶磷酸吡哆醛(plp)的添加下,一步脱羧得到产物1,5-戊二胺。生物转化法具有底物转化率高、催化周期短、生产过程简便易调控的优势,得到广泛应用。
但是由于酶催化过程中,酶的不可回收、重复利用率低、生产成本的提升制约了1,5-戊二胺的工业化生产。
文献“用固定化l-赖氨酸脱羧酶细胞制备1,5-戊二胺”(蒋丽丽等,精细化工,2007,24(11),1080-1084)中报道采用3wt%的海藻酸钙固定含有赖氨酸脱羧酶的细胞,此固定化方法固定的细胞稳定性差,第2批转化时酶活就发生显著下降,第4批转化时酶活降低到约为第1批酶活的38%。
申请号201610726632.5公开了一种利用重氮基修饰的高分子载体制备固定化赖氨酸脱羧酶,并用其制备1,5-戊二胺的方法。该固定化方法的固定化酶制备过程中,涉及多步反应且排放的化学试剂会对环境造成污染。
申请号201610726608.1公开了一种环氧基修饰的高分子载体的制备,以及赖氨酸脱羧酶与环氧基进行反应通过共价键固定于高分子载体上的固定化酶的制备方法,以及用该固定化酶生产1,5-戊二胺的方法。该方法的高分子载体制备以及赖氨酸脱羧酶的固定化过程中,设计的环氧基修饰与共价结合,过程繁琐,需要多种有机试剂的参与,整个过程中会造成较大的化学污染物的排放,不利于大规模的产业化进程。
综合文献和专利报道可得出,目前制备的固定化的赖氨酸脱羧酶,多采用高分子凝胶载体,实际操作过程中的步骤繁琐,反应排放污染大,且也存在着重复率低下的情况。因此,本领域需要一种更廉价的固定化载体、更简便、更稳定的的赖氨酸脱羧酶固定化酶的制备方法。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种固定化赖氨酸脱羧酶生产戊二胺的方法。该方法首先构建融合蛋白菌株pet-29a(+)-chbd-cada,在发酵所得粗酶液中,加入成本低廉可再生的生物基材料几丁质作为固定化载体,进行亲和吸附后一步制备得到固定化酶。所得固定化酶的制备方式简便、酶活损失小、稳定性好、底物转化率高,也可简化产品中1,5-戊二胺与酶的分离步骤,降低生产成本,为酶法直接催化生产1,5-戊二胺实现产业化具有一定推动作用。
为解决现有技术问题,本发明采取的技术方案为:
一种固定化赖氨酸脱羧酶生产戊二胺的方法,包括以下步骤:
步骤1,融合蛋白质粒的构建
提取赖氨酸脱羧酶基因cada与几丁质结合域基因chbd基因,以连接转化方法将所得基因片段在空质粒pet-29a(+)中依次连接上chbd基因和cada基因,其中chbd基因连接在cada基因的n端,完成质粒pet-29a(+)-chbd-cada构建后,转入克隆载体trans1-t1,经过lb平板初筛后,挑点进行菌落pcr验证后测序,并将测序正确的菌株培养、提质粒后,转化进表达载体bl21(de3),即得含有赖氨酸脱羧酶融合蛋白的基因工程菌;
步骤2,赖氨酸脱羧酶粗酶液的制备
培养含有赖氨酸脱羧酶融合蛋白的基因工程菌,将种子液以体积分数1%-5%接种量接入lb培养基中,37℃下培养至菌密度od600为0.4-0.6时,加入诱导剂诱导12-14h后收集发酵液,再在低温离心机进行6000-8000g离心,收集菌株,用蒸馏水洗涤2-5次后破碎细胞,低温离心机6000-8000g离心后收集上清,即得赖氨酸脱羧酶粗酶液;
步骤3,赖氨酸脱羧酶与几丁质的亲和吸附
向赖氨酸脱羧酶粗酶液中加入质量分数为1-4%的几丁质,4-37℃、100-400rpm下搅拌,再调节ph至5.6-8.0,亲和吸附10-120min,即得固定化酶;
步骤4,1,5-戊二胺的生产
将固定化酶从粗酶液中分离出来,加入底物赖氨酸盐酸盐与辅酶磷酸吡哆醛,42℃下,200-400rpm的搅拌速度进行转化反应2-5小时后得戊二胺转化液,并回收转化液中的固定化酶,备用;所述底物赖氨酸盐酸盐浓度为100g/l-200g/l,辅酶磷酸吡哆醛浓度为0.05-0.2mm。
作为改进的是,所述几丁质高压均质处理过的几丁质粉粒。
作为改进的是,所述几丁质结合域基因chbd来自菌株chitinolyticbactermeiyuanensisybc-h1;所述赖氨酸脱羧酶基因cada来自大肠杆菌(escherichiacoli)mg1655。
作为改进的是,步骤4中从粗酶液或转化液中分离固定化酶的方法为离心或抽滤。
作为改进的是,所述步骤4中底物赖氨酸盐酸盐的浓度为100g/l-200g/l,辅酶磷酸吡哆醛浓度为0.1mm。
作为改进的是,步骤4中回收的固定化酶用蒸馏水或柠檬酸-磷酸氢二钠缓冲液冲洗。
进一步改进的是,其特征在于:所述柠檬酸-磷酸氢二钠缓冲液的浓度为100mm,ph为6.2-6.8。
有益效果:
(1)本发明中构建的基因工程菌表达得到的赖氨酸脱羧酶融合蛋白,可特异性亲和吸附在几丁质上,实现酶蛋白的固定化,制备得到固定化赖氨酸脱羧酶。所制备赖氨酸脱羧酶可直接应用于1,5-戊二胺的酶催化生产。
(2)本发明固定化酶具有吸附性好、固定化效率高、酶活损失小等优点,且多次回收使用都可保持较高酶活。解决了游离酶的不可回收、稳定性差以及传统全细胞固定化方法的重复率低下的缺点,产物与酶的分离简便,简化分离工艺,降低生产成本。
(3)本发明固定化酶所用的固定化材料为可再生的生物质材料几丁质,成本低廉,大大降低传统固定化材料的成本,且吸附方式简单,简化固定化酶的制备工艺。
(4)固定化赖氨酸脱羧酶催化底物生成1,5-戊二胺的生产率高、简化下游产品分离工艺,降低了生产成本,对生物转化法生产1,5-戊二胺的工业化具有一定的推动作用。
附图说明
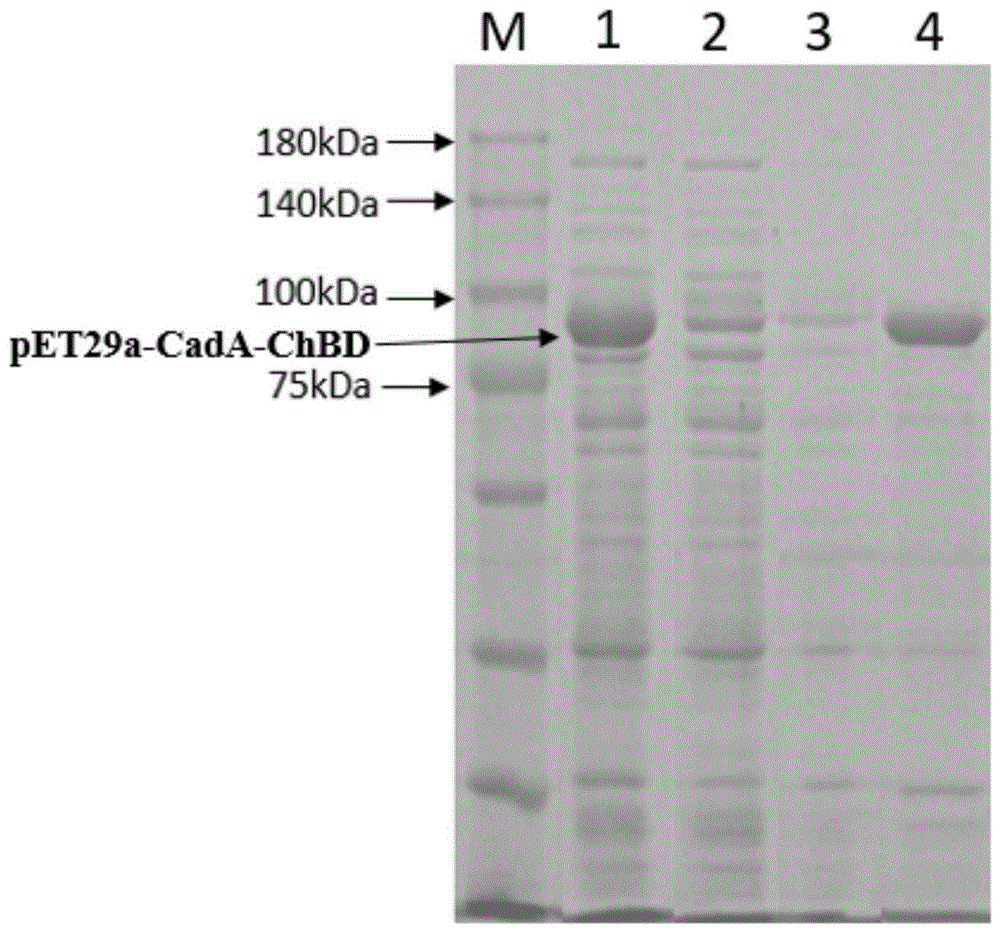
图1显示融合蛋白pet-29a(+)-chbd-cada的sds-page分析:
m-蛋白marker,
1-融合蛋白上清,
2-融合蛋白沉淀,
3-融合蛋白吸附后上清液,
4-固定蛋白重复反应9次后,sds洗脱蛋白;
图2为不同温度下,赖氨酸脱羧酶与固定化酶的活性情况;
图3为赖氨酸脱羧酶与固定化酶的温度稳定性;
图4为不同ph下,赖氨酸脱羧酶与固定化酶的活性情况;
图5为赖氨酸脱羧酶与固定化酶的ph稳定性;
图6为固定化酶催化反应情况;
图7为实施例7中固定化酶的重复利用情况;
图8为实施例6生产得1,5-戊二胺的液相分析图。
具体实施方式
下面的实施例可使本专业技术人员更全面地理解本发明,但不以任何方式限制本发明。
实施例1融合蛋白质粒的构建
使用细菌基因组提取试剂盒(tiangen)提取来源于大肠杆菌mg1655(购于武汉淼灵生物科技有限公司)和来源于江南大学江南大学郝之奎赠与的chitinolyticbactermeiyuanensissybc-h1(atccbaa-2140t)的基因组,再分别通过pcr扩增得到赖氨酸脱羧酶基因cada和几丁质结合域基因chbd。
使用下列引物
1:5’-cgggatccttctttcaataccttaacgg-3’
2:5’-catgccatggatgaacgttattgcaatattg-3’
以e.colimg1655的总dna为模板进行pcr扩增,pcr反应结束后,在ncoli和bamhi酶切位点处酶切得到大小为2.1kb的目的片段cada,核酸胶验证后通过胶回收试剂盒(tiangen)回收目的基因。
使用下列引物
3:5’-cccaagcttcggcgtcggagtagcaacaacc-3’
4:5’-cgggatccacgccggttgctgccacc-3’
以chitinolyticbactermeiyuanensisybc-h1的总dna为模板进行pcr扩增,pcr反应结束后,在bamhi和hindiii酶切位点处酶切得到大小为0.4kb的目的片段chbd,核酸胶验证后通过胶回收试剂盒(tiangen)回收目的基因。
将质粒pet29a(+)进行双酶切(酶切位点为hindiii和ncoli),将所得基因片段cada与chbd与酶切好的质粒用t4dna连接酶连接得到重组质粒pet-29a(+)-chbd-cada。
重组质粒抗性为卡那霉素,启动子为t7,终止子为rrnb。将重组质粒将重组质粒pet-29a(+)-chbd-cada(10μl)与大肠杆菌trans1-t1感受态细胞(20μl)混合并置于冰上25-30min,然后热激42-45s,热激完成后于超净台中加入800μl的lb培养基,置于摇床上37℃培养1h。培养完成后离心机4000g离心4min,离心完成后吸去上清(700μl),将剩余的100μl进行涂布(平板为lb,抗性为卡那霉素,浓度为0.5mm)并置于30-37℃的培养箱中培养10-18h。对所得平板上的菌落进行菌落pcr验证,对跑胶结果为阳性的菌,送测序完成初筛。挑取测序正确的菌,接种于lb培养基中,培养12-14h后,提质粒。将质粒(10μl)与大肠杆菌bl21(de3)感受态细胞(20μl)以同样方法完成转化后,得到赖氨酸脱羧酶融合蛋白的菌株。
所用的lb培养基的配方如下:10g/l蛋白胨,5g/l酵母粉,5g/l氯化钠。
实施例2赖氨酸脱羧酶粗酶液的制备
制备构建得到的赖氨酸脱羧酶生产菌的种子液,培养基为lb培养基,在37℃、200rpm下培养6-7h,将种子液以体积分数2%接种于装有500mllb的发酵培养基中,在37℃、200rpm下培养至od为0.6,以1‰的添加量添加诱导剂iptg,在30℃、200rpm下诱导12h后结束发酵收集发酵液。
对发酵液进行8000g离心后收集菌体,用蒸馏水洗涤两次后,重悬于25ml柠檬酸-磷酸氢二钠(100mmph6.8)中,超声破碎后进行8000g离心,收集上清即为赖氨酸脱羧酶粗酶液,4℃贮存备用。
实施例3赖氨酸脱羧酶与几丁质的亲和吸附
取10ml实施例2中所得赖氨酸脱羧酶粗酶液,加入0.1g高压均质处理过的几丁质粉末进行赖氨酸脱羧酶的亲和吸附。吸附完成后6000g离心去除上清液并收集沉淀,沉淀即为我们所需的吸附有赖氨酸脱羧酶的几丁质粉粒(固定化酶)。用蒸馏水洗涤两次后,收集洗涤后的固定化赖氨酸脱羧酶,4℃下保藏备用,吸附环境参数为温度20℃,搅拌转速200rpm,ph6.8。
实施例4融合蛋白pet-29a(+)-chbd-cada的sds-page分析
分别取实施例2中所得的粗酶液与实施例3中所得固定化酶,对其进行sds-page凝胶电泳分析其蛋白表达。取200μl粗酶液,经12000g离心后,收集上清备用;离去上清后,沉淀用蒸馏水补至200μl体系,震荡重悬后备用;取200μl实施例3中固定化酶吸附后的上清备用;取200μl酶量吸附后的固定化酶,用200μl的1%浓度的sds溶液对其进行变性,变性条件为99℃,10min。变性结束12000g离心收集上清备用。取准备好的粗酶液上清(即融合蛋白上清)、粗酶液沉淀(即融合蛋白沉淀)、固定化酶吸附上清(即融合蛋白吸附后上清)、固定化酶sds洗脱蛋白,用4xproteinsdsloadingbuffer(takara)完成热变性后,进行sds-page凝胶电泳分析,具体分析结果如图1所示。
实施例5固定化酶与游离酶的酶学性质对比
分别取等量酶活的粗酶液与固定化酶,添加至一个2ml的反映体系内,体系的底物l-赖氨酸浓度为100g/l,辅酶磷酸吡哆醛浓度为0.01mm。在25℃到60℃的温度区间内,分别测其最适温度以及温度稳定性,其体系ph为6.8,搅拌为200rpm;按照同样的体系,在ph4.0-8.0范围内,分别测粗酶液与固定化酶的最适ph以及ph稳定性,其体系中,反应温度为42℃,搅拌为200rpm。游离酶和固定化酶的最适反应温度分别为42℃与47℃,最适ph分别为6.2与6.8。相比较而言,固定化酶在47℃到60℃的区间范围内能保持更高的酶活,47℃时,游离酶酶活骤降而固定化酶能保持超过85%的酶活,57℃时,固定化酶还能保持超过75%的酶活。在ph范围为6.8-8.0时,固定化酶能保持更好的稳定性,在ph为8.0时,可保持超过83%的酶活性。
实施例61,5-戊二胺的生产
转化反应在50ml离心管中进行,在实施例3中制备得到的赖氨酸脱羧酶固定化酶中,加入赖氨酸盐酸盐溶液和辅酶磷酸吡哆醛(plp),用柠檬酸-磷酸二氢钠溶液(100mm,ph6.8)补至10ml的反应体系,其中,反应体系的赖氨酸盐酸盐和磷酸吡哆醛(plp)的终浓度分别为100g/l和0.01mm,在42℃,200rpm条件下转化3h,得到戊二胺转化液,其摩尔转化率达98.3%。
1,5-戊二胺检测方法为hplc,检测条件为agilgent1260infinitysystem;示差检测器;色谱柱:ymccarotenoid色谱柱,250×4.6mml.d.s-5µm(产品货号:ct99s05-2546wt);流动相成分:50ml乙腈+5ml三氟乙酸加水定容到1l;流速:0.8ml/min;进样量:10µl,柱温:35℃。具体如图8所示。
实施例7固定化酶的重复利用
在6000g转速下,离心收集实施例5中所得的几丁质,用蒸馏水反复洗涤两次后,6000g离心收集得到固定化酶进行下一次转化反应,该方法制备的固定化酶,重复转化9次后,还可保持75%以上初始酶活。
与本发明所使用的固定化酶相比,当使用游离酶进行脱羧反应时,游离酶只可进行一次催化反应并无法重复使用,且固定化酶具有相较于游离酶更好的热稳定性与ph稳定性。本方法提供一种,一步纯化-吸附的固定化策略,具有吸附效率高、蛋白固定牢固、特异性吸附强的优势。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到的技术方案的简单变化或等效替换均落入本发明的保护范围内。
序列表
<110>南京工业大学
<120>一种固定化赖氨酸脱羧酶生产戊二胺的方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgggatccttctttcaataccttaacgg28
<210>2
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>2
catgccatggatgaacgttattgcaatattg31
- 还没有人留言评论。精彩留言会获得点赞!