一种血浆中α1微球蛋白的提取方法与流程
本发明属于蛋白质分离纯化领域,尤其是涉及一种血浆中α1微球蛋白的提取方法。
背景技术:
α1微球蛋白(alpha1-microglobulin,α1-mg)是人体内相对分子质量约26000~33000kda的小分子糖蛋白,通常由182个氨基酸残基组成,最早由ekstrom等从慢性镉中毒患者的尿液中分离、提纯得到,电泳时位于α1区带而得名。其独特的大小和电荷的不均一性,使功能变得十分重要。作为判断肝脏及肾脏功能的重要指标,在体内分布广泛,主要由肝细胞或淋巴细胞特异性合成后,随血液运输分配到体内各种组织中。在血液中,α1微球蛋白主要存在形式有游离、与免疫球蛋白iga或白蛋白结合形式存在。当重度肝功能损害时,由于肝细胞受损,使肝脏合成、代谢和分泌α1-mg减少,肝病患者血清中α1-mg含量降低。游离型α1-mg能自由地通过肾小球滤过膜,但在近曲小管处因重吸收作用几乎又被吸收,同时结合形式的α1-mg不能通过肾小球滤过,正常情况下人的尿液中只可以检测到游离型α1-mg的存在,一旦由于肾小球滤过功能受损或肾小管重吸收和代谢能力降低,就会导致结合形式α1-mg更多地由血液释放到尿液中,引起α1-mg的含量增高。因此,α1-mg作为筛查早期肾病、肝病的重要指标,在临床,门诊及健康诊断等多方面被广泛应用。
由于α1-mg在疾病诊断上有广泛的应用,因此开发高效的纯化方案具有显著的现实意义和应用价值。现有报道的相关的提纯方法均比较复杂,操作繁琐且费用高,见沈新义等《人尿液α1—微球蛋白的分离,纯化及鉴定》(第二军医大学学报,1992,13),所用的传统的纤维介质de52/cm52,流速慢,重生效果差,寿命短,不适合量化生产。
技术实现要素:
本发明所要解决的问题就是提供一种血浆中α1微球蛋白的提取方法,为制备诊断试剂盒中抗体原料提供基础,其技术方案如下:
一种血浆中α1微球蛋白的提取方法,包括以下步骤:
1)取α1微球蛋白抗原免疫后的新鲜羊血浆,待血液凝固后,取血浆离心除去纤维蛋白原及某些凝血因子后分离出淡黄色透明液体-血清;
2)虹吸法吸出上层淡黄色透明液体,采用硫酸铵沉淀法沉淀至溶液硫酸铵终饱和浓度达到33%(w/v)。血清充分沉淀后,采用ph7.5的磷酸钾缓冲液复溶沉淀,采用生理盐水溶液透析,采用peg20000浓缩蛋白。
3)取装有sephadexg100填料的色谱柱,用ph7.5的磷酸钾缓冲液作为平衡缓冲液平衡所述色谱柱,上样,然后用相同缓冲液以0.5ml/min洗脱,收集洗脱液,用peg20000浓缩收集液。
4)吸取proteing亲和层析介质匀浆到一个预先装有1mlbindingbuffer的层析柱内,让填料填料自然沉降到柱子底部,加入5mlbindingbuffer到柱中,让buffer缓慢流出,流速为1ml/min。将步骤3)中的浓缩液用bindingbuffer1:1稀释,开始加样,流速约为0.2-0.5ml/min,收集流出液,后续用sds-page检测纯化效率。使用大约30mlbindingbuffer洗涤,流速大约为2ml/min,边洗涤边检测280nm处的吸光度,直至出现稳定值。洗涤完毕后,开始加入10-15mlelutionbuffer,使用1ml/min较低流速,收集洗脱液,再调节ph至7.4,即为纯的α1微球蛋白。其中bindingbuffer为:20mmnahpo4,0.15mnacl,ph8.0。elutionbuffer为:0.1m甘氨酸ph2.5。
5)利用sds-page鉴定α1微球蛋白纯度。采用12%分离胶,5%浓缩胶,取50μl样品溶液加10μl10x样品缓冲液混合均匀,煮沸5min,12000rpm离心5min上样。
本发明的有益效果是:
本发明提供的方法中,使用的sephadexg100,这种胶ph范围宽,载量大,更适合α1-mg的纯化,而且整体操作简便,重复性强,单次操作生产量大。
附图说明
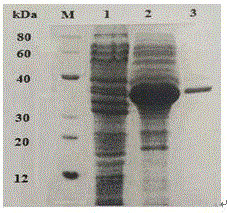
图1为本发明实施例纯化后α1微球蛋白sds-page图谱。
具体实施方式
下面结合附图及具体的实施例对本发明的内容作进一步的阐述,但实施例仅是本发明的较佳实施方式,故凡依本发明专利申请范围所述的特征及原理所做的等效变化,均包括于本发明专利申请范围内。
实施例1:
第一步,取α1微球蛋白免疫后的羊血浆,常温下自然沉降过夜,次日于4℃下,4000xg离心15min,去除红细胞、白细胞、血小板出等多种血细胞;
第二步,吸出上层淡黄色透明液体,采用硫酸铵沉淀法沉淀至溶液硫酸铵终饱和浓度达到33%(w/v),置于4℃过夜沉淀。血清充分沉淀后,次日于4℃下,8000xg离心20min,弃上清,收集沉淀。采用ph7.5的磷酸钾缓冲液将沉淀复溶,并采用生理盐水溶液于4℃下过夜透析,以除去血清中存有的大量硫酸铵,透析结束后,采用peg20000浓缩蛋白;
第三步,取装有sephadexg100填料的色谱柱(2cm*60cm),用ph7.5的磷酸钾缓冲液作为平衡缓冲液平衡所述色谱柱,将第二步中的浓缩液上样,然后用相同缓冲液以0.5ml/min的流速洗脱,同时检测280nm处的吸光度,收集洗脱液直至280nm处的吸光度出现恒定值,用peg20000浓缩收集液。
第四步,吸取proteing亲和层析介质匀浆到一个预先装有1mlbindingbuffer的层析柱内,让填料填料自然沉降到柱子底部,加入5mlbindingbuffer到柱中,让buffer缓慢流出,流速为1ml/min。将步骤3)中的浓缩液用bindingbuffer1:1稀释,开始加样,流速约为0.2-0.5ml/min,收集流出液,后续用sds-page检测纯化效率。使用大约30mlbindingbuffer洗涤,流速大约为2ml/min,边洗涤边检测280nm处的吸光度,直至出现稳定值。洗涤完毕后,开始加入10-15mlelutionbuffer,使用1ml/min较低流速,收集洗脱液,再调节ph至7.4。其中bindingbuffer为:20mmnahpo4,0.15mnacl,ph8.0。elutionbuffer为:0.1m甘氨酸ph2.5。之后用截留量为10kd的超滤膜进行浓缩,即为纯的α1微球蛋白。
第五步,利用sds-page鉴定α1微球蛋白纯度。采用12%分离胶,5%浓缩胶,取50μl样品溶液加10μl10x样品缓冲液混合均匀,煮沸5min,12000rpm离心5min后取样10μl加入凝胶点样孔。连接电泳仪,调整电压至80v,待样品全部进入凝胶后,换用130v,开始电泳直至溴酚蓝指示剂达到凝胶底部。电泳结束后将胶块置于蒸馏水洗涤2次,再置于r-250染色液中过夜染色,蒸馏水洗涤脱色,检测目的蛋白。
本实施例获得的α1微球蛋白分子量为35kda,α1微球蛋白的纯度为90%,回收率为85%。
本发明提供的方法纯化后α1微球蛋白sds-page图谱如图1所示。
图1中,从左至右分别为maker、羊血清样品、33%硫酸铵沉淀羊血清后的样品、羊血清亲和层析纯化后的样品。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!