一种基于CRISPR/Cas9技术的牛磺酸转运体基因敲除大鼠模型的构建方法与流程
本发明属于生物工程技术领域,涉及一种基于crispr/cas9技术的牛磺酸转运体基因敲除大鼠模型的构建方法。
背景技术:
牛磺酸(taurine,tau)是一种含硫氨基酸,能调节细胞渗透压,防止细胞内钙超载,减少自由基产生,改善细胞膜的通透性,防止细胞肿胀变形,是婴儿中枢神经系统发育期间的重要营养因子,有增强突触传递,缓解中风、癫痫、神经退行性疾病症状等神经保护作用。tau主要是由细胞膜上的牛磺酸转运体(taurinetransporter,taut;基因序列slc6a6,nc_005103.4)转运至细胞内,以维持细胞内tau的高浓度,taut是由621个氨基酸残基组成的约74kda的蛋白质,包含12个跨膜螺旋区。在急性损伤发生后,细胞内的tau可调节脑细胞渗透压,改善神经元肿胀。本课题组前期实验证实颅脑创伤后细胞膜上taut的活性失调,脑水含量和水通道蛋白4的表达升高,损伤神经元等。
为研究tau缺乏对机体的影响,研究人员通常是用补充taut抑制剂如β-丙氨酸等干扰tau吸收的方法制作动物模型,但是这种一过式的抑制牛磺酸摄入的方法,短暂且不稳定,故急需一种更稳定有效的方法构建该动物模型。在研究人类中枢神经系统疾病方面,大鼠与人更为接近,在生理、行为、代谢方面比小鼠更有优势。大鼠广泛被用于:奖励和惩罚实验、迷宫实验、神经官能症等高级神经活动的研究。由于构建和繁殖敲除大鼠比小鼠困难,2010年才建立了第一个基于胚胎干细胞的p53基因敲除大鼠模型。近几年发展的crispr/cas9技术可以敲除特定基因位点,有靶向精确性高、实验周期短,无物种限制,且比zfn、talen技术易操纵等优势,得以推广。据报道:自2013年crispr/cas9系统发明以来,已有超过30种不同的转基因大鼠实验模型被用于神经科学、内分泌学和癌症等领域。目前,仅有关于taut基因敲除(taut-/-)小鼠模型的研究,对于敲除该基因的大鼠模型及其有关的病理生理研究尚无文献报道。
技术实现要素:
本发明为了解决上述现有技术中存在的问题,提供了一种基于crispr/cas9技术的牛磺酸转运体基因敲除大鼠模型的构建方法。
本发明为解决这一问题所采取的技术方案是:
一种基于crispr/cas9技术的牛磺酸转运体(taut)基因敲除大鼠模型的构建方法,包含以下步骤:
步骤1:针对taut基因(slc6a6)第5外显子,选择2个不同的sgrna的作用靶点,合成两对寡聚核苷酸链(rat-slc6a6-grna1、rat-slc6a6-grna2),合成的两对寡聚核苷酸链经退火,退火条件是:95℃5min后自然降至室温,连入经bsai酶切回收的puc57-sgrna表达载体(addgene质粒,#51132),构建得到sgrna表达载体;通过测序验证连入片段是否正确,选择正确的进行克隆,扩大培养后提取质粒用于准备体外转录模板;
步骤2:将cas9表达质粒(addgeneno.44758:pst1374-nls-flag-linker-cas9)经ageⅰ酶切线性化,经酚氯仿抽提纯化后,溶于无核酸酶的水中作为模板,用于体外转录,经体外转录获得cas9mrna,其中,cas9mrna的合成由试剂盒t7ultrakit(ambion,am1345)在体外利用t7rna聚合酶完成;将步骤1中构建得到的sgrna表达载体经draⅰ酶切线性化后,经酚氯仿抽提纯化,溶于无核酸酶的水中作为模板,用于体外转录,经体外转录获得sgrna,其中,sgrna的体外转录使用试剂盒megashortscriptkit(ambion,am1345),具体按试剂盒操作说明进行;
步骤3:将转录好的所述cas9mrna、sgrna混合并调节浓度至cas9mrna(20ng/μl),sgrna(10ng/μl/每种sgrna),添加同源重组donor(5-10ng/ul),通过显微注射法(te2000u纤维注射仪)注射到sd大鼠受精卵的雄性胞核和细胞质中,再植入假孕大鼠体内,繁殖得到f0代大鼠;
步骤4:将步骤3获得的f0代大鼠进行基因型鉴定,筛选获得f0代杂合子大鼠,将f0代杂合子大鼠与野生型sd大鼠合笼,得到f1代杂合子(taut+/-)大鼠;
步骤5:将f1代杂合子(taut+/-)大鼠与野生型sd大鼠合笼,得到f2代杂合子(taut+/-)大鼠;
步骤6:将f2代杂合子大鼠自交后,得到f3代纯合子(taut-/-)大鼠、f3代杂合子(taut+/-)大鼠、f3代阴性(taut+/+)大鼠,其中,f3代纯合子(taut-/-)大鼠即为牛磺酸转运体(taut)基因敲除大鼠模型。
优选的,所述步骤1中的两对寡聚核苷酸链分别为:
rat-slc6a6-grna1-up:taggcccctttgtcccacagac,其核苷酸序列如seqidno:1所示;
和rat-slc6a6-grna1-down:aaacgtctgtgggacaaagggg,其核苷酸序列如seqidno:2所示;
rat-slc6a6-grna2-up:tagggacagaccctgtctctgg,其核苷酸序列如seqidno:3所示;
和rat-slc6a6-grna2-down:aaacccagagacagggtctgtc,其核苷酸序列如seqidno:4所示。
优选的,所述步骤4、5、6包括进一步对所得到的大鼠进行基因型鉴定,分析新生大鼠的基因分型。
优选的,将出生10-12d左右的大鼠,采用剪趾法编号,并提取大鼠基因组dna,通过pcr扩增靶点区域dna片段,对获得pcr产物通过测序确定crispr/cas9介导的基因突变情况。
进一步优选的,基因型鉴定所用的引物序列为:
上游引物:tcattgtcctgtccccacttctt,其核苷酸序列如seqidno:5所示;
下游引物:tcctcatctgacagttaaagaatctaagg,其核苷酸序列如seqidno:6所示。
本发明具有的优点和积极效果是:
本发明利用crispr/cas9技术定向敲除大鼠的taut基因(slc6a6)外显子,成功构建taut-/-大鼠模型,并进行繁殖和鉴定,为进一步研究牛磺酸对大鼠神经疾病模型的影响提供可靠而稳定的基因工程模型,为研究牛磺酸对神经系统疾病的影响提供稳定的动物模型,为阐明牛磺酸对相关疾病的治疗作用等探究工作奠定基础。
附图说明
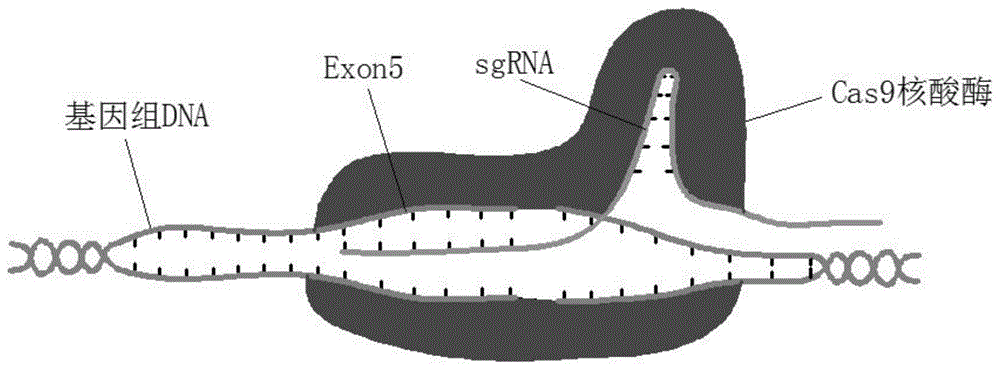
图1利用crispr/cas9技术敲除slc6a6第五外显子的示意图;
图2部分大鼠基因型pcr鉴定结果;其中,m:dna分子量标记;2#f1代:taut+/-;c:空白对照;n:wt。taut-/-大鼠:3、5、7;taut+/+大鼠:2、6;taut+/-大鼠:1、4;
图3目的基因测序比对结果;其中,a:taut-/-大鼠测序结果:在“tttg”碱基中间敲除了约390bp;b:taut-/-和taut+/+大鼠序列比对结果:taut-/-缺失390bp;c:taut+/+和taut-/-大鼠碱基序列对比:矩形框区域是包含taut第5外显子的靶序列,划线部分是cas9核酸酶切割目的序列后,重组修复随机添加的序列;
图4不同基因型大鼠脑组织taut蛋白和slc6a6mrna表达的情况;其中,a:taut-/-组与taut+/+组taut蛋白表达情况(n=6);b:taut-/-组与taut+/+组taut蛋白表达相对定量分析比较,***p<0.001(n=6);c:taut+/+组、wt分别与taut-/-组slc6a6mrna表达相对定量分析比较,***p<0.001,(n=6);
图5taut-/-与taut+/+鼠脑部皮层和海马区附近的免疫组化结果比较;注:图a、b、c为taut+/+大鼠海马分别放大40×、100×、200×的图;图d、e、f为taut-/-大鼠海马分别放大40×、100×、200×的图;图g、h、i为taut+/+大鼠皮层分别放大40×、100×、200×的图;图j、k、l为taut-/-大鼠皮层分别放大40×、100×、200×的图;箭头所示为taut表达位置举例。
具体实施方式
以下将结合附图和实施例来对本发明的技术方案作进一步的详细描述。
实施例1
1.材料及方法
1.1实验动物
实验所需大鼠均选用spf级sd大鼠,体重240~260g,购自北京华阜康生物科技股份有限公司。
1.2方法
1.2.1牛磺酸转运体基因敲除(taut-/-)sd大鼠的构建和繁殖
taut-/-sd大鼠模型,是采用crispr/cas9基因编辑技术,针对taut基因(slc6a6)第5外显子,选择2个不同sgrna的作用靶点,合成两对寡聚核苷酸链,
其中,两对寡聚核苷酸链分别为:
rat-slc6a6-grna1-up:taggcccctttgtcccacagac,其核苷酸序列如seqidno:1所示
和rat-slc6a6-grna1-down:aaacgtctgtgggacaaagggg,其核苷酸序列如seqidno:2所示;
rat-slc6a6-grna2-up:tagggacagaccctgtctctgg,其核苷酸序列如seqidno:3所示
和rat-slc6a6-grna2-down:aaacccagagacagggtctgtc,其核苷酸序列如seqidno:4所示;
退火后,连入经bsai酶切回收的puc57-sgrna表达载体(addgene质粒,#51132),构建得到sgrna表达载体,通过测序验证连入片段是否正确,选择正确的进行克隆,扩大培养后提取质粒用于准备体外转录模板;
将cas9表达质粒(addgeneno.44758:pst1374-nls-flag-linker-cas9)经ageⅰ酶切线性化,经酚氯仿抽提纯化后,溶于无核酸酶的水中作为模板,用于体外转录,经体外转录获得cas9mrna,其中,cas9mrna的合成由试剂盒t7ultrakit(ambion,am1345)在体外利用t7rna聚合酶完成;
将sgrna表达载体经draⅰ酶切线性化后,经酚氯仿抽提纯化,溶于无核酸酶的水中作为模板,用于体外转录,经体外转录获得sgrna,其中,sgrna的体外转录使用试剂盒megashortscriptkit(ambion,am1345),具体按试剂盒操作说明进行;
将转录好的所述cas9mrna、sgrna混合并调节浓度至cas9mrna(20ng/μl),sgrna(10ng/μl/每种sgrna),添加同源重组donor(5-10ng/ul),通过显微注射法(日本尼康公司te2000u纤维注射仪)注射到sd大鼠受精卵的雄性胞核和细胞质中,再植入假孕大鼠体内,繁殖得到f0代大鼠;
将f0代大鼠进行基因型鉴定,筛选获得f0代杂合子大鼠,将f0代杂合子大鼠与野生型sd大鼠合笼,得到f1代杂合子(taut+/-)大鼠;将f1代杂合子(taut+/-)大鼠与野生型sd大鼠合笼以扩充体系,得到f2代杂合子(taut+/-)大鼠;将f2代杂合子大鼠自交后,得到f3代纯合子(taut-/-)大鼠、f3代杂合子(taut+/-)大鼠、f3代阴性(taut+/+)大鼠,其中,f3代纯合子(taut-/-)大鼠即为牛磺酸转运体(taut)基因敲除大鼠模型。
1.2.2基因组提取、扩增和测序
利用crispr/cas9系统,将slc6a6基因的第五外显子235bp及内含子共约90bp的片段靶向敲除,通过基因型鉴定,分析新生大鼠的基因分型。将出生10-12d左右的大鼠,采用剪趾法编号,并根据北京全式金生物技术有限公司的easypuregenomicdnakit(ee101-12)提取大鼠基因组dna。
大鼠基因组dna经pcr扩增靶序列,基因型鉴定所用的引物序列为:
上游引物:tcattgtcctgtccccacttctt,其核苷酸序列如seqidno:5所示;
下游引物:tcctcatctgacagttaaagaatctaagg,其核苷酸序列如seqidno:6所示。
利用深圳辉诺生物科技有限公司genstar2×taqpcrstarmixwithloadingdye(a112-10)试剂盒在定量pcr仪(瑞士roche公司,lc480)上进行扩增。
pcr反应体系(见表1)和条件如下所示:
表1pcr反应体系如下
pcr反应步骤如下所示:
dna扩增产物,用1.5%琼脂糖凝胶-tae缓冲系统进行水平电泳,5%genered核酸染料;上样量为5ul,电压200v,30min
结果判断依据:阴性taut+/+是一条带:702bp;杂合子taut+/-含有两条带,分别为702bp和312bp;纯合子taut-/-是一条带:312bp。
提取f1代taut+/-、f3代taut+/+和taut-/-的基因组,经pcr扩增,由上海生物工程公司测序后(美国abi公司基因测序仪3500),再与f0代比对,以确定crispr/cas9介导的基因敲除情况。
1.2.3real-timepcr检测taut-/-和taut+/+大鼠脑组织中slc6a6的表达
利用天根生化科技(北京)有限公司rnasimpletotalrnakit(天根dp419)提取taut-/-和taut+/+大鼠大脑组织总rna,用rt-pcrkit(天根kr118)反转录后,用superrealpremixplus(sybrgreen)(天根fp205)real-timepcr检测slc6a6mrna表达。
slc6a6基因引物序列为:
上游5’-gaggtcatcataggccagtac-3’,其核苷酸序列如seqidno:7所示;
下游5’-gtacacattcaggagggacac-3’,其核苷酸序列如seqidno:8所示,
扩增产物为120bp。
以gapdh为内参:
上游5’-aactcccattcttccacc-3’,其核苷酸序列如seqidno:9所示;
下游5’-accaccctgttgctgtag-3’,其核苷酸序列如seqidno:10所示,
扩增产物为100bp。
pcr反应体系:10μl的2×sybrgreenmix,上下游引物(10μmol/l)各1μl,1μl的cdna,补充ddh2o至20μl。pcr反应条件:95℃预变性5min,94℃变性15s,60℃退火15s,72℃延伸15s,40个循环,最后72℃延伸5min。taut、gapdh的退火温度分别是60℃和55℃。
样本目的基因的相对表达量计算公式为:相对表达量=2-△△ct
(△ct=ct1-ct2;ct1:样品目的基因的临界循环数;ct2:样品管家基因的临界循环数;△△ct=每个△ct值-(对照组△ct的平均值))
1.2.4westernblot技术检测taut-/-和taut+/+大脑组织中taut蛋白表达
麻醉处死taut-/-和taut+/+大鼠,取大脑组织,匀浆后,提取并测定总蛋白浓度,等质量上样,利用mini-proteantetracell电泳系统(美国bio-rad公司,1658033)进行sds-page电泳,70v,40min,120v,90min。在minitrans-blotcell型转膜系统(美国bio-rad公司,1703930)上,300ma湿转120min,5%脱脂奶粉封闭2h,加入taut抗体(e-10)(美国santcruzbiotechnology公司,货号sc-166640,1:200)、β-action一抗(北京博奥森生物科技有限公司,货号bs-0061r,1:1000),4℃孵育过夜,次日洗膜,加入兔抗小鼠辣根过氧化物酶标记二抗、β-actin二抗(北京中杉金桥生物技术有限公司,bs-10966r、zb2301)(1:1000)常温孵育2h,洗膜3次。加入dab显影剂(美国sigma公司,d8001),于凝胶成像系统(英国syngene公司,genegenius)进行图像采集。
样本中目的蛋白的相对表达量是目的蛋白条带与内参β-actin蛋白条带灰度值的比值。
1.2.5免疫组化检测taut-/-和taut+/+大脑组织taut蛋白的表达
心脏灌注taut-/-和taut+/+大鼠后,取脑组织,放入10%中性福尔马林溶液,固定24h之后,脱水,包埋制成蜡块,4μm切片,68℃烤箱烤片,再利用leicabond-ⅲ全自动免疫组化仪(德国leica公司,bond-ⅲ)进行常规染色程序:脱蜡、水化、封闭、孵育taut一抗(1:100)、冲洗、孵育二抗、冲洗、dab染色、苏木精复染,脱水透明、封片,光学显微镜(日本olympus公司,bx3-cbh)下观察,图像采集、分析结果。
1.3统计学分析
应用spss17.0和graphpadprism5软件分析数据。实验结果均以
实施例2
2.结果
2.1大鼠的构建和繁殖情况
利用crispr/cas9系统进行目的基因敲除,使slc6a6基因发生移码突变,并提前产生了终止密码子,使翻译提前终止,造成蛋白功能障碍,如图1所示。
历时约15个月,f1和f2代共繁育出23窝,f1-f3代总计186只,f3代出现纯合子,该代纯合率约为20.59%。
f3代taut+/+:taut+/-:taut-/-的比例约为1:2.57:1.28,近似满足孟德尔遗传定律。繁殖过程中,成年鼠死亡14只,死亡率约为7.53%。
f1-f3代大鼠繁殖情况见表2,多组f2代taut+/-大鼠自交情况统计见表3。
表2f1-f3代大鼠繁殖情况
表3f2代不同种群大鼠的繁育结果
2.2基因型鉴定和测序结果
f0代taut+/-(阳性/杂合子)大鼠与野生sd大鼠杂交,得到f1代taut+/-和taut+/+大鼠,f1代taut+/-与野生大鼠杂交继续扩充体系,f2后代taut+/-自交,f3代出现taut-/-(纯合子)。基因型鉴定结果如图2所示:taut-/-:一条带312bp;taut+/-:两条带,为702bp和312bp;taut+/+/wt:一条带702bp。
测序比对结果显示,taut-/-或taut+/-(包含的缺失链)的基因缺失位点,如图3a所示。taut-/-和taut+/+大鼠序列比对和靶点敲除情况,如图3b、3c。taut+/+基因型大鼠和taut-/-基因型大鼠序列相差约390bp,缺失靶点上下游序列对应一致。
由基因型鉴定和测序结果可知:taut-/-大鼠的第5外显子及其附近390bp碱基被敲除,并发生重组修复。
2.3realtimepcr检测taut-/-和taut+/+大鼠脑组织slc6a6的表达
taut-/-大鼠脑组织slc6a6mrna表达和同窝taut+/+大鼠slc6a6mrna表达,结果如图4c所示。结果显示:taut-/-大鼠脑组织slc6a6mrna几乎不表达。
2.4westernblotting技术检测taut-/-和taut+/+大鼠脑组织taut蛋白的表达
蛋白免疫印迹实验结果表明,taut-/-组大鼠大脑中taut蛋白表达量与taut+/+组大鼠相比,显著降低。(如图4a、4b所示)
2.5taut-/-和taut+/+大鼠脑组织免疫组化结果
观察taut-/-大鼠和taut+/+大鼠两组皮层和海马区taut蛋白表达的情况。如图5可见,taut-/-大鼠的海马和皮层区细胞膜上基本无taut蛋白表达,而taut+/+鼠的海马和皮层区细胞膜上有taut蛋白表达,表明slc6a6基因的敲除导致taut-/-大鼠脑组织taut蛋白基本不表达。
综上所述,本发明利用crispr/cas9技术定向敲除大鼠的slc6a6基因外显子,成功构建taut-/-大鼠模型,并进行繁殖和鉴定,为进一步研究牛磺酸对大鼠神经疾病模型的影响提供可靠而稳定的基因工程模型,为研究牛磺酸对神经系统疾病的影响提供稳定的动物模型,为阐明牛磺酸对相关疾病的治疗作用等探究工作奠定基础。
序列表
<110>天津市环湖医院(天津市神经外科研究所、天津市脑系科中心医院)
<120>一种基于crispr/cas9技术的牛磺酸转运体基因敲除大鼠模型的构建方法
<160>10
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>1
taggcccctttgtcccacagac22
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
aaacgtctgtgggacaaagggg22
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
tagggacagaccctgtctctgg22
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
aaacccagagacagggtctgtc22
<210>5
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>5
tcattgtcctgtccccacttctt23
<210>6
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>6
tcctcatctgacagttaaagaatctaagg29
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
gaggtcatcataggccagtac21
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
gtacacattcaggagggacac21
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>9
aactcccattcttccacc18
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
accaccctgttgctgtag18
- 还没有人留言评论。精彩留言会获得点赞!