酵母葡聚糖提取物、组合物及在制备预防便秘制剂中的应用的制作方法
本发明涉及一种酵母β-葡聚糖提取物、组合物及其制备预防便秘的药物、食品以及保健品中的应用。
背景技术:
慢传输型便秘(slowtransitconstipation,stc)是由不同病理过程引起的一种复杂症状,主要临床表现为排便次数减少、粪便干结和排便费力等,严重影响患者生活质量。随着现代生活水平的提高,人们生活节奏加快,饮食结构改变以及亚健康问题的出现,stc的患病率呈逐年上升趋势,且随着年龄的增长而增加。慢性便秘全球发病率约为14%,其中stc占便秘4种亚型之首。
便秘不仅严重影响患者的生存质量,还与急性心脑血管疾病、阿尔茨海默症、帕金森、结直肠癌等有着密切的关系。现有研究认为慢传输型便秘的发生与结肠平滑肌活动、结肠反射、神经递质或结肠起搏细胞活动障碍有关,患有慢传输型便秘的患者整体结肠活动减少,胃及结肠反应能力受损或缺失。目前临床上用于治疗stc的非处方泻药主要为大便软化剂(二辛基磺酸钠二辛酯)、兴奋性和渗透性泻药。渗透性泻药诸如聚乙二醇(peg)可以吸收水分并保持在肠腔中。兴奋性泻药主要为西沙必利和番泻叶,可以加速结肠运输其中西沙必利以苯甲酰胺衍生物为主要成分,是一种新型全胃肠道促动力药。而番泻叶为刺激性泻药,主要成分为番泻苷,可以通过肠粘膜和神经丛刺激肠蠕动。
50%以上的患者表示对临床上使用的泻剂的使用满意度不高,且越来越多的研究证明长期服用刺激性泻剂如西沙比利和番泻叶等,会导致不可逆性的神经损伤。此外,便秘是是一种异质性、多症状、多因素的疾病,导致便秘的因素包括物理因素、化学因素、情绪因素以及环境因素等等,产后、术后以及老年卧床都有伴随便秘并发症的可能性,因此相应加强预防和干预措施能够对及时治疗便秘,降低痔疮发生率,提高临床病人预后效果,降低相关并发症的发生,最终提高患者的生活质量。
益生菌和益生元对肠道菌群以及肠道组织的保护作用近两年越来越成为研究热点。益生元和益生菌这一类功能辅助食品将肠道功能与肠道菌群巧妙地联系起来,在以往的便秘治疗中,人们往往更注重肠道动力、肠道吸收排水能力以及肠道平滑肌动力等直接因素,而对肠道菌群的关注则较少,刺激性泻剂如西沙必利和番泻苷的短期强效性也让人更加不重视肠道菌群多样性的重要性。但是长期依赖泻剂已经被证实对机体产生不可逆的神经损伤,并且在治疗便秘的效果上也是不可持续的,长期摄入还会伴随诸如肠黑变病等副作用。为了提高便秘治疗的可持续性,微生态制剂在调节肠道菌群和肠道功能方面的作用越来越受到关注。
酵母β-葡聚糖是天然的益生元,广泛的分布于真菌、细菌和植物细胞壁,如美洲姬松茸、香菇、灵芝、燕麦等当中。不仅在各种生物体内发挥多种生物学活性,而且在各种生物间的相互影响中也起着十分重要的作用,是发挥保健作用的主要功效成分。目前研究发现其具有抗肿瘤、抗辐射、降血脂、降胆固醇、调节血糖和预防心血管疾病、修复细胞、改善肠道功能等作用,作为高效的生物反应调节因子(brm),是近年来的研究热点。β-葡聚糖是一种结构复杂的葡萄糖多聚复合物,普遍存在于细菌、酵母、蘑菇、谷类和海藻等的细胞壁中。体内和体外试验已经表明,不同来源的β-1,3/1,6-葡聚糖可增强宿主先天性免疫和获得性免疫功能,增强抗病原细菌、病毒和寄生虫感染的能力,是极具生物活性的免疫增强剂。面包酵母葡聚糖是最早被发现的多聚糖化合物,也是目前研究过的活性最高的多糖化合物。
技术实现要素:
本发明涉及一种酵母葡聚糖提取物及其组合物与在制备用于预防便秘的药品、食品以及保健品中的应用,在酵母β-葡聚糖的提取过程中,往往存在有机溶剂使用量大,目标产物提取率较低、提取时间较长、提取效率不高等问题,严重制约了酵母β-葡聚糖资源的开发利用。因此,研究开发环保、高效、低成本、技术成熟的新工艺十分必要。益生元和益生菌这一类功能辅助食品将肠道功能与肠道菌群巧妙地联系起来,在以往的便秘治疗中,人们往往更注重肠道动力、肠道吸收排水能力以及肠道平滑肌动力等直接因素,而对肠道菌群的关注则较少,但是长期依赖泻剂已经被证实可能对机体产生不可逆的神经损伤,并且在治疗便秘的效果上也是不可持续的,长期摄入还会伴随诸如肠黑变病等毒副作用。为了提高便秘治疗的可持续性,微生态制剂在调节肠道菌群和肠道功能方面的作用越来越受到关注。酵母β-葡聚糖由于缺乏蛋白质而不具有免疫原性,不会引起非特异性免疫,从而满足人们追求绿色、纯天然的诉求,此外,酵母β-葡聚糖的免疫调节作用是特异性的,通过特异性表面受体介导免疫细胞的免疫增强活性,通过增强自身免疫力、肠道屏障保护作用来达到预防慢传输型便秘的效果。
本发明采用的技术方案:
本发明提供一种酵母β-葡聚糖提取物,所述提取物按如下方法制备:(1)将酵母粉经过机械化学球磨成28-38nm的酵母粉末;(2)将酵母粉末浸渍于提取剂水溶液中,在30-60℃浸提完全后,过滤,取滤饼;所述提取剂水溶液中的提取剂为氯化钠、氢氧化钠、碳酸氢钠、亚硫酸氢钠或硫酸氢钠中的一种,优选氢氧化钠;(3)将步骤(2)滤饼中加入蛋白酶,30~60℃(优选55℃)酶解完全后,加热灭酶,离心(1000rpm离心10min),取上清液,干燥(-5℃,98kpa冷冻真空干燥),获得所述酵母β-葡聚糖提取物。
进一步,步骤(1)中酵母粉为市售安琪高活性面包酵母粉,产品标准号gb/t20886;所述研磨在滚筒球磨机或高能行星球磨机中进行,加入粒径为10mm的中号粒径球磨珠30颗,球磨转速为20-500rpm(优选20-100rpm);球磨时间为10-60min(优选30-40min),最优选在100rpm条件下球磨30min。
进一步,步骤(2)提取剂水溶液浓度为0.2-0.5g/ml,优选提取剂为氢氧化钠;所述提取剂水溶液体积用量以酵母粉末重量计为3-10ml/g(优选7-10ml/g);所述浸提时间为30-60min,优选浸提2次,第一次浸提结束后过滤,滤饼加入与第一次提取所用提取剂水溶液等体积的相同提取剂水溶液在相同条件下提取相同时间,过滤,取滤饼。更优选提取在微波辅助下进行,微波功率为300-600w。
进一步,步骤(3)蛋白酶质量添加量以滤饼质量计为0.2-1.0%,蛋白酶选自纤维素酶、木瓜蛋白酶、果胶酶中的一种或者多种,优选为木瓜蛋白酶,酶活为10000u/g;酶解时间为60min,酶解过程通过加入提取剂水溶液维持ph值为5.5-7.0(优选7.0)。
本发明所述酵母β-葡萄糖提取物中蛋白质质量含量为5-7%,酵母β-葡聚糖质量含量达到70-91%。
本发明还提供一种所述酵母β-葡萄糖提取物组合物,所述组合物由酵母β-葡聚糖提取物与活性益生菌以重量比1:1~10(优选为1:1~3)混合而成;所述益生菌为青春双歧杆菌、长双歧杆菌、嗜酸乳酸杆菌、拉曼乳酸杆菌、干酪乳酸杆菌、鼠李糖乳杆菌、动物双歧杆菌、嗜热双歧杆菌、明串珠菌中的一种或多种任意比例的混合,优选为长双歧杆菌bncc185354,组合物中所含初始活菌高于5.00×109cfu/g。
本发明还提供一种所述酵母β-葡聚糖提取物在制备预防便秘制剂中的应用,所述制剂为预防便秘的药品、食品或保健品,所述制剂是由酵母β-葡聚糖提取物与活性益生菌以重量比1:1~10(优选为1:1~3)混合而成的酵母β-葡萄糖提取物组合物。
进一步,所述制剂为增加血清il-18、nrf-2或ho-1表达的药物、食品或保健品,能够提高免疫力、抗氧化能力,增加粪便短链脂肪酸种类和含量,增加肠道菌群多样性。
与现有技术相比,本发明有益效果主要体现在:
本发明采用机械化学辅助以及酶诱导相结合的方法从酵母细胞中分离得到酵母β-葡聚糖提取物,所得产品产率最高为18.8%,其中的有效成分β-葡聚糖的含量最高达90.13%。
利用洛哌丁胺造成小鼠便秘模型,利用便秘小鼠模型评价酵母β-葡聚糖提取物以及益生菌的配合组方在体内预防便秘的效果,最终发现酵母β-葡聚糖提取物与益生菌配伍对洛哌丁胺导致的便秘具有良好的预防作用,同时对恢复肠道微生态平衡起到较好作用,该方具有起效剂量低、给药次数少及易于提取制备等优点,为预防便秘和改善肠道菌群失衡提供了新的选择。
本发明将酵母粉与球磨助剂混合后用滚筒式球磨机进行磨粉,采用碱提法进行提取以及蛋白酶纯化,所得提取液通过冷冻干燥得到酵母β-葡聚糖提取物冻干粉。以盐酸洛派丁胺作为造模药物,以balb/c小鼠为实验动物进行便秘模型的制备。在此模型基础上,灌胃给予酵母β-葡聚糖提取物以及双歧杆菌益生菌对便秘进行预防性给药治疗,测定胃肠道蠕动以及排便情况,探讨酵母β-葡聚糖提取物组合益生菌对洛哌丁胺诱导的便秘模型小鼠的预防作用。同时利用shs/gc/ms对小鼠粪便短链脂肪酸(scfa)进行分析,以及利用16srna高通量测序分析小鼠肠道菌群。结果表明,酵母β-葡聚糖提取物联合益生菌能促进胃肠道蠕动,调节血清il-18、nrf-2和ho-1等的表达,表明酵母β-葡聚糖提取物能有效预防洛哌丁胺引起的慢传输型便秘症状,其中包括抵御洛哌丁胺干预诱导的肠道动力抑制以及肠动力减弱,达到预防便秘的效果,并且该组合具有提高小鼠自身免疫以及抗氧化能力的效果,同时由增加的粪便短链脂肪酸种类和含量以及肠道菌群多样性可以表明酵母β-葡聚糖提取物可以通过维持肠道菌群微生态平衡这一潜在的机制,达到比化学药物更优的预防便秘的效果。
本发明研究显示酵母β-葡聚糖提取物结合益生菌组成的组合物具有有效预防便秘以及调节肠道菌群的作用,且具有给药剂量低,给药次数少及易于提取制备等优点,预示着酵母β-葡聚糖提取物与益生菌结合可以作为一种预防便秘的新型功能性食品、保健品或药物应用于临床上。
附图说明
图1是实施例5酵母β-葡聚糖提取物干预后便秘小鼠肠道菌群与空白组和模型组对比venn图,byc:实施例5酵母β-葡聚糖提取物给药组;lop:模型组;no:空白组;注:不同的颜色代表不同的分组(或样本),重叠部分表示多个分组(或样本)中共有的物种,没有重叠的部分表示该分组(或样本)所特有的物种,数字表示对应的物种数目;
图2是实施例6酵母β-葡聚糖提取物干预后便秘小鼠肠道菌群与空白组和模型组对比venn图,
byc:实施例6酵母β-葡聚糖提取物给药组;lop:模型组;no:空白组;注:不同的颜色代表不同的分组(或样本),重叠部分表示多个分组(或样本)中共有的物种,没有重叠的部分表示该分组(或样本)所特有的物种,数字表示对应的物种数目;
图3是实施例7酵母β-葡聚糖提取物干预后便秘小鼠肠道菌群与空白组和模型组对比venn图;,byc:实施例7酵母葡聚糖提取物给药组;lop:模型组;no:空白组;注:不同的颜色代表不同的分组(或样本),重叠部分表示多个分组(或样本)中共有的物种,没有重叠的部分表示该分组(或样本)所特有的物种,数字表示对应的物种数目;
图4是实施例8酵母β-葡聚糖提取物干预后便秘小鼠肠道菌群与空白组和模型组对比venn图;byc:实施例8酵母葡聚糖提取物给药组;lop:模型组;no:空白组;注:不同的颜色代表不同的分组(或样本),重叠部分表示多个分组(或样本)中共有的物种,没有重叠的部分表示该分组(或样本)所特有的物种,数字表示对应的物种数目;
图5是酵母β-葡聚糖提取物干预后便秘小鼠血清ho-1表达水平图(a:实施例5;b:实施例6;c:实施例7;d:实施例8);
图6是酵母β-葡聚糖干预后便秘小鼠血清nrf-2表达水平图(a:实施例5;b:实施例6;c:实施例7;d:实施例8);
图7是酵母β-葡聚糖干预后便秘小鼠血清il-18表达水平图(a:实施例5;b:实施例6;c:实施例7;d:实施例8);
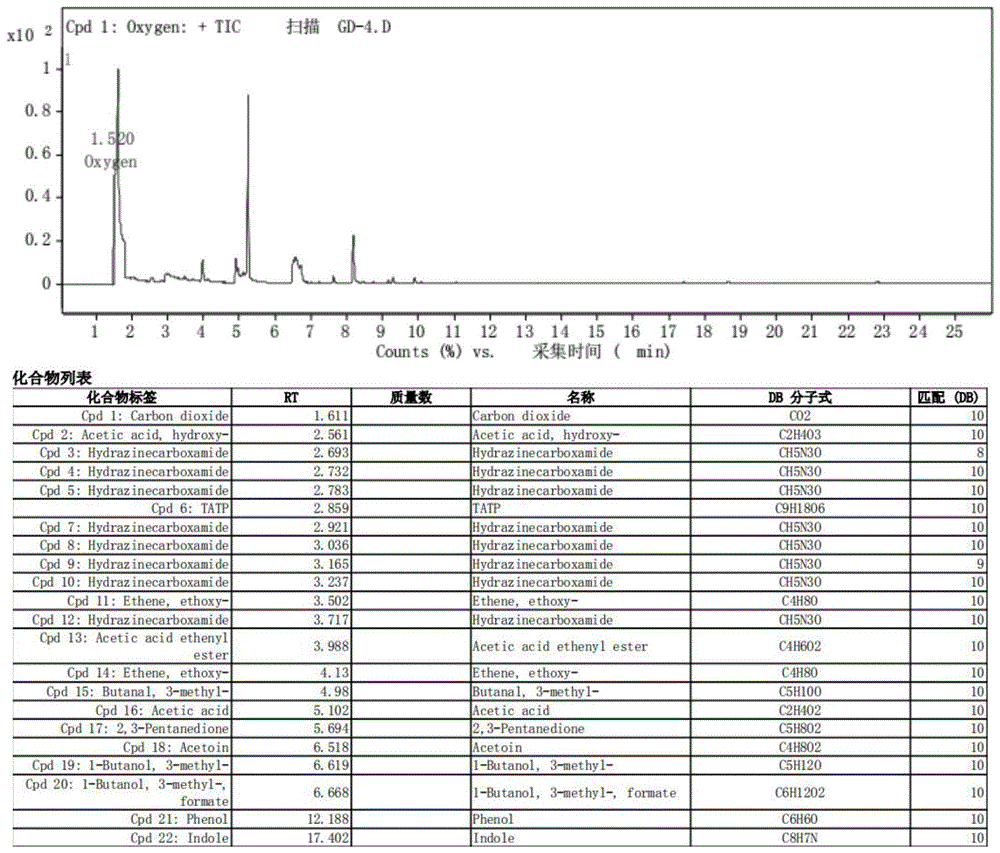
图8是实施例5酵母β-葡聚糖提取物干预后便秘小鼠粪便短链脂肪酸的总化合物信息;
图9是实施例6酵母β-葡聚糖提取物干预后便秘小鼠粪便短链脂肪酸的总化合物信息;
图10是实施例7酵母β-葡聚糖提取物干预后便秘小鼠粪便短链脂肪酸的总化合物信息;
图11是实施例8酵母β-葡聚糖提取物干预后便秘小鼠粪便短链脂肪酸的总化合物信息;
具体实施方式
下面结合具体实施例对本发明方案进行进一步描述,但本发明的保护范围并不仅限于此。
以下实施案例中酵母β-葡聚糖中蛋白质、灰分和水分的测定方法为:
蛋白质的测定:采用凯氏定氮法,参照gb/t5009.5-2003《食品中蛋白质的测定》;
灰分的测定:采用灼烧称质量法,参照gb/t5009.4-2003《食品中灰分的的测定》;
水分的测定:采用直接干燥法,参照gb/t5009.3-2003《食品中水分的测定》。
以下实施案例中酵母β-葡聚糖中多糖的含量测定方法为:
称取样品10mg,先用5ml8mol/l的h2so4水解5min后,加水使h2so4浓度稀释至1.5mol/l,于100℃下水解3h,冷却至室温后,定容至250ml,获得样品水解液。取1.0ml样品水解液,按苯酚硫酸法测定葡萄糖浓度。
苯酚硫酸法标准曲线制作:分析天平称取0.5000g分析纯葡萄糖溶于10ml蒸馏水中,得50mg/ml的标准葡萄糖溶液,用蒸馏水将标准葡萄糖溶液分别稀释成0、0.05、0.1、0.15、0.2、0.25、0.5mg/ml标准溶液。首先分别取各浓度标准溶液100μl于试管内,然后加入200μl50mg/ml苯酚水溶液,混匀后立即在各个管中加入1ml浓硫酸(质量浓度98%),震荡均匀,室温(25-30℃)静置30min,在490nm下测定吸光度,以吸光值(y)为纵坐标,以葡萄糖浓度(x)为横坐标,最终得到回归方程y=9.9286x+0.01(r2=0.9991),线性良好。
葡聚糖的含量按照以下公式计算:
式中:x——β-d-葡聚糖含量,%;
c——为样品水解液中葡萄糖浓度,g/ml;
v——为样品水解液定容体积,ml;
m——为被测样品的质量,g;
f——为葡萄糖换算成β-葡聚糖的系数,0.9。
一、酵母葡萄糖提取物的制备
实施例1、酵母β-葡聚糖提取物的制备
步骤1)球磨成粉:将10g市售安琪高活性面包酵母粉(产品标准号gb/t20886),置于滚筒式球磨机中,加入30颗、粒径10mm的中号球磨珠,在转速100rpm下混合研磨30min,获得球磨后的酵母粉10g,粒径为28-38nm;
步骤2)碱提:取步骤1)球磨后的酵母粉10g,加入0.2g/ml的naoh水溶液30ml,在40℃、300w微波辅助下浸提40min,过滤,滤饼再加入0.2g/ml的naoh水溶液30ml在40℃、300w微波辅助下浸提40min,过滤,合并两次过滤的滤渣,干燥后得到酸不溶性碱不溶性的酵母β-葡聚糖粗提物1.85g;
步骤3)纯化:向步骤2)1.85g酵母β-葡聚糖粗提物中加入18.50mg(10000u/g)木瓜蛋白酶,加酶量为1.0%,在55℃下酶解60min,酶解过程用1mol/l的naoh水溶液维持ph恒定为7.0,得到酶解液;
步骤4)干燥:将步骤3)全部酶解液放入沸水浴中,加热灭酶30min,将灭酶后的酶解液用离心机离心,转速1000rpm,离心10min,弃去上清液,得到沉淀为纯化的酵母β-葡聚糖;将沉淀用过量无水乙醇、无水乙醚洗涤脱水,-5℃真空冷冻干燥后得到精制酵母β-葡聚糖提取物1.842g,质量提取率为18.42%,蛋白质质量含量为6.23%,多糖质量含量达到79.20%。
实施例2、酵母β-葡聚糖提取物的制备
步骤1)球磨成粉:将10g市售安琪高活性面包酵母粉(产品标准号gb/t20886),置于滚筒式球磨机中,加入30颗、粒径10mm的中号球磨珠,在转速100rpm下混合研磨30min,获得球磨后的酵母粉10g,粒径为28-38nm;
步骤2)碱提:取步骤1)球磨后的酵母粉10g,加入0.3g/ml的naoh水溶液30ml,在40℃、400w微波辅助下浸提40min,过滤,滤饼再加入0.3g/ml的naoh水溶液30ml在40℃、400w微波辅助下浸提40min,过滤,合并两次过得到的不溶性滤渣,即为酵母β-葡聚糖粗提物1.89g;
步骤3)纯化:向步骤2)1.89g酵母β-葡聚糖粗提物中加入(10000u/g)木瓜蛋白酶18.90mg,酶质量加入量为1%,在55℃下酶解60min,酶解过程用1mol/l的冰乙酸水溶液维持ph恒定为7.0,得到酶解液;
步骤4)干燥:将步骤3)全部酶解液放入沸水浴中,加热灭酶30min,将灭酶后的酶解液用离心机离心,转速1000rpm,离心10min,得到沉淀为纯化的酵母β-葡聚糖,将沉淀用过量无水乙醇、无水乙醚洗涤脱水,-5℃真空冷冻干燥后得到精制酵母β-葡聚糖提取物1.785g,质量提取率为17.85%,蛋白质质量含量为6.08%,多糖质量含量达到74.28%。
实施例3、酵母β-葡聚糖提取物的制备
步骤1)球磨成粉:将10g市售安琪高活性面包酵母粉(产品标准号gb/t20886),置于滚筒式球磨机中,加入30颗、粒径10mm的中号球磨珠,在转速300rpm下混合研磨30min,获得球磨后的酵母粉10g,粒径为28-38nm;
步骤2)碱提:取步骤1)球磨后的酵母粉10g,加入0.4g/ml的naoh水溶液40ml,在40℃、500w微波辅助下浸提40min,过滤,滤饼再加入0.4g/ml的naoh水溶液40ml,在40℃、500w微波辅助下浸提40min,过滤,弃去滤液,滤渣干燥后即为酵母β-葡聚糖粗提物1.88g;
步骤3)纯化:向步骤2)1.79g酵母β-葡聚糖粗提物中加入18.80mg(10000u/g)木瓜蛋白酶,加酶量为1.0%,在55℃下酶解60min,酶解过程用1mol/l的冰乙酸溶液维持ph恒定为7.0,得到酶解液;
步骤4)干燥:将步骤3)全部酶解液放入沸水浴中,加热灭酶30min,将灭酶后的酶解液用离心机离心,转速1000rpm,离心10min,弃去上清液,得到沉淀为纯化的酵母β-葡聚糖;将沉淀用过量无水乙醇、无水乙醚洗涤脱水,-5℃真空冷冻干燥后得到精制酵母β-葡聚糖提取物1.776g,质量提取率为17.76%,蛋白质质量含量为5.65%,多糖质量含量达到81.74%。
实施例4、酵母β-葡聚糖提取物的制备
步骤1)球磨成粉:将10g市售安琪高活性面包酵母粉(产品标准号gb/t20886),置于滚筒式球磨机中,加入30颗、粒径10mm的中号球磨珠,在转速100rpm下混合研磨30min,获得球磨后的酵母粉10g,粒径为28-38nm;
步骤2)碱提:取步骤1)球磨后的酵母粉10g,加入0.5g/ml的naoh水溶液40ml,在40℃、600w微波辅助下浸提40min,过滤,滤饼再加入0.5g/ml的naoh水溶液40ml在40℃、600w微波辅助下浸提40min,过滤,取滤饼,得到酵母β-葡聚糖粗提物1.96g;
步骤3)纯化:向步骤2)1.1.96g酵母β-葡聚糖粗提物中加入19.60mg(10000u/g)木瓜蛋白酶,加酶量为1.0%,在55℃下酶解60min,酶解过程用1mol/l的冰乙酸溶液维持ph恒定为7.0,得到酶解液;
步骤4)干燥:将步骤3)全部酶解液放入沸水浴中,加热灭酶30min,将灭酶后的酶解液用离心机离心,转速1000rpm,离心10min,得到沉淀为纯化的酵母β-葡聚糖;将沉淀用过量无水乙醇、无水乙醚洗涤脱水,-5℃真空冷冻干燥后得到精制酵母β-葡聚糖提取物1.880g,质量提取率为18.80%,蛋白质质量含量为5.27%,多糖质量含量达到90.13%。
二、酵母葡聚糖提取物制剂的通便作用及调节肠道菌群作用考察试验
以下实施案例中试剂:
(1)盐酸洛哌丁胺悬液:取盐酸洛哌丁胺100mg,研磨成粉,加无菌蒸馏水,定容至100ml,得到浓度1mg/ml的盐酸洛哌丁胺悬液。
(2)生理盐水溶液:取西沙必利20mg,研磨成粉,加无菌蒸馏水,定容至100ml,得到浓度0.2mg/ml的西沙必利悬液。
(3)酵母β-葡聚糖提取物悬液:分别取实施例1-4制备好的酵母β-葡聚糖提取物100mg,研磨成粉,加无菌蒸馏水,定容至100ml,得到浓度1mg/ml的酵母β-葡聚糖提取物悬液。
(4)墨汁:取10g阿拉伯胶,加水煮沸,后加入活性炭粉5g,煮沸三次,放置室温后定容到100ml,4℃保存,用前摇匀。
(5)酶联免疫(elisa)试剂盒购自南京建成生物工程研究所,包含标准品(il-18、nrf-2或ho-1)、生物素抗原、亲和素hrp、显色剂a和b、反应终止、elisa样本稀释液:pbs(ph7.4)。
以下实施案例中动物肠道参数测定方法为:
1、便秘小鼠肠道墨汁推进率的测定:给盐酸洛派丁胺悬液0.5小时后,给药组给予含酵母β-葡聚糖提取物和益生菌的墨汁,空白组和模型组给墨汁灌胃。25分钟后立即脱颈椎处死动物,打开腹腔分离肠系膜,剪取上端自幽门、下端至回盲部的肠管,置于托盘上,轻轻将小肠拉成直线,测量肠管长度为“小肠总长度”,从幽门至墨汁前沿为“墨汁推进长度”,按下式计算墨汁推进率:
2、小鼠排便状况的评估:各组小鼠灌胃给药后,立即转移至垫有滤纸的代谢笼中,禁食不禁水,观察并记录5小时内每只小鼠排出首粒黑便时间,排便颗粒数,粪便重量;观察结束后,测定粪便干重(80℃烘干24h后的重量)。
粪便含水量按照以下公式计算:
(其中m1、m2分别为粪便湿重和粪便干重)。
3、酶联免疫法测定便秘小鼠血清中胃肠道免疫因子il-18:
组织标本:获得各组小鼠远端结肠0.1g,加入1mlpbs(ph7.4)用匀浆器将标本充分匀浆,3000rpm离心20分钟,收集上清液待测。
酶联免疫法(elisa)具体步骤:使用前试剂盒在室温下平衡半小时。首先设置标准品孔、空白孔和样本孔,空白孔不加样,用于调零,只加显色剂a、b和终止液。标准品孔每孔加入不同浓度的il-18标准品50μl,然后加入生物素抗原50μl;样品孔加入10μl样本,再加入40μl样本稀释液,然后加入生物素抗原50μl。轻轻摇晃,盖板封膜,37℃温育60min。弃去各孔中液体,拍干,加满洗涤液室温静置1min,拍干,洗涤拍干重复5次。每孔加入显色剂a、b各50μl,37℃避光孵育15min,加入反应终止液50μl,终止反应。15min内在450nm下测定各孔od值,根据浓度(x)和od值(y)得到四参数logistic曲线拟合方程:y=(5.440-0.005)/[1+(x/287.793)^(-1.092)]+0.005(r2=0.9999),并计算样本中il-18含量。
酶联免疫法测定便秘小鼠血清中胃肠道氧化因子nrf-2,具体方法同上。得到nrf-2四参数logistic曲线拟合方程:y=(0.527-0.106)/[1+(x/340.231)^(-3.283)]+0.106(r2=0.9974)。
酶联免疫法测定便秘小鼠血清中胃肠道氧化因子ho-1,具体方法同上。得到ho-1四参数logistic曲线拟合方程:y=(0.802-0.087)/[1+(x/28.041)^(-1.802)]+0.087(r2=0.9963)。
4、应用顶空气质联用(shs-gc-ms)分析粪便短链脂肪酸:
粪便样品处理:准确称取100mg粪便样品,加入0.9ml0.01mol/lpbs缓冲液,充分溶解,加入1ml6%体积分数的磷酸水溶液混匀后,再加入1ml乙醚,震荡10min,3000rpm离心5min,取乙醚层,加入无水氯化钙除去水分后取1ml样品用7697a-7890b-5977b气相色谱-质谱联用仪(美国aglient公司)分析粪便短链脂肪酸。
色谱条件:db-624ui毛细管柱(30mx0.25mm,1.40μm,中极性柱);进样口温度:250℃;载气为he气;程序升温条件:初始温度50℃,保持1min,以10℃/min的速率升温至200℃,保持10min;柱流量:1ml/min;顶空进样,顶空瓶平衡温度为100℃,平衡时间为25min,定量环温度110℃,传输线温度120℃,分流比10:1。
质谱条件:连接处温度280℃,电子能量为70ev,离子源温度230℃,扫描方式:全扫描;溶剂延迟0;谱库nist17。
标准曲线绘制:分别精密称取50.2mg乙酸、25.8mg丙酸、47.2mg丁酸,加2ml乙醚,用体积浓度6%磷酸水溶液定容至10ml,制成每1ml含有乙酸5.02mg、丙酸2.58mg和丁酸4.72mg的储备液。取1000μl储备液加入50μl内标溶液(10mg/mldl-2-甲基丁酸)混匀后,取0.5、1、2、4、6、8ml用体积浓度6%磷酸水溶液定容至10ml混匀后取1ml进样分析。以标准品和内标物浓度的比为横坐标,对应峰面积比为纵坐标,绘制各个标准品的标准曲线,结果见表1。
表1shs-gc方法学验证
实验数据处理:各组实验数据均用均数±标准差(mean±sd)表示,单因素方差分析;p<0.05表示两组差异有统计学意义。
5、动物肠道菌群测定方法为:
便秘小鼠肠道菌群高通量测定:取粪便进行16srrna基因扩增及miseq高通量测序。以样品总dna为模板,使用细菌的16srrna基因引物338f(5’-actcctacgggaggcagcag-3)和806r(5-ggactachvgggtwtctaat-3’)扩增其中的16srdna的v3-v5高变区基因。(tangr,weiy,liy,etal.gutmicrobialprofileisalteredinprimarybiliarycholangitisandpartiallyrestoredafterudcatherapy[j].gut,2017:gutjnl-2016-313332.)
可操作分类单元otu分析:扩增序列按照差异为0.03划分otu,统计每个otu的序列数目,序列比例大于10%的otu将用于后续分析。统计只有一条序列的otu,按照c=(1-(n1/n))*100来计算。其中,将其与ncbi的genbank数据库进行blast比对,将结果中具有确定分类信息的序列下载后用clustalx进行比对,neighbour-joining方法构建系统发育树,bootstrap值为1000。(linz,yew,zux,etal.integrativemetabolicandmicrobialprofilingonpatientswithspleen-yang-deficiencysyndrome[j].scientificreports,2018,8(1):6619.)
实验数据处理:miseq测序得到的是双端序列数据,首先根据pereads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,即为优化数据。(zhul,liaor,wun,etal.heatstressmediateschangesinfecalmicrobiomeandfunctionalpathwaysoflayinghens[j].appliedmicrobiologyandbiotechnology,2019,103(1):461-472.)
数据去杂方法和参数:
1)过滤reads尾部质量值20以下的碱基,设置50bp的窗口,如果窗口内的平均质量低于20,从窗口开始截去后端碱基,过滤质控后50bp以下的reads,去除含n碱基的reads;
2)根据reads之间的overlap关系,将成对reads拼接成一条序列,最小overlap长度为10bp;
3)拼接序列的overlap区允许的最大错配比率为0.2,筛选出不符合的序列;
4)根据序列首尾两端的barcode和引物调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
使用软件:flash、trimmomatic
物种组成分析:venn图坐标轴用于统计各组样本中所有物种otu数目,venn图可以比较直观的表现各组样本的物种组成相似性及重叠情况。分析时选用相似水平为97%的otu,各组实验数据均用均数±标准差(mean±sd)表示,单因素方差分析。p<0.05表示两组差异有统计学意义。软件:采用r语言工具统计和作图。
通过单样本的多样性(alpha多样性)分析反映微生物群落的丰富度和多样性,包括一系列统计学分析指数估计环境群落的物种丰度和多样性。多样性检验方法采用studentttest(t检验),采用t分布理论来推论差异发生的概率。chao是用chao1算法估算样本中所含otu数目的指数,在生态学中常用来估计物种总数,由chao(1984)最早提出,本次分析使用计算公式如下:
其中schao1=估计的otu数;sobs=实际观测到的otu数;n1=只含有一条序列的otu数目(如"singletons");n2=只含有两条序列的otu数目(如"doubletons")。
ace:用来估计群落中otu数目的指数,由chao提出,是生态学中估计物种总数的常用指数之一,本次分析使用计算公式如下:
其中,
ni=含有i条序列的otu数目;srare=含有“abund”条序列或者少于“abund”的otu数目;sabund=多于“abund”条序列的otu数目;abund=otu的阈值,默认为10。
simpson:用来估算样本中微生物多样性指数之一,由edwardhughsimpson(1949)提出,在生态学中常用来定量描述一个区域的生物多样性。本次分析使用计算公式如下:
其中,sobs=实际观测到的otu数目;ni=第i个otu所含的序列数;n=所有的序列数。
shannon:用来估算样本中微生物多样性指数之一。常用于反应alpha多样性指数。本次分析使用计算公式如下:
其中,sobs=实际观测到的otu数目;ni=第i个otu所含的序列数;n=所有的序列数。
实施例5
取balb/c小鼠30只,总共3组(给药组(byc)、模型组(lop)和空白组(no)),每组10只,雄性,体重18~22g。给药组每天早上9:00灌胃实施例1制备的酵母β-葡聚糖提取物悬液(10mg/kg体重)和长双歧杆菌bncc185354(100mg/kg体重,含有活菌5.03×109cfu/g),连续灌胃4周,模型组和空白组灌胃等体积生理盐水,其他操作均相同。四周后,给药组和模型组每天早上9:00灌胃盐酸洛派丁胺悬液(10mg/kg),连续5天,空白组不造模,用生理盐水做相同处理。记录各组小鼠的日常行为情况。
取粪便样品用于16srrna高通量测序,并通过venn图和alpha多样性进行物种组成分析。实验结果见图1和表2,结果表明肠道菌群多样性及组成结构明显改变,洛哌丁胺造成小鼠肠道菌群otu数量显著性减少(由576otu减少至449otu),而给药组小鼠肠道菌群的otu数量471,说明酵母β-葡聚糖提取物结合益生菌可以抵抗便秘导致的肠道菌群失衡(p<0.05)并且促进胃肠道菌群的调节。alpha多样性结果表明,与空白组相比,给药组小鼠肠道菌群otu数量增加,shannon指数和simpson指数显著升高(p<0.05),提示酵母β-葡聚糖提取物结合益生菌可以恢复便秘小鼠肠道微生物多样性。
肠道动力实验结果见表1,结果表明空白组与模型组比较,洛派丁胺可以显著抑制小鼠的胃肠道蠕动力,并延长排便时间(253.21±0.54分钟),抑制排便(数量、重量)(p<0.05),给药组均可明显预防洛派丁胺所致的便秘状况,显著提高便秘小鼠的胃肠道蠕动力,并缩短排便时间(218.21±5.43分钟),增加排便(p<0.05)。此外相较于空白组,模型组中与免疫能力相关的il-18明显下降(图7,p<0.05)。酵母β-葡聚糖提取物及益生菌预防给药后,对肠道免疫及抗氧化能力相关基因il-18、oh-1、nrf-2的表达量具有明显恢复作用(图5、图6、图7,p<0.05),且给药组il-18的含量未见明显下降。
预防给药后粪便短链脂肪酸种类和含量的变化见图8,结果显示,模型组中粪便短链脂肪酸种类和含量明显减少,几乎没有吸收峰,给药组小鼠结肠内容物中乙酸、丙酸和丁酸含量较模型组显著性增加(p<0.05),表明洛哌丁胺干预可以极大的减少结肠中scfas的产生,而葡聚糖预防给药可以使小鼠结肠内容物中乙酸、丙酸和丁酸水平有升高的趋势,提示葡聚糖干预会影响洛哌丁胺引起的便秘小鼠肠道微环境,此结果与已有研究中多糖对便秘疾病小鼠粪便丙酸含量的影响趋势相一致。
实施例6
将实施例5给药组中提取物悬液改为实施例2方法制备的酵母β-葡聚糖悬液(20mg/kg体重),长双歧杆菌bncc185354(100mg/kg体重,含有活菌4.55×109cfu/g),其他分组及操作同实施例5,记录各组小鼠的日常行为情况。
取粪便样品用于16srrna高通量测序,并通过venn图和alpha多样性进行物种组成分析。实验结果见图2和表2,洛哌丁胺造成小鼠肠道菌群otu数量显著性减少(由552otu减少至430otu),而给药组小鼠肠道菌群的otu数量增加至471,说明酵母β-葡聚糖提取物结合益生菌可以抵抗便秘导致的肠道菌群失衡(p<0.05)并且促进胃肠道菌群的调节。alpha多样性结果表明,与空白组相比,给药组小鼠肠道菌群otu数量增加,shannon指数和simpson指数显著升高(p<0.05),提示酵母β-葡聚糖提取物结合益生菌可以恢复便秘小鼠肠道微生物多样性。
肠道动力实验结果见表1,结果分析表明空白组与模型组比较,洛派丁胺可以显著抑制小鼠的胃肠道蠕动力,并延长排便时间,抑制排便(数量、重量)(p<0.05),酵母β-葡聚糖提取物结合益生菌均可以明显预防洛派丁胺所致的便秘状况,显著提高便秘小鼠的胃肠道蠕动力,并缩短排便时间(211.23±1.35分钟),增加粪便含水量(66.35±15.53%)和粪便重量(1.243±0.42g)(p<0.01),此外,模型组中与免疫能力相关的il-18明显下降(图7,p<0.05)相较于空白组。酵母β-葡聚糖提取物及益生菌预防给药后,粪便scfa中乙酸和丙酸含量显著增加(11.13±1.34mg/g,15.06±4.44mg/g,p<0.05)以及肠道免疫及抗氧化能力相关基因il-18、oh-1、nrf-2的表达量具有明显的恢复作用(图5、6、7,p<0.05),且给药组il-18的含量未见明显下降。
酵母β-葡聚糖提取物及益生菌预防给药后粪便短链脂肪酸种类和含量见图9,结果显示,模型组中粪便短链脂肪酸种类和含量明显减少,几乎没有吸收峰,给药组小鼠结肠内容物中乙酸、丙酸和丁酸含量较模型组显著性增加(p<0.05),表明洛哌丁胺干预可以极大的减少结肠中scfas的产生,而酵母β-葡聚糖提取物+益生菌预防给药可以使小鼠结肠内容物中乙酸、丙酸和丁酸水平有升高的趋势,提示酵母β-葡聚糖提取物干预会影响洛哌丁胺引起的便秘小鼠肠道微环境,此结果与已有研究中多糖对便秘疾病小鼠粪便丙酸含量的影响趋势相一致。
实施例7
将实施例5给药组中酵母β-葡聚糖提取物悬液改为实施例3方法制备的酵母β-葡聚糖提取物(25mg/kg体重),长双歧杆菌bncc185354(100mg/kg体重,含有活菌3.63×109cfu/g),其他分组及操作同实施例5,记录各组小鼠的日常行为情况。
取粪便样品用于16srrna高通量测序,并通过venn图和alpha多样性进行物种组成分析。实验结果见图3和表2,洛哌丁胺造成小鼠肠道菌群otu数量显著性减少(由483otu减少至443otu),而给药组小鼠肠道菌群的otu数量增加至471,说明酵母β-葡聚糖提取物结合益生菌可以抵抗便秘导致的肠道菌群失衡(p<0.05)并且促进胃肠道菌群的调节。alpha多样性结果表明,与空白组相比,给药组小鼠肠道菌群otu数量增加,shannon指数和simpson指数显著升高(p<0.05),提示酵母β-葡聚糖提取物结合益生菌可以恢复便秘小鼠肠道微生物多样性。
肠道动力实验结果见表1,结果分析表明空白组与模型组比较,洛派丁胺可以显著抑制小鼠的胃肠道蠕动,并延长排便时间,抑制排便(数量、重量)(p<0.05),酵母β-葡聚糖提取物结合益生菌均可以明显预防洛派丁胺所致的便秘状况,显著提高便秘小鼠的胃肠道蠕动力,并增加粪便颗粒数(50.34±11.53,p<0.01),增加排便重量(1.153±0.32g,p<0.05),此外相较于空白组,模型组中与免疫能力相关的il-18明显下降(图7,p<0.05),酵母β-葡聚糖提取物及益生菌预防给药后,对粪便scfa中乙酸和丙酸含量显著增加(11.90±4.10,18.46±6.40,p<0.05),肠道免疫及抗氧化能力相关基因il-18、oh-1、nrf-2的表达量具有明显增加,且给药组il-18的含量未见明显下降(图5、6、7,p<0.05)。
酵母β-葡聚糖提取物及益生菌预防给药后粪便短链脂肪酸种类和含量见图10,结果显示,模型组中粪便短链脂肪酸种类和含量明显减少,几乎没有吸收峰,给药组小鼠结肠内容物中乙酸、丙酸和丁酸含量较模型组显著性增加(p<0.05),表明洛哌丁胺干预可以极大的减少结肠中scfas的产生,而葡聚糖预防给药可以使小鼠结肠内容物中乙酸、丙酸和丁酸水平有升高的趋势,提示葡聚糖干预会影响洛哌丁胺引起的便秘小鼠肠道微环境,此结果与已有研究中多糖对便秘疾病小鼠粪便丙酸含量的影响趋势相一致。
实施例8
将实施例5给药组中提取物改为实施例4方法制备的酵母β-葡聚糖提取物悬液,用量为25mg/kg体重,长双歧杆菌bncc185354(100mg/kg体重,含有活菌4.54×109cfu/g),其他分组及操作同实施例5,记录各组小鼠的日常行为情况。
取粪便样品用于16srrna高通量测序,并通过venn图和alpha多样性进行物种组成分析。实验结果见图4和表2,洛哌丁胺造成小鼠肠道菌群otu数量显著性减少(由483otu减少至443otu),而给药组小鼠肠道菌群的otu数量增加至468,说明酵母β-葡聚糖提取物结合益生菌可以抵抗便秘导致的肠道菌群失衡(p<0.05)并且促进胃肠道菌群的调节。alpha多样性结果表明,与空白组相比,给药组小鼠肠道菌群otu数量增加,shannon指数和simpson指数显著升高(p<0.05),提示酵母β-葡聚糖提取物结合益生菌可以恢复便秘小鼠肠道微生物多样性。
肠道动力实验结果见表1,结果分析表明空白组与模型组比较,洛派丁胺可以显著抑制小鼠的胃肠道蠕动,延长排便时间,抑制排便(数量、重量)(p<0.05),酵母β-葡聚糖提取物结合益生菌均可以明显预防洛派丁胺所致的便秘状况,显著提高便秘小鼠的胃肠道蠕动力,并缩短排便时间,增加粪便重量(1.274±0.51g,p<0.05)增加粪便含水量和肠道转运率(70.43±14.32%,59.34±13.53%,p<0.05),此外,相较于空白组,模型组中与免疫能力相关的il-18明显下降(图7,p<0.05),酵母β-葡聚糖提取物及益生菌预防给药后,对粪便scfa总量显著增加(43.67±13.98mg/g),其中主要的几种锻炼脂肪酸包括乙酸、丙酸和丁酸含量均显著增加(11.75±3.98,11.75±3.98,9.18±4.07,43.67±13.98,p<0.01)以及肠道免疫及抗氧化能力相关基因il-18、oh-1、nrf-2的表达量显著增加(p<0.05),且给药组il-18的含量未见明显下降(图5、6、7,p<0.05)。
酵母β-葡聚糖提取物及益生菌预防给药后粪便短链脂肪酸见图11,结果显示,模型组中粪便短链脂肪酸种类和含量明显减少,几乎没有吸收峰,给药组小鼠结肠内容物中乙酸、丙酸和丁酸含量较模型组显著性增加(p<0.05),表明洛哌丁胺干预可以极大的减少结肠中scfas的产生,而酵母β-葡聚糖提取物预防给药可以使小鼠结肠内容物中乙酸、丙酸和丁酸水平有升高的趋势,提示酵母β-葡聚糖提取物干预会影响洛哌丁胺引起的便秘小鼠肠道微环境,此结果与已有研究中多糖对便秘疾病小鼠粪便丙酸含量的影响趋势相一致。
表1酵母β-葡聚糖提取物与益生菌对便秘小鼠粪便参数的影响
注:a:实施例5;b:实施例6;c:实施例7;d:实施例8
*p<0.05表示与模型组相比有显著性差异;**p<0.01表示与模型组相比有极显著差异,
#p<0.05表示与空白组有差异,,##p<0.01表示与空白组相比有极显著差异。
表2酵母β-葡聚糖提取物干预对便秘小鼠肠道菌群β-多样性的影响
注:a:实施例5;b:实施例6;c:实施例7;d:实施例8
*p<0.05表示与模型组相比有显著性差异;**p<0.01表示与模型组相比有极显著差异,#p<0.05表示与空白组有差异,,##p<0.01表示与空白组相比有极显著差异。
表3酵母β-葡聚糖提取物干预对便秘小鼠粪便短链脂肪酸的影响
注:a:实施例5;b:实施例6;c:实施例7;d:实施例8
*p<0.05表示与模型组相比有显著性差异;**p<0.01表示与模型组相比有极显著差异,#p<0.05表示与空白组有差异,,##p<0.01表示与空白组相比有极显著差异。
- 还没有人留言评论。精彩留言会获得点赞!