一种二苯基脲类抗肿瘤小分子抑制剂及其制备方法与流程
本发明属于医药技术领域,特别是化学药物合成及药理活性领域,具体涉及一种二苯基脲类靶向uba3的抗肿瘤小分子抑制剂及其制备方法。
背景技术:
neddylation类泛素化修饰在调节cullinringe3连接酶(crl)的活性中起着关键作用。crl是泛素连接酶中最大的亚家族,调控细胞内~20%经蛋白酶体降解的蛋白质的泛素化修饰,因而参与众多的生理和病理过程,包括肿瘤的发生发展。蛋白质泛素化修饰由泛素激活酶(e1)、泛素偶联酶(e2)和泛素连接酶(e3)参与的级联反应催化,将泛素标记到目标蛋白质进而被蛋白酶体识别并降解。在这个过程中,泛素连接酶在底物特异性结合中发挥关键作用。同样地,neddylation修饰经过nedd8激活酶(nae/e1)、nedd8偶联酶(e2)和nedd8连接酶(e3)参与的级联反应,将类泛素分子nedd8共价结合到crl的骨架蛋白cullin上,进而激活crl泛素连接酶。负责蛋白neddylation修饰的激活酶(nae/e1)只有一种,它是由调节亚基appbp1(nae1)和催化亚基uba3组成的异二聚体,其中uba3是关键的酶活性中心。neddylation通路在多种肿瘤中过度激活,直接抑制它们的活性具有重大的抗肿瘤治疗前景。
近年来,靶向neddylation通路中关键酶的小分子抑制剂筛选已成为研发新型抗肿瘤药物的一个重要领域。其中,soucyta等人研发的靶向nae/e1的mln4924(又称pevonedistat)已进入ⅰ期和ⅱ期临床试验,包括治疗非小细胞肺癌在内的多种实体肿瘤及血液系统肿瘤,表现出了良好的抗肿瘤效果。本发明中靶向uba3的小分子抑制剂与mln4924的结构及作用机制截然不同,具有良好的抗肿瘤应用前景。
技术实现要素:
本发明的目的是提供一种二苯基脲类抗肿瘤小分子抑制剂及其制备方法。
本发明采用如下技术方案:一种二苯基脲类抗肿瘤小分子抑制剂,具有通式ⅰ的结构,或具有通式ⅰ的结构的盐或溶剂合物:
其中:
r1选自氢、卤原子、c1-6烷基、卤代的c1-6烷基、c1-6烷氧基、c2-6烯基、无取代的或者取代的五元或六元芳环或芳杂环、酰胺、氰基;
r2选自c1-6烷氧基、无取代或取代的芳基氧基、无取代或取代的杂芳基氧基、c1-12胺基、c1-12环状胺基、无取代或取代的芳胺基、酰胺基;
r3选自氢、卤原子、c1-6烷基、卤代的c1-6烷基、c1-6烷氧基、c2-6烯基、无取代的或者取代的五元或六元芳环或芳杂环、酰胺、硝基、氰基。
上述通式i的化合物合成如下:苯甲酸a和b在dppa(叠氮磷酸二苯酯)作用下,直接合成二苯基脲类抗肿瘤小分子抑制剂。
作为本领域的公知常识,具有通式ⅰ的结构的盐或溶剂合物可以通过酸碱成盐或溶剂溶解加热/冷却析出方法获得。
进一步地,所述小分子抑制剂具有通式ⅱ的结构,或具有通式ⅱ的结构的盐或溶剂合物:
其中:x=o,n;环a选自取代的或者无取代的五元或六元芳杂环;
r1选自氢、卤原子、c1-6烷基、卤代的c1-6烷基、c1-6烷氧基、c2-6烯基、无取代的或者取代的五元或六元芳环或芳杂环、酰胺、氰基;
r4选自氢、c1-6烷基、卤代的c1-6烷基、c1-6烷氧基、c2-6烯基、无取代的或者取代的五元或六元芳环或芳杂环、氰基;
r5选自氢、卤原子、c1-6烷基、氰基、酰胺基、亚甲二氧基。
进一步地,所述小分子抑制剂具有通式ⅲ的结构,或具有通式ⅲ的结构的盐或溶剂合物:
其中:环a选自五元或者六元杂环,环上包含氢原子,甲基,甲酰基,哌啶基取代基。
进一步地,所述的小分子抑制剂为:1-(3-((2,4-二氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3-((4-氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3-((2-氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3,5-二氟苯基)-3-(3-((对-甲苯基氧基)甲基)苯基)脲、1-(3-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲、4-((3-(3-(3,5-二氟苯基)脲基)苄基)氧基)-n-甲基苯甲酰胺、1-(3-((苯并[d][1,3]二氧杂环戊烯-5-基氧基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3,5-二氟苯基)-3-(3-(((6-甲基吡啶-3-基)氧基)甲基)苯基)脲、1-(3,5-二氟苯基)-3-(3-((嘧啶-2-基氧基)甲基)苯基)脲、1-(3-(1-(4-氰基苯氧基)乙基)苯基)-3-(3,5-二氟苯基)脲、n-(3-((4-氰基苯氧基)甲基)-5-(3-(3,5-二氟苯基)脲基)苯基)乙酰胺、1-(3-(((4-氯苯基)氨基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3-(((4-氰基苯基)氨基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3,5-二氟苯基)-3-(3-(吡咯烷-1-基甲基)苯基)脲、1-(3,5-二氟苯基)-3-(3-((2-氧代吡咯烷-1-基)甲基)苯基)脲、1-(3,5-二氟苯基)-3-(3-(哌啶-1-基甲基)苯基)脲、1-(3-([1,4'-联哌啶]-1'-基甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3,5-二氟苯基)-3-(3-(吗啉代甲基)苯基)脲、1-(3,5-二氟苯基)-3-(3-((4-甲基哌嗪-1-基)甲基)苯基)脲、1-(3-((4-乙酰哌嗪-1-基)甲基)苯基)-3-(3,5-二氟苯基)脲、1-(3,5-二氟苯基)-3-(3-(哌嗪-1-基甲基)苯基)脲、1-(2-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲或1-(4-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲。
一种二苯基脲类抗肿瘤小分子抑制剂的制备方法,该方法为:3-甲基苯甲酸1在浓硫酸催化下酯化生成化合物2,化合物2经aibn催化nbs溴代生成化合物3,化合物3与化合物4反应得到化合物5,化合物5在lioh作用下水解得到相应的酸6,化合物6与3,5-二氟苯胺、dppa经过curtius重排反应得到二苯基脲类抗肿瘤小分子抑制剂8。具体如下:
其在,r6,r7各自独立的选自氢、卤原子、c1-6烷基、氰基、酰胺基、亚甲二氧基。
一种二苯基脲类抗肿瘤小分子抑制剂的制备方法,该方法为:3-羧基苯甲醛9硼氢化钠作用下还原生成化合物10,10与tbscl反应得的产物在naoh作用下脱去羧基的tbs得到11,化合物11与3,5-二氟苯胺7与dppa经过curtius重排反应,并在6mhcl作用下脱去醇羟基的tbs保护基得到化合物12,化合物12经过三溴化磷溴代得到13,13在氢氧化钾存在下与化合物14反应得到所述的二苯基脲类抗肿瘤小分子抑制剂15,具体如下:
环a选自五元或者六元杂环,环上包含氢原子,甲基,甲酰基,哌啶基取代基。
本发明的有益效果在于:本发明的小分子抑制剂特异性靶向uba3,且具有良好的抗肿瘤活性,在多种人源非小细胞肺癌细胞中的半抑制浓度(ic50)低至5μm左右,可以作为良好的抗肿瘤治疗的小分子抑制剂。该小分子抑制剂作用靶点明确,与mln4924有不同的抑制nae酶活性的作用机制,可有效抑制泛素化修饰关键酶crl连接酶的骨架结构cullin的neddylation修饰,从而抑制crl连接酶的活化,达到抑制肿瘤生长的效果。
附图说明
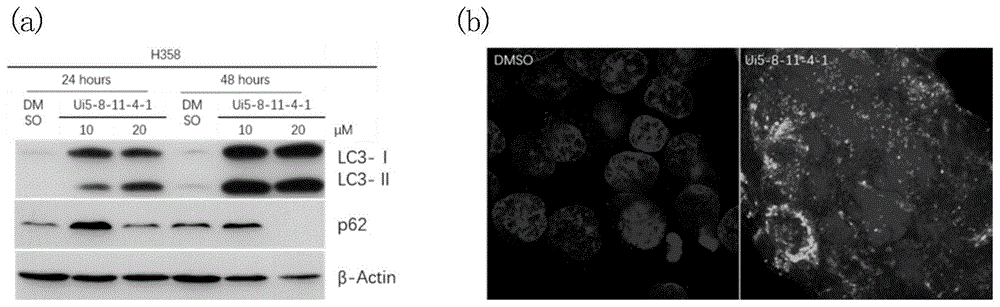
图1a小分子抑制剂诱导肺癌细胞自噬a肺癌细胞h358应用10μm或20μm的小分子抑制剂处理24小时或48小时后,westernblot检测自噬相关蛋白lc3和p62的变化;1b肺癌细胞h358应用20μm的小分子抑制剂处理24小时后,应用特异性的lc3抗体,荧光二抗和dapi染色,于nikona1共聚焦显微镜观察荧光强度;
图2ui5-8-11-4系列小分子试剂剂量依赖性抑制cullin蛋白的neddylation修饰肺癌细胞系h2170和h358经ui5-8-11-4系列小分子试剂处理24小时后,应用特异的cullin抗体检测多个cullin蛋白的neddylation修饰水平;
图3ui5-8-11-4系列小分子试剂能特异性增强蛋白质uba3的稳定性人肺癌细胞h2170和h358细胞经ui5-8-11-4系列小分子试剂处理24小时后,于57℃加热3分钟,然后加入含有蛋白酶抑制剂的pbs,液氮反复冻融3次提取细胞总蛋白,应用westernblot法检测neddylation通路相关酶的含量变化。β-actin作为上样量的参照。se:短曝光;le:长曝光。
具体实施方式
本发明结合实施例作进一步的说明。以下的实施例是说明本发明,而不是以任何方式限制本发明。
制备实施例1,包括如下步骤:
(1)制备3-甲基苯甲酸甲酯(2)
在单口圆底烧瓶中,加入3-甲基苯甲酸(5g,36.8mmol),再加入甲醇作溶剂,加几滴浓硫酸做催化剂,搅拌回流过夜。tlc监测反应结束后,旋掉溶剂,加入饱和nahco3溶液至中性,乙酸乙酯萃取三次,合并有机层,饱和氯化钠溶液洗一次,无水硫酸钠干燥,浓缩后得到淡黄色液体,收率95%。
(2)制备3-(溴甲基)苯甲酸甲酯(3)
在二口圆底烧瓶中,加入nbs(6.2g,34.9mmol)和aibn(0.3g,1.7mmol),氩气保护,将上步产物2(5.2g,34.9mmol)溶于四氯化碳中加入烧瓶,回流反应过夜。经tlc监测反应结束,旋干溶剂,水洗,乙酸乙酯萃取三次,无水硫酸钠干燥,浓缩,得到淡黄色固体3,收率85%。
(3)制备3-((2,4-二氯苯氧基)甲基)苯甲酸甲酯(5)
在二口圆底烧瓶中,将上步产物3(0.25g,1.9mmol)、3,5-二氯苯酚(0.38g,2.3mmol)、k2co3(0.4g,2.9mmol)、ki(0.48g,2.9mmol)加入其中,氩气保护,丙酮作溶剂,回流过夜,tlc监测反应结束后,旋干溶剂,饱和碳酸氢钠溶液洗一次,乙酸乙酯萃取三次,有机层无水硫酸钠干燥,浓缩后经层析柱得到油状物5,收率85%。
(4)制备3-((2,4-二氯苯氧基)甲基)苯甲酸(6)
在单口圆底烧瓶中,加入上步产物6(0.52g,1.7mmol),四氢呋喃作溶剂,加入2mlioh溶液(3.3ml,6.6mmol),常温反应,tlc监测反应结束后,1mhcl调ph至酸性,乙酸乙酯萃取三次,无水硫酸钠干燥,旋干,得淡白色固体6,收率95%。
(5)制备1-(3-((2,4-二氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8a)
在二口圆底烧瓶中分别加入上步产物6(0.47g,1.6mmol),3,5-二氟苯胺(0.2g,1.6mmol),氩气保护,甲苯作溶剂,再加入叠氮磷酸二苯酯(英文简称dppa,0.52g,1.9mmol),三乙胺(0.48g,4.7mmol),在100℃下回流搅拌过夜。经tlc监测反应进度,反应完全后,加水,乙酸乙酯萃取三次,用饱和氯化钠溶液洗涤一次后,无水硫酸钠干燥,旋干溶剂,柱层析得白色固体8a,收率70%。
m.p.202.5-211.6℃;1hnmr(600mhz,acetone)δ8.54(s,1h),8.35(s,1h),7.71(s,1h),7.56(d,j=8.0hz,1h),7.50(d,j=2.4hz,1h),7.40–7.32(m,2h),7.29–7.23(m,3h),7.20(d,j=7.5hz,1h),6.66–6.61(m,1h),5.26(s,2h).13cnmr(151mhz,acetone)δ163.30(d,j=243.11hz),163.20(d,j=243.11hz),153.27(s),152.08(s),142.74(t,j=13.9hz),139.71(s),137.34(s),129.52(s),129.02(s),127.87(s),125.32(s),123.41(s),121.53(s),118.50(s),117.67(s),115.32(s),101.15(d,j=22.65hz),101.10(d,j=22.65hz),96.68(t,j=26.2hz),70.66(s).;hrms(esi)(m/z):calcdforc20h14cl2f2n2o2(m+h+):423.0400;found:423.0400.
制备实施例21-(3-((2-氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8b)
制备方法同制备实施例1,由2-氯苯酚与3反应,最终化合物乙醇重结晶白色固体8b,收率70%。
m.p.172.9-177.0℃;1hnmr(600mhz,acetone)δ8.50(s,1h),8.32(s,1h),7.65(m,1h),7.53(dd,j=8.1,1.2hz,1h),7.41(dd,j=7.9,1.6hz,1h),7.33(m,1h),7.29–7.25(m,1h),7.23(m,2h),7.18(m,2h),6.95(m,1h),6.60(m,1h),5.20(s,2h);13cnmr(151mhz,acetone)δ164.90(d,j=243.1hz),164.80(d,j=243.1hz),155.78(s),153.68(s),144.35(t,j=14.0hz),141.26(s),139.38(s),131.69(s),130.60(s),129.68(s),123.96(s),123.21(s),123.10(s),119.96(s),119.18(s),115.75(s),102.73(d,j=24.2hz),102.68(d,j=24.2hz),98.29(t,j=26.2hz),71.76(s).hrms(esi)(m/z):calcdforc20h15clf2n2o2(m+h+):388.0790;found:388.0761.
制备实施例31-(3-((4-氯苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8c)
制备方法同制备实施例1,由4-氯苯酚与3反应最终化合物乙醇重结晶白色固体8c,收率80%。
m.p.187.1-192.6℃;1hnmr(600mhz,acetone)δ8.53(s,1h),8.32(s,1h),7.65(m,1h),7.48(dd,j=8.1,1.2hz,1h),7.33–7.27(m,3h),7.26–7.20(m,2h),7.12(d,j=7.8hz,1h),7.05–7.00(m,2h),6.60(m,1h),5.10(s,2h);13cnmr(151mhz,acetone)δ164.89(d,j=243.1hz),164.78(d,j=243.1hz),159.27(s),153.70(s),144.34(t,j=14.1hz),141.25(s),139.50(s),130.85(s),130.56(s),126.67(s),123.29(s),119.91(s),119.39(s),118.02(s),102.72(d,j=24.2hz),102.68(d,j=24.2hz),98.29(t,j=26.2hz),71.38(s).hrms(esi)(m/z):calcdforc20h15clf2n2o2(m+h+):389.0761;found:388.0790.
制备实施例41-(3,5-二氟苯基)-3-(3-((对-甲苯基氧基)甲基)苯基)脲(8d)
制备方法同制备实施例1,由4-甲基苯酚与3反应,最终化合物乙醇重结晶白色固体8d,收率75%。
m.p.159.8-163.2℃;1hnmr(600mhz,acetone)δ8.53(s,1h),8.31(s,1h),7.62(m,1h),7.49(dd,j=8.1,1.3hz,1h),7.30(m,1h),7.26–7.20(m,2h),7.11(m,1h),7.08(m,2h),6.91–6.86(m,2h),6.60(m,,1h),5.05(s,2h),2.23(s,3h).13cnmr(151mhz,acetone)δ164.80(dd,j=241.6hz),164.70(dd,j=241.6hz),158.39(s),153.70(s),144.36(t,j=13.9hz),141.18(s),140.16(s),131.41(s),131.28(s),130.48(s),123.19(s),119.72(s),119.30(s),116.21(s),102.71(dd,j=24.2hz),102.66(dd,j=24.2hz),98.26(t,j=26.2hz),70.99(s),21.20(s).hrms(esi)(m/z):calcdforc21h18f2n2o2(m+h+):369.1370;found:369.1370.
制备实施例51-(3-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8e)
制备方法同制备实施例1,由4-氰基苯酚与3反应,最终化合物乙醇重结晶白色固体8e,收率70%。
m.p.193.2-196.5℃;1hnmr(600mhz,acetone)δ8.54(s,1h),8.34(s,1h),7.71(m,3h),7.47(dd,j=8.1,1.3hz,1h),7.32(m,1h),7.25–7.21(m,2h),7.21–7.16(m,2h),7.14(m,1h),6.60(m,1h),5.21(s,2h).13cnmr(151mhz,acetone)δ164.89(d,j=243.1hz),164.79(d,j=243.1hz),163.76(s),153.70(s),144.30(t,j=13.9hz),141.33(s),138.85(s),135.62(s),130.66(s),123.43(s),120.32(s),120.12(s),119.52(s),117.42(s),105.56(s),102.73(d,j=24.2hz),102.69(d,j=24.2hz),98.32(t,j=26.2hz),71.53(s).hrms(esi)(m/z):calcdforc21h15f2n3o2(m+h+):380.1166;found:380.1166.
制备实施例64-((3-(3-(3,5-二氟苯基)脲基)苄基)氧基)-n-甲基苯甲酰胺(8f)
制备方法同制备实施例1,由4-乙酰胺及苯酚与3反应,最终化合物乙醇重结晶白色固体8f,收率72%。
m.p.218.9-221.3℃;1hnmr(600mhz,dmso)δ9.05(s,1h),8.90(s,1h),8.26(m,1h),7.81–7.73(m,2h),7.53(m,1h),7.38–7.33(m,1h),7.27(m,1h),7.15(m,2h),7.04(m,1h),7.02(m,2h),6.75(m,1h),5.10(s,2h),2.71(d,j=4.5hz,3h).13cnmr(151mhz,dmso)δ167.06(s),163.65(d,j=243.1hz),163.54(d,j=243.1hz),161.42(s),153.19(s),143.40(t,j=13.9hz),140.37(s),138.46(s),129.98(s),129.82(s),127.96(s),122.57(s),119.02(s),118.54(s),115.27(s),101.95(d,j=24.2hz),101.91(d,j=24.2hz),97.78(t,j=26.2hz),70.27(s),27.18(s).hrms(esi)(m/z):calcdforc22h19f2n3o3(m+h+):412.1394;found:412.1428.
制备实施例71-(3-((苯并[d][1,3]二氧杂环戊烯-5-基氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8g)
制备方法同制备实施例1,由芝麻酚与3反应,最终化合物乙醇重结晶棕色固体8g,收率75%。
m.p.187.5-193.1℃;1hnmr(600mhz,acetone)δ8.56(s,1h),8.35(s,1h),7.67(m,1h),7.53(dd,j=8.1,1.1hz,1h),7.35(m,1h),7.31–7.25(m,2h),7.15(m,1h),6.78(m,1h),6.69–6.59(m,2h),6.49(dd,j=8.5,2.5hz,1h),5.97(s,2h),5.07(s,2h).13cnmr(151mhz,acetone)δ164.90(d,j=243.1hz),164.80(d,j=243.1hz),155.92(s),153.69(s),149.97(s),144.36(t,j=14.0hz),143.37(s),141.19(s),140.00(s),130.50(s),123.25(s),119.78(d,j=16.4hz),119.36(d,j=16.6hz),109.46(s),107.70(s),102.73(d,j=24.2hz),102.67(d,j=24.2hz),99.63(s),98.28(t,j=26.2hz),71.86(s).hrms(esi)(m/z):calcdforc21h16f2n2o4(m+h+):399.1112;found:399.1112.
制备实施例81-(3,5-二氟苯基)-3-(3-(((6-甲基吡啶-3-基)氧基)甲基)苯基)脲(8h)
制备方法同制备实施例1,由3-羟基-6-甲基吡啶与3反应,最终化合物乙醇重结晶白色固体8h,收率70%。
m.p.174.1-177.5℃;1hnmr(600mhz,acetone)δ8.57(s,1h),8.37(s,1h),8.26(d,j=3.0hz,1h),7.70(s,1h),7.53(dd,j=8.1,1.4hz,1h),7.39–7.32(m,2h),7.31–7.25(m,2h),7.17(d,j=8.4hz,2h),6.65(m,1h),5.19(s,2h),2.43(s,3h).13cnmr(151mhz,acetone)δ164.89(d,j=243.1hz),164.79(d,j=243.1hz),154.56(s),153.70(s),151.86(s),144.34(t,j=14.0hz),141.27(s),139.50(s),138.74(s),130.59(s),124.66(s),123.47(s),123.32(s),119.94(s),119.41(s),102.73(d,j=24.2hz),102.68(d,j=24.2hz),98.30(t,j=26.3hz),71.40(s),24.11(s).;hrms(esi)(m/z):calcdforc20h17f2n3o2(m+h+):370.1322;found:370.1322.
制备实施例91-(3,5-二氟苯基)-3-(3-((嘧啶-2-基氧基)甲基)苯基)脲(8i)
制备方法同制备实施例1,由2-羟基嘧啶盐酸盐与3反应,最终化合物乙醇重结晶白色固体8i,收率65%。
m.p.251.9-260.7℃;1hnmr(600mhz,dmso)δ10.34(s,1h),9.73(s,1h),8.61(dd,j=3.9,2.9hz,1h),8.40(dd,j=6.4,2.7hz,1h),7.47(m,1h),7.40(m,1h),7.29(m,1h),7.19(m,2h),6.93(m,1h),6.80(m,1h),6.53(m,1h),5.08(s,2h).13cnmr(151mhz,dmso)δ167.42(s),164.70(d,j=243.1hz),162.60(d,j=243.1hz),156.64(s),153.45(s),150.96(s),143.64(t,j=14.3hz),140.66(s),138.10(s),130.17(s),122.38(s),118.52(s),118.34(s),105.16(s),101.42(d,j=24.2hz),101.37(d,j=6.3hz),97.54(t,j=27.6hz),54.14(s).hrms(esi)(m/z):calcdforc18h14f2n4o2(m+h+):357.1085;found:357.1118.
制备实施例101-(3-(1-(4-氰基苯氧基)乙基)苯基)-3-(3,5-二氟苯基)脲(8j)
制备方法同制备实施例1,以2-羧基苯乙酮为原料,总产物通过乙醇重结晶得白色固体8j,收率81%。
m.p.169.5-173.2℃;1hnmr(600mhz,dmso-d6)δ9.07(s,1h),8.91(s,1h),7.75-7.70(m,2h),7.62-7.52(m,1h),7.39-7.34(m,1h),7.31(t,j=7.8hz,1h),7.27–7.17(m,2h),7.13-7.06(m,3h),6.85–6.77(m,1h),5.71–5.58(m,1h),1.61(d,j=6.3hz,3h).13cnmr(151mhz,dmso-d6)δ163.60(d,j=243.1hz),163.49(d,j=243.1hz),161.89,153.09,143.77,144.32(t,j=13.6hz),140.47,135.02,130.13,120.57,119.98,118.81,117.54,116.35,103.73,101.93(d,j=24.2hz),101.89(d,j=24.2hz),97.72(t,j=25.7hz),76.29,24.90.hrms(esi)(m/z):calcdforc22h17f2n3o2(m+h+):394.1289.0790;found:394.1322.
制备实施例111-(3-(((4-氯苯基)氨基)甲基)苯基)-3-(3,5-二氟苯基)脲(8k)
制备方法同制备实施例1,以4-氯苯胺为原料与化合物3反应,产物柱层析得淡黄色固体8k,收率40%。
m.p.186.5-190.3℃;1hnmr(600mhz,acetone-d6)δ8.53(s,1h),8.29(s,1h),7.54(m,1h),7.48(m,1h),7.30–7.23(m,3h),7.12–7.05(m,3h),6.70–6.66(m,2h),6.63(m,1h),5.74(t,j=6.3hz,1h),4.36(d,j=5.9hz,2h).13cnmr(151mhz,acetone-d6)δ164.92(d,j=243.1hz),164.82(d,j=243.1hz),153.74,149.32,144.42(t,j=13.6hz),142.40,141.21,130.48,130.25,123.08,121.90,119.12,119.06,115.42,102.71(d,j=24.2hz),102.67(d,j=24.2hz),98.23(t,j=25.7hz),48.83.hrms(esi)(m/z):calcdforc20h16clf2n3o(m+h+):388.0950;found:388.0920.
制备实施例121-(3-(((4-氰基苯基)氨基)甲基)苯基)-3-(3,5-二氟苯基)脲(8l)
制备方法同制备实施例1,以4-氰基苯胺为原料与化合物3反应,产物柱层析得白色色固体8l,收率40%。
m.p.198.8-200.8℃;1hnmr(600mhz,acetone-d6)δ8.50(s,1h),8.28(s,1h),7.57(m,1h),7.46(m,3h),7.30(m,1h),7.28–7.24(m,2h),7.09(m,1h),6.79(m,2h),6.63(m,1h),6.54(t,j=5.4hz,1h),4.46(d,j=5.9hz,2h).13cnmr(151mhz,acetone-d6)δ164.94(d,j=243.1hz),164.84(d,j=243.1hz),153.77,153.73,144.39(t,j=13.9hz),141.54,141.34,134.93,130.63,123.09,121.58,119.30,119.13,114.07,102.76(d,j=22.7hz),102.71(d,j=22.7hz),99.44,98.30(t,j=26.2hz),48.13.hrms(esi)(m/z):calcdforc21h16f2n4o(m+h+):379.1292;found:279.1326.
制备实施例13n-(3-((4-氰基苯氧基)甲基)-5-(3-(3,5-二氟苯基)脲基)苯基)乙酰胺(8m)
制备方法同制备实施例1,以3,5-二氨基苯甲酸为原料,终产物通过乙醇重结晶得白色固体8m,收率70%。
m.p.238.9-243.4℃;1hnmr(600mhz,dmso-d6)δ10.03(s,1h),9.01(s,1h),8.99(s,1h),7.82(m,2h),7.77(s,1h),7.33(m,2h),7.21(m,4h),6.86–6.78(m,1h),5.20(s,2h),2.07(s,3h).13cnmr(151mhz,dmso-d6)δ169.42,163.61(d,j=243.11hz),163.51(d,j=243.11hz),162.68,153.02,143.29(t,j=14.1hz),140.93,140.62,138.21,135.16,120.04,116.85,112.96,112.88,109.50,103.99,101.89(d,j=24.2hz),101.85(d,j=24.2hz),97.74(t,j=26.6hz),70.68,24.98.hrms(esi)(m/z):calcdforc23h18f2n4o3(m+h+):437.1347;found:437.1381.
制备实施例141-(2-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8n)
制备方法同制备实施例1,以2-甲基苯甲酸为原料,终产物通过乙醇重结晶的白色固体8n,收率80%。
m.p.221.1-222.9℃;1hnmr(600mhz,dmso-d6)δ9.49(s,1h),8.28(s,1h),7.85–7.81(m,2h),7.80(m,1h),7.50(m,1h),7.42–7.37(m,1h),7.27–7.23(m,2h),7.23–7.16(m,3h),6.82(m,1h),5.24(s,2h).13cnmr(151mhz,dmso-d6)δ163.63(d,j=243.1hz),163.52(d,j=243.1hz),162.69,153.57,143.40(t,j=13.6hz),137.81,135.15,130.64,129.87,128.26,124.87,124.36,120.08,116.99,104.11,101.95(d,j=22.7hz),101.91(d,j=22.7hz),97.75(t,j=25.7hz),67.94.hrms(esi)(m/z):calcdforc21h15f2n3o2(m+h+):380.1132;found:380.1166.
制备实施例151-(4-((4-氰基苯氧基)甲基)苯基)-3-(3,5-二氟苯基)脲(8o)
制备方法同制备实施例1,以4-甲基苯甲酸为原料,总产物乙醇重结晶得白色固体8o,收率81%。
m.p.241.6-243.8℃;1hnmr(600mhz,dmso-d6)δ9.15(s,1h),8.97(s,1h),7.80(d,j=8.7hz,2h),7.52(d,j=8.3hz,2h),7.42(d,j=8.3hz,2h),7.22(m,4h),6.82(t,j=9.2hz,1h),5.16(s,2h).13cnmr(151mhz,dmso-d6)δ163.64(d,j=243.1hz),163.54(d,j=243.1hz),162.81,153.17,143.38(t,j=15.1hz),140.15,135.15,130.75,129.89,120.13,119.46,116.86,103.87,101.95(d,j=24.2hz),101.91(d,j=24.2hz),97.75(t,j=27.2hz),70.50.hrms(esi)(m/z):calcdforc21h15f2n3o2(m+h+):380.1132;found:380.1166.
制备实施例16:包括如下步骤:
(1)制备3-(羟甲基)苯甲酸(10)
在单口圆底烧瓶中,加入3-羧基苯甲醛9(1.5g,10mmol),乙醇作溶剂,0℃下分批加入nabh4(0.57g,15mmol)。反应完毕后,加入饱和氯化铵溶液淬灭,浓缩后,1mhcl酸化,使用乙酸乙酯提取三次,合并有机相,使用饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,浓缩后得淡黄色液体10,收率95%。
(2)制备3-(((叔丁基二甲基甲硅烷基)氧基)甲基)苯甲酸(11)
在单口圆底烧瓶中,加入上一步产物10(1.44g,9.5mmol),无水dmf作溶剂,冷却至0℃,加入tbscl(1.72g,11.4mmol)和咪唑(0.77g,11.4mmol)常温反应1.5h。tlc确定反应完毕后,水稀释,乙酸乙酯萃取三次,合并有机相,使用饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,浓缩后,加入四氢呋喃作溶剂,加5%naoh溶液(57mmol),常温反应,反应结束后,1mhcl酸化,乙酸乙酯萃取三次,饱和氯化钠水溶液洗一次,无水硫酸钠干燥,浓缩后得淡黄色固体11,收率90%。
(3)制备1-(3,5-二氟苯基)-3-(3-(羟甲基)苯基)脲(12)
在二口圆底烧瓶中,加入上一步产物11(2.27g,8.5mmol),3,5-二氟苯胺7(1.10g,8.5mmol),氩气保护,无水甲苯作溶剂,加入叠氮磷酸二苯酯(2.2ml,10.2mmol)和三乙胺(3.6ml,25.6mmol),100℃过夜反应。tlc确定反应完毕后,水稀释,乙酸乙酯萃取三次,6mhcl洗两次,合并有机相,使用饱和氯化钠溶液洗涤两次,无水硫酸钠干燥,浓缩后,二氯甲烷:甲醇10:1柱层析得淡黄色固体12,收率70%。
(4)制备1-(3-(溴甲基)苯基)-3-(3,5-二氟苯基)脲(13)
在单口圆底烧瓶中,加入上一步产物13(1.66g,6.0mmol),四氢呋喃作溶剂,0℃下滴入三溴化磷(0.6ml,11.9mmol),常温反应。tlc确定反应完毕后,旋干溶剂,加水稀释,乙酸乙酯萃取三次,使用饱和氯化钠溶液洗涤一次,无水硫酸钠干燥,浓缩后,柱层析得白色固体13,收率95%。
(5)制备1-(3,5-二氟苯基)-3-(3-(吡咯烷-1-基甲基)苯基)脲(15a)
在单口圆底烧瓶中,化合物13(0.50g,1.5mmol),化合物14(0.13ml,1.6mmol),无水乙醇作溶剂,加入氢氧化钾(0.09g,1.6mmol),常温反应。tlc确定反应完毕后,旋干溶剂,加水稀释,乙酸乙酯萃取三次,使用饱和氯化钠溶液洗涤一次,无水硫酸钠干燥,浓缩后,柱层析得白色固体15a,收率90%。
m.p.168.1-172.5℃;1hnmr(600mhz,acetone)δ9.72(s,1h),9.33(s,1h),7.78(s,1h),7.54(m,1h),7.32(m,1h),7.26(m,3h),6.55(m,1h),4.44(s,2h),2.15–2.05(m,8h).13cnmr(151mhz,acetone)δ164.83(d,j=243.1hz),164.73(d,j=243.1hz),153.98(s),153.89(s),144.35(s),141.72(s),133.65(s),130.96(s),125.73(s),121.56(s),120.72(s),102.16(d,j=24.2hz),102.11(d,j=24.2hz),97.98(t,j=24.6hz),55.05(s),24.46(s).hrms(esi)(m/z):calcdforc18h19f2n3o(m+h+):332.1496;found:332.1530.
制备实施例171-(3,5-二氟苯基)-3-(3-((2-氧代吡咯烷-1-基)甲基)苯基)脲(15b)
制备方法同制备实施例16,二口瓶加入2-吡咯烷酮与nah,无水dmf作溶剂,反应10min后加入化合物13,常温反应,反应结束后终产物柱层析得白色固体15b,收率40%。
m.p.168.1-171.9℃;1hnmr(600mhz,acetone)δ8.74(s,1h),8.50(s,1h),7.49(dd,j=8.1,1.3hz,1h),7.38(m,1h),7.26–7.19(m,3h),6.90(m,1h),6.58(m,1h),4.39(s,2h),3.30(t,j=7.2hz,2h),2.33(t,j=7.8hz,2h),1.99(m,2h).13cnmr(151mhz,acetone)δ175.85(s),164.89(d,j=243.1hz),164.79(d,j=243.1hz),153.79(s),144.48(t,j=14.0hz),141.45(s),139.68(s),130.60(s),123.50(s),119.60(s),119.32(s),102.65(d,j=24.2hz),102.60(d,j=24.2hz),98.15(t,j=26.3hz),47.89(s),47.45(s),31.97(s),19.22(s).;hrms(esi)(m/z):calcdforc18h17f2n3o2(m+h+):346.1289;found:346.1322.
制备实施例181-(3,5-二氟苯基)-3-(3-(哌啶-1-基甲基)苯基)脲(15c)
制备方法同制备实施例16,以哌啶为原料与化合物13反应,终产物柱层析得白色固体15c,收率90%。
m.p.92.5-94.8℃;1hnmr(600mhz,acetone)δ7.52(s,1h),7.44(dd,j=8.1,1.2hz,1h),7.24(m,2h),7.20(m,1h),6.98(m,1h),6.60–6.50(m,1h),3.48(s,2h),2.44(s,4h),1.63–1.52(m,4h),1.42(s,2h).13cnmr(151mhz,acetone)δ164.81(d,j=243.1hz),164.71(d,j=243.1hz),153.76(s),144.23(t,j=13.9hz),140.80(s),130.11(s),124.92(s),120.86(s),119.14(s),102.48(d,j=24.2hz),102.44(d,j=24.2hz),98.08(t,j=26.2hz),64.58(s),55.66(s),27.05(s),25.48(s).;hrms(esi)(m/z):calcdforc19h21f2n3o(m+h+):346.1653;found:346.1686.
制备实施例191-(3-([1,4'-联哌啶]-1'-基甲基)苯基)-3-(3,5-二氟苯基)脲(15d)
制备方法同制备实施例16,以4-哌啶基哌啶为原料与化合物13反应,终产物石油醚:乙酸乙酯3:1重结晶得白色固体15d,收率80%。
m.p.204.3-208.1℃;1hnmr(600mhz,dmso)δ9.36(s,1h),9.05(s,1h),7.49(m,1h),7.34(m,1h),7.28(m,1h),7.23(m,2h),6.96(m,1h),6.83(m,1h),3.50(s,2h),3.17–2.90(m,6h),2.08–1.94(m,4h),1.67(m,9h).13cnmr(151mhz,dmso)δ163.67(d,j=243.1hz),163.57(d,j=243.1hz),153.24(s),143.48(t,j=14.0hz),140.18(s),129.68(s),124.00(s),119.79(s),118.29(s),101.77(d,j=24.2hz),101.73(d,j=24.2hz),97.74(t,j=26.1hz),63.61(s),62.50(s),52.37(s),50.12(s),26.83(s),24.07(s),22.74(s).hrms(esi)(m/z):calcdforc24h30f2n4o(m+h+):429.2388;found:429.2421.
制备实施例201-(3,5-二氟苯基)-3-(3-(吗啉代甲基)苯基)脲(15e)
制备方法同制备实施例16,以吗啉为原料与化合物13反应,柱层析得白色固体15e,收率82%。
m.p.156.5-159.3℃;1hnmr(600mhz,acetone)δ8.50(s,1h),8.25(s,1h),7.51(m,1h),7.44(dd,j=8.0,1.7hz,1h),7.23(m,3h),6.99(d,j=7.5hz,1h),6.61(m,1h),3.60(t,j=4.4hz,4h),3.45(s,2h),2.39(s,4h).13cnmr(151mhz,acetone)δ164.90(d,j=243.1hz),164.80(d,j=243.1hz),153.71(s),144.42(t,j=13.9hz),140.96(s),140.75(s),130.18(s),124.88(s),120.90(s),119.18(s),102.68(d,j=24.2hz),102.64(d,j=24.2hz),98.22(t,j=26.2hz),68.18(s),64.57(s),55.19(s).hrms(esi)(m/z):calcdforc18h19f2n3o2(m+h+):348.1445;found:348.1479.
制备实施例211-(3,5-二氟苯基)-3-(3-(哌嗪-1-基甲基)苯基)脲(15f)
制备方法同制备实施例16,以1-叔丁氧羰基哌嗪为原料与化合物13反应,后经三氟乙酸脱去叔丁氧羰基,柱层析得白色固体15f,收率75%。
m.p.171.5-174.3℃;1hnmr(600mhz,dmso)δ9.25(s,1h),9.02(s,1h),7.44(m,1h),7.36(m,1h),7.31–7.16(m,3h),6.95(m,1h),6.82(m,1h),3.43(s,21h),2.74(s,4h),2.33(s,4h).13cnmr(151mhz,dmso)δ163.68(d,j=243.1hz),163.57(d,j=243.1hz),153.26(s),143.54(t,j=14.5hz),140.13(s),139.94(s),129.57(s),123.92(s),119.81(s),118.11(s),101.88(d,j=24.2hz),101.85(d,j=24.2hz),97.69(t,j=25.9hz),63.85(s),54.64(s),46.34(s).hrms(esi)(m/z):calcdforc18h20f2n4o(m+h+):347.1605;found:347.1639.
制备实施例221-(3,5-二氟苯基)-3-(3-((4-甲基哌嗪-1-基)甲基)苯基)脲(15g)
制备方法同制备实施例16,以n-甲基哌嗪为原料与化合物13反应,柱层析得白色固体15g,收率75%。
m.p.179.1-182.5℃;1hnmr(600mhz,dmso)δ9.33(s,1h),9.06(s,1h),7.44(m,1h),7.37(m,1h),7.24(m,3h),6.94(m,1h),6.82(m,1h),3.44(s,2h),2.39(s,8h),2.19(s,3h).13cnmr(151mhz,dmso)δ163.69(d,j=243.1hz),162.58(d,j=243.1hz),153.28(s),143.56(t,j=13.7hz),140.19(s),140.03(s),129.61(s),123.85(s),119.73(s),118.13(s),101.86(d,j=24.2hz),101.81(d,j=24.2hz),97.67(t,j=26.1hz),63.16(s),55.66(s),53.47(s),46.65(s).hrms(esi)(m/z):calcdforc19h22f2n4o(m+h+):361.1762;found:361.1795.
制备实施例231-(3-(4-乙酰哌嗪-1-基)甲基)苯基)-3-(3,5-二氟苯基)脲(15h)
制备方法同制备实施例16,以n-乙酰基哌嗪为原料与化合物13反应,柱层析得白色固体15h,收率77%。
m.p.203.4-205.9℃;1hnmr(600mhz,dmso)δ9.05(s,1h),8.87(s,1h),7.43(m,1h),7.33(dd,j=8.0,1.7hz,1h),7.23(m,1h),7.19(m,2h),6.93(d,j=7.5hz,1h),6.79(m,1h),3.44(s,2h),3.43(m,4h),2.35(m,2h),2.29(m,2h),1.97(s,3h).13cnmr(151mhz,dmso)δ168.61(s),163.12(d,j=243.2hz),162.02(d,j=243.2hz),152.66(s),142.92(t,j=13.9hz),139.62(s),139.08(s),129.13(s),123.39(s),119.29(s),117.74(s),101.40(d,j=24.2hz),101.36(d,j=24.2hz),97.20(t,j=26.9hz),62.41(s),53.26(s),52.75(s),46.11(s),41.28(s),21.66(s).hrms(esi)(m/z):calcdforc20h22f2n4o2(m+h+):389.1711;found:389.1744.
制备实施例241-(3-(4-乙酰哌嗪-1-基)甲基)苯基)-3-(3,5-二氟苯基)脲(16)
在二口圆底烧瓶中加入8l(0.50g,1.3mmol),氩气保护,加入hcl/乙酸乙酯溶液10ml,至原料全部溶解完全,常温反应。1h后当反应有固体析出,充分反应完全后过滤,少量乙酸乙酯洗三次,收集固体,60℃烘干得到灰色固体16,收率85%。
m.p.178.3-180.1℃;1hnmr(500mhz,dmso)δ9.80(s,1h),9.35(s,1h),7.46(m,5h),7.38(m,1h),7.28(m,1h),7.24–7.15(m,2h),7.00(m,1h),6.80(m,1h),6.68(m,2h),4.34(s,2h).13cnmr(101mhz,dmso)δ163.68(d,j=241.0hz),163.52(d,j=241.0hz),153.30(s),153.06(s),143.55(t,j=14.0hz),140.78(s),140.47(s),134.31(s),129.90(s),121.96(s),121.56(s),117.92(s),117.78(s),113.11(s),101.59(d,j=21.0hz),101.51(d,j=21.0hz),97.53(t,j=26.3hz),96.86(s),46.79(s).c21h17clf2n4o(m+h+):415.1059;found:415.1029.
生物实验实例:
试验例1:肿瘤细胞增殖抑制实验
检测本发明的小分子抑制剂抑制人肿瘤细胞增殖的活性,采用cck8法(美国mce)。
细胞株采用人肺鳞癌细胞株h2170和人肺腺癌细胞株h358。培养基为rpmi1640(美国gibco)+10%fbs(美国gibco)+双抗。
试剂配制:母液浓度为20mm,溶剂为dmso(美国sigma-aldrich),储存于-20℃,使用时室温化开,应用细胞培养基稀释至所需浓度。
cck8检测方法:将对数生长期的肺癌细胞h2170或h358,用胰蛋白酶消化,重悬于细胞培养基,浓度为8×104个/ml。在96孔培养板中每孔加细胞悬液100μl,于细胞培养箱(37℃,5%二氧化碳)培养。24小时后,加入含有小分子试剂的培养基100μl,使终浓度分别为0,0.003,0.01,0.03,0.1,0.3,1,3,10和30μm。设三个副孔,继续培养72小时后弃去培养基溶液,加入含有10%的cck8溶液的培养基,继续培养1小时后,使用酶标仪spectramaxid3检测450nmod值。采用graphpadprism6数据处理软件,通过绘制量效曲线计算半数抑制浓度(ic50)。结果见表1。
表1本发明小分子抑制剂对不同人肺癌细胞ic50值
以上实验结果显示,本发明的化合物有良好的抑制肺癌细胞生长的活性,可作为潜在的抗肿瘤小分子抑制剂。
试验例2:诱导肿瘤细胞自噬实验
检测本发明的小分子抑制剂诱导肿瘤细胞自噬的活性,采用westernblot法和免疫荧光染色法。
细胞株采用人肺腺癌细胞株h358。培养基为rpmi1640(美国gibco)+10%fbs(美国gibco)+双抗。
试剂配制:母液浓度为20mm,溶剂为dmso(美国sigma-aldrich),储存于-20℃,使用时室温化开,应用细胞培养基稀释至所需浓度。免疫荧光封闭液,2.5%的bsa(美国sigma-aldrich),0.1%的tritonx-100(美国thermofisherscientific),配制于pbs(美国thermofisherscientific)中,-20℃存放,使用时室温化开。
westernblot法:肺癌细胞以30-40%密度种于60mm细胞培养皿,于细胞培养箱(37℃,5%二氧化碳)培养。24小时后,加入含有小分子试剂的培养基,终浓度分别为10和20μm,溶剂dmso作为阴性对照,继续培养24小时或48小时后收获细胞,应用westernblot法检测自噬通路相关蛋白含量的变化。应用抗体分别为lc3抗体(美国sigma-aldrich),p62抗体(美国mbl),β-actin抗体(美国sigma-aldrich)。结果见图1a。
免疫荧光染色法:将对数生长期的肺癌细胞,用胰蛋白酶消化,重悬于细胞培养基,浓度为4×105个/ml。在24孔培养板中(板底预置盖玻片)每孔加细胞悬液500μl,于细胞培养箱(37℃,5%二氧化碳)培养。24小时后,更换为含有小分子试剂的培养基500μl,终浓度为20μm。设两个副孔,继续培养24小时后弃去培养基溶液,立即加入-20℃预冷的甲醇,于-20℃固定6-8分钟,封闭液室温封闭1小时。与lc3抗体(1:200稀释于封闭液)于4℃孵育过夜;dapi(美国abnova)及特异性免疫荧光二抗(美国life)(1:500稀释于封闭液)室温孵育1小时后,封片,次日于nikona1共聚焦显微镜(日本,nikona1ti)观察。结果见图1b。
以上实验结果显示,本发明的化合物诱导lc3ⅰ型向ⅱ型的转变及p62的降解,同时免疫荧光染色显示化合物处理后lc3颗粒状聚集,均表明化合物有良好的诱导肿瘤细胞发生自噬的活性。
试验例3:cullinneddylation修饰抑制实验
检测本发明的小分子抑制剂抑制肺癌细胞内cullin分子发生neddylation修饰的活性,采用westernblot法。
细胞株采用人肺鳞癌细胞株h2170和人肺腺癌细胞株h358。培养基为rpmi1640(美国gibco)+10%fbs(美国gibco)+双抗。
试剂配制:母液浓度为20mm,溶剂为dmso,储存于-20℃,使用时室温化开,应用细胞培养基稀释至所需浓度。
westernblot检测方法:肺癌细胞以50-60%密度种于60mm细胞培养皿,于细胞培养箱(37℃,5%二氧化碳)培养。24小时后,加入含有小分子试剂的培养基,终浓度分别为5,10和20μm,溶剂dmso和mln4924(0.3μm)分别作为阴性和阳性对照,继续培养24小时后收获细胞,应用westernblot法检测多个cullin蛋白的neddylation水平。应用抗体分别为cul1抗体(美国santacruz),cul2抗体(美国santacruz),cul3抗体(美国cellsignalingtechnology),cul4a抗体(美国proteintech),cul4b抗体(美国proteintech),cul5抗体(美国santacruz),β-actin抗体(美国sigma-aldrich)。结果见图2。
以上实验结果显示,本发明的化合物均以剂量依赖方式抑制所有检测的cullin蛋白发生neddylation修饰,提示作用靶点为nedd8e1活化酶nae。
试验例4:细胞热转变分析实验
检测本发明的小分子抑制剂的作用靶点,采用细胞热转变分析法。
细胞株采用人肺鳞癌细胞株h2170和人肺腺癌细胞株h358。培养基为rpmi1640(美国gibco)+10%fbs(美国gibco)+双抗。
试剂配制:母液浓度为20mm,溶剂为dmso,储存于-20℃,使用时室温化开,应用细胞培养基稀释至所需浓度。
细胞热转变分析检测方法:肺癌细胞以50-60%密度种于60mm细胞培养皿,于细胞培养箱(37℃,5%二氧化碳)培养。24小时后,加入含有小分子试剂的培养基,终浓度分别为5,10,20和30μm,溶剂dmso作为阴性对照,继续培养24小时后用胰蛋白酶消化收获细胞,将细胞沉淀应用bio-radt100tmthermalcyclerpcr仪于57℃加热3分钟后,加入30μl含蛋白酶抑制剂的pbs,置于冰上操作,于液氮反复冻融3次后,14000rpm,25分钟,4℃离心提取蛋白。应用westernblot法检测neddylation通路相关酶的含量变化,应用抗体分别为uba3抗体(英国abcam),nae1抗体(美国cellsignalingtechnology),ube2f抗体(英国abcam),sag抗体(本实验室提供),roc1抗体(本实验室提供),β-actin抗体(美国sigma-aldrich),结果见图3。
以上实验结果显示,本发明的化合物以剂量依赖方式特异性稳定uba3,证明其作用靶点为nedd8e1活化酶nae。
通过以上细胞实验可知,这些二苯基脲类小分子抑制剂可以有效的抑制肿瘤细胞的增殖,具有良好的抗肿瘤活性。它们的结构母核相同,只是侧链稍有区别;二苯基脲的结构片段非常重要,对二苯基脲进行替换会造成化合物的活性明显减弱或者消失。因此,以二苯基脲为结构母核的化合物可以作为uba3抑制剂,并应用于抗肿瘤药物的研发。
- 还没有人留言评论。精彩留言会获得点赞!