作为一类新型抗微生物剂的四分枝肽和类似物及其制备的制作方法
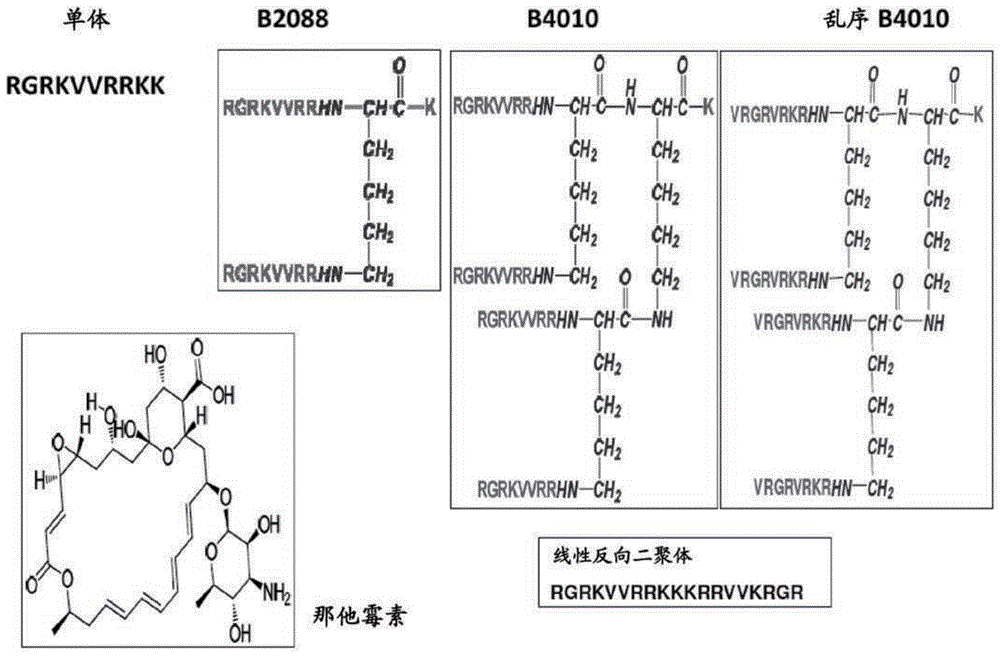
本申请是申请日为2013年9月9日、中国申请号为201380055526.3、发明名称为“作为一类新型抗微生物剂的四分枝肽和类似物及其制备”的发明申请的分案申请。发明领域本发明涉及具有抗微生物特性(特别是抗真菌特性)的四聚体形式的肽。本发明还涉及制造这些四聚肽的方法。本发明还涉及这些多聚体用于抑制微生物(特别是真菌)生长的用途。本发明进一步涉及包含这些四聚肽的组合物。发明背景抗真菌剂用于抑制真菌生长和/或杀死真菌(杀真菌剂)。例如,抗真菌药物是用于在患者(尤其是免疫系统遭到削弱的患者)中治疗由真菌引起的感染和预防真菌感染发生的药物。在美国,致病性真菌感染是感染相关性死亡中第七常见的原因。实际上,近期的调查提示真菌疾病正对全球生物区构成日益增长的威胁。与抗细菌药物相比,可用的抗真菌剂的数目有限,因为真菌中的常用药物靶标与人体中的相似分子类型同源,后者可能也受到抑制。抗真菌剂的例子包括多烯、唑、烯丙胺、氟胞嘧啶(fluocytosine)和棘球白素(echniocandin)(图9)。此外,近期的报告表明真菌对现有抗真菌剂的抗性的发生率日益增加。眼的真菌感染(例如真菌性角膜炎或角膜霉菌病)在热带气候中常见。在发达国家,隐形眼镜或眼镜护理液的使用是真菌性角膜炎的主要风险因素。自从第一次报道隐形眼镜相关真菌性角膜炎,一些国家记录了眼部真菌病原体感染的发病(图10)。对于真菌性角膜炎,那他霉素是仅有的美国fda批准的眼科抗真菌剂真菌中抗药性的出现连同免疫受损患者数目的增加已限制临床医师的治疗选项,并凸显了对新类型的抗真菌剂的需要。因此,需要开发特别适合作为抗真菌剂的抗微生物剂,所述抗真菌剂具有广谱,适于多种用途,尤其是眼部感染的治疗,优选对真菌形成抗性能复原。发明概述根据第一方面,本发明涉及一种包含式[(rgrkvvrr)2k]2kki的分离的肽四聚体或一种具有初始肽单体(rgrkvvrr)的肽四聚体[(rgrkvvrr)2k]2kki的分离的肽四聚体衍生物;包含至少1处氨基酸替代、至少1处氨基酸删除、至少1个肽单体与初始肽单体相比的重排和/或至少一个肽单体中与初始肽单体相比的至少一处非蛋白质发生性(non-proteogenic)氨基酸修饰;其中i=0或1。本发明还涉及此处描述的分离的肽四聚体衍生物或分离的肽四聚体的用途。本发明还包括制备此处描述的分离的肽衍生物或分离的肽四聚体的方法。附图简述图1:单体、线性反向二聚体(retrodimer)、肽二聚体b2088、肽四聚体b4010、乱序b4010(scrambledb4010)和那他霉素的结构。图2:b4010介导的对白色假丝酵母(c.albicans)(a)atcc10231和(b)临床隔离群df2672r的杀伤的动力学。将2x106个细胞与指定浓度的b4010、两性霉素b和那他霉素一起温育。在指定时间点将样品的小样铺在sda上,并测定细胞存活力。图3:b4010在金属离子和复杂生物学流体存在下的抗真菌特性。(a)在单价和二价金属离子存在下测定的mic值。条上方的数字指示测定的mic值。(b)b4010在金属离子存在下的杀假丝酵母特性。b4010的浓度为5.5μm。(c)在胰蛋白酶存在下的抗真菌活性(胰蛋白酶:b4010=1:100)。(d)b4010在50%家兔泪液存在下的杀假丝酵母活性。图4:b4010的毒性和角膜上皮重形成速率。(a)b4010和多烯抗真菌剂(那他霉素和两性霉素b)对4%家兔红血细胞的溶血毒性。(b)b4010和多烯抗真菌剂对人角膜上皮(hce)细胞的细胞毒性。(c)b4010对新西兰白色家兔角膜上皮重形成的影响,通过荧光染色测量。肽浓度为22μm。图5:b4010对白色假丝酵母细胞质膜电位、膜通透性和形态的影响。(a)sds-page,显示b4010对真菌细胞壁多糖、β-几丁质缺乏亲和力。(b)由不同浓度的b4010诱导的白色假丝酵母sytox绿摄取。(c)b4010介导的膜去极化,通过disc35测定法监测。(d)b4010诱导的白色假丝酵母细胞外atp释放。插图显示atp释放的动力学。b4010浓度为5.5μm。(e)未处理的白色假丝酵母的sem。比例尺为2μm(插图比例尺=200nm)。(f)用5.5μmb4010处理的白色假丝酵母的sem图像。比例尺为1μm(插图比例尺=100nm)。图6:多种添加剂对b4010的杀假丝酵母和膜通透特性的影响。(a)cccp和nan3对膜电位的影响。(b)多种添加剂对(b)存活力和(c)atp释放的影响。(d)离子通道抑制剂对膜电位的影响。箭指示添加剂的添加时间。图7:b4010与哺乳动物和真菌模型膜的相互作用。(a)添加b4010和乱序b4010之后,钙黄绿素从pc:pe:ps:麦角固醇的suv释放的时间过程。(b)钙黄绿素从pc:胆固醇suv释放的时间过程。肽:脂比在图中指出。图8:pbs(ph=7.0)中b4010和乱序b4010的cd光谱。图9:目前抗真菌剂的例子。图10:2007-2012年眼部真菌病原体调查。定义非蛋白质发生性氨基酸指在天然发生的蛋白质中正常情况下在它们的序列中找不到的氨基酸,天然发生的蛋白质典型地由20种标准氨基酸的不同成员和组合构成。受保护的氨基酸意指有保护基团连接到羧基或胺基团任一,保护该基团从而允许只以羧基或氨基形成肽键但不允许以二者形成肽键的氨基酸。若胺基团受保护,则仅有羧基可供与另一个胺基团形成肽键。若羧基受保护,则仅有胺基团可供与另一个羧基形成肽键。多肽的末端胺基团或末端羧基可以类似地受保护,从而仅能从羧末端或胺末端形成肽键。发明详述本发明涉及一种包含式[(rgrkvvrr)2k]2kki的分离的肽四聚体或一种具有初始肽单体(rgrkvvrr)的肽四聚体[(rgrkvvrr)2k]2kki的分离的肽四聚体衍生物;包含至少1处氨基酸替代、至少1处氨基酸删除、至少1个肽单体与初始肽单体相比的重排和/或至少一个肽单体中与初始肽单体相比的至少一处非蛋白质发生性氨基酸修饰;其中i=0或1。而且,任何2个、3个或全部肽单体可用至少1处氨基酸替代、至少1处氨基酸删除、肽单体的重排和/或至少1处非蛋白质发生性氨基酸修饰来修饰。初始肽单体的序列是rgrkvvrr(seqidno:1)。若i=0,则分离的肽四聚体是[(rgrkvvrr)2k]2k。若i=1,则分离的肽四聚体是[(rgrkvvrr)2k]2kk。分离的肽四聚体可以衍生自(rgrkvvrr)2k]2k或者是[(rgrkvvrr)2k]2kk。分离的肽四聚体衍生物具有式[(肽)2k]2kk。具体而言,分离的肽四聚体衍生物是以如下结构分枝的:分离的肽四聚体衍生物类似地以如下结构分枝:肽1、肽2、肽3和肽4各自衍生自所述的初始肽单体。肽1、肽2、肽3和肽4可具有相同的序列或可具有不同的序列。肽1、肽2、肽3和肽4可独立包含seqidno:2-26任一。氨基酸替代可以是将初始肽单体的一个或多个氨基酸残基替代为任何合适氨基酸的替代。替代可以是将初始肽单体的一个氨基酸替代为任何合适氨基酸的替代。例如,氨基酸替代可以是至少1处丙氨酸替代。氨基酸替代可以包括连续地将至少一个初始肽单体(rgrkvvrr)的一个氨基酸替代为任何合适氨基酸。具体而言,氨基酸替代包括连续地将至少一个初始肽单体(rgrkvvrr)的一个氨基酸替代为丙氨酸。相应地,分离的肽四聚体衍生物可以选自下组:[(agrkvvrr)2k]2kki、[(rarkvvrr)2k]2kki、[(rgakvvrr)2k]2kki、[(rgravvrr)2k]2kki、[(rgrkavrr)2k]2kki、[(rgrkvarr)2k]2kki、[(rgrkvvar)2k]2kki和[(rgrkvvra)2k]2kki;其中i=0或1。agrkvvrr=seqidno:2rarkvvrr=seqidno:3rgakvvrr=seqidno:4rgravvrr=seqidno:5rgrkvarr=seqidno:6rgrkvarr=seqidno:7rgrkvvar=seqidno:8rgrkvvra=seqidno:9当i=0时,分离的肽四聚体衍生物选自下组:[(agrkvvrr)2k]2k、[(rarkvvrr)2k]2k、[(rgakvvrr)2k]2k、[(rgravvrr)2k]2k、[(rgrkavrr)2k]2k、[(rgrkvarr)2k]2k、[(rgrkvvar)2k]2k和[(rgrkvvra)2k]2k。当i=1时,分离的肽四聚体衍生物选自下组:[(agrkvvrr)2k]2k、[(rarkvvrr)2k]2kk、[(rgakvvrr)2k]2kk、[(rgravvrr)2k]2kk、[(rgrkavrr)2k]2kk、[(rgrkvarr)2k]2kk、[(rgrkvvar)2k]2kk和[(rgrkvvra)2k]2kk。在进一步的实施方案中,可以将初始肽单体的2个或更多个氨基酸替代为丙氨酸残基。例如,分离的肽四聚体衍生物可以选自下组:[(rgaavvrr)2k]2kki、[(rgrkvvaa)2k]2kki、[(rgakavrr)2k]2kki、[(rgrkaarr)2k]2kki、[(rgaaavrr)2k]2kki、[(rgakaarr)2k]2kki、[(rgraaarr)2k]2kki、[(rgaaaarr)2k]2kki、[(rgrkaaaa)2k]2kki;其中i=0或1。rgaavvrr=seqidno:10rgrkvvaa=seqidno:11rgakavrr=seqidno:12rgrkaarr=seqidno:13rgaaavrr=seqidno:14rgakaarr=seqidno:15rgraaarr=seqidno:16rgaaaarr=seqidno:17rgrkaaaa=seqidno:18当i=0时,分离的肽四聚体衍生物选自下组:[(rgaavvrr)2k]2k、[(rgrkvvaa)2k]2k、[(rgakavrr)2k]2kki、[(rgrkaarr)2k]2k、[(rgaaavrr)2k]2k、[(rgakaarr)2k]2ki、[(rgraaarr)2k]2k、[(rgaaaarr)2k]2k、[(rgrkaaaa)2k]2k。当i=1时,分离的肽四聚体衍生物选自下组:[(rgaavvrr)2k]2kk、[(rgrkvvaa)2k]2kk、[(rgakavrr)2k]2kk、[(rgrkaarr)2k]2kk、[(rgaaavrr)2k]2kk、[(rgakaarr)2k]2kk、[(rgraaarr)2k]2kk、[(rgaaaarr)2k]2kk、[(rgrkaaaa)2k]2kk。在进一步的实施方案中,分离的肽四聚体衍生物可包含[vrgrvrkr)2k]2kki;其中i=0或1。在这个实施方案中,有初始肽单体(rgrkvvrr)的重排;即初始肽单体的序列是乱序的。当i=0时,分离的肽四聚体衍生物是[vrgrvrkr)2k]2k。当i=1时,分离的肽四聚体衍生物是[vrgrvrkr)2k]2kk。vrgrvrkr=seqidno:19在另一个例子中,氨基酸删除可以包括从至少1个初始肽单体的n末端连续地去除氨基酸。相应地,分离的肽四聚体衍生物可以选自下组:[(grkvvrr)2k]2kki、[(rkvvrr)2k]2kki、[(kvvrr)2k]2kki、[(vvrr)2k]2kki、[(vrr)2k]2kki、[(rr)2k]2kki和[(r)2k]2kki;其中i=0或1。grkvvrr=seqidno:20rkvvrr=seqidno:21kvvrr=seqidno:22vvrr=seqidno:23vrr=seqidno:24rr=seqidno:25r=seqidno:26当i=0时,分离的肽四聚体衍生物选自下组:[(grkvvrr)2k]2k、[(rkvvrr)2k]2k、[(kvvrr)2k]2k、[(vvrr)2k]2k、[(vrr)2k]2k、[(rr)2k]2k和[(r)2k]2k。当i=1时,分离的肽四聚体衍生物选自下组:[(grkvvrr)2k]2kk、[(rkvvrr)2k]2kk、[(kvvrr)2k]2kk、[(vvrr)2k]2kk、[(vrr)2k]2kk、[(rr)2k]2kk和[(r)2k]2kk。分离的肽四聚体非蛋白质发生性氨基酸修饰可以包括:(i)在至少1个肽单体的任何位置包含至少1个附加的非蛋白质发生性氨基酸和/或(ii)在至少1个肽单体中将至少1个氨基酸残基替代为非蛋白质发生性氨基酸。具体而言,可以在至少1个肽单体的任何位置包含附加的非蛋白质发生性氨基酸。根据本发明任一方面的分离的肽四聚体或分离的肽四聚体衍生物可以用作药物、药物组合物和/或抗微生物组合物和/或用于治疗。抗微生物组合物可以是抗细菌、抗真菌或抗原生动物组合物。具体而言,抗微生物组合物包括抗真菌组合物。本发明包括根据本发明任一方面的分离的肽四聚体或分离的肽四聚体衍生物在制备用于预防和/或治疗至少一种微生物感染的药物中的用途。微生物感染可以选自下组:细菌感染、真菌感染和原生动物感染。具体而言,微生物感染包括真菌感染。本发明还包括一种抑制和/或减少至少一种微生物生长的方法,其包括使微生物接触至少一种根据本发明任一方面的分离的肽四聚体或分离的肽四聚体衍生物。该方法可以是体外方法。微生物可以选自下组:细菌、真菌和原生动物。具体而言,微生物包括真菌。本发明还包括一种预防和/或治疗至少一种微生物感染的方法,其包括施用至少一种根据本发明任一方面的分离的肽四聚体或分离的肽四聚体衍生物。本发明还包括一种隐形眼镜和/或滴眼液溶液、药物组合物和/或抗微生物组合物、用于包被装置的组合物和/或试剂盒,其包含根据本发明任一方面的分离的肽四聚体或分离的肽四聚体衍生物。作为本发明的一部分,包括制备所述分离的肽四聚体或分离的肽四聚体衍生物的方法。在一个例子中,制备包含4个相同的肽单体的肽四聚体或包含4个相同的肽单体的分离的肽四聚体衍生物的方法包括如下步骤:(i)提供至少1个固相;(ii)将第1个受保护的k残基偶联到固相上;(iii)将保护基团从第1个k残基中的1个胺基团移除;(iv)将第2个受保护的k残基连接到第1个k残基;(v)将保护基团从第2个k残基中的1个胺基团移除;(vi)将两个受保护的k残基连接到第2个k残基;(vii)将保护基团从两个连接的k残基移除;(viii)根据各自肽单体从c末端到n末端的序列,通过连接受保护的氨基酸残基以提供附加的链延伸,其中在每次连接后,移除保护基团以供下一次连接;(ix)根据要添加的残基数终止氨基酸残基的连接;和(x)任选地从固相释放多聚体。在另一个例子中,制备包含4个相同的肽单体的肽四聚体或包含4个相同的肽单体的分离的肽四聚体衍生物的方法包括如下步骤:(i)提供至少1个固相;(ii)将第1个受保护的k残基偶联到固相上;(iii)将保护基团从第1个k残基中的1个胺基团移除;(iv)将第2个受保护的k残基连接到第1个k残基;(v)将保护基团从第2个k残基中的1个胺基团移除;(vi)将两个受保护的k残基连接到第2个k残基;(vii)将保护基团从两个连接的k残基移除;(viii)将1个带有受保护的末端胺基团的肽单体连接到来自所述两个k残基的每个胺基团;和(iv)任选地从固相释放多聚体。依照另一个方面,制备包含4个相同的肽单体的肽四聚体或包含4个相同的肽单体的分离的肽四聚体衍生物的方法包括如下步骤:(i)提供至少1个固相;(ii)将第1个k残基偶联到固相上;(iii)将两个受保护的k残基连接到偶联的第1个k残基;(iv)将保护基团从连接的k残基移除;(v)根据各自肽单体从c末端到n末端的序列,通过连接受保护的氨基酸残基以提供附加的链延伸,其中在每次连接后,移除保护基团以供下一次连接;(vi)根据要添加的残基数终止氨基酸残基的连接;和(vii)任选地从固相释放多聚体。进一步地,制备包含4个相同的肽单体的肽四聚体或包含4个相同的肽单体的分离的肽四聚体衍生物的方法包括如下步骤:(i)提供至少1个固相;(ii)将第1个k残基偶联到固相上;(iii)将两个受保护的k残基连接到偶联的第1个k残基;(iv)将保护基团从连接的k残基移除;(v)将1个带有受保护的末端胺基团的肽单体连接到来自所述两个k残基的每个胺基团;和(vi)任选地从固相释放多聚体。现在已一般性描述了本发明,通过对如下实施例的提述会更易于理解本发明,所述实施例是通过举例方式提供的,而且并非意在对本发明进行限制。实施例本领域所知的且未具体描述的标准分子生物学技术一般是遵循green,molecularcloning:alaboratorymanual,coldspringsharborlaboratory,newyork(2012)中所述进行的。实施例1:b4010四聚体肽和乱序b4010肽单体rgrkvvrrkk(seqidno:27)、线性反向二聚体rgrkvvrrkkkrrvvkrgr(seqidno:28)、肽二聚体b2088(rgrkvvrr)2kk、肽四聚体b4010[(rgrkvvrr)2k]2kk和乱序b4010[(vrgrvrkr)2k]2kk在图1中图示。那他霉素的结构也在图1中显示。经修饰的肽在这个规程中,b4010序列(rgrkvvrr)中的每个氨基酸替换为丙氨酸残基,并且抗微生物和溶血活性会通过高通量筛选(hts)方法进行评估。在第二种方法中,会连续删除b4010序列中的每个氨基酸残基,并且会像之前那样评估它们的活性-毒性简况。在评估所有肽对至少3种菌株的mic后,会选出最佳的肽并在50%家兔泪液、25%血清和在胰蛋白酶中(酶:肽~1:100)评估它们的活性。表1显示经修饰的肽和它们的特性。表1:经修饰的肽在鉴定了在复杂生物学流体中表现出优良活性的肽后,会选择通过表2中例示的非蛋白质发生性氨基酸残基的下述修饰。表2:供修饰用的非蛋白质发生性氨基酸残基实施例2:化学品和肽化学品和肽:sabouraud右旋糖琼脂购自acumedia(michigan,mi,usa)。肽购自ezbiolabsinc.(carmel,in,usa)。脂质如l-α-磷脂酰胆碱(pc),l-α-磷脂酰乙醇胺(pe),l-α-磷脂酰丝氨酸(ps)和l-α-磷脂酰肌醇(pi)购自avantipolarlipidsinc.(al,usa)。麦角固醇,叠氮化钠(nan3),羰基氰化物间氯苯腙(carbonylcyanidem-chlorophenylhydrazone,cccp),4-氨基吡啶(4-ap),5-硝基-2-(3-苯基丙基氨基)苯甲酸(nppb),钆iii氯化物,四乙基氯化铵(tea)和3',3'-二丙基硫杂二羰花青(dis-c3-5)染料购自sigma-aldrichcorp.(mo,usa)。atp生物发光试剂盒得自molecularprobesinc(or,usa)。两性霉素b和那他霉素以粉末形式得自sigma-aldrich(s)pteltd(singapore)。实施例3:圆二色性(cd)旋光分光法使用0.1cm光程长度的石英比色皿,于25℃,在10mmpbs(ph7.0)中,在jascoj810旋光分光仪(jasco,tokyo,japan)上记录肽(0.6mg/ml)的远uv-cd光谱。以0.1nm的步幅,以50nm/min的扫描速率记录260nm至190nm的光谱。最终的光谱为4次扫描的平均值。cd数据以均值残余椭圆率(residualellipticity)((θ)mrw,degcm2dmol-1)表示。实施例4:多价肽的抗真菌活性最低抑制浓度(mic)的测定将酵母菌株培养并悬浮于sabouraud右旋糖(sd)培养基中,在平底微量滴定板中以1比6稀释,起始od600=约0.08。将相同培养基中肽的系列稀释液与接种体混合,以产生0.4–22μm的最终肽浓度。通过于37℃使用infinitem200微量板读数仪(tecangroupltd.,switzerland)以30分钟的周期和100rpm的轨道摇动监测od600达24/48小时来评估抗真菌活性。使用不含肽的培养物作为阳性对照,而单独的或含22μm肽的培养基充当阴性对照。通过肉眼观察以及测量od600二者来评估完全抑制所需的最小浓度,并将其作为mic。每个实验重复三次。结果:肽单体rgrkvvrrkk(seqidno:27)和线性反向二聚体rgrkvvrrkkkrrvvkrgr(seqidno:28)对白色假丝酵母和镰孢属(fusarium)菌株二者表现出弱抗真菌活性(表3)。然而,在通过分枝的赖氨酸(b2088,图1)连接两个拷贝的序列后观察到mic值与单体相比的实质性(约14倍)降低(表3)。进一步通过分枝的赖氨酸组装两个拷贝的分枝二聚体产生四分枝肽(b4010),与共价二聚体相比,该四分枝肽将mic又降低了4-10倍(表3)。b4010对两种白色假丝酵母临床隔离群的mic值(0.34μm)也比两性霉素b(1.4μm)和那他霉素(15μm)(仅有的美国fda批准用于眼部应用的抗真菌剂)的mic值更低。有趣的是,打乱(scrambling)b4010的序列(sc_b4010)导致mic值升高2-4倍,扔保持显著的效力。cd光谱对于两种四分枝肽都表现出200nm左右的强负最小值(strongnegativeminima),提示两种肽都是无序构象(图8)。肽b4010对atcc参考隔离群以及临床隔离群表现出广谱的抗真菌活性(表3)。该活性要优于那他霉素(唯一的美国fda批准的眼科药物)2-4倍。表4显示了其它设计肽的mic和细胞毒性。表3:肽和那他霉素对多种真菌的最小抑制浓度(mic)值n.d.–未测定表4:多种设计四聚肽的mic和细胞毒性实施例5:时间杀伤动力学测定法测量了两种白色假丝酵母菌株(atcc10231和df2672r)的时间杀伤动力学。培养物在sd培养基中生长过夜,并用磷酸盐缓冲液将细胞浓度调整到105-106cfu/ml。将肽或抗真菌剂添加到各培养物中。为接种体将b4010、或两性霉素b和那他霉素调整为合适的终浓度(b4010:atcc是1.4–11μm,而ca2672r是0.37–3.7μm;两性霉素b:ca2672r菌株是0.55μm–11μm;那他霉素:atcc是4.7μm–75μm,而ca2672r菌株是30μm)。将测试溶液于37℃在恒速摇动下温育。在预先确定的时间点取出100μl悬浮液,将其系列稀释(102或103倍)并倒入sda板中。将板在37℃温育48小时进行菌落计数。数据按照相对于阳性对照的%细胞存活力来表示。图2小图a和图2小图b显示了浓度依赖性的时间杀伤实验的结果,所述实验在将白色假丝酵母暴露于b4010和多烯抗真菌剂后进行。对于atcc菌株,在1小时中1xmic的b4010诱导了约91%的杀伤,而当浓度升到2xmic时观察到了约97%的杀伤。将b4010的浓度升到4x和8xmic值导致可存活细胞在20分钟和10分钟内分别降低了4个数量级(4logreduction)(99.99%)。相比之下,那他霉素即使在16xmic处也需要24小时才实现类似终点。还比较了b4010、那他霉素和两性霉素b对临床隔离群白色假丝酵母df2672r菌株的杀伤动力学。2xmic的b4010在1小时中引发了完全杀伤,然而16xmic的两性霉素b在不到8小时中才实现最大效果。然而,2xmic的那他霉素甚至在24小时暴露后也未观察到杀真菌作用。实施例6:单价和二价阳离子对b4010的抗真菌活性的影响为了研究金属离子的影响,用合适浓度的盐调整sd培养基以产生100和135mmnacl和kcl及0.5-2mmcacl2和mgcl2的终浓度。如上文所述进行mic测定。将培养基中的白色假丝酵母atcc10231细胞和盐作为阳性对照。培养基中盐(nacl,kcl,及cacl2和mgcl2)单独地或伴随肽作为阴性对照。为了研究金属离子对存活力的影响,将含有白色假丝酵母的培养液(od600=0.4-0.6)调整到合适的金属离子终浓度,与5.5μmb4010一起温育6小时,并如前所述在48小时后测定细胞存活力。结果:测验了生理浓度的金属离子(nacl,cacl2和mgcl2)对b4010抗真菌活性的影响。在多个肽浓度及在生理相关(与泪液中存在的浓度接近)浓度的单价和二价阳离子的存在下监测白色假丝酵母atcc10231的生长(图3小图a和图3小图b)。因为在3.125μg/ml没有观察到可见的生长,添加100和135mmnacl看起来改进了b4010的抗真菌活性(图3小图a)。135mmnacl的存在改进了抗真菌活性,将mic降低了2倍,而生理浓度的二价阳离子仅造成了mic值升高2倍(图3小图a)。高浓度的ca2+和mg2+离子导致mic值升高2倍。然而,钾对b4010的抗真菌活性有着显著的影响,因为在存在25mmkcl时观察到mic值升高了8倍(图3小图b)。添加100mmkcl导致mic与没有补充kcl的培养基相比升高了>16倍。还测定了b4010的杀假丝酵母活性的阳离子敏感性。添加b4010(5.5μm)导致在单价和二价阳离子存在下可存活细胞的完全失去(图3小图b)。然而,在高浓度kcl存在下观察到杀假丝酵母活性的轻微降低。实施例7:胰蛋白酶、血清和泪液对b4010抗真菌活性的影响在胰蛋白酶和50%泪液存在下的b4010抗真菌活性对于所有实验,除非另有说明,否则使用的是atcc10231菌株。将b4010(1mg/ml)与胰蛋白酶一起(酶:肽比率1:100)于37℃温育。在多个时间间隔(0.5,1,2,4和6小时)取出此混合物的20μl小样,并与1μl胰蛋白酶抑制剂混合。通过将此混合物添加到180μl接种体并在od600监测生长24小时来测定肽的抗真菌活性。在胰蛋白酶/胰蛋白酶抑制剂(无b4010)存在下实施的类似实验用作阳性对照。为了评估泪液中的抗真菌活性(tf),将肽溶解于新鲜收集的家兔tf,并于37℃温育6小时。温育后,将等体积的白色假丝酵母过夜培养物(约106cfu/ml)与肽在泪液中混合,并于37℃温育24小时。肽的终浓度是4.4,8.8和22μm。将此混合物的系列稀释物(102或103倍)的100μl小样接种在sd琼脂板上,然后于37℃温育48小时。单独的培养物和含50%泪液的培养物充当阳性对照。数据以相对于没有泪液的培养物的%杀伤来表示。在50%泪液存在下观察到约6-10%杀伤。5%人血清中mic的测定测定了5%人血清对于b4010对两种白色假丝酵母临床隔离群的活性的影响。将人男性血清以13,000rpm离心10分钟以去除脂类,并收集上清液。如前所述在标准培养基(sd培养基)中以及在含有5%血清上清液的培养基中测定了对白色假丝酵母2672r和白色假丝酵母1976r的临床隔离群的mic值。在3种复杂生物学环境中测验了肽的抗真菌特性。胰蛋白酶将肽b4010与胰蛋白酶一起(胰蛋白酶:肽比率=1:100)于37℃温育。在多个时间间隔取出此混合物的小样,将其添加到白色假丝酵母接种体,并监测生长(=图3小图c)。直至与胰蛋白酶一起温育6小时未发现抗真菌活性的损失,提示四分枝肽的蛋白水解抗性得到改进。泪液和人血清还在复杂生物学流体诸如泪液和人血清存在下监测了b4010的抗真菌功效。泪液在50%泪液中评估了b4010的抗真菌活性。在泪液缺失下,在5.5μm的肽浓度观察到约98±2%的可存活细胞损失。然而,在更低的浓度(4.4和8.8μmb4010),50%泪液的存在中度抑制了杀假丝酵母活性(图3小图d)。然而,在22μm没有观察到活性损失,提示需要更高的肽浓度以在泪液存在下实现超过3个数量级的白色假丝酵母减少。血清通过在5%人血清存在下测量b4010对两种白色假丝酵母临床隔离群的mic变化来评估了血清对b4010抗真菌功效的影响。对于两种菌株来说,mic值从无血清时的0.34μm转变到血清存在下的5.5μm,提示在5%血清中mic升高了16倍。实施例8:b4010对溶血,细胞毒性,角膜上皮重形成速率和体内毒性的影响溶血测定法已测定了肽和抗真菌药物对家兔红细胞的溶血活性(orenetal.,1997)。简短来说,将肽/抗真菌剂在pbs中的系列稀释物与rrbc(终浓度4%v/v)混合,于37℃温育1小时,并以3000rpm离心10分钟。通过测量在576nm处的血红蛋白吸光度来监测上清中的血红蛋白释放。来自pbs(没有任何添加物)或1%triton-x100中的细胞悬浮液的读数用作0%或100%溶血。溶血测定法的结果:使用家兔红血细胞通过溶血测定法评估了b4010在破坏哺乳动物细胞膜完整性方面的能力。甚至在440μm,肽对家兔红细胞也没有显著的溶血活性(<1%溶血)(图4小图a)。另一方面,两性霉素b和那他霉素在低浓度表现出显著的溶血活性,而且hc50值分别是59.4±7.8μm和139.6±0.18μm。表5汇总了多种肽四聚体的溶血测定法。表5:溶血测定法肽,200μg/ml%溶血b40101%b4010-r1a无溶血作用b4010-g2a无溶血作用b4010-r3a无溶血作用b4010-k4a无溶血作用b4010-v5a无溶血作用b4010-v6a无溶血作用b4010-r7a无溶血作用b4010-r8a无溶血作用2%triton-x100100%对人结膜上皮细胞的毒性在标准条件下(于37℃,5%co2的增湿气氛)在补充有1μg/ml牛胰腺胰岛素、2ng/ml小鼠表皮生长因子、0.1μg/ml霍乱毒素、5μg/ml氢化可的松、10%胎牛血清(fbs)、50ui/ml青霉素和50ui/ml链霉素的dmem/f12中培养ioba-nhc细胞。在所有实验中使用来自50-80代的细胞。每天通过相差显微术来观察常规培养物发展。在汇合时通过温和的胰蛋白酶温育来取出细胞并计数。将它们接种在96孔培养板(corning,schiphol-rijk,thenetherlands)中进行流式细胞毒性测定法的微量滴定分析(约10,000个细胞/孔)。将培养物于37℃维持24小时。然后将亚汇合的细胞(培养物表面覆盖接近70%)暴露于多种肽浓度(0.22–225μm)。使用multitox-fluor多路测定试剂盒(promega,wi,usa)通过测量afc荧光(λex=485和λem=520nm)来定期测量细胞毒性。在细胞与肽一起温育24小时后报告细胞存活力,因为甚至在温育8小时后也没有检测得到的毒性,并且测定了ec50(肽将可存活细胞减少50%的有效浓度)。体内细胞毒性用c57bl6(6-8周龄)野生型小鼠来评估b4010的急性毒性。为每种施用途径选择了两只健康的野生型小鼠。通过腹膜内(200mg/kg)或静脉内(100mg/kg)途径递送b4010。每种施用使用了两只动物,并监测24/48小时以测定死亡率或毒性迹象。细胞毒性测定法的结果:在220μm,b4010的暴露引起细胞存活力损失50%(图4小图b)。b4010的ec50值与那他霉素(211.7±20.5μm)相当,并优于两性霉素b(134±16μm)(图4小图b)。角膜伤口愈合的家兔模型进一步测验了b4010的表面施用是否影响体内角膜伤口愈合。所有动物实验都是按照对于眼科和视力研究中动物使用的arvo声明、实验动物的关怀和使用指南(国家研究委员会)、以及在singhealth实验医学中心(semc)的监管下进行的。将4只新西兰白色家兔分入两组,两只是对照组(盐水)而两只是用b4010处理的研究组。通过肌内注射1ml氯胺酮(100mg/ml)和0.5ml赛拉嗪(20mg/ml)来使家兔镇静。通过表面施用1%赛洛卡因来麻醉角膜。用5mm环钻来勾描伤口边缘,并通过无菌微型刀片(bd-beaver)来进行上皮细胞的机械去除,使基膜完好,如前所述(crossonetal.,1986)进行。通过每天3次表面施用22μmb4010来处理动物。如下揭示角膜伤口,即用荧光素钠染色将角膜伤口可视化(荧光素钠在眼科临床中用作无毒染料),并使用钴蓝色滤光器及裂隙灯活组织显微术。在上皮重形成过程期间通过image-j1.440实施残余伤口区域的测量。结果:一天3次表面应用b4010(22μm)与对照组相比没有改变上皮伤口愈合速率(图4小图c)。这是重要的结果,因为角膜上皮伤口愈合重建了眼睛先天免疫的重要组件。在小鼠上的初步体内毒性测试指示当通过ip(200mg/kg)或iv(100mg/kg)途径注射时没有死亡、发病或毒性的迹象。实施例9:b4010对ergδ株的抗真菌活性对野生型(wt)和酿酒酵母(s.cerevisiae)突变株的mic的测定还测试了b4010对携带改变的固醇结构和组成的酿酒酵母ergδ突变体的抗真菌活性。在含有0.1mg/ml氨苄青霉素的sd培养基直接接种来自wt和突变株的一些相同的菌落并于30℃生长过夜。通过离心收获细胞,用无菌水清洗并冷冻。将细胞再次铺在sd琼脂板上并于37℃温育48小时。收集突变株的2或3个相同菌落并接种在sd培养基中。将肽溶解于无菌水中,并与wt和突变株混合,并在试管中于37℃温育48或72小时。通过目测来确定肽抑制酵母菌株生长的最低浓度。结果:有抗性的病原体的出现给真菌感染的管控带来了更大的威胁。为了确定固醇改变是否对b4010的抗真菌活性有影响,使用携带麦角固醇途径中特定突变(ergδ)的酿酒酵母菌株实施实验。表6汇总了b4010对野生型和多种ergδ突变体的mic值,所述ergδ突变体携带改变的固醇结构和组成。有趣的是,所有ergδ突变体都表现出对b4010的高易感性,即mic值与野生株相比降低2-4倍。ergδ突变体对b4010是高度敏感的。突变的结果是,菌株积累了麦角固醇b或c环和侧链结构改变的固醇。为简便起见,在表5中给出了菌株的主要固醇。总体而言,突变株表现出与野生株相比降低2-4倍的mic值。突变株erg2δ,erg3δ,erg3δerg6δ和erg4δerg5δ表现出对b4010的敏感度升高(与野生型相比mic降低4倍)。突变株erg2δerg6δ和erg6δ表现出对b4010的敏感度升高2倍。表6:b4010对含有多种固醇结构和组成的酿酒酵母菌株的mic值实施例10:与细胞外壁组分的相互作用sds-page下拉测定法在另一项探查作用机制的研究中,测验了b4010对不溶性多糖(诸如几丁质和β-d-葡聚糖,真菌细胞壁的主要组分)的亲和力。将b4010(5.5–22μm)与几丁质(来自虾壳)或β-d-葡聚糖一起于37℃温育2小时。将混合物以10,000g离心,并通过sds-page(4-20%)分析上清液。还实施了没有几丁质/β-d-葡聚糖的对照实验以量化结合到碳水化合物聚合物的肽。肽对细胞壁多糖未显示出亲和力,因为与几丁质或β-d-葡聚糖均未观察到共沉淀(图5小图a)。实施例11:b4010的膜破坏活性实施了两种互补荧光测定法以确定b4010是否具有膜靶向作用。sytox绿(sg)摄取测定法为了检查肽是否使细胞质膜透化,测定了sg的摄取。这是一种膜不透性染料,其在与具有完整细胞膜的细胞一起温育时不发出荧光。在膜受损的细胞中,在结合到胞内核酸时强烈地发出荧光。对于sg摄取测定法,通过离心收获假丝酵母(atcc10231)的过夜培养物,用hepes缓冲液清洗三次,并重悬于相同缓冲液中。添加肽之前,将细胞与1μmsg一起在黑暗中温育。添加多种浓度的肽(λex=485nm)后,在520nm处监测发射强度的升高。在实验结束时添加1%triton-x100以测定%摄取。结果:通过sytox绿摄取测定法评估了b4010使细胞质膜透化的能力。荧光染料将具有受损质膜的细胞染色,并在结合到胞内核酸时展示出强荧光。在添加b4010时观察到白色假丝酵母的荧光有显著且快速的增加,确认了膜裂解作用(图5小图b)。对与1μmsg一起温育的白色假丝酵母添加b4010导致染料的快速摄取,伴随着荧光强度以浓度依赖性的方式增加(图5小图b)。在1/2xmic(13%)和1xmic值(24%)观察到弱渗透。在以2xmic添加b4010后在10分钟中约70%细胞的膜受损。然而,当b4010的浓度增加至4xmic时,在25分钟内观察到更高水平的染料摄取(>90%)。dis-c3-5膜去极化通过电位敏感性探针dis-c3-5染料的释放来监测在添加b4010时白色假丝酵母的膜电位的变化。简言之,将1ml过夜生长的对数中期假丝酵母细胞(在5mmhepes缓冲液中)与10μmdis-c3-5染料混合,并于37℃在热摇床中温育1-2小时。将800μl加载了染料的细胞悬浮液转移到搅动石英杯中,并使用quantamaster荧光分光计(photontechnologyinternational,nj,usa)在670nm的发射波长(λem)(激发波长622nm)监测荧光强度的变化。激发和发射的带宽分别设为1和2nm。一旦达到恒定荧光水平,便添加10μlhepes缓冲液中的浓缩肽溶液,以使肽的终浓度是0.22–22μm。连续监测荧光强度的变化1或2小时。为了研究能量毒药和离子通道抑制剂的影响,在添加5.5μmb4010之前添加添加物。如前所述监测荧光强度的变化。因为酵母在细胞内部维持负的静息膜电位,为了使用电位敏感性探针确定b4010的杀假丝酵母作用是否是由于对跨膜电化学梯度的损耗,使用了dis-c3-5。使用加载有电位敏感性探针的白色假丝酵母,图5小图c显示了在添加b4010时浓度依赖性的膜电位损耗。在添加b4010后立即发生去极化的时间过程,指示探针从细胞释放。然而,添加2x以上mic的肽对最终膜电位损耗没有显著影响。为了验证膜电位的损耗是否与杀假丝酵母活性有关联,在相同条件下实施了细胞存活力测定法。当肽的浓度超过4xmic时,观察到存活力的完全损失。连同sg摄取测定法,这些结果确认了b4010以浓度依赖性的方式引起快速膜电位损耗并将白色假丝酵母的细胞质膜透化。评估了用b4010攻击白色假丝酵母时金属离子和atp的胞外释放以确定膜的扰乱是否会影响其屏障功能。胞外阳离子的测量通过离心收获过夜培养的对数晚期白色假丝酵母,用10mmhepes(ph7.0)清洗5次,重悬浮于相同缓冲液中并调整到od600=0.4。对5ml此悬浮液添加b4010(终浓度5.5μm),并于37℃温育2小时。将混合物以3,000g离心,并通过perkinelmerdual-viewoptima5300dvspectrometry电感耦合等离子体-光学发射光谱法(icp-ocsmassachusetts,usa)(在cmmac设备科(新加坡国立大学化学系)可得)来评估上清液中的k+,ca2+和mg2+。atp生物发光测定法如前所述(koshlukovaetal.,1999)测定用b4010攻击白色假丝酵母后的胞外atp水平。将细胞(od600≈0.6)于37℃温育1.5小时,在有或无多种添加物的情况下于37℃在轨道摇动下2小时。添加b4010(5.5μm),并于37℃在摇动下再温育1.5小时。然后将每个管以5000g离心5分钟。然后将225μl沸腾te缓冲液(50mmtris,2mmedta,ph7.8)添加到25μl上清液并充分混合。再次将此混合物再煮沸2分钟,并保存于4℃直到进一步实验。将100μl萤光素-萤光素酶atp测定混合物添加到100μl上清液,使用infinitem200微量板读数仪(tecangroupltd.,switzerland)监测发光。对于时间进程实验,用5.5μm肽在多种时间间隔处理细胞(od600=0.4)。对于剂量依赖性研究,肽的浓度在0.4–44μm变动。自通过atp测定试剂盒(molecularprobes,or,usa)遵照制造商的说明书获得的校正曲线确定胞外atp浓度。结果:上清液中的背景k+和ca2+浓度分别是43.4±2μm和2.5±0.5μm。将白色假丝酵母与b4010(5.5μm)一起温育2小时后,观察到钾(104±4.2μm)和钙(5.8±1.3μm)浓度有超过2倍的提高,而na+和mg2+离子水平则未观察到显著变化。atp生物发光测定法指示在添加b4010后atp从白色假丝酵母快速释放(图5小图d插图)。atp的释放还依赖于肽的浓度,在4xmicb4010左右最大(图5小图d)。通过扫描电子显微术来研究用b4010处理的白色假丝酵母中的形态学变化。未处理的细胞展示出圆形、圆顶状、具有光滑表面的形态(图5小图e)。然而,与b4010一起温育30分钟的白色假丝酵母的细胞表面揭示严重的损伤,在表面上出现芽痕(图5小图f)。在某些细胞中还可见不规则物质释放(图5小图f插图),提示b4010的膜裂解作用。b4010在能量毒药和离子通道抑制剂存在下的杀假丝酵母活性对于能量毒药和离子通道抑制剂的影响,在有或无添加物的情况中将酵母细胞(105-106cfu/ml)于37℃温育2小时。将终浓度5.5μm的b4010肽添加到细胞悬浮液,并于37℃进一步再温育1.5小时。将各细胞悬浮液进一步稀释,并将100μl细胞铺板并于37℃温育。含添加物(且不含肽)的sda板充当阳性对照。通过对于37℃温育48小时后每块板中形成的菌落数计数来获得细胞存活力。添加物的终浓度为:cccp(5μm),nan3(5mm),4-ap(1mm),nppb(0.5mm),钆ii氯化物(1mm)和四乙基氯化铵(15mm)。报告的值是两个独立重复实验的平均值。还实施了有所有添加物的对照实验,以评估添加物对白色假丝酵母的毒性。结果:为了研究白色假丝酵母代谢活动对b4010易感性的影响,将加载有dis-c3-5的细胞与5μmcccp(一种质子梯度解偶联剂)或5mmnan3(其阻断线粒体抑制的经典和旁路途径二者)一起温育,并监测添加b4010后的荧光强度变化。cccp的添加导致荧光强度的强烈降低,指示膜电位的瓦解。随后添加b4010在跨膜电位中有弱变化(图6小图a)。如veerman等人之前所示,将nan3添加到加载有染料的细胞引起弱去极化。随后添加b4010导致荧光强度升高(图6小图a)。然而,在叠氮化物处理的细胞中观察到与对照细胞相比荧光强度有约25倍的降低。通过离心去除nan3逆转了强度变化,指示能量毒药可逆地抑制杀假丝酵母活性。这些结果提示质子解偶联剂和能量毒药都显著降低b4010诱导的细胞质膜去极化。将白色假丝酵母细胞与cccp一起预温育赋予针对b4010诱导的致死的部分保护,而在nan3存在下观察到完全保护(图6小图b)。还调查了cccp/nan3对b4010所致atp释放的影响。与细胞存活力测定法一致,atp生物发光测定法指示b4010处理的细胞中的胞外atp水平的显著升高(图6小图c)。然而,用cccp/nan3预处理,然后添加b4010的细胞导致了与b4010处理的细胞相比atp释放的显著减少(图6小图c)。离子通道抑制剂对b4010的抗真菌活性的影响:观察到b4010引起k+以及atp的快速释放,而添加外部k+降低细胞死亡的程度,在升高的离子浓度mic升高超过16倍,这提出了一个问题,即离子通道抑制剂是否能针对b4010保护白色假丝酵母。测试了非特异性有机阳离子抑制剂(tea和4-ap)以及酵母伸展(stretch)活化离子通道阻断剂gd3+对b4010的杀假丝酵母活性的影响。该肽在用tea和4-ap预处理的细胞中引起显著的存活力损失(图6小图b)。与存活力损失一致,添加b4010后从用tea和4-ap预处理的细胞释放了与没有这些抑制剂时所观察到的相似量的atp(图6小图c)。另一方面,与gd3+一起温育的细胞针对b4010诱导的杀伤提供了部分保护(54±6%存活力损失)。对用阴离子通道抑制剂nppb预处理的白色假丝酵母细胞添加b4010赋予白色假丝酵母针对b4010的显著保护(12±4%杀伤)(图6小图b)。atp释放测定法进一步确认了来自分别赋予完全或部分保护的添加物的atp流出减少或缺失(图6小图c)。为了确定b4010活性的损失是否与膜电位的改变有关,监测添加物对加载有dis-c3-5染料的细胞在添加b4010之前和之后的强度变化的影响。tea或4-ap没有改变膜电位,而随后添加b4010导致膜电位的完全丧失,而且强度变化的幅度与没有在先添加到tea或4-ap的细胞中观察到的强度变化的幅度是相似的(图6小图d)。当向加载有染料的白色假丝酵母添加gd3+时,观察到显著的去极化。进一步添加b4010引起膜电位的弱损耗,增加细胞存活力和atp释放(测定法)。细胞与nppb一起温育导致膜电位的瓦解而不影响细胞存活力。向nppb处理的细胞进一步添加b4010防止了膜电位的损耗(图6小图d)并消除了b4010的杀假丝酵母特性。在多种添加物存在下的染料释放测定法提示静息负膜电位和代谢活动对于b4010的杀假丝酵母活性是至关重要的。使用pc/pe/pi或含有15wt%麦角固醇的ps脂质(5:2.5:2.5)或pc/胆固醇(10:1)制备小单层囊泡(suv)(makovitzkietal.,2006)。为了制备pc/pe/pi或ps/ergsuv,将脂质在玻璃管里溶解于氯仿/甲醇(2:1,v/v)中。将麦角固醇溶解于相同溶剂中,并添加到脂质混合物中以制成15wt%的最终麦角固醇含量。使用氮气干燥脂质-麦角固醇混合物以形成脂质层。将膜在含20mmpbs(ph7)的缓冲液中水合,涡旋震荡,并超声处理。每个超声处理周期(5秒,40℃)随后是冷冻于液氮中并在保持于37℃的水浴上融化。重复规程5-6次直到出现光学透明分散。将suv分为两部分。向第一部分添加50mm钙黄绿素并温育1小时。通过将100μl加载有钙黄绿素的suv注射进用20mmpbs(ph7.0)平衡的ultrahydrogeltm250(7.8mmx300mm)柱,并以1ml/min的流速等度洗脱1.5个柱体积来去除过量的钙黄绿素。将加载有钙黄绿素的脂质体与无钙黄绿素的脂质体混合(1:1)以调整最终脂质体浓度。增加肽浓度以获得1:30或1:15的肽:脂质体比。在pti分光荧光计上使用480nm的激发波长和512nm的发射波长测量添加肽或tritonx-100后的荧光信号变化。用如下等式来计算每个时间点释放的百分比钙黄绿素:其中a0是在添加肽时观察到的荧光强度,amin是基线处(添加肽之前)的平均强度,amax是添加1%tritonx-100后饱和阶段的平均强度。对pc/胆固醇suv的制备物遵循类似的方案。结果:图7小图a显示了当肽:脂质比为1:30和1:15时来自suv的钙黄绿素快速释放。提高肽浓度则增加了钙黄绿素释放的量。b4010导致约68%钙黄绿素释放,而乱序肽释放约41%,与对后一种肽观察到的更高的mic值一致。然而,对那他霉素未观察到钙黄绿素释放,那他霉素与麦角固醇复合且不形成大的跨膜孔(图7小图a)。在哺乳动物模型膜(pc:胆固醇)上,b4010诱导的钙黄绿素泄露更少(图7小图b),提示对升高的真菌模型膜的选择性。讨论在热带国家,真菌病具有高发病率且对主要健康和经济问题负有责任。免疫受损患者人群的扩大、食物中抗真菌剂的大规模使用及医疗装置和植入物的使用增多进一步提高了真菌感染的发病率。在美国,系统性假丝酵母属菌种占了40%死亡率并且是医院获得的血流感染的第4位原因。当前的抗真菌的例子和它们的特性在表7中显示。然而,抗真菌剂抗性增加和抗真菌剂选项有限的问题尚存。表7:当前抗真菌剂的特性这项研究报告了弱抗真菌肽的多聚化导致了与其单体对应物相比高度增强的抗真菌和膜透化活性。b系列的肽的特殊特性为:1.快速杀伤许多形式的真菌和酵母(低于1小时)。2.能杀伤具有改变的固醇膜组成的突变形式的酵母。3.对降解有抗性。4.对生理浓度的单价和二价离子有抗性。携带4个拷贝的最有活性的肽(b4010)对假丝酵母属和镰孢属菌株表现出卓越的抗真菌活性。打乱序列导致抗真菌活性降低2-4倍,指示氨基酸序列的重要性。将b4010的杀假丝酵母活性的动力学与多烯抗真菌剂进行比较。对于atcc和临床隔离群二者而言,b4010以2x或4xmic值不到1小时引起可存活细胞减少3个数量级,而多烯抗真菌剂需要升高的浓度和更长的时间来实现相似的终点。在单价和二价阳离子存在下以及在复杂生物学流体中评估了b4010的抗真菌活性。结果显示生理相关离子强度未改变b4010的抗真菌活性,尽管在高浓度k+离子观察到活性降低。k+在升高的浓度对酵母细胞的强去极化活性可能对抗真菌活性的部分损失负有责任。当与胰蛋白酶或泪液一起温育6小时时,b4010保留显著的抗真菌功效。这些结果提示b4010在复杂生物学环境中改进的稳定性。在人血清存在下,肽对两种临床隔离群的mic值升高约16倍。很可能b4010与清蛋白或其它蛋白质的相互作用可能对mic值升高负有责任。总的来说,这些结果突显了b4010在复杂生物学流体中可观的抗真菌功效。在白色假丝酵母对唑类和多烯类抗真菌剂的抗性的进化中,已有一些机制的记录。改变麦角固醇生物合成途径中的特定步骤所致固醇结构和组成的定性和定量改变是已知的唑类和多烯类抗性的最重要机制之一。对来自aids和白血病患者的唑类抗性白色假丝酵母菌株中的固醇组成的分析指示麦角固-7,22-二烯醇的积累。已显示酿酒酵母erg4,erg6和erg3中的突变表现出增强的对多烯类和唑类抗真菌剂的抗性。然而,所有携带改变的固醇结构和组成的酵母突变体都对b4010超级敏感。有趣的是,发现对唑类和多烯类抗真菌剂有固有抗性的erg3δ突变体对b4010比erg2d和erg2d6d突变体更易感。可能的是源自固醇改变的增强的膜流动性可能有助于增加b4010的穿透性,因而导致观察到的突变株的超级易感性。宿主防御肽的治疗潜力还受到细胞毒性和溶血活性升高的限制。与那他霉素和两性霉素b相比,该肽在更高的浓度对家兔红细胞是非溶血性。然而,该肽对hce细胞的细胞毒性与那他霉素相当,而且优于两性霉素b。b4010既未在家兔中影响角膜的上皮重形成速率,也未在小鼠中表现出急性毒性,指示该肽在外科背景中的安全性。由于许多抗真菌肽需要完整的细胞壁以发挥抗真菌作用,因此测验了b4010对细胞壁多糖的亲和力。b4010对b-d-葡聚糖或几丁质没有亲和力,因为在下拉实验中未观察到共沉淀。为了探查膜靶向特性及关联快速杀假丝酵母活性,通过sg摄取和dis-c3-5释放测定法来监测b4010的浓度对膜透化的动力学的影响。在所有浓度都观察到了快速的sg摄取,尽管最大摄取是在4xmic实现的。这些结果支持如下的时间-杀伤动力学(测定法),即完全杀伤在4xmic在30分钟内出现。dis-c3-5染料释放研究提示在更低浓度膜电位的弱损耗,并且在2xmic以上观察到最大损耗。在相同条件下暴露于4xmicb4010的酵母细胞中存活力的损失提示膜电位的损耗与杀假丝酵母活性有关联。膜电位的快速损耗和sg摄取可指示肽与细胞质膜的直接相互作用。用b4010攻击白色假丝酵母引起k+和ca2+离子升高2倍,指示膜损伤。来自用b4010处理的酵母细胞的atp胞外释放是浓度依赖性的,最大流出在4xmic。在4xmic处的atp流出的动力学在30分钟内实现最大值,与杀假丝酵母活性的动力学一致。sem研究显示用b4010处理的白色假丝酵母显得粗糙,具有遭到破坏的形态和广泛的起泡,再次指向膜是肽的首要且可能关键的靶标的观察结果。这项研究显示,改变细胞质膜电位或能量代谢的添加物针对b4010诱导的杀伤赋予白色假丝酵母以实质性保护。在5μm,cccp已显示引起细胞质膜的去极化,而线粒体去极化需要高浓度(>50μm)。细胞存活力测定法确认了用5μmcccp预处理细胞针对b4010提供部分保护(45%可存活细胞)。dis-c3-5测定法指示在5μmcccp存在下膜电位的瓦解。在阴离子通道抑制剂dids存在下观察到了类似的效果。这些结果提示转阴性(transnegative)电化学梯度的改变可能潜在是针对b4010保护白色假丝酵母的根本机制。已显示酿酒酵母的膜电位是-76±5mv,而白色假丝酵母的值是-120mv(55,56)。酿酒酵母降低的膜电位可能是观察到的酿酒酵母mic值(5.5μm)比白色假丝酵母(0.37-1.4μm)更高的原因。支持这一点的是,高浓度的胞外k+强烈地使酵母细胞去极化而不影响细胞存活力,并且随后添加b4010引起膜电位的小变化和针对b4010的部分保护(40%可存活细胞)。此外,不改变膜电位的离子通道抑制剂没有针对b4010保护酵母细胞。然而,nan3的存在完全消除b4010的杀假丝酵母活性。已显示nan3改变酵母质膜的流动性而不影响膜电位。与此一致的是,添加膜流化剂(fluidizer)挽救了b4010的抗真菌活性。因此,这提示b4010的杀假丝酵母作用与质膜电位和膜流动性相关联。b4010对含有纯化的脂质和麦角固醇的加载有钙黄绿素的suv的影响毫无疑义地指向肽的膜裂解作用。来自这些研究的结果进一步指示四分枝和氨基酸序列对膜破坏是重要的,因为在b2088和sc_b4010肽存在下观察到钙黄绿素释放减少。然而。在含有胆固醇的两性离子suv中,b4010引起钙黄绿素释放减少,提示更弱的与哺乳动物模型膜的相互作用。在含有麦角固醇的混合脂质体中钙黄绿素释放的高%和肽的伸展构象的保持支持从md模拟结果中获得的结果。此外,针对酵母的低mic和针对hce细胞的高ec50值确认了b4010选择性损伤真菌膜。总之,这项研究显示,将4个拷贝的弱活性肽装配在分枝的赖氨酸核上放大了特性并克服了线性抗微生物肽的一些限制。此外,该肽对一些有改变的固醇结构和组成的酵母菌株是超级有力的,因此提示它们抗击抗性的潜力。在体外和体内测试时该肽是无毒的。b4010靶向细胞质膜并引起膜电位的快速损耗和胞内组分的损失。改变膜电位或代谢活动的添加物对抗真菌特性有深刻的影响。使用suv,这项研究显示该肽对于真菌模型膜比对哺乳动物模型膜更有选择性。推定序列的第一个精氨酸残基在介导与带负电荷的真菌模型膜的相互作用中起重要作用。支持这一点的是,替换第一个精氨酸导致抗真菌活性降低2-4倍。虽然模拟体内条件是困难的,但是这项研究组合了广泛的实验和计算机模拟研究以推进对抗真菌肽与模型脂质的相互作用的了解,并为有希望抗击抗性、在治疗上重要的新型抗真菌药物的理性设计提供了指导。参考文献crossonc.e.,klyces.d.andbeuermanr.w.(1986)epithelialwoundclosureintherabbitcornea.abiphasicprocess.investophthalmolvissci.27:464-73.koshlukova,s.e.,lloyd,t.l.,araujo,m.w.andedgorton,m.(1999)salivaryhistatin5inducesnon-lyticreleaseofatpfromcandidaalbicansleadingtocelldeath.j.biol.chem.274:8872-18879.makovitzki,a.,avrahami,d.andshai,y.(2006)ultrashortantibacterialandantifungallipopeptides.procnatlacadsciusa.103:15997-6002.oren,z.andshai,y.(1997)selectivelysisofbacteriabutnotmammaliancellsbydiastereomersofmelittin:structure-functionstudy.biochemistry36:1826-1835.veerman,e.c.,valentijn-benz,m.,nazmi,k.,ruissen,a.l.,walgreen-weteringse.,vanmarle,j.,doust,a.b.,van'thof,w.,bolscher,j.g.andamerongen,a.v.(2007)energydepletionprotectscandidaalbicansagainstantimicrobialpeptidesbyrigidifyingitscellmembrane.jbiolchem.282:18831-41.序列表<110>新加坡保健服务集团有限公司(singaporehealthservicespteltd)新加坡科技研究局(agencyforscience,technologyandresearch)<120>作为一类新型抗微生物剂的四分枝肽和类似物及其制备<130>fp6608<150>sg201206715-3<151>2012-09-07<160>28<170>patentin版本3.5<210>1<211>8<212>dna<213>人工的<220><223>初始肽单体<400>1rgrkvvrr8<210>2<211>8<212>dna<213>人工的<220><223>初始肽单体的第1位r替换为a<400>2agrkvvrr8<210>3<211>8<212>dna<213>人工的<220><223>初始肽单体的第2位g替换为a<400>3rarkvvrr8<210>4<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r替换为a<400>4rgakvvrr8<210>5<211>8<212>dna<213>人工的<220><223>初始肽单体的第4位k替换为a<400>5rgravvrr8<210>6<211>8<212>dna<213>人工的<220><223>初始肽单体的第5位v替换为a<400>6rgrkvarr8<210>7<211>8<212>dna<213>人工的<220><223>初始肽单体的第6非v替换为a<400>7rgrkvarr8<210>8<211>8<212>dna<213>人工的<220><223>初始肽单体的第7位a替换为a<400>8rgrkvvar8<210>9<211>8<212>dna<213>人工的<220><223>初始肽单体的第8位r替换为a<400>9rgrkvvra8<210>10<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r和第4位k替换为a<400>10rgaavvrr8<210>11<211>8<212>dna<213>人工的<220><223>初始肽单体的第7位a和第8位r替换为a<400>11rgrkvvaa8<210>12<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r和第5位v替换为a<400>12rgakavrr8<210>13<211>8<212>dna<213>人工的<220><223>初始肽单体的第5位和第6位v替换为a<400>13rgrkaarr8<210>14<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r、第4位k和第5位v替换为a<400>14rgaaavrr8<210>15<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r、第5位和第6位v替换为a<400>15rgakaarr8<210>16<211>8<212>dna<213>人工的<220><223>初始肽单体的第4位k、第5位和第6位v替换为a<400>16rgraaarr8<210>17<211>8<212>dna<213>人工的<220><223>初始肽单体的第3位r、第4位k、第5位和第6位v替换为a<400>17rgaaaarr8<210>18<211>8<212>dna<213>人工的<220><223>初始肽单体的第5位和第6位v、第7位和第8位r替换为a<400>18rgrkaaaa8<210>19<211>8<212>dna<213>人工的<220><223>乱序的初始肽单体<400>19vrgrvrkr8<210>20<211>7<212>dna<213>人工的<220><223>初始肽单体的r删除<400>20grkvvrr7<210>21<211>6<212>dna<213>人工的<220><223>初始肽单体的rg删除<400>21rkvvrr6<210>22<211>5<212>dna<213>人工的<220><223>初始肽单体的rgr删除<400>22kvvrr5<210>23<211>4<212>dna<213>人工的<220><223>初始肽单体的rgrk删除<400>23vvrr4<210>24<211>3<212>dna<213>人工的<220><223>初始肽单体的rgrkv删除<400>24vrr3<210>25<211>2<212>dna<213>人工的<220><223>初始肽单体的rgrkvv删除<400>25rr2<210>26<211>1<212>dna<213>人工的<220><223>初始肽单体的rgrkvvr删除<400>26r1<210>27<211>10<212>dna<213>人工的<220><223>10bp线性单体<400>27rgrkvvrrkk10<210>28<211>19<212>dna<213>人工的<220><223>线性反向二聚体<400>28rgrkvvrrkkkrrvvkrgr19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1