一种海因酶和氨甲酰水解酶产生菌及其制备方法和应用与流程
本发明属于应用微生物技术领域,具体涉及一种同时产海因酶和n-氨甲酰水解酶的新微生物蒙氏假单胞菌cm株,以及该菌株的制备方法和利用该菌株合成d-对羟基苯甘氨酸的应用。
背景技术:
d-对羟基苯甘氨酸是合成β-内酰胺类半合成广谱抗生素(如:青霉素类、头孢菌素类等)的重要中间体,也是合成抗菌和抗病毒药物、人工甜味剂的重要中间体。中国是抗生素类药物的生产和需求大国,而且中国制药行业已把半合成青霉素和半合成头孢菌素作为发展重点,因此,d-对羟基苯甘氨酸新工艺的研究具有重要的现实意义。
d-对羟基苯甘氨酸没有天然产物,必须通过人工合成才能得到。合成方法大致分两类:一类是采用化学法,化学合成法有对甲氧基苯甲醛法、strecker氨基酸合成法以及醛酸-苯酚法3种,其中醛酸-苯酚法工艺成熟,是目前工业上普遍采用的方法,但对环境有一定污染。另一类是采用物酶催化选择性合成d-对羟基苯甘氨酸,该法选择性高,污染小,反应条件温和,是未来发展的方向。
现有技术中,利用微生物发酵产生的酶合成d-对羟基苯甘氨酸的报道较少,且合成效率较低。因此,亟需寻求一种可高效合成d-对羟基苯甘氨酸的菌种。
技术实现要素:
本发明所要解决的技术问题是针对现有技术中合成d-对羟基苯甘氨酸的方法合成效率低的问题,筛选出一种产高活性的海因酶和n-氨甲酰水解酶的菌株,将该菌株制备的海因酶和n-氨甲酰水解酶用于催化d,l-对羟基苯海因合成d-对羟基苯甘氨酸,转化率可达到99%以上,从而提供一种新的绿色、高效、便捷的合成d-对羟基苯甘氨酸的方法。
为此,本发明第一方面提供了一种产生海因酶和/或n-氨甲酰水解酶的菌株,其为蒙氏假单胞菌cm株(pseudomonasmonteiliicm),所述菌株的16srdna具有seqidno:1所示的核苷酸序列。
本发明第二方面提供所述的菌株在海因酶和n-氨甲酰水解酶的制备中的应用。
本发明第三方面提供海因酶或n-氨甲酰水解酶,其由cm株产生。
本发明第四方面提供制备所述的菌株的方法,其步骤包括:
1)从样品中分离纯化菌株,获得同时产生海因酶和n-氨甲酰水解酶的菌株;
2)对同时产生海因酶和n-氨甲酰水解酶的各个菌株进行人工诱变,筛选出具有较高产海因酶和n-氨甲酰水解酶的酶活性的蒙氏假单胞菌cm株(pseudomonasmonteiliicm)。
在本发明的一些实施方式中,步骤1)中所述同时产生海因酶和n-氨甲酰水解酶的菌株为恶臭假单胞菌(pseudomonasputida)、蒙氏假单胞菌(pseudomonasmonteilii)、绿脓假单胞菌(pseudomonasaeruginosa)、虫媒假单胞杆菌(pseudomonasentomophila)及嗜热脂肪芽孢杆菌(bacillusstearothermophilus)。
在本发明的另一些实施方式中,所述恶臭假单胞菌(pseudomonasputida)为s1、s2两株,所述s1株的16srdna具有seqidno:2所示的核苷酸序列,所述s2株的16srdna具有seqidno:3所示的核苷酸序列;所述蒙氏假单胞菌(pseudomonasmonteilii)为s3、s4两株,所述s3株的16srdna具有seqidno:4所示的核苷酸序列,所述s4株的16srdna具有seqidno:5所示的核苷酸序列;所述绿脓假单胞菌(pseudomonasaeruginosa)为s5、s6两株,所述s5株的16srdna具有seqidno:6所示的核苷酸序列,所述s6株的16srdna具有seqidno:7所示的核苷酸序列;所述虫媒假单胞杆菌(pseudomonasentomophila)为s7、s8两株,所述s7株的16srdna具有seqidno:8所示的核苷酸序列,所述s8株的16srdna具有seqidno:9所示的核苷酸序列;所述嗜热脂肪芽孢杆菌(bacillusstearothermophilus)为s9、s10两株,所述s9株的16srdna具有seqidno:10所示的核苷酸序列,所述s10株的16srdna具有seqidno:11所示的核苷酸序列。
在本发明的一些实施方式中,所述样品为能够分离纯化出上述s1-s10菌株的样品。
在本发明的一些优选的实施方式中,所述样品为海泥。
在本发明的一些实施方式中,步骤2)中对同时产生海因酶和n-氨甲酰水解酶的各个菌株进行人工诱变的步骤:
a)分别对s1-s3菌株进行单一人工诱变,检测各诱变后菌株产海因酶和n-氨甲酰水解酶的酶活性,获得具有较高产海因酶和n-氨甲酰水解酶的酶活性的诱变后的菌株a1;
b)分别对s4-s6菌株进行单一人工诱变,检测各诱变后菌株产海因酶和n-氨甲酰水解酶的酶活性,获得具有较高产海因酶和n-氨甲酰水解酶的酶活性的诱变后的菌株a2;
c)分别对s7-s10菌株进行单一人工诱变,检测各诱变后菌株产海因酶和n-氨甲酰水解酶的酶活性,获得具有较高产海因酶和n-氨甲酰水解酶的酶活性的诱变后的菌株a3;
d)分别对菌株a1、a2及a3进行复合人工诱变,检测各诱变后菌株产海因酶和n-氨甲酰水解酶的酶活性,获得具有较高产海因酶和n-氨甲酰水解酶的酶活性的诱变后的蒙氏假单胞菌cm株(pseudomonasmonteiliicm)。
在本发明的一些优选的实施方式中,所述单一人工诱变为紫外照射突变、激光诱变、电子束诱变、离子注射诱变和化学诱变剂诱变中的一种。
在本发明的另一些优选的实施方式中,所述单一人工诱变为紫外照射突变、激光诱变和离子注射诱变中的一种。
在本发明的一些实施方式中,所述复合人工诱变为紫外照射突变、激光诱变、电子束诱变、离子注射诱变和化学诱变剂诱变中的至少两种。
在本发明的另一些实施方式中,所述复合人工诱变为紫外照射突变、激光诱变和离子注射诱变中的至少两种。
在本发明的一些优选的实施方式中,所述复合人工诱变为紫外照射突变、激光诱变和离子注射诱变。
本发明第五方面提供一种由本发明提供的菌株或本发明的方法制备的菌株经发酵培养获得的发酵培养物。
本发明第六方面提供一种由本发明提供的菌株或本发明的方法制备的菌株制备海因酶和n-氨甲酰水解酶的方法,包括从所述菌株发酵培养产生的发酵培养物中提取粗酶提取液的步骤。
本发明第七方面提供本发明的菌株或本发明的方法制备的菌株在合成d-对羟基苯甘氨酸中的应用。
在本发明的一些实施方式中,所述应用包括步骤:将所述菌株发酵培养产生的发酵培养物中提取的粗酶提取液与d,l-对羟基苯海因混合,发生酶促反应,获得d-对羟基苯甘氨酸。
在本发明的另一些实施方式中,所述粗酶提取液中的海因酶和n-氨甲酰水解酶的酶活力均不低于0.3u/ml。
在本发明的一些优选的实施方式中,在酶促反应体系中,反应底物d,l-对羟基苯海因浓度为0.3-2m,粗酶提取液加入量为反应底物总质量的1-12%。
在本发明的一些实施方式中,所述反应底物d,l-对羟基苯海因溶解于无氧水中。
在本发明的一些优选的实施方式中,所述酶促反应条件:ph为6.2-8.6,温度为30-50℃。
在本发明的一些实施方式中,所述酶促反应的最适ph值范围为7.0-8.5。
在本发明的一些优选的实施方式中,所述酶促反应的最适ph值范围为7.2-8.0。
在本发明的一些优选的实施方式中,所述酶促反应的最适ph值范围为7.3-7.6。
在本发明的一些更为优选的实施方式中,所述酶促反应的最适ph值为7.4。
在本发明的一些实施方式中,所述酶促反应的最适温度范围为35-47℃。
在本发明的一些优选的实施方式中,所述酶促反应的最适温度范围为42-47℃。
在本发明的一些优选的实施方式中,所述酶促反应的最适温度范围为43-46℃。
在本发明的一些更为优选的实施方式中,所述酶促反应的最适温度为45℃。
在本发明的一些实施方式中,所述酶促反应的最适ph值范围为7.0-8.5,所述酶促反应的最适温度范围为35-47℃。
在本发明的一些优选的实施方式中,所述酶促反应的最适ph值范围为7.2-8.0,所述酶促反应的最适温度范围为42-47℃。
在本发明的一些优选的实施方式中,所述酶促反应的最适ph值范围为7.3-7.6,所述酶促反应的最适温度范围为43-46℃。
在本发明的一些更为优选的实施方式中,所述酶促反应的最适ph值为7.4,所述酶促反应的最适温度为45℃。
d-对羟基苯甘氨酸是合成β-内酰胺类半合成广谱抗生素的重要中间体,也是合成抗菌和抗病毒药物、人工甜味剂的重要中间体。然而,d-对羟基苯甘氨酸没有天然产物,必须通过人工合成才能得到。现有的d-对羟基苯甘氨酸合成方法对环境不友好且合成效率较低,且直接购买酶制品成本较高。
本发明的发明人创造性的发现,从海泥样品中分离纯化出10株产海因酶和n-氨甲酰水解酶的菌株,对其进行人工诱变,从而筛选出一种产高活性的海因酶和n-氨甲酰水解酶的菌株,即蒙氏假单胞菌cm株。将该菌制备的海因酶和n-氨甲酰水解酶可用于催化d,l-对羟基苯海因合成d-对羟基苯甘氨酸,具体的,底物d,l-对羟基苯海因在海因酶的作用下生成中间产物n-氨甲酰对羟基苯甘氨酸,n-氨甲酰对羟基苯甘氨酸在n-氨甲酰水解酶(n-氨甲酰-d-氨基酸酰胺水解酶)的作用下生成d-对羟基苯甘氨酸,转化率可达到99%以上。从而提供一种新的绿色、高效、便捷的合成d-对羟基苯甘氨酸的方法,同时降低了成本,为d-对羟基苯甘氨酸的合成路线提供了一种新思路。
附图说明
下面将结合附图来说明本发明。
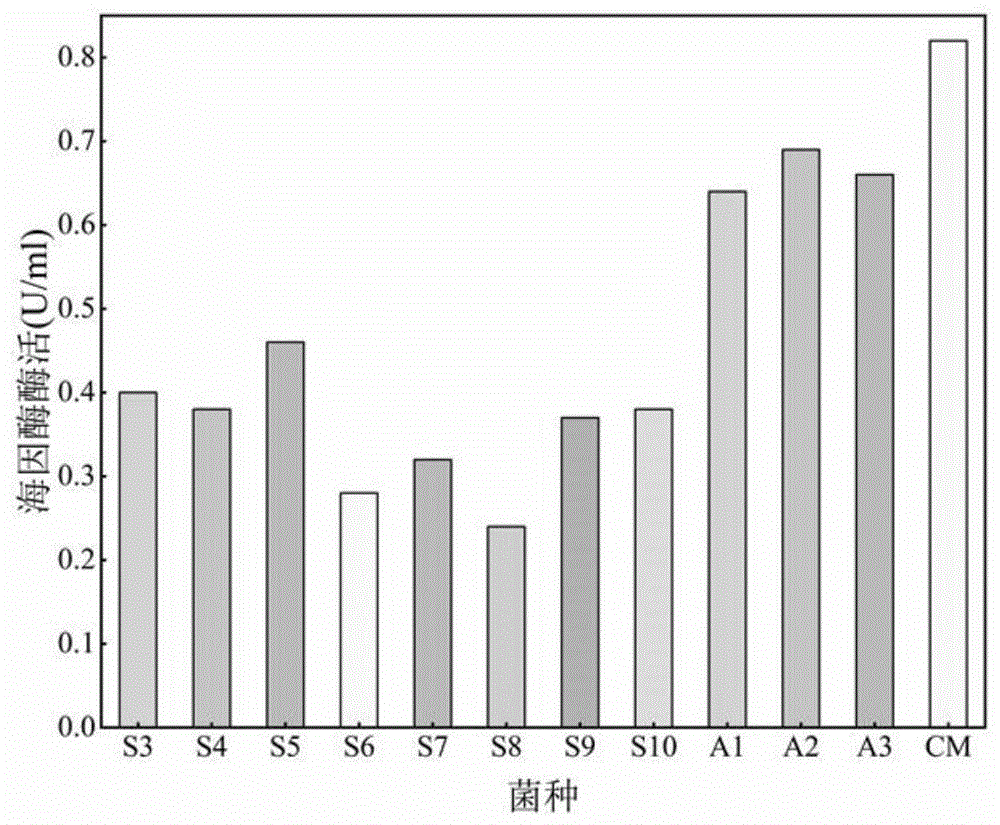
图1示出本发明中s3-s10、a1-a3及cm菌株产生的海因酶的酶活性测定结果;
图2示出本发明中s1-s10、a1-a3及cm菌株产生的n-氨甲酰水解酶的酶活性测定结果;
图3示出本发明中cm菌株产生的海因酶和n-氨甲酰水解酶合成d-对羟基苯甘氨酸的最适ph值范围;
图4示出ph值对海因酶和n-氨甲酰水解酶合成d-对羟基苯甘氨酸的影响;
图5示出本发明中cm菌株产生的海因酶和n-氨甲酰水解酶合成d-对羟基苯甘氨酸的最适温度范围;
图6示出温度对海因酶和n-氨甲酰水解酶合成d-对羟基苯甘氨酸的影响;
图7示出海因酶和n-氨甲酰水解酶以d,l-对羟基苯海因为底物生成d-对羟基苯甘氨酸的实时监测转化率折线图;
上述附图3-7中的d-hpg为对羟基苯甘氨酸;c-hpg为n-氨甲酰对羟基苯甘氨酸;d,l-hph为d,l-对羟基苯海因。
具体实施方式
为使本发明容易理解,下面将详细说明本发明。
在本发明的一些具体的实施例中,本发明中提供的产高活性的海因酶和n-氨甲酰水解酶的蒙氏假单胞菌cm株的筛选具体过程如下:
1.获取s1-s10菌株
1)采集海泥样品,立即放置于无菌封口袋,于4℃冰箱保存;
2)将海泥样品置于室温风干3周后,将0.5g泥样溶于4ml无菌水中,55℃加热6min,1000rpm离心10min,取上清;
3)分别吸取200μl上清,稀释涂布于1-5号分离培养基,28℃培养7-14天备用。从分离平板上挑取单菌落,随后在6号选择培养基上划线接种,28℃培养7天,然后从6号选择培养基上挑取单菌落在isp2平板上划线接种,28℃培养7天,重复该步骤3-5次,对菌株进行纯化。刮取所得纯培养物的孢子用30%甘油作保护剂冻存于-80℃冰箱作长期保藏。
4)将分离得到的单菌落接种于6号选择培养基上,28℃培养7天,然后覆盖一薄层45℃左右的含有d-对羟基苯海因及1.5%琼脂的tris-hcl作为上层,待凝固后置于28℃条件下培养4天,在菌落上滴加10%对二甲氨基苯甲醛(6mol/lhcl配制),5-10s内呈特异的黄色者为阳性菌株,重复三次。
5)将得到的阳性菌株接种于6号选择培养基斜面上,28℃培养21h。配制含底物d-对羟基苯海因的0.9%tris-hcl缓冲液(ph9.0)。在96孔板的微孔中加入包含底物缓冲液100μl,同时在另一孔内加入不含底物的ph9.0tris-hcl缓冲液作为对照。从斜面上各挑少许菌体分别加入两孔内,混匀,37℃反应30min,然后在各孔中加入10%对二甲氨基苯甲醛15μl,5-10s出现特异黄色而对照无色者为阳性菌株。
6)将海因酶阳性菌株接种于6号选择培养基斜面上,28℃培养21h后用生理盐水5ml洗下菌体,3800r/min离心30min,去上清,生理盐水洗涤2次,收集菌体,加入0.9%底物液(ph8.0磷酸盐缓冲液)500μl,37℃振荡反应0.5h,离心取上清200μl,加茚三酮丙酮溶液50μl、0.2mol/lhcl6.5μl,沸水加热3min,呈紫色者为n-氨甲酰水解酶阳性菌株。
经过上述筛选步骤,获得产海因酶和n-氨甲酰水解酶的10株菌株,根据16srdna分子生物学鉴定及同源性比对,发现s1菌株和s2菌株为恶臭假单胞菌(pseudomonasputida),s3菌株和s4菌株为蒙氏假单胞菌(pseudomonasmonteilii),s5菌株和s6菌株为绿脓假单胞菌(pseudomonasaeruginosa),s7菌株和s8菌株为虫媒假单胞杆菌(pseudomonasentomophila),s9菌株和s10菌株为嗜热脂肪芽孢杆菌(bacillusstearothermophilus)。
上述步骤3)对样品中的菌进行富集、分离、纯化,并通过1-6号筛选培养基的筛选,获得产海因酶的菌株。为了防止获得假阳性结果,本申请的发明人又通过步骤4)和5)进行多次筛选鉴定。同时,对获得的产海因酶阳性菌株进行n-氨甲酰水解酶的鉴定,从而获得能够同时产生海因酶和n-氨甲酰水解酶的菌株。
所用培养基的配方如下:
1号分离培养基
2号分离培养基
3号分离培养基
4号分离培养基
5号分离培养基
6号选择培养基
isp2培养基
基本培养基
完全培养液
2.蒙氏假单胞菌cm株的获取
1)在28℃条件下,先将菌株s1-s10接种于基本培养基中活化,让其生长到对数期,然后扩大培养。分别随机选取单菌落接种于含有5ml无菌水的小指管(直径0.6cm)中,制成菌悬液。
2)分别将s1-s3菌株置于20w紫外灯下距离30cm照射2min,将照射后的菌悬液倒入液体完全培养液中,其中,菌悬液与完全培养液的体积比为1:20,在28℃避光培养12h,然后分别取0.1ml,涂布在基本培养基平板(直径为9cm)上,分别对紫外照射突变后的三种菌株进行细胞培养,后进行粗酶提取以及酶活检测,比较三种菌株产海因酶和n-氨甲酰水解酶的酶活性,获得紫外照射突变后的三种菌株中酶活性最高的菌株,即菌株a1;
3)在无菌条件下用he-ne激光(波长632.8nm,输出功率40mw)对s4-s6菌液分别照射13min,将照射后的菌悬液倒入液体完全培养液中,其中,菌悬液与完全培养液的体积比为1:20,在28℃避光培养12h,然后分别取0.1ml,涂布在基本培养基平板(直径为9cm)上,分别对激光诱变后的三种菌株进行细胞培养,后进行粗酶提取以及酶活检测,比较三种菌株产海因酶和n-氨甲酰水解酶的酶活性,获得激光诱变后的三种菌株中酶活性最高的菌株,即菌株a2;
4)将s7-s10采用离子注射利福霉素进行诱变,离子能量为20-30kev,束流为20ma,采用脉冲注入方式,注入剂量为1×1015ions/cm2,然后分别取0.1ml,涂布在基本培养基平板(直径为9cm)上,分别对离子注射诱变后的四种菌株进行细胞培养,后进行粗酶提取以及酶活检测,比较三种菌株产海因酶和n-氨甲酰水解酶的酶活性,获得离子注射诱变后的四种菌株中酶活性最高的菌株,即菌株a3;
5)将a1-a3三种菌株依次进行上述步骤2)-4)中的紫外照射突变、激光诱变和离子注射诱变,分别将诱变后的三种菌液涂布于基本培养基平板(直径为9cm)上,分别对复合人工诱变后的三种菌株进行细胞培养,后进行粗酶提取以及酶活检测,比较三种菌株产海因酶和n-氨甲酰水解酶的酶活性,获得复合人工诱变后的三种菌株中具有最高海因酶和n-氨甲酰水解酶的酶活性的菌株,即蒙氏假单胞菌cm株。
蒙氏假单胞菌cm株的获取过程中,各菌株产生的海因酶的酶活性及n-氨甲酰水解酶的酶活性测定结果如附图1和2所示。
利用筛选出的蒙氏假单胞菌cm株以d,l-对羟基苯海因为底物合成d-对羟基苯甘氨酸中的步骤:
3.粗酶提取以及酶活检测
对得到的阳性菌株(蒙氏假单胞菌cm株)进行细胞培养,粗酶提取以及酶活检测:细胞培养在基本培养基上30℃、ph7培养24h,得到的发酵液10000rpm,离心30min(sorvallrc5c),浓缩细胞悬液至100g/kg,将浓缩的细胞在超声作用下破坏。10000rpm,4℃,离心30min,将细胞碎片从细胞匀浆中分离出来,将含有两种酶的上清液保存在-80℃,直至所需,将得到的多酶提取液进行海因酶和n-氨甲酰-d-氨基酸酰胺水解酶酶活测定。
4.合成d-对羟基苯甘氨酸
1)在酶催化反反应釜中,投入d,l-对羟基苯海因和溶剂,反应底物d,l-对羟基苯海因浓度为0.3-2m,其中溶剂选用无氧水;
2)加入酶活不低于0.3u/ml的酶制剂,加入量为反应液总质量的1-12%,在ph为6.2-8.6、温度为30-44℃条件下,开始搅拌反应;所述的酶制剂为由菌株cm的发酵培养物中提取的含有海因酶和n-氨甲酰胺水解酶制剂的酶提取液;
3)取样并用高压液相色谱检测反应情况,当反应进行6-12h后,则有d-对羟基苯甘氨酸晶体开始析出,待反应体系中n-氦甲酰对羟基苯甘氨酸浓度降至0.25%以下时,反应结束;
4)反应结束后,静置分两部分处理:(1)抽取上清夜,经过陶瓷膜过滤,未穿滤部分做废液处理,滤过滤液转入中和釜,加入盐酸调节ph,加入活性炭,搅拌脱色,经过脱碳设备,滤液转入双效蒸发仪,蒸去大部分水,残留物转入结晶釜,降温结晶,离心,离心滤液,经脱盐设备,滤液并入下一批双效蒸发。滤饼烘干,即为目标物d-对羟基苯甘氨酸,(2)下层混悬项,转入成盐釜,加碱调节ph,搅拌溶解完全,加入活性炭,搅拌脱色,经过脱碳设备,滤液转入中和釜,加入酸调节ph,降温结晶,离心,离心滤液,经脱盐设备,滤液并入下一批双效蒸发。滤饼烘干,即为目标物d-对羟基苯甘氨酸。
实施例1
酶活的测定
①以d,l-对羟基苯海因为底物的海因酶的活性的定义:1个单位海因酶的活性定义为在ph8.0,45℃,每分钟还原1μmold,l-对羟基苯海因所需的酶量。
②以n-氨甲酰对羟基苯甘氨酸为底物的n-氨甲酰水解酶的活性的定义:1个单位海因酶的活性定义为在ph8.0,45℃,每分钟还原1μmoln-氨甲酰对羟基苯甘氨酸所需的酶量。
测定方法如下:
通过分析标准反应中形成的d-对羟基苯甘氨酸和n-氨甲酰对羟基苯甘氨酸的含量,测定了可溶性多酶提取液中海因酶和n-氨甲酰水解酶活性。
测定海因酶活性的标准反应体系:d,l-对羟基苯海因(10g/l),0.1mph8.0的na2po4缓冲液,酶,45℃,反应60min后,取反应混合液样品,用0.1mhcl离心1:50稀释,停止酶促反应。采用hplc进行分析。
测定n-氨甲酰水解酶活性的标准反应体系:n-氨甲酰对羟基苯甘氨酸(6g/l),0.1mph8.0的na2po4缓冲液,酶,45℃,反应60min后,取反应混合液样品,用0.1mhcl离心1:50稀释,停止酶促反应。采用hplc进行分析。
实施例2
多酶提取液酶学性质的研究
酶促反应的最适ph和ph稳定性
分别取用不同ph的0.1m的缓冲液(ph范围7.0-10.4,ph7.0-8.0(0.1mna2po4),ph8.0-9.0(0.1mtris-hcl),ph9.0-10.4(0.1mk2co3)),反应体系:d,l-对羟基苯海因(10g/l),稀释酶液,设置三个平行,测定45℃下各ph值条件下生成d-对羟基苯甘氨酸和n-氨甲酰对羟基苯甘氨酸的能力。以生成d-对羟基苯甘氨酸最高者定为100%,以相对产率对ph作图。
将稀释酶液在不同ph的缓冲液(ph范围7.0-10.4)中45℃放置2h,各设三个平行,按上述标准方法测定不同ph下保存的酶生成d-对羟基苯甘氨酸的能力和n-氨甲酰对羟基苯甘氨酸,以未经处理的酶生成d-对羟基苯甘氨酸最高者定为100%,以相对产率对ph作图,结果如附图3,4所示酶的最适反应ph为7.4,在ph7.0-8.5的范围内活性比较稳定。
酶促反应的最适温度和温度稳定性
分别测定ph7.4下不同温度条件下生成d-对羟基苯甘氨酸和n-氨甲酰对羟基苯甘氨酸的能力,每个温度设三个平行,以生成d-对羟基苯甘氨酸最高者定为100%,以相对产率对温度作图。
将酶液分别放入不同温度的水浴中保温2h,取出酶液后置于冰上,设置三个平行,同时用未经处理的酶作正对照,按照上述标准方法测定不同温度下样品的酶活力。以未处理酶液的酶活力为100%,以相对产率对温度作图,如图5,6所示,该酶最适反应温度为45℃,升高或降低温度都会导致产率减少。该酶在30-50℃时活性较稳定。
实施例3
在300l的酶催化反应釜中,加入无氧水210kg,然后投入d,l-对羟基苯海因32-38kg,在65rpm转速下搅拌,加入湿的酶活为0.62u/ml的酶制剂约15kg,加热,控制温度为32-44℃,间隔3h取样用高压液相色谱检测反映情况,当反应进行6-8h后,则有d-对羟基苯甘氨酸晶体析出,具体的生成d-对羟基苯甘氨酸的实时监测转化率结果如附图7所示。待反应体系中n-氨甲酰对羟基苯甘氨酸0.25%以下时,反应基本结束,转化率在99%以上。粗晶和溶液部分提炼后得到产品,合计收率在85%。
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
- 还没有人留言评论。精彩留言会获得点赞!