FHY3蛋白在抑制叶片衰老以及提高作物产量中的应用的制作方法
本发明涉及fhy3蛋白的新用途,尤其涉及fhy3蛋白在抑制叶片衰老以及提高作物产量中的应用,属于fhy3蛋白的新用途领域。
背景技术:
衰老是普遍存在于生物界的生理现象,是生物的某些器官或整个个体生理功能渐渐衰退直至最终死亡的过程。叶片是高等植物进行光合作用的器官,也是作物产量潜力的重要来源。一旦叶片开始衰老,叶片对整个植物体的贡献就开始下降(lietal.,2018)。叶片衰老的过程也是一个程序化的物质回收、循环利用的过程,营养成分从衰老叶片运输到处于旺盛生长中的叶片及种子(ganandamasino,1997;limetal.,2007)。叶绿体中的蛋白质约占整个叶片总蛋白质的70%,是叶片衰老过程中第一个被降解的细胞器(quirinoetal.,2000)。
叶片衰老是一个复杂的过程,受植物体内和体外信号调节。内部信号主要包括激素、碳源水平等,其中促进叶片衰老的物质包括乙烯、茉莉酸、水杨酸、脱落酸、油菜素内酯、活性氧、糖类等;延缓叶片衰老的物质主要包括细胞分裂素、生长素、赤霉素、一氧化氮等。外部因素主要包括温度、光照、水分、病虫害侵染、遮荫条件等等(limetal.,2007;alietal.,2018;kimetal.,2018)。这些因子最后整合到发育相关并且叶龄依赖的调控过程,通过调节衰老相关基因表达从而启动和执行了衰老程序,最终导致植物细胞死亡。在过去的十几年中,通过大量的遗传和基因组研究,人们已经在叶片衰老的分子机制上取得了重大进展,发现了很多转录因子调控衰老相关基因(senescence-associatedgenes,sags)的表达,进而调控衰老进程(guoandgan,2006;kimetal.,2009;zhangandgan,2012)。
大量研究已表明乙烯在调控叶片衰老中扮演着重要的角色(lietal.,2013;liandguo,2018;lietal.,2018)。ein3可以直接结合nac2/ore1、atnap和mir164的启动子,促进nac2/ore1(mir164的靶基因)、atnap的表达,抑制mir164的表达,说明ein3通过激活nac2/ore1和atnap的表达来加速衰老进程(lietal.,2013;kimetal.,2014)。遗传分析表明过表达mir164或敲除ore1/nac2能够解除ein3对衰老的促进作用(lietal.,2013;kimetal.,2014),说明ore1/nac2在乙烯和ein3诱导的叶片衰老过程中发挥着关键作用。
fhy3/far1(far-redelongatedhypocotyl3/far-redimpairedresponse1)是光敏色素a信号转导途径的两个关键的正向调控因子,其功能缺失导致植物对远红光的反应大大下降(wanganddeng,2002),但是fhy3/far1是否具有抑制叶片衰老的功能尚不清楚。
研究fhy3蛋白是否具有抑制叶片衰老的功能并进一步研究其抑制叶片衰老的分子机制不仅具有重要的理论意义,同时也可为通过控制叶片衰老从而提高农作物的产量和品质性状提供重要理论依据。
技术实现要素:
本发明的主要目的是提供fhy3蛋白在抑制叶片衰老的一种新用途;
本发明的上述目的是通过以下技术方案来实现的:
本发明发现fhy3能够与乙烯信号通路中的核心转录因子ein3和光信号通路中的负调因子pif5互作并抑制ein3和pif5对下游衰老关键基因ore1启动子的结合,从而抑制叶片衰老,并且,随着植物叶片年龄增加或黑暗处理时间的延长,叶片中的fhy3蛋白含量会逐渐减少,对ein3和pif5的抑制作用减弱,导致叶片衰老;由此,本发明最终确证了fhy3蛋白具有抑制叶片衰老的功能。
进一步,本发明提供了一种抑制抑制叶片衰老的方法,包括:将fhy3蛋白编码基因在植物中进行过表达得到转基因植物;譬如:将fhy3蛋白编码基因可操作的与表达调控元件相连接,得到在植物中表达该编码基因的重组植物表达载体;将所述重组植物表达载体转化目标植物,使fhy3蛋白编码基因在植物中进行过表达。
在农业生产上,叶片衰老导致作物光合作用下降进而影响了农作物产量、采后储存以及引起营养流失等。研究发现,过去几十年中,一些主要农作物(如玉米、小麦)产量潜力的提升在很大程度上得益于叶片衰老进程的延缓或叶片功能期的延长(martinetal.,2005;rampinoetal.,2011;lietal.,2012),表明长期以来育种家把延缓叶片衰老进程作为作物产量改良的育种目标之一。
因此,本发明提供了一种提高农作物产量或提高采后储存品质的方法,包括:将fhy3蛋白编码基因在农作物中进行过表达得到转基因农作物;譬如:将fhy3蛋白编码基因可操作的与表达调控元件相连接,得到在作物中表达该编码基因的重组植物表达载体;将所述重组植物表达载体转化目标农作物,使fhy3蛋白编码基因在农作物中进行过表达或超表达。
对于蔬菜而言,叶片衰老进程不仅影响到产量和品质要素的形成,而且会直接地影响到采收产量、采后品质和货架寿命。延缓叶片衰老进程中叶绿素的降解不仅能够显著延缓植物叶片中蛋白质和相关品质指标的劣变,而且还能够显著改变观赏植物的叶片景观(tripathiandtuteja,2007)。对于花卉植物而言,叶片和花器官的衰老进程直接影响到其观赏价值和销售价格。
由此,本发明进一步提供了一种提高蔬菜的采收产量和品质或延长蔬菜货架寿命的方法,包括:将fhy3蛋白编码基因在蔬菜中进行过表达得到转基因蔬菜;譬如:将fhy3蛋白编码基因可操作的与表达调控元件相连接,得到在蔬菜中表达该编码基因的重组植物表达载体;将所述重组植物表达载体转化目标蔬菜,使fhy3蛋白编码基因在该蔬菜中进行过表达或超表达。
本发明还提供了一种提高花卉植物观赏价值的方法,包括:将fhy3蛋白编码基因在花卉中进行过表达得到转基因花卉;譬如:将fhy3蛋白编码基因可操作的与表达调控元件相连接,得到能够在花卉中表达该编码基因的重组植物表达载体;将所述重组植物表达载体转化目标花卉,使fhy3蛋白编码基因在该花卉中进行过表达或超表达。
本发明公开了含有所述fhy3蛋白编码基因的重组表达载体以及含有所述重组表达载体的重组宿主细胞;包括,将所述fhy3蛋白编码基因可操作的与表达调控元件相连接得到重组植物表达载体;该重组植物表达载体可以由5′端非编码区,fhy3蛋白编码基因和3′非编码区组成;其中,所述的5′端非编码区可以包括启动子序列、增强子序列或/和翻译增强序列;所述的启动子可以是组成性启动子、诱导型启动子、组织或器官特异性启动子;所述的3′非编码区可以包含终止子序列、mrna切割序列等。合适的终止子序列可取自根癌农杆菌的ti-质粒,例如章鱼碱合成酶和胭脂碱合成酶终止区。
所述重组植物表达载体还可含有用于选择转化细胞的选择性标记基因,用于选择经转化的细胞或组织。所述标记基因包括:编码抗生素抗性的基因以及赋予除草化合物抗性的基因等。此外,所述的标记基因还包括表型标记,例如β-半乳糖苷酶和荧光蛋白等。
转化方案以及将所述多核苷酸或多肽引入植物的方案可视用于转化的植物(单子叶植物或双子叶植物)或植物细胞的类型而变化。将所述多核苷酸引入植物细胞的合适方法包括:显微注射、电穿孔、农杆菌介导的转化、直接基因转移以及高速弹道轰击等。在特定的实施方案中,可利用多种瞬时转化法将fhy3/far1蛋白编码基因提供给植物。利用常规方法可使已转化的细胞再生稳定转化植株(mccormicketal.plantcellreports.1986.5:81-84)。
所述的目标植物包括但不限于:单子叶植物或双子叶植物。更优选的,所述的目标植物包括农作物、蔬菜、观赏植物或果树等,例如,可以是玉米、水稻、高粱、小麦、大豆、马铃薯、大麦、番茄、菜豆、花生、甘蔗、各种花卉等。
本发明中所述的fhy3蛋白的氨基酸序列为seqidno.1所示。另外,本领域技术人员还可以将编码seqidno.1所示氨基酸序列的核苷酸进行优化以增强在目标植物中的表达效率。
本发明整体技术方案的详述
本发明首先构建了fhy3far1双突变体,通过观察发现,在自然生长条件下随着叶片年龄增加,fhy3far1双突变体表现出早衰的表型,叶片中叶绿素含量下降速度显著快于野生型,并且衰老相关基因的表达也显著上调;此外,在黑暗或遮荫条件下,fhy3far1的突变体叶片同样表现出早衰的表型,根据这些试验结果表明fhy3/far1很可能参与调控叶片衰老过程。
根据上述试验结果可见ein3与fhy3直接互作并且可能共同调控了一些衰老相关基因的表达,本发明人由此推测fhy3/far1很可能是通过ein3来调控叶片衰老的;据此,本发明进一步将fhy3far1双突变体与ein3突变体杂交,获得ein3fhy3far1三重突变体,并对其进行表型分析。分析结果发现ein3fhy3far1三重突变体的表型类似于ein3eil1,而不像fhy3far1一样早衰,说明fhy3/far1对衰老的调控作用是依赖于ein3/eil1的。进一步,本发明构建了ore1fhy3far1和wrky75fhy3far1三重突变体,表型研究、叶绿素含量测定及对下游衰老相关基因表达的检测结果表明ore1能够回复fhy3far1突变体的早衰表型,而wrky75不能,说明ore1是fhy3调控衰老过程的主要下游基因。
为了研究fhy3对ein3的调控机理,本发明采用了双荧光报告系统(dlr)、酵母单杂交(y1h)、凝胶电泳迁移实验(emsa)以及染色质免疫共沉淀(chip)等方法,在烟草叶片的dlr实验中,ein3可以激活ore1启动子的转录,单独表达fhy3并没有显著效果,而同时表达ein3和fhy3蛋白时,ein3的转录激活效应被抑制,说明fhy3抑制了ein3对ore1启动子的转录激活。在酵母单杂交及emsa实验中,ein3可以直接结合ore1的启动子,而加入fhy3蛋白后结合显著变弱(图4c,d)。chip实验中,ein3-ha/col-0的植株中,ha抗体能够富集ore1启动子序列,而在fhy3far1突变体中,ore1启动子富集增加,进一步说明fhy3抑制了ein3对ore1启动子的结合。
本发明所涉及到的术语定义
除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。
术语“多核苷酸”或“核苷酸”意指单股或双股形式的脱氧核糖核苷酸、脱氧核糖核苷、核糖核苷或核糖核苷酸及其聚合物。除非特定限制,否则所述术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有类似于参考核酸的结合特性并以类似于天然产生的核苷酸的方式进行代谢。除非另外特定限制,否则所述术语也意指寡核苷酸类似物,其包括pna(肽核酸)、在反义技术中所用的dna类似物(硫代磷酸酯、磷酰胺酸酯等)。除非另外指定,否则特定核酸序列也隐含地涵盖其保守修饰的变异体(包括(但不限于)简并密码子取代)和互补序列以及明确指定的序列。特定而言,可通过产生其中一个或一个以上所选(或所有)密码子的第3位经混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代(batzer等人,nucleicacidres.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);和cassol等人,(1992);rossolini等人,molcell.probes8:91-98(1994))。
术语“多肽”、“肽”和“蛋白”在本文中互换使用以意指氨基酸残基的聚合物。即,针对多肽的描述同样适用于描述肽和描述蛋白,且反之亦然。所述术语适用于天然产生氨基酸聚合物以及其中一个或一个以上氨基酸残基为非天然编码氨基酸的氨基酸聚合物。如本文中所使用,所述术语涵盖任何长度的氨基酸链,其包括全长蛋白(即抗原),其中氨基酸残基经由共价肽键连接。
术语“重组宿主细胞株”或“宿主细胞”意指包含本发明多核苷酸的细胞,而不管使用何种方法进行插入以产生重组宿主细胞,例如直接摄取、转导、f配对或所属领域中已知的其它方法。外源性多核苷酸可保持为例如质粒的非整合载体或者可整合入宿主基因组中。宿主细胞可为原核细胞或真核细胞,宿主细胞还可为单子叶或双子叶植物细胞。
术语“可操作的连接”指两个或更多个元件之间功能性的连接,可操作的连接的元件可为邻接或非邻接的。
术语“重组植物表达载体”意指一种或多种用于实现植物转化的dna载体;本领域中这些载体常被称为二元载体。二元载体连同具有辅助质粒的载体是大多常用于土壤杆菌介导转化的。二元载体通常包括:t-dna转移所需要的顺式作用序列、经工程化处理以便能够在植物细胞中表达的选择标记物,待转录的异源性dna序列等。
术语“转化”指将异源性dna序列引入到宿主细胞或有机体的方法。
术语“表达”指内源性基因或转基因在植物细胞中的转录和/或翻译。
附图说明
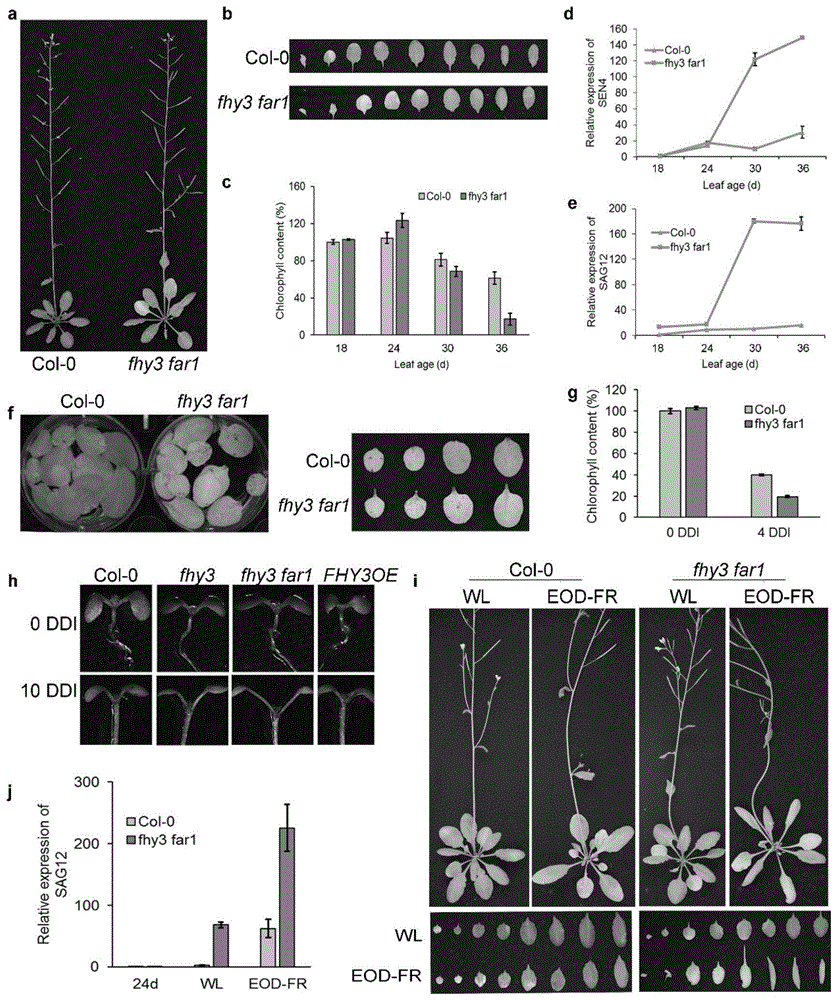
图1fhy3far1突变体早衰;a、b.温室生长6周的拟南芥,fhy3far1叶片已经大部分变黄,而野生型只有最老的2片叶子变黄;c.叶片年龄18、24、30、36天时叶绿素含量;d、e.衰老关键基因的表达;f.温室生长三周的拟南芥离体叶片黑暗处理4天后的表型;g.f中第四片叶子中的叶绿素含量;h.在ms板上生长7天后暗处理10天的表型;i.24天的拟南芥,温室正常光照下(wl)以及模拟避荫反应条件(end-of-day)处理2周后的表型;j.i中衰老关键基因sag12的表达。
图2fhy3抑制衰老的功能依赖于ein3;a.温室生长三周的拟南芥离体叶片黑暗处理4天后的表型;b.a中第四片叶子中的叶绿素含量;c.在ms板上生长7天后暗处理10天的表型。
图3fhy3/far1通过ore1调控衰老;a.温室生长三周的拟南芥离体叶片黑暗处理4天后的表型;b.a中第四片叶子中的叶绿素含量;c.在ms板上生长7天后暗处理10天的表型。
图4fhy3/far1抑制ein3结合ore1启动子;a.双荧光报告系统(dlr)检测ore1启动子的转录水平;b.a中luc与ren的比值统计;c.酵母单杂交证明fhy3抑制ein3对ore1启动子的结合;d.凝胶电泳迁移实验(emsa)证明fhy3抑制ein3对ore1启动子的结合;e.染色质免疫共沉淀(chip)证明在植物体内fhy3抑制ein3对ore1启动子的结合。
图5黑暗处理使fhy3蛋白水平降低。
图6随着叶片年龄的增加,fhy3蛋白水平降低。
具体实施方式
以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
试验例1fhy3far1双突变体的构建以及表型分析试验
1、试验方法
fhy3突变体(salk_002711)和far1突变体(salk_031652)购买于美国abrc突变体库(https://abrc.osu.edu/),fhy3far1双突变体由fhy3和far1单突变体杂交获得。
fhy3far1突变体(salk_002711,salk_031652)长在正常长日照条件下生长六周,观察叶片衰老表型;fhy3far1突变体在长日照条件下生长4周后,取离体叶片黑暗处理,观察黑暗诱导的衰老表型;fhy3far1突变体在正常长日照生长24天后,模拟遮荫条件(eod-fr)处理2周,观察衰老表型。
2、试验结果
在自然生长条件下随着叶片年龄增加,fhy3far1双突变体表现出早衰的表型,叶片中叶绿素含量下降速度显著快于野生型,并且衰老相关基因的表达也显著上调(图1a-e),说明fhy3/far1很可能参与调控叶片衰老过程。在黑暗或遮荫条件下,fhy3far1的突变体叶片同样表现出早衰的表型(图1f-j)。
试验例2ein3fhy3far1三重突变体的构建及表型分析试验
1、试验方法
ein3与fhy3直接互作并且可能共同调控了一些衰老相关基因的表达,由此推测fhy3/far1很可能是通过ein3来调控叶片衰老的;基于上述分析,本发明将fhy3far1双突变体与ein3突变体(chaoetal.,1997,由南方科技大学郭红卫教授实验室惠赠)杂交,获得ein3fhy3far1三重突变体并对其进行表型分析。
2、试验结果
结果发现ein3fhy3far1三重突变体的表型类似于ein3eil1,而不像fhy3far1一样早衰(图2),说明fhy3/far1对衰老的调控作用是依赖于ein3/eil1的。
试验例3ore1fhy3far1和wrky75fhy3far1三重突变体的构建及表型分析试验
1、试验方法
本试验构建了ore1fhy3far1和wrky75fhy3far1三重突变体,ore1(kimetal.,2009)和wrky75(guoetal.,2017)突变体由南方科技大学郭红卫教授实验室惠赠,将ore1和wrky75分别与fhy3far1双突变体杂交,获得ore1fhy3far1和wrky75fhy3far1三重突变体。
2、试验结果
表型研究、叶绿素含量测定及对下游衰老相关基因表达的检测结果表明ore1能够回复fhy3far1突变体的早衰表型,而wrky75不能回复fhy3far1突变体的早衰表型(图3),说明ore1是fhy3调控衰老过程的主要下游基因。
试验例4fhy3对ein3的调控机理研究试验
1、试验方法
为了研究fhy3对ein3的调控机理,本试验采用了双荧光报告系统(dlr)、酵母单杂交(y1h)、凝胶电泳迁移实验(emsa)以及染色质免疫共沉淀(chip)等方法。
双荧光报告系统(dlr):从-80℃冰箱中取出保存的菌种(pspyne、pcambia1307、pore1:luc、pspyne-fhy3、pcambia1307-ein3),涂在含有相应抗生素的lb固体培养基上,30℃培养至长出菌落。挑取菌落转接至含有抗生素的液体lb培养基中,于30℃、220rpm摇菌过夜;按1:100-1:1000的比例将菌液转接入15ml液体lb培养基,并于30℃、220rpm摇菌8-12小时至od600在1.0-2.0之间;然后于4℃、4000rpm离心15分钟,并弃上清;之后用15ml烟草叶片浸染缓冲液(5g/l葡萄糖、2.033g/lmgcl2·6h2o、2.132g/lmes、150μm乙酰丁香酮,ph5.7)重悬菌体,并用4℃、4000rpm离心15分钟,并弃上清;接着用10ml烟草叶片浸染缓冲液重悬菌体,用4℃、4000rpm离心15分钟,并弃上清;之后用10ml烟草叶片浸染缓冲液重悬菌体,测菌体浓度,将od600调至0.5(若同时注射两种菌,将od600调至0.6,两种菌液按1:1的体积比混合),用1ml注射器紧贴烟草叶片背面将菌液注入。22℃培养2-3天后检测荧光强度。
酵母单杂交(y1h):70℃储存的酵母菌株eg48,在固体ypd平板上划线,30℃培养过夜。挑取单菌落于25ml液体ypd培养基中,250rpm培养过夜。吸取1ml菌液在1.5ml离心管中,3,000rpm离心2min,去除上清液,加入1ml无菌水,漩涡震荡,重悬菌液,3,000rpm离心2min,去除上清液,再次用1ml无菌水清洗,3,000rpm离心5min,去除上清液。菌体用100μl的1-stepbuffer重悬。加入3μllcarrierdna,混匀。加入1μljg-ein3(或jg空载体,或同时加入jg-ein3和ad-fhy3)和1μlore1启动子融合laczi-2μ报告基因,漩涡震荡,混匀。在45℃下培养30min,每隔10min漩涡震荡。涂于选择培养基,30℃培养3天。选择较大单菌落,在sd培养基上过夜扩大培养,将菌体在x-galsd培养基上培养过夜,观察蓝色的显色情况。
凝胶电泳迁移实验(emsa):参照碧云天化学发光法emsa试剂盒(gs009)说明书操作。其中野生型探针序列:5’-atactttacaaggttcatgcatgcatac-3’,突变探针序列:5’-atactttacaagggtaatgcatgcatac-3’。
染色质免疫共沉淀(chip):分别将10片左右新鲜的拟南芥(col-0、ein3ha/col-0、ein3ha/fhy3far1)莲座叶叶片置于64ml1%甲醛中,抽真空甲醛交联20-30min,加入5ml2m甘氨酸,继续抽真空5min终止交联;清水漂洗3-4次,吸干水分,置于液氮中充分研磨成细粉末;加入30ml提取缓冲液1(0.4m蔗糖、10mmtris-clph8.0、10mmmgcl2、5mmβ-巯基乙醇、0.1mmpmsf、1xcocktail),充分混匀,并在冰上放置5min;用双层miracloth过滤提取液两次,将滤液收集在干净的50ml离心管中;滤液于4℃离心机,3000g离心20min,弃上清,沉淀用1ml提取缓冲液2(0.25m蔗糖、10mmtris-clph8.0、10mmmgcl2、1%tritonx-100、5mmβ-巯基乙醇、0.1mmpmsf、1xcocktail)重悬;将重悬液转移至新的1.5ml离心管中,于4℃离心机,13000rpm离心10min,弃上清,沉淀用300μl预冷的提取缓冲液3(1.7m蔗糖、10mmtris-clph8.0、2mmmgcl2、0.15%tritonx-100、5mmβ-巯基乙醇、0.1mmpmsf、1xcocktail)重悬,尽量避免出现泡沫;另取300μl预冷的提取缓冲液3加入到一个新的1.5ml离心管中;重悬液轻轻覆盖在提取缓冲液3上,并于4℃离心机,14000rpm离心1h;弃上清,沉淀用300μl新鲜配制的核裂解缓冲液(50mmtris-clph8.0、10mmedta、1%sds、1xcocktail)重悬,避免产生泡沫;超声破碎重悬液;超声完成后,于4℃离心机,13000rpm离心5min,取上清至新的15ml离心管中,并取出10μl作为inputdna保存;向15ml离心管中加入染色质稀释溶液(16.7mmtris-clph8.0、1.2mmedta、1.1%tritonx-100、167mmnacl、1xcocktail)至最终体积为3ml;将3ml染色质溶液等分为两份,并分别加入40μlproteingagarose,置于4℃冰箱旋转结合2h;于4℃离心机,12000g离心1min,取上清至新的1.5ml离心管中,一管中加入7.5μl相应抗体,一管不加作为对照,置于4℃冰箱旋转结合过夜;每管中分别加入40μlproteingagarose,置于4℃冰箱旋转结合2h;于4℃离心机,3700g离心30s,弃上清;依次加入1ml低盐洗液、高盐洗液、licl洗液及te缓冲液洗涤沉淀,每次旋转洗涤5min;弃上清,每管加入250μlchip洗脱缓冲液,充分混匀,并放置于65℃水浴锅中加热洗脱,随后室温离心机3800g离心2min,取上清至另一新的1.5ml离心管中;再次洗脱一次,并合并两次洗脱液;向洗脱液中加入33.3μl3mnacl,并置于65℃水浴锅加热过夜;向上述洗脱液中加入10μl0.5medta,20μl1mtris-cl(ph=6.5)和2μl10mg/ml蛋白酶k,并置于后45℃水浴锅中加热2h;加入等体积酚/氯仿充分抽提,并于4℃离心机,13000rpm离心15min,取上清,并依次加入1/10体积3m醋酸钠,三倍体积无水乙醇及2μl10mg/mlglycogen,随后放置于-80℃冷冻1h;于4℃离心机,13000rpm离心15min,弃上清,加入70%乙醇洗涤沉淀,充分吹干后,加入16μl去离子水充分溶解沉淀,产物即为得到的dna。将得到的dna产物稀释5-10倍后即可用于pcr或者qpcr检测。检测ore1启动子的引物序列如下:
5’-tcttataacggtagacactggaataagac-3’
5’-acatggttacatataatttgttttatttgtttaac-3’。
2、试验结果
在烟草叶片的dlr实验中,ein3可以激活ore1启动子的转录,单独表达fhy3并没有显著效果,而同时表达ein3和fhy3蛋白时,ein3的转录激活效应被抑制,说明fhy3抑制了ein3对ore1启动子的转录激活(图4a,b)。在酵母单杂交及emsa实验中,ein3可以直接结合ore1的启动子,而加入fhy3蛋白后结合显著变弱(图4c,d)。chip实验中,ein3-ha/col-0的植株中,ha抗体能够富集ore1启动子序列,而在fhy3far1突变体中,ore1启动子富集增加(图4e),进一步说明fhy3抑制了ein3对ore1启动子的结合。
试验例5黑暗处理对fhy3蛋白水平的影响以及不同年龄叶片中fhy3蛋白水平变化的试验
1、试验方法
持续光照条件下生长5天的gfp-fhy3转基因植物,置于暗中培养0、0.5、1、2、5小时后收样提取总蛋白并进行westernblot实验,检测黑暗处理对fhy3蛋白水平的影响。
在正常长日照生长条件下,随着叶片年龄的增加,在第18、24、30、36天时,分别取叶片提取总蛋白并进行westernblot实验,检测不同年龄叶片中fhy3蛋白水平。
westernblot实验方法:取适量不同处理条件及时间点下gfp-fhy3转基因植物材料于研钵中,液氮速冻后充分研磨成粉末;加入粉末体积1/4的蛋白提取缓冲液(tris-hcl0.606g、nacl0.8766g、甘油10ml、np-40100μl,定容至100ml,使用前每毫升加入dtt、cocktail及pmsf),剧烈震荡混匀并冰上静置15分钟;然后用4℃、13000rpm离心15分钟;取上清并加入1/4溶液体积的上样缓冲液,混匀;65℃或沸水煮5-10分钟,然后将蛋白样品迅速置于冰上冷却;最后用4℃,13000rpm离心5分钟,置于冰上备用。将蛋白样品及marker上样跑胶;跑胶结束后转膜1小时;转膜完成后,将膜置于用tbst配制的5%牛奶中封闭1小时,待膜浸润后将牛奶倒出,加入含有gfp一抗的tbst(1:5000)孵育1-2小时;用tbst洗膜;然后加入含有二抗的tbst(1:5000)孵育45分钟,用tbst洗膜;最后将膜浸泡在化学发光底物中室温孵育2分钟,用保鲜膜将膜包好,曝光。
2、试验结果
根据试验结果可见,黑暗处理条件下fhy3蛋白含量减少、叶片衰老进程加快(图5)。随着叶片年龄增加fhy3蛋白含量下降、叶片逐渐衰老(图6)。
sequencelisting
<110>中国农业科学院生物技术研究所,华南农业大学
<120>fhy3蛋白在抑制叶片衰老以及提高作物产量中的应用
<130>bj-2002-190305a
<160>4
<170>patentinversion3.5
<210>1
<211>28
<212>dna
<213>artificalsequence
<400>1
atactttacaaggttcatgcatgcatac28
<210>2
<211>28
<212>dna
<213>artificalsequence
<400>2
atactttacaagggtaatgcatgcatac28
<210>3
<211>29
<212>dna
<213>artificalsequence
<400>3
tcttataacggtagacactggaataagac29
<210>4
<211>35
<212>dna
<213>artificalsequence
<400>4
acatggttacatataatttgttttatttgtttaac35
- 还没有人留言评论。精彩留言会获得点赞!