SUMO荧光探针及其制备方法与流程
本发明涉及蛋白质合成技术领域,具体涉及一种sumo荧光探针及其制备方法,尤其涉及一种sumo探针sumo2-rho110-gly的制备方法。
背景技术:
翻译后修饰(ptms)对于许多细胞过程是必不可少的,其通常是可逆的。并且有大量的翻译后修饰是发生在细胞中(如磷酸化,甲基化,乙酰化和糖基化)以调节各种生命活动。其中小泛素样修饰蛋白(sumo)化修饰是一个可以由sumo特异性蛋白酶逆转的高度动态的过程,在各种细胞过程中发挥着重要的作用,如调节核质转运,蛋白质稳定,dna损伤修复,细胞周期调节,基因转录,分化以及细胞定位等。sumo分子通过在e1活化酶、e2结合酶和e3连接酶的参与下共价结合到底物蛋白赖氨酸残基上,调控底物蛋白的结构与功能,而sumo特异性蛋白酶能够从与sumo连接的靶蛋白上催化去除sumo,以及从它的前体蛋白上裂解sumo,进而调控细胞功能。例如,多聚sumo化(polysumoylation)的早幼粒细胞白血病蛋白(pml)优先被一种泛素连接酶ringfingerprotein4(rnf4)所识别,随后被泛素-蛋白酶体途径所降解。这一过程对于用砷成功治疗急性早幼粒细胞白血病至关重要。癌症等相关疾病的发生、发展,其本质上是细胞内信号紊乱,ptms的动态调控失衡,癌症的治疗依赖于对这些机制的阐释。为了掌握sumo化在相关疾病发生中的作用,需要从基因到蛋白质水平对其进行全方位的研究。因此,通过研究相关的sumo荧光探针和去sumo化酶捕获探针,了解人体内疾病发生过程中sumo化水平的动态变化,以及为肿瘤及其他相关疾病的诊断和治疗提供新的方法、技术和工具是目前至关重要的研究方向。
然而sumo荧光探针的制备工艺还需要进一步改进。
技术实现要素:
本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的在于提出一种sumo荧光探针的制备方法。本发明所提供的sumo荧光探针的制备方法工艺简单可控,而且成本低,适合sumo荧光探针的工业生产和应用。应用本发明所提供的制备方法尤其适用于制备sumo2探针sumo2-rho110-gly,其可以作为去sumo化酶活性筛查和抑制剂的筛选的一种重要的sumo荧光探针。
在sumo荧光探针的研究过程中,一些小分子荧光基团总是会带有荧光,而这一特性往往会将生物学实验中有价值的信息给掩蔽了,从而阻碍了生物分子成像的荧光标记。而罗丹明作为常见的染色剂,由于其在电磁波谱的可见光区域具有高吸收系数和高荧光,以及具有高荧光量子产率和光稳定性强的特点而被广泛用作荧光探针。作为罗丹明b的最终产物的罗丹明110(rho110),它是一种黄原烯染料,类似于荧光素和曙红,其丰富的共轭π键使得自身具有持久的和强烈的荧光性质。因此,rhodamine110(rho110)现被作为一种常见的荧光探针和染色剂,在生物医学和工业领域有着广泛的应用;并且由于其优良的光稳定性和光物理特性,在体内癌症的诊断中具有潜在的应用价值。而且荧光罗丹明110已与氨基酸、多肽和小分子结合,在探测癌症细胞的生物成像中得到广泛的应用。因此,将rho110和sumo制备sumo荧光探针,用于去sumo化酶活性筛查和抑制剂的筛选等,具有重要的意义。
具体而言,本发明提供了如下技术方案:
根据本发明的一个方面,本发明提供了一种sumo荧光探针的制备方法,包括:(1)基于内含肽n-s迁移的方法制备获得sumo酰肼sumo2(2-92)-nhnh2;(2)基于所述sumo酰肼sumo2(2-92)-nhnh2,酰肼法获得sumo硫酯sumo2(2-92)-mesna;(3)基于所述sumo硫酯sumo2(2-92)-mesna和荧光素小分子反应,以便获得所述sumo荧光探针。
在制备sumo荧光探针的过程中,首先运用intein法n-s迁移的策略制备sumo酰肼sumo2(2-92)-nhnh2,并基于酰肼法将其进一步转化为sumo硫酯sumo2(2-92)-mesna,进而将其和荧光素小分子反应,获得sumo荧光探针。本发明所提供的方法步骤简单,而且所用到的各原料成本低,适合大规模制备获得sumo荧光探针。尤其适合利用本发明所提供的方法制备sumo探针sumo2-rho110-gly,可以用于去sumo化酶活性筛查和抑制剂的筛选等。
根据本发明的实施例,以上所述sumo荧光探针的制备方法可以进一步包括如下技术特征:
在本发明的一些实施例中,所述荧光素小分子罗丹明为gly-rho110-gly,所述带有罗丹明的sumo荧光探针为sumo2-rho110-gly。
在本发明的一些实施例中,步骤(1)进一步包括:(1-1)利用含有载有intein和sumo2的载体的菌株进行培养,裂解,分离获得上清液,所述载有intein和sumo2的载体上含有intein和sumo2编码序列;(1-2)将所述上清液进行亲和层析,获得亲和层析产物;(1-3)基于所述亲和层析产物,利用含有水合肼的切割缓冲液进行切割处理,以便获得所述sumo酰肼sumo2(2-92)-nhnh2。水合肼可以作为亲核试剂进攻内含肽(intein)的n端,从而通过氮-硫(n-s)迁移将内含肽与目标蛋白(sumo2(2-92)-nhnh2)分离,得到c末端为酰肼的目标蛋白sumo(2-92)-nhnh2。
在本发明的一些实施例中,步骤(1-2)中利用几丁质珠进行所述亲和层析。
在本发明的一些实施例中,步骤(1-3)中所述切割缓冲液含有:hepes,nacl,edta和4%~6%体积的水合肼。由此可以对亲和层析产物进行快速切割,获得sumo酰肼。
在本发明的一些实施例中,步骤(2)进一步包括:(2-1)将所述sumo酰肼sumo2(2-92)-nhnh2溶于含有盐酸胍的缓冲液中,与亚硫酸钠水溶液进行第一反应;(2-2)将步骤(2-1)的反应溶液和美司钠进行第二反应,纯化获得所述sumo硫酯sumo2(2-92)-mesna。
在本发明的一些实施例中,所述第一反应的温度为零下20摄氏度,所述第二反应的温度为25摄氏度。
在本发明的一些实施例中,步骤(3)进一步包括:(3-1)将所述sumo硫酯sumo2(2-92)-mesna和boc2o酸酐进行第三反应,以便获得boc-sumo2(2-92)-mesna;(3-2)将所述boc-sumo2(2-92)-mesna和所述荧光素小分子进行第四反应,以便获得boc-sumo-荧光素小分子罗丹明;(3-3)利用含有三氟乙酸和三异丙基硅烷的切割液对所述boc-sumo-荧光素小分子罗丹明进行切割,纯化获得所述sumo荧光探针。
在本发明的一些实施例中,所述切割液中所述三氟乙酸、三异丙基硅烷和水的体积比为90~95:2.5~5:2.5~5。
在本发明的一些实施例中,将所述sumo硫酯sumo2(2-92)-mesna溶于二甲基亚砜中,和boc2o酸酐、n,n-二异丙基乙胺混合,在20~30摄氏度下进行所述第三反应,以便获得boc-sumo2(2-92)-mesna。
在本发明的一些实施例中,将所述boc-sumo2(2-92)-mesna溶于二甲基亚砜,和苯硫酚、荧光素小分子gly-rho110-gly、n,n-二异丙基乙胺混合,在20~30摄氏度下进行所述第四反应,以便获得boc-sumo-rho110-gly。利用dmso作为有机溶剂,将sumo硫酯sumo2(2-92)-mesna用gly-rho-gly直接氨解为sumo2-rho110-gly,具有反应转化效率高,合成步骤简易,合成成本低的特点。
根据本发明的第二方面,本发明提供了一种sumo荧光探针,所述sumo荧光探针根据本发明第一方面任一实施例所述的方法制备而成。
本发明所取得的有益效果为:本发明通过以intein法n-s迁移的策略制备sumo酰肼sumo2(2-92)-nhnh2,具有制备产率高,合成纯度高,操作简易,可大量制备的特点,冻干后每1l培养基约可得到12mg的sumo2(2-92)-nhnh2。将sumo硫酯sumo2(2-92)-mesna和荧光素小分子罗丹明反应生成荧光探针,反应转化效率高,合成步骤简易,合成成本低,适合sumo探针的工业生产和制备。
附图说明
图1是根据本发明的实施例提供的sumo酰肼sumo2(2-92)-nhnh2的高效液相色谱图。
图2是根据本发明的实施例提供的sumo酰肼sumo2(2-92)-nhnh2的质谱图。
图3是根据本发明的实施例提供的sumo硫酯sumo2(2-92)-mesna的高效液相色谱图。
图4是根据本发明的实施例提供的sumo硫酯sumo2(2-92)-mesna的质谱图。
图5是根据本发明的实施例提供的sumo探针sumo2-rho110-gly的高效液相色谱图。
图6是根据本发明的实施例提供的sumo探针sumo2-rho110-gly的质谱图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
本文在表示氨基酸的时候,可以采用本领域通用的表述方式,即采用三个字母或者用一个字母进行表述,例如gly或者g均可以用来表示甘氨酸。
本文中,sumo2蛋白的1-93的氨基酸序列为madekpkegvktenndhinlkvagqdgsvvqfkikrhtplsklmkaycerqglsmrqirfrfdgqpinetdtpaqlemededtidvfqqqtgg(seqidno:1)。
本文中,术语“sumo2(2-92)-nhnh2”中2-92代表sumo的氨基酸序列位点从第2位到92位adekpkegvktenndhinlkvagqdgsvvqfkikrhtplsklmkaycerqglsmrqirfrfdgqpinetdtpaqlemededtidvfqqqtg。
本文中,术语“sumo2-rho110-gly”代表sumo2(2-93)-rho110-g,其是由sumo2(2-92)-mesna与带有两个甘氨酸修饰的荧光素小分子gly-rho110-gly(也可以缩写为g-rho110-g)缩合耦连得到的。荧光素小分子g-rho110-g与sumo2(2-92)-mesna结合后正好多了一个gly,而sumo2的第93个氨基酸序列也恰到为g,所以所获得的最终产物带有罗丹明的sumo2荧光探针(即sumo2-rho110-gly)即为sumo2(2-93)-rho110-g。
根据本发明的一个方面,本发明提供了一种简易合成sumo探针sumo2-rho110-gly的方法,具体包括如下步骤:
步骤1:以intein法n-s迁移的策略制备sumo酰肼sumo2(2-92)-nhnh2
1a、获取含有intein和sumo2编码序列的质粒载体,然后转化大肠杆菌,挑取含有该质粒载体的单克隆菌落至4ml含有氨苄抗性的lb培养基中,37℃、220rpm培养过夜,使菌液充分浑浊;
所述含有氨苄抗性的lb培养基的配方构成如下:2g胰蛋白胨,2gnacl,1g酵母粉,200ml去离子水,200μl50mg/ml的amp。
1b、取1a中培养的菌液按体积比1:100放大至含有氨苄抗性的1llb培养基中,37℃、220rpm继续培养,待菌液od600吸光值达到0.6~0.8时,加入500μl1.0m的iptg对菌液进行诱导,37℃、220rpm继续培养5~6h;
1c、离心收集1b培养完成的菌液,弃去上清液后用裂解缓冲液(20mmhepes,300~500mmnacl,1mmedta,ph7.4)将所得菌体充分重悬(每1llb培养基所得菌体重悬于20~30ml裂解缓冲液中),使用超声破碎仪裂解菌体;
一般来说,超声破碎的时间与需要破碎的菌体量成正比例关系,每1llb培养基所得菌体正常需要破碎1~2h。用裂解液重悬后的菌体在未破碎时成乳浊液状,待破碎后会逐渐变得澄清,透亮。
1d、使用高速冷冻离心机将1c获得的细胞破碎液离心(13000rpm,30min,4~8℃)后收集上清液,用0.22μm微孔滤膜过滤;
1e、平衡几丁质珠:取约10ml体积的液体几丁质珠置于多肽合成管中,通过重力将液体流尽。用10倍柱床体积的裂解缓冲液冲洗几丁质珠,待充分平衡后将步骤1d中所得蛋白质上清液缓慢滴加于柱中,使其与几丁质珠充分混匀,在室温下静置0.5h;
由于在几丁质珠和蛋白上清液混合的过程中会逐渐沉降,因此可将其置于摇床上缓慢摇动以保证充分混匀。
1f、放开合成管的下口使蛋白质上清液依靠重力缓慢流尽(控制流速在1~2ml/min),用20倍体积的裂解缓冲液冲洗几丁质珠以除去杂蛋白质,使溶液依靠重力慢慢流下;
通过该步骤,融合表达有cbd结构域的目标蛋白会与几丁质珠特异性结合,而杂蛋白会被除去,初步达到了蛋白纯化的目的。
1g、向几丁质珠中加入约2倍体积的切割缓冲液(20mmhepes,500mmnacl,1mmedta,4%~6%水合肼,ph7.4),室温下静置2~3h;
通过该步骤,水合肼作为亲核试剂会进攻intein的n端,通过氮-硫迁移将intein与目标蛋白分离,得到c末端为酰肼的目标蛋白sumo2(2-92)-nhnh2。
1h、使用3倍体积的裂解缓冲液冲洗几丁质柱,收集流出液。所得含有sumo2(2-92)-nhnh2的溶液使用rp-hplc进行分离纯化。冻干后每1llb培养基约可得12mg的sumo2(2-92)-nhnh2。
步骤2:蛋白质酰肼法制备sumo硫酯sumo2(2-92)-mesna
将1倍量的sumo2(2-92)-nhnh2溶于ph=3.0的含有6.0m盐酸胍的pbs缓冲液中,并加入10倍量的亚硝酸钠水溶液,在-20℃条件下反应20min;反应结束后,加入40倍量的美司钠,并调节ph至5.0,室温反应20min;反应完成后使用半制备型高效液相色谱进行纯化,收集纯化后的溶液,冻干后每1llb培养基约可得到6~8mg的sumo2(2-92)-mesna;
步骤3:通过boc2o酸酐保护sumo硫酯sumo2(2-92)-mesna形成boc-sumo2(2-92)-mesna,紧接着通过直接氨解boc-sumo2(2-92)-mesna从而获得sumo探针sumo2-rho110-gly。
3a、将步骤2制备的sumo2(2-92)-mesna蛋白干粉用有机溶剂dmso(二甲亚砜)溶解,加并入boc2o酸酐(二碳酸二叔丁酯)和diea(n,n-二异丙基乙胺),室温下搅拌1h后用冰乙醚沉淀出蛋白,自然晾干,得到boc-sumo2(2-92)-mesna;
3b、将3a中沉淀出来的蛋白溶于dmso中,依据溶液体积加入2%(v/v)的苯硫酚,并加入5eq的gly-rho110-gly,待小分子gly-rho110-gly完全溶解后,加入10eq的diea,于室温下反应1.5~2h后,反应液用冰乙醚沉淀,然后自然晾干,得到boc-sumo2-rho110-gly;
3c、将3b中沉淀出来的蛋白加入适量的切割液(tfa(三氟乙酸):tis(三异丙基硅烷):h2o=95:2.5:2.5),于室温下搅拌30min后加入冰乙醚沉淀出蛋白,然后自然晾干后加入溶剂进行溶解后,使用半制备型高效液相色谱进行纯化,收集纯化后的溶液,冻干后每1llb培养基约可得到2~3mg的目标产物sumo探针sumo2-rho110-gly。
步骤3中,所述有机溶剂为dmso(二甲亚砜)。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
实施例1利用intein法n-s迁移策略制备sumo酰肼sumo2(2-92)-nhnh2。其基于商用的含有intein的菌株,基于常规技术借助于载体,在intein的n端连接sumo2蛋白,在其c端连接几丁质结合域,转化大肠杆菌,从而获得能够表达intein和sumo2蛋白的菌株。其中,含有intein的菌株为商业化的bl21,购自于全式金公司,该菌株中所克隆的载体为ptxb1,酶切位点为ndei和sapi。
将所述能够表达intein和sumo2的菌株培养,裂解获得上清液,然后利用几丁质珠进行亲和层析,几丁质珠和上清液中的几丁质结合蛋白结合,几丁质结合蛋白和内含肽相连,内含肽的另一端和sumo2目标蛋白相连,由此将sumo2目标蛋白固定在几丁质珠上。然后利用水合肼进行裂解,获得sumo酰肼sumo2(2-92)-nhnh2。
包括如下步骤:
挑取能够表达intein和sumo2的单克隆菌落至4ml含有氨苄抗性的lb培养基中,37℃,220rpm培养过夜。其中,含有氨苄抗性的lb培养基的配方构成如下:2g胰蛋白胨,2gnacl,1g酵母粉,200ml去离子水,200μl50mg/ml的amp。
取上述步骤培养的菌液按体积比1:100放大至含有氨苄抗性的1llb培养基中,37℃、220rpm继续培养,待菌液od600吸光值达到0.6~0.8时,加入500μl1.0m的iptg对菌液进行诱导,37℃、220rpm继续培养5~6h。
离心收集培养完成的菌液,弃去上清液后用裂解缓冲液(20mmhepes,300~500mmnacl,1mmedta,ph7.4)将所得菌体充分重悬(每1llb培养基所得菌体重悬于20~30ml裂解缓冲液中),使用超声破碎仪裂解菌体;然后使用高速冷冻离心机将1c获得的细胞破碎液离心(13000rpm,30min,4~8摄氏度)后收集上清液,用0.22μm微孔滤膜过滤。
平衡几丁质珠:取约10ml体积的液体几丁质珠置于多肽合成管中,通过重力将液体流尽。用10倍柱床体积的裂解缓冲液冲洗几丁质珠,待充分平衡后将步骤1d中所得蛋白质上清液缓慢滴加于柱中,使其与几丁质珠充分混匀,在室温下静置0.5h。
放开合成管的下口使蛋白质上清液依靠重力缓慢流尽(控制流速在1~2ml/min,用20倍体积的裂解缓冲液冲洗几丁质珠以除去杂蛋白质,使溶液依靠重力慢慢留下)。
向几丁质珠中加入约2倍体积的切割缓冲液(该切割缓冲液含有20mmhepes,500mmnacl,1mmedta,4%~6%水合肼,ph7.4),室温下静置2~3h。
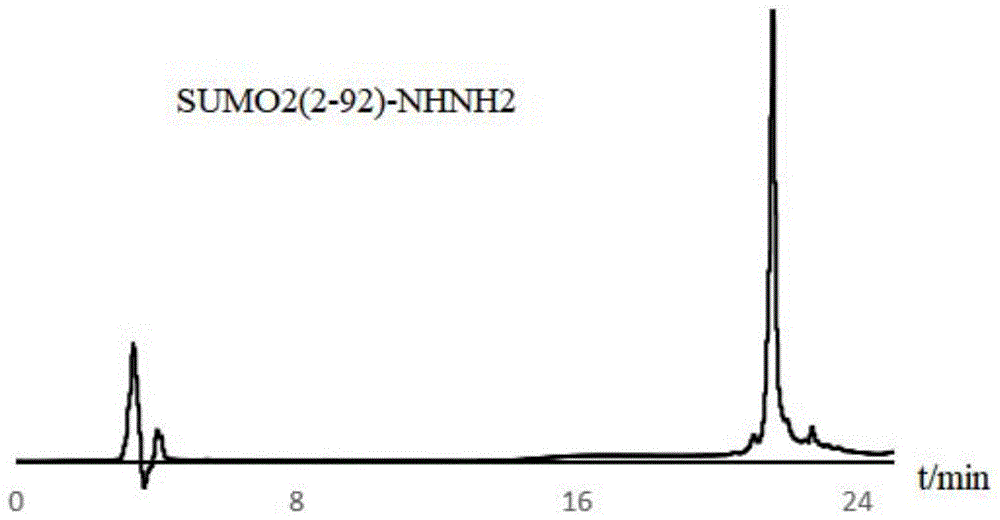
使用3倍体积的裂解缓冲液冲洗几丁质柱,收集流出液。所得含有sumo2(2-92)-nhnh2的溶液使用rp-hplc进行分离纯化,如图1所示。冻干后每1llb培养基约可得12mg的sumo2(2-92)-nhnh2。
图1是sumo2(2-92)-nhnh2的高效液相色谱图,其中横坐标为时间,表示的是用高效液相色谱分离纯化时不同物质被洗脱下来是用到的时间长短,纵坐标表示吸收值,由表1可以反映出该蛋白的表达效果。
同时对高效液相色谱分离纯化时出现的峰所对应的样品进行质谱检测,所获得的质谱结果如图2所示,其中图2中横坐标代表质荷比,通过计算得到该蛋白的分子量,然后与该蛋白的理论分子量进行比较,从而检测所得到的蛋白是否正确。计算公式为:所获得的荷质比(m/z)*n-n=蛋白分子量。其中,n代表电荷数。经计算,并与理论分子量比较,确认获得需要的蛋白。
实施例2
实施例2利用蛋白质酰肼法制备sumo硫酯sumo2(2-92)-mesna,包括如下步骤:
将50mg的sumo2(2-92)-nhnh2溶于6mlph=3.0的6m盐酸胍、0.2m磷酸氢二钠的pbs缓冲液中,并加入60ul1.0m亚硝酸钠水溶液,在-20℃条件下反应20min;反应结束后,加入39mg的美司钠,并调节ph至5.0,室温反应20min;反应完成后使用半制备型高效液相色谱,如图3所示,将上述反应液进行纯化,收集纯化后的溶液,冻干后每1llb培养基约可得到6~8mg的sumo硫酯sumo2(2-92)-mesna。
图3为sumo硫酯sumo2(2-92)-mesna的高效液相色谱图,横坐标代表时间,纵坐标代表吸收值。同时对高效液相色谱分离纯化时出现的峰所对应的样品进行质谱检测,所获得的结果如图4所示,参照实施例1的计算方法,经确认获得所需要的蛋白。
实施例3
实施例3提供了一种利用sumo硫酯sumo2(2-92)-mesna生成sumo探针sumo2-rho110-gly的方法,其包括:首先通过boc2o酸酐保护sumo硫酯sumo2(2-92)-mesna形成boc-sumo2(2-92)-mesna,紧接着通过直接氨解boc-sumo2(2-92)-mesna从而获得sumo探针sumo2-rho110-gly。
具体包括如下步骤:
3a、称取43mg的sumo2(2-92)-mesna蛋白干粉用1.5mldmso(二甲亚砜)溶解,并加并入18.5μl的boc2o酸酐(二碳酸二叔丁酯)和8μl的diea(n,n-二异丙基乙胺),室温下搅拌1h后用冰乙醚沉淀出蛋白,自然晾干,得到boc-sumo2(2-92)-mesna;
3b、将3a中沉淀出来的蛋白溶于2.5mldmso中,并加入10μl的苯硫酚,然后加入11.5mg的gly-rho110-gly,待小分子gly-rho110-gly完全溶解后,加入8.5μldiea,于室温下反应1.5~2h后,反应液用冰乙醚沉淀,然后自然晾干,得到boc-sumo2-rho110-gly;
3c、将3b中沉淀出来的蛋白加入适量的切割液(tfa(三氟乙酸):tis(三异丙基硅烷):h2o=95:2.5:2.5),于室温下搅拌30min后加入冰乙醚沉淀出蛋白,然后自然晾干后加入溶剂进行溶解后,使用半制备型高效液相色谱进行纯化,如图5所示。收集纯化后的溶液,冻干,得到目标产物泛素探针sumo2-rho110-gly。
图5为探针sumo2-rho110-gly的高效液相色谱图,其中横坐标代表时间,纵坐标代表吸收值。
同时对高效液相色谱分离纯化时出现的峰所对应的样品进行质谱检测,其结果如图6所示。参照实施例1的方法,经确认获得所需要的带有荧光素小分子罗丹明的荧光探针。
本文中,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>合肥科生景肽生物科技有限公司
<120>sumo荧光探针及其制备方法
<130>pidc7190023
<160>1
<170>patentinversion3.5
<210>1
<211>93
<212>prt
<213>artificialsequence
<220>
<223>sumo2
<400>1
metalaaspglulysprolysgluglyvallysthrgluasnasnasp
151015
hisileasnleulysvalalaglyglnaspglyservalvalglnphe
202530
lysilelysarghisthrproleuserlysleumetlysalatyrcys
354045
gluargglnglyleusermetargglnileargpheargpheaspgly
505560
glnproileasngluthraspthrproalaglnleuglumetgluasp
65707580
gluaspthrileaspvalpheglnglnglnthrglygly
8590
- 还没有人留言评论。精彩留言会获得点赞!