治疗大肠癌的化合物的制作方法
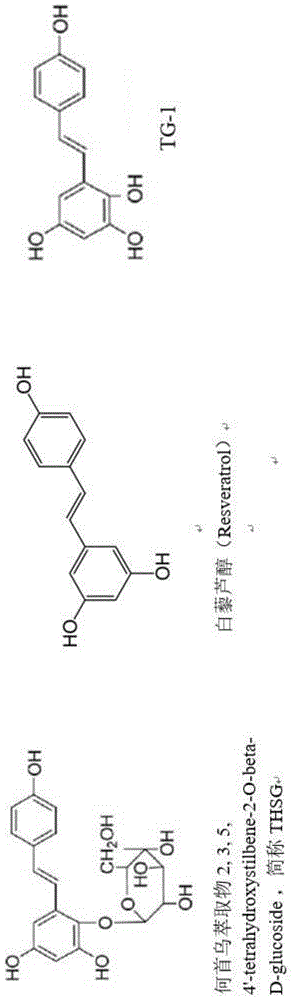
本发明有关于一种化合物2,3,5,4’-四羟基二苯乙烯tg-1(2,3,5,4’-tetrahydroxy-trans-stilbene),该化合物具有治疗大肠癌症的新用途。
背景技术:
:在台湾,大肠癌发生、死亡人数,每年呈快速增加的趋势,居所有癌症发生率及死亡率的第2位及第3位,大部份的大肠癌起因为生活习惯及老化,少部分则因为遗传疾病。大肠癌的治疗方式包括手术、放射线治疗、化学治疗、及标靶治疗或是合并使用以上疗法,局限在肠壁的大肠癌可能藉由手术治愈。在美国,五年存活率约65%,然而主要取决于病人健康状况与癌症分期,而分期又关系到是否能藉由手术移除。整体来说,大肠癌为第三常见癌症,约占10%。大肠癌在已开发国家较为常见,占全世界总案例数的65%。而在女性较男性少见。手术是治疗大肠癌最主要的方法,除了第四期以外,基本上一到三期会建议手术切除为主,但是经检查评估后,肿瘤位置若接近肛门口,手术时有可能肛门会保留不住,需要装人工肛门,对于大多数人而言是很难接受的,因此,会先建议手术前使用化学治疗或化学治疗合并放射治疗,当肿瘤缩小后再施行手术,肛门也许就有机会保留,并且可以降低局部复发机率,但放射线治疗和化疗的副作用大,非一般大众所接受,因此需要一种可专一性的缩小大肠癌肿瘤的药物来取代放射线治疗和化疗,满足病患的治疗需求。在目前临床前研究中,已显示白藜芦醇具有许多生物活性,其可用于预防和/或治疗癌症、心血管疾病和神经退行性疾病。白藜芦醇是一种天然存在于花生,葡萄,红葡萄酒和一些浆果中的多酚化合物,当口服时,白藜芦醇很好地被人吸收。虽然已有许多先前文献揭示白藜芦醇的生物活性,但尚未有证据可推知白藜芦醇或其衍生物,对于特定癌症具有专一性毒杀的效果。此外,先前文献资料(saunier,elise,etal."resveratrolreversesthewarburgeffectbytargetingthepyruvatedehydrogenasecomplexincoloncancercells."scientificreports7.1(2017):6945.)揭示白藜芦醇诱发细胞凋亡的作用,在不同的人类癌症细胞上有不同的反应。该文献进一步指出,白藜芦醇对于人类大肠癌(caco2、sw480、hct116)并无任何抑制癌细胞能力。由此可知,虽然白藜芦醇的生物活性已见于先前技术,然而还未有证据证实白藜芦醇或其衍生物,针对人类大肠癌细胞具有专一性毒杀能力。综合上述,由于大肠癌在手术前使用副作用较小的医药组合物来毒杀大肠癌细胞使肿瘤缩小后再施行手术或早期发现不需手术,保留肛门并且降低局部复发机率,增加病患的就医意愿,能早期发现早期治疗,增长病患的生存期间是刻不容缓急需解决的问题,因此,业界亟需开发一种具有专一性毒杀大肠癌细胞的化合物用于治疗大肠癌症。技术实现要素:有鉴于此,本发明提供一种化合物tg-1(2,3,5,4’-tetrahydroxy-trans-stilbene),该化合物具有治疗大肠癌症的新用途。本发明提供一种化合物,如式i所示。式i中:r1、r2、r3、r4、r5以及r6为-h、-nh2、-oh或-c=o、或增加化合物水溶性的取代基;或其医药可接受的顺反异构物。本发明提供的化合物,其中所述r1、r2、r3、r4、r5以及r6为选自-nh2、-oh、-c=o、或增加化合物水溶性的取代基,此取代基具极化共价键,可与水形成作用力,因此可增加亲水极性。本发明提供一种用于制备治疗大肠癌的药物的用途,其中所述药物包含如式i所示的化合物;及药学上可接受的载剂、佐剂或媒剂。本发明提供一种用于制备治疗大肠癌的药物的用途,其中所述药物包含tg-1(2,3,5,4’-tetrahydroxy-trans-stilbene)化合物;及药学上可接受的载剂、佐剂或媒剂。本发明提供一种用于制备治疗大肠癌的药物的用途,其中所述药物对于其他种类如:乳癌、肺癌及淋巴癌等,本发明揭示的化合物均无显著抑制生长的效果。本发明所称的“大肠癌”,是指源自结肠或直肠(为大肠的一部份)的癌症,包含其癌细胞侵犯或转移至身体其他部位的情况。本发明所称的“大肠癌”,包含带有msi+、cin+、cimp+、tgf-β、kras突变或braf突变等的癌细胞,其形态可为管状线癌(tubularadenoma)、绒毛腺癌(villousadenoma)或锯齿状线癌(serratedadenoma)。本发明提供的化合物,包括以抑制β-catenin讯息路径促使癌细胞走向细胞凋亡,主要为提升细胞内bax/bcl-2比例,增加caspase-3活化,使得dna修复酶parp分裂,进而开启癌细胞凋亡效应。为达到上述及其它目的,以下对本发明一个或多个具体实施例进行说明。本发明的其它特征或优点以实施例及请求项详细描述。附图说明图1显示何首乌水萃取物的活性成分thsg(2,3,5,4'-tetrahydroxystilbene-2-o-beta-d-glucoside,2,3,5,4'-四羟基二苯乙烯-2-o-β-d-葡萄糖苷)修饰其官能基后的产物tg-1。图2a及2b显示将产物tg-1(2,3,5,4'-tetrahydroxy-trans-stilbene)溶于meod中〈约0.4毫升〉,置入核磁共振测量管内,室温下于dpx-200核磁共振仪上进行测定的1h-nmr、13c-nmr谱图。图3显示针对人类大肠癌细胞株hct-116给予化合物tg-1,检测其抑制能力,其mtt试验结果显示ic50值低至0.031μm,代表化合物tg-1在0.031μm即可抑制50%大肠癌细胞株hct-116。图4为显示针对人类大肠癌细胞株dld-1给予化合物tg-1,检测其抑制能力,mtt试验结果显示ic50值为0.056μm,代表化合物tg-1在0.056μm即可抑制50%大肠癌细胞株dld-1。图5显示针对人类乳癌细胞株mcf-7给予化合物tg-1,检测其药物是否具有抑制作用。mtt试验结果发现ic50值为190μm,代表化合物tg-1在190μm即可抑制50%的人类乳癌细胞株mcf-7,其浓度相当高,无显著效果。图6显示针对人类肺癌细胞株a549给予化合物tg-1,检测其药物是否具有抑制作用。mtt试验结果发现,ic50值为63μm,代表化合物tg-1在63μm可抑制50%的人类肺癌细胞株a549,即表示无显著抑制肺癌细胞效果。图7显示针对淋巴癌细胞株e.g7给予化合物tg-1,检测其药物是否具有抑制作用。mtt试验结果发现,化合物tg-1对于淋巴癌细胞并无特别抑制能力,ic50值为180μm,代表化合物tg-1在180μm可抑制50%的淋巴癌细胞株e.g7,即表示无显著抑制淋巴癌细胞效果。图8显示针对纤维母细胞株l929给予化合物tg-1,检测其药物是否具有抑制作用。mtt试验结果发现,化合物tg-1对于纤维母细胞并无特别抑制能力,ic50值为255μm,代表化合物tg-1在255μm可抑制50%的纤维母细胞株l929,即表示无显著抑制纤维母细胞效果。图9显示利用小鼠作为模式生物,观察无治疗组别(control)和治疗组别(tg-1或irinotecan(伊立替康))的大肠癌肿瘤生长情形。具体实施方式实施例1、tg-1(2,3,5,4'-tetrahydroxy-trans-stilbene)的合成方法在本发明一范畴中,本发明提供一种如式i所示的化合物。其中:r1、r2、r3、r4、r5以及r6为包含-h、-nh2、-oh、-c=o、或增加化合物水溶性的取代基;或其医药可接受的顺反异构物。如图1,tg-1(2,3,5,4’-tetrahydroxy-trans-stilbene)的合成方法为将何首乌水萃取物的活性成分thsg(2,3,5,4’-tetrahydroxystilbene-2-o-beta-d-glucoside)修饰其官能基后的产物tg-1,相关的合成方法如步骤(1)-(3)所示。在圆底烧瓶中将thsg〈2.06g,5.62mmol〉溶于乙醇〈50ml〉,加入盐酸〈1.0m,75ml〉,回流加热至70℃,反应18小时。(2)冷却至常温后使用旋转浓缩仪除去乙醇,水溶液使用乙醚进行萃取,取出乙醚后使用无水硫酸镁除去乙醚中残留的水,过滤去除硫酸镁后使用旋转浓缩仪将乙醚抽干。(3)使用正相管柱层析法纯化产物〈展开溶液为二氯甲烷/甲醇体积比14:1→13:1→12:1的混合溶液〉,得到最终产物634.2mg,产率为51%。实施例2、使用核磁共振测定tg-1如图2a及2b,将产物溶于meod中〈约0.4毫升〉,置入核磁共振测量管内,室温下于dpx-200核磁共振仪上进行测定。1hnmr(200mhz,meod)δppm:7.31,6.72(dt,j=8.5,2.9,1.8hz;j=8.7,2.8,2.0hz2h;2h,h-2’,h-6’,h-3’,h-5’),7.21,6.90(d,j=16.5hz;j=16.4hz,1h;1h,h-7,h-8),6.45,6.20(d,j=2.7hz;j=2.7hz,1h;1h,h-3,h-5);13cnmr(50mhz,meod)δppm:157.1,150.3,146.5,136.4(c2,c4,c6,c4’),130.1,126.0(c1,c1’),128.1,120.7(c7,c8),127.7,115.4(c2’,c3’,c4’,c5’),102.1,101.9(c3,c5)。实施例3、tg-1对大肠癌细胞的影响细胞株hct-116为成人大肠癌细胞,其细胞表现tgf-β1及tgf-β2,为临床前研究大肠癌常使用的目标细胞;细胞株dld-1为男性人类大肠癌细胞,为晚期已侵犯至淋巴结的癌细胞,生长快速具转移性,也是临床前研究大肠癌常使用的目标细胞;细胞株mcf-7为成人女性乳癌细胞,具有tx-4致癌基因,为临床前研究乳癌常使用的目标细胞;细胞株a549为成人男性肺癌细胞,其细胞特性为具合成卵磷脂的能力,为临床前研究肺癌常使用的目标细胞;细胞株eg7为淋巴癌细胞,其细胞带有抗原ova,为临床前研究癌症免疫治疗常使用的目标细胞;细胞株l929为纤维母细胞(成纤维细胞),为临床前研究细胞毒性标准测试常使用的指定细胞。实验方法:细胞存活率试验(cellviabilitybymttassay)1)前一天先将癌细胞培养于24或48孔盘上24小时,细胞数为104cells/well(孔),使癌细胞完全贴附于孔盘。2)抽取培养液,加入含有不同浓度的化合物tg-1的培养液,让细胞与药物在培养箱作用24小时。3)抽取培养液,加入含有10%mtt的培养液,使其在培养箱中且避光反应4小时后取出。4)抽取培养液,加入dmso,使紫色结晶溶解呈色,以波长570nm测量其吸光值。5)通过不同组别的吸光值来对比控制组的数值,计算出该药物的细胞存活率与ic50。6)通过不同组别的吸光值来对比控制组的数值,计算出该比例下合并药物的细胞存活率与ic507)利用药物合并指数定理(thecombinationindextheorem)公式计算出该药物合并指数(combinationindex)实验结果(如图3-8):针对人类大肠癌细胞株hct-116给予化合物tg-1,检测其抑制能力,mtt试验结果显示,化合物tg-1在低的药物浓度即可毒杀大肠癌细胞,ic50值低至0.031μm,代表化合物tg-1在0.031μm即可抑制50%大肠癌细胞株hct-116,具有相当显著毒杀能力。(如表1、图3所示)针对人类大肠癌细胞株dld-1给予化合物tg-1,检测其抑制能力,细胞存活率试验(mtt试验),化合物tg-1在低浓度即有显著毒杀大肠癌细胞能力,ic50值为0.056μm,效果相当突出。(如表1、图4所示)但针对人类乳癌细胞株mcf-7给予化合物tg-1,检测其药物是否具有抑制作用,细胞存活率试验(mtt试验)结果发现,化合物tg-1对于人类乳癌细胞并无特别抑制能力,ic50值为190μm,药物浓度相当高,无显著效果。(如表1、图5所示)但针对人类肺癌细胞株a549给予化合物tg-1,检测其药物是否具有抑制作用。细胞存活率试验(mtt试验)结果发现,化合物tg-1对于人类肺癌细胞并无特别抑制能力,ic50值为63μm,即表示无显著抑制肺癌细胞效果。(如表1、图6所示)但针对淋巴癌细胞株e.g7给予化合物tg-1,检测其药物是否具有抑制作用。细胞存活率试验(mtt试验)结果发现,化合物tg-1对于淋巴癌细胞并无特别抑制能力,ic50值为180μm,即表示无显著抑制淋巴癌细胞效果。(如表1、图7所示)但针对纤维母细胞株l929给予化合物tg-1,检测其药物是否具有抑制作用。细胞存活率试验(mtt试验)结果发现,化合物tg-1对于纤维母细胞并无特别抑制能力,ic50值为255μm,即表示无显著抑制纤维母细胞效果。(如表1、图8所示)进一步分析其抑制半数癌细胞所需药物浓度,以ic50值表示(如表1所示),发现对于不同种类的人类大肠癌细胞tg-1药物皆有显著抑制生长的功效,在相当低的药物浓度即可抑制大肠癌细胞,反之对于其他癌症如肺癌细胞、乳癌细胞或纤维母细胞等,则无明显抑制效果。表1.化合物tg-1对不同癌细胞的ic50值。癌细胞株ic50hct116colorectalcells(hct116大肠癌细胞)0.031μmdld-1colorectalcells(dld-1大肠癌细胞)0.056μmmcf-7breastcancercells(mcf-7乳腺癌细胞)190μma549lungcancercells(a549肺癌细胞)63μmeg7lymphomacells(eg7淋巴癌细胞)180μml929fibroblastcells(l929成纤维细胞)255μm经由上述实验结果得知,本发明揭露的化合物tg-1,针对大肠癌细胞具有高度专一性的毒杀能力,其毒杀大肠癌细胞的能力比毒杀其他细胞高出1000至6000倍。tg-1以抑制β-catenin讯息路径促使癌细胞走向细胞凋亡,主要为提升细胞内bax/bcl-2比例,增加caspase-3活化,使得dna修复酶parp分裂,进而开启癌细胞凋亡效应。实施例4、利用动物实验评估tg-1对于大肠癌肿瘤的抑制生长效果利用小鼠作为模式生物,观察tg-1对于大肠癌肿瘤的抑制生长情形。在小鼠(nu/numice)背部植入人类大肠癌细胞(ht-29),当肿瘤生长至约250mm3左右后,分别以一周两次的频率于小鼠尾静脉给予tg-1(10mg/kg)或临床治疗药物irinotecan(10mg/kg),比较无治疗组别(control)和治疗组别(tg-1或irinotecan)抑制大肠癌细胞生长的效果,各组别小鼠观察只数为8只。动物实验方法:在小鼠(nu/numice)背部植入人类大肠癌细胞(ht-29),待肿瘤生长至约250mm3进行分组。将小鼠分为3组(无治疗组、治疗组tg-1和治疗组临床抗癌药物irinotecan),每组8只。治疗组tg-1与irinotecan给药浓度为10mg/kg,以尾静脉方式给予药物,频率为每周2次。观察肿瘤体积生长情况,肿瘤体积计算公式为:长*宽*宽*0.5。实验结果(如图9):经由测量肿瘤体积得知,无治疗组别的小鼠大肠癌肿瘤生长速度快,于第10天测量肿瘤体积平均值体积约846mm3,而治疗组别皆能有效抑制肿瘤生长,其中tg-1组别于第10天测量肿瘤体积平均值为291mm3,irinotecan组别于第10天测量肿瘤体积平均值体积约327mm3。于第15天测量时,无治疗组别的肿瘤体积平均值体积约1100mm3,而治疗组别皆能有效抑制肿瘤生长,其中tg1组别于第15天测量肿瘤体积平均值为300mm3,irinotecan组别于第15天测量肿瘤体积平均值体积约600mm3。于第20天测量时,无治疗组别平均值体积已超过1400mm3,而治疗组别仍非常有效抑制肿瘤生长,其中tg-1组别于第20天测量肿瘤体积平均值为461mm3、irinotecan组别于第20天测量肿瘤体积平均值为617mm3。经由动物实验的结果显示,本发明揭示的tg-1化合物针对人类大肠癌具有相当好的抑制效果。综上所述,由thsg修饰官能基后得到产物tg-1,经细胞存活率试验(mtt试验)可知,化合物tg-1具有高度专一毒杀人类大肠癌细胞能力;相反的,对于其他种类如乳癌、肺癌及淋巴癌等,化合物tg-1均无显著抑制生长的效果。进一步,由动物实验结果得知,与控制组别相比,本发明揭示的化合物tg-1化合物提供了与现行癌症药物irinotecan相近似甚至更优良的抑制大肠癌肿瘤生长的效果。因此经由本发明的揭示,可望提供业界一种具有高度专一性毒杀大肠癌细胞的化合物,用于治疗大肠癌症。发明所揭露的所有特征应可以任何结合方式实现。本发明所揭露的每一特征应可以相同、均等或相似目的的取代物所取代。因此,除非有明确的指定,否则所揭露的每一个特征仅仅只是均等物或相似特征的一个种类的一实施例。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1