一种创制高香型矮牵牛新种质的分子方法与流程
本发明属于分子生物学技术领域,具体涉及一种创制高香型矮牵牛新种质的分子技术。
背景技术:
香气是园艺植物的重要园艺性状,它不仅能赋予观赏植物特定的气味特征,决定其经济和园林应用价值,在吸引传粉昆虫,保护作物免受生物和非生物胁迫,介导植物-植物之间的通讯等方面同样具有重要作用,对植物生存及繁衍至关重要。基于香气的重要作用,利用分子育种手段创新香型种质是园艺作物育种工作的重要方面。
茉莉花是著名的芳香植物和香料作物,其香气清香怡人、沁人心脾,更有由其窨制的“茉莉花茶”享誉全国,足见其香味的独特之处。具有花香的矮牵牛现代杂交品种(petuniahybrida)基本上是p.axillaris的后代,它们的花香挥发性成分是苯环类化合物,来源于苯丙氨酸代谢途径。将茉莉花特色香气合成关键基因通过花特异性启动子在矮牵牛花器官中特异的表达,可以获得新/高香型种质。
技术实现要素:
本发明的目的在于提供一种创制高香型矮牵牛新种质的分子方法。该方法以遗传转化的手段,能够特异性地在矮牵牛花瓣中获得香气合成酶基因的高度表达,包括启动子的合成、香气合成酶tps(terpenesynthase)基因的扩增,表达载体构建。同时通过遗传操作导入矮牵牛植物,获得香气显著增强的转基因植株。其特征在于,人工合成花特异性启动子,以其启动可以合成茉莉花香型的关键合成酶基因tps在矮牵牛花朵中表达,获得的转进因植株在香气含量上与对照相比存在明显提高。
本发明是通过以下技术方案实现的:
1、构建pk7fwg2.0-procblis:jstps4表达载体
(1)合成花特异性启动子序列。
构建委托英潍捷基(上海)贸易有限公司合成花特异性启动子procblis核苷酸序列(genebank登录号af067601.1)。
(2)构建pk7fwg2.0-procblis空载体。
采用酶切连接的方法,将花特异性启动子procblis通过单向限制性内切酶位点spei和saci置换掉表达载体pk7fwg2.0的camv35s启动子,获得重构的pk7fwg2.0-procblis表达载体。
(3)扩增茉莉花香气合成关键酶基因jstps4编码序列。
提取茉莉花花瓣总rna,采用race(smartertmracecdnaamplificationkit,clontechlaboratories,inc.)试剂盒扩增得到jstps4的5’和3’cdna序列,拼接后获得cdna全长,并获得其编码序列。
(4)构建pk7fwg2.0-procblis:jstps4表达载体
将jstps4编码序列克隆入pentr/d-topo载体(invitrogen)获得topo-jstps4中间载体,再利用lr酶(gatewaylrclonase™πenzymemix,invitrogen)将topo-jstps4中载体与pk7fwg2.0-procblis载体进行置换反应,使jstps4序列置换入procblis启动子之下,获得pk7fwg2.0-procblis:jstps4表达载体。
2、pk7fwg2.0-procblis:jstps4表达载体转化矮牵牛
(1)获得供转化的矮牵牛叶片愈伤组织
剪取旺盛生长的矮牵牛植株叶片,在自来水轻柔清洗干净。消毒后切成大小适宜的方块置于固体预培养基(4.43g/lms粉+20g/l蔗糖+6g/l琼脂+2mg/l6-ba+0.2mg/lnaa,ph=5.8)上进行预培养,3-4天后叶片拱起,叶片伤口处组织膨大时准备浸染。
(2)pk7fwg2.0-lispro:jstps4转化矮牵牛愈伤组织
将pk7fwg2.0-lispro:jstps4质粒通过冻融法转化农杆菌(gv3101)中,通过pcr检测为阳性克隆后,使用含有spe、rif、gm抗生素的lb培养基在28℃培养至od=0.8,然后4000rmp、4℃离心15min,去上清,再加入等体积的重悬液(1/2ms液体培养基+150μmas)进行重悬。超净台中,将预培养后的矮牵牛叶片放入侵染液中浸泡10min,取出后置于滤纸上吸干水分,然后置于共培养基(4.43g/lms粉(m519)+20g/l蔗糖+8g/l琼脂+2mg/l6-ba+0.2mg/lnaa+15mg/las,ph=5.8)之上,组培室中遮光培养2~3天。为防止农杆菌污染培养基,在培养基表面加铺一层灭菌滤纸。
(3)转基因矮牵牛的获得
将共培养后的叶片使用含头孢(300mg/l)的无菌水轻晃清洗15min,无菌水清洗3遍后在滤纸上吸干表面水分,置于分化培养基(4.43g/lms粉+20g/l蔗糖+8g/l琼脂+2mg/l6-ba+0.2mg/lnaa+300mg/lcef+100mg/lkan,ph=5.8)培养。
当分化苗生长到高度为4~5cm,具有4~5片叶时,转入生根培养基(2.215g/lms+10g/l蔗糖+6g/l琼脂+0.1mg/liba+0.1mg/lnaa+300mg/lcef,ph=5.8)进行培养,4周左右可长出发达的根系,之后移栽到无菌基质中生长。移栽后的植株置于人工气候室进行培养,光照时间为昼/夜=16h/8h,温度为昼/夜=24℃/20℃,湿度为70%。
3、转基因矮牵牛的鉴定及花朵香气成分检测
(1)阳性株的鉴定
提取转基因矮牵牛叶片组织,提取dna,用kana引物进行pcr验证筛选转基因阳性植株。
(2)香气物质的测定
待转基因矮牵牛开始进入花期,取多个单株出现花粉的花朵进行香气成份检测,以相同时间接种、相同环境下生长以及相同开放程度的未转基因矮牵牛刚花朵为对照。
将0.3g的花瓣样品用液氮研麿充分,转移至1.5ml正已烷(色谱级,sigma)试剂中[含有浓度为1ug/ml的内标异丁基苯(isobutylbenzene)],室温涡旋2h,13000rpm离心10min,取上清,使用0.45μm有机膜过滤,过滤后的溶液即可用于检测。
使用气相色谱-质谱联用仪(美国perkinelemer公司clarussq8型号)测定提取物中的香气成分及含量,色谱柱为hp-5色谱柱(30m×0.25mm×0.25μm)。电子轰击(ei)离子源,质量扫描范围:40×500amu。定性分析:将获得的质谱结果在nist11.0质谱数据库(nist11.0msdatalibrary)中进行检索初步定性,再与它们的保留指数(retentionindices,ris)进行比较。定量分析:以提取物溶液中内标的浓度和对应的峰面积计算各组分相对内标的含量,不同样品中同种组分的倍数关系,为内标校正后的倍数关系。
本发明的有益效果:
使用该发明获得的矮牵牛花朵总香气成分,特别是苯甲酸苄酯(benzylbenzoate)和苯甲酸甲酯(methylbenzoate)含量得到了显著提高,能获得新的高香型矮牵牛种质。该技术获得的高香型矮牵牛植株在转化后代中的比例达到50%以上。
附图说明
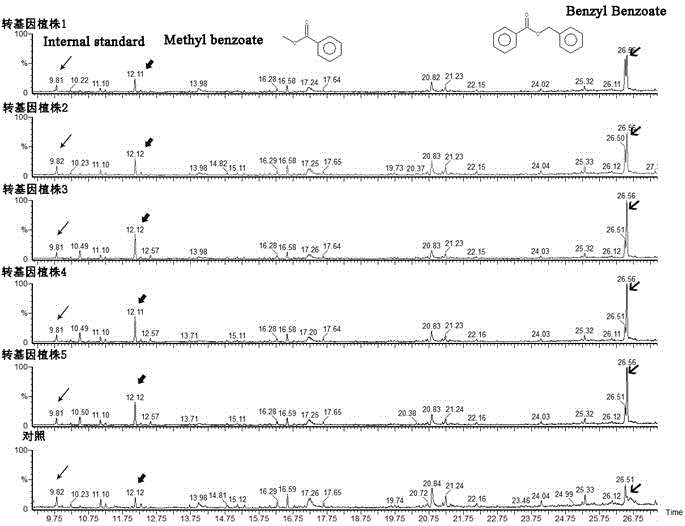
图1为转基因矮牵牛植株(lispro:jstps4)和野生型矮牵牛植株(wt)花朵香气gc-ms检测的tic图。
图2为转基因矮牵牛植株(lispro:jstps4)相比野生型矮牵牛植株(wt)花朵总香气含量以及苯甲酸苄酯(benzylbenzoate)和苯甲酸(benzoicacid)含量差异,图中*表示与野生型相比有显著差异(t-test,n=3,p<0.05)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件
实施例1、构建pk7fwg2.0-procblis:jstps4表达载体
(1)合成花特异性启动子
委托英潍捷基(上海)贸易有限公司合成花特异性启动子procblis(genebank登录号af067601.1)核苷酸序列,序列两端分别带有一个spei和saci酶切位点。
花特异性启动子procblis序列如下,划线部分为酶切位点:
gagctcgcggccgcaagcttatctaataatgtatcaaaatctaaaataaaatttaggttaagaagtgggtgcaatttgttaggcacccacttcttaatgatccatgtgtaatgtttgttaggcacgctaagctggagtgcacattatttgttggctttgtcttgatgtggtaattttatttttgccaaattatcacgtatatttgcccgatcgggcattctaatatctaatctaaaaatataattttaagttagataataatatcttacgaaataaacatttataatatttaaaactaatattaacttttgtccttcaaatatttattatcgtgtcttacgtaacacacgaggtgattatatataaatttaaaacgaatcacagaaaaatttatgtcattaaataattattgatatatattttatttaatttactataatattatctactcgaatcataatttttttaaggtattttgatttacaaacggtttatttcaagtaaaaaacattttggaatgaacatggattatataacatttcgaacaagcgtacaccataagaagttaattaacaataatgtgtatatgtttgtttaatatattaatttagaaaatgaatttatatatgatggtcgagtgattgataatataatacaaatatacaagtttcatttaatatgcgcgggttagtggctagttcaaattacttcatgagcttttctattcaaacatttactattgcataagctgacccaactcttgtattaacccttataaatttaaatgatcagtttgaccatgacagattatattaattccgattagattaattaatttattataattggcaattaaaactcatttattatatattatgtatagtaataaaataattgatgatgttaggatggaagggacgggagatgagtgcagtaattaaattaaggccacatcctatcatatcccagtctataaatacagatccagatccacttcatataagcaagctatcttcccagaaaaccaaaccaccttaaacaagacaaccatctcgagcccgggactagt。
(2)构建pk7fwg2.0-procblis空载体
使用spei和saci酶(thermal)将procblis启动子序列和表达载体pk7fwg2.0分别进行双酶切,使pk7fwg2.0载体上35s启动序列被切除,并适用于与procblis启动子序列相匹配。酶切体系50μl,包含5μldigestbuffer、2μlspei、2μlsaci,1μgpk7fwg2.0或1μgprocblis启动子序列和ddh2o,37℃反应15min。将酶切后载体和启动子序列分别进行回收(axygenpcrcleankit),电泳检测无误后,使用t4连接酶(takara)进行连接。连接体系为10μl,包括1μlt4连接酶、1μl10×ligationbuffer、酶切后的procblis启动子序列、酶切后的pk7fwg2.0载体序列,其中procblis启动子序列和载体亦可摩尔比在3:1至10:1之间(体积视浓度而定),16℃连接过夜。将连接产物与easy-blunt载体(北京全式金)相连,转化大肠杆菌感受态,涂布amp抗性平板,挑取单克隆并进行培养,使用启动了序列特性性引物(f:5’-tctataaatacagatccagatccacttc-3’;r:5’-agcttgccgtaggtggcatcg-3’)进行pcr检测。从pcr阳性的菌液中提取质粒,再次使用spei和saci酶进行双酶切,检测酶切产物,验证procblis启动子是否已成功替换掉pk7fwg2.0的camv35s启动子。将验证呈阳性的质粒送测序,核验序列的准确性。至此,花特异性启动子procblis成功置换掉表达载体pk7fwg2.0的camv35s启动子,获得重构的pk7fwg2.0-procblis表达载体。
(3)扩增茉莉花香气合成关键酶基因jstps4编码序列
选择生长良好,无病虫害的茉莉花苞(混合3个花苞),利用transzolupplusrnakit(北京全式金生物)抽提总rna。用电泳鉴定rna的完整性,然后在分光光度计上测定rna的纯度及浓度。
使用smartertmracecdnaamplificationkit(clontechlaboratories,inc.)进行cdna全长克隆。5’端序列以5’racereadycdna为模板,通过二轮巢式pcr获得:第一轮:upm+jstps4-5-1(5’-gctgaggcttcaagagcggcatcg-3’);第二轮:nup+jstps4-5-2(5’-atggtcaagatgatcgagtcgagcga-3’)。3’端序列以3’racereadycdna为模板,通过二轮巢式pcr获得:第一轮:upm+jstps4-3-1(5’-ggcggattttggggcgagatagacg-3’);第二轮:nup+jstps4-3-2(5’-tgacacccacatacaatgttgacccg-3’),反应程序依据说明书执行。upm和nup为试剂盒提供,5’和3’race序列分别回收,连接easy-blunt克隆载体并转化大肠杆菌感受态dh5α,涂布50μg/mlamp平板,挑单克隆进行菌液pcr验证,阳性菌液送测序。测序结果通过在ncbi网站进行blast(http://blast.ncbi.nlm.nih.gov/)比对已有的数据库(genbank),其核酸序列及编码蛋白与其它物种萜类合成酶同源性高。
将5’和3’序列进行拼接并提交blast分析,并结合ncbi的orffinding(http://www.ncbi.nlm.nih.gov/gorf)预测,获得2535bp茉莉花jstps4蛋白的编码序列。
(4)构建pk7fwg2.0-procblis:jstps4表达载体
设计用于扩增jstps4编码序列全长并连接topo载体的引物(f:caccatggagacgtcaaagtattcctc;r:gatggaacagaaactaaacctcattgg),以cdna为模板,获得的pcr产物,回收后送测序,取测序正确的回收产物与pentr/d-topo载体(invitrogen)相连,连接体系6μl为,包含1.0μltopo载体、100ngpcr回收产物,ddh2o补齐,25℃连接15min。将连接产物全部转化大肠杆菌感受态dh5α,涂布50μg/mlkana平板,挑单克隆进行菌液pcr验证,阳性菌液送测序。
将测序正确的topo-jstps4中间载体,利用lr酶(gatewaylrclonase™πenzymemix,invitrogen)与pk7fwg2.0-procblis载体进行置换反应,反应体系共10μl,包含topo质粒(50-150ng)、pk7fwg2.0-procblis质粒(150ng)、lrclonese2μl,ddh2o补齐,25℃连接2h后加入1μlksolution,再于37℃反应10min。反应结束后,转化大肠杆菌感受态dh5α,涂布50μg/mlspec平板,挑单克隆进行菌液pcr验证,阳性菌液送测序。测序正确的菌液提取质粒,至此,jstps4序列置换入procblis启动子之下,获得pk7fwg2.0-procblis:jstps4过表达载体。
实施例2、pk7fwg2.0-procblis:jstps4表达载体转化矮牵牛
(1)获得供转化的矮牵牛叶片愈伤组织
剪取旺盛生长的矮牵牛植株叶片,在自来水下轻柔清洗干净。在超净台上用2w/v%次氯酸钠消毒6-8min,再用无菌水清洗3次。将消毒后的叶片除去叶脉后切成1×2cm2大小的方块置于预培养基上,配方为4.43g/lms粉+20g/l蔗糖+8g/l琼脂+2mg/l6-ba+0.2mg/lnaa,ph=5.8。培养3-4天后叶片拱起,叶片伤口处组织膨大时准备浸染。
(2)制备含pk7fwg2.0lispro:jstps4表达载体的农杆菌菌液并浸染矮牵牛
将pk7fwg2.0-lispro:jstps4质粒通过冻融法转化农杆菌gv3101中(质粒放入感受态中,冰浴10min,液氮冷激5min,28℃5min,加800μllb在28℃200rpm摇菌4-5h后涂含50μg/mlgm、50μg/mlrif和50μg/mlspec抗生素的平板),通过菌液pcr验证表达载体是否成功转入农杆菌gv3101,再将含表达载体的农杆菌用含有50μg/mlgm、50μg/mlrif和50μg/mlspec三种抗生素的lb培养基28℃、180rpm培养至od约0.8,然后将菌液在4000rmp、4℃离心15min,去除上清,加入等体积的重悬液(1/2ms液体培养基+150μmas)进行重悬,室温静置2小时备用。
超净台中,将(1)中获得的矮牵牛叶片放入制备好的农杆菌重悬液中浸泡10min,取出后置于滤纸上吸干水分,然后置于共培养基上遮光培养2~3天。共培养的培养基配方为4.43g/lms粉(m519)+20g/l蔗糖+8g/l琼脂+2mg/l6-ba+0.2mg/lnaa+15mg/las,ph=5.8。为防止农杆菌污染培养基,在培养基表面加铺一层灭菌滤纸。
(3)转基因矮牵牛的获得
超净台上,将共培养后的叶片使用含头孢(300mg/l)的无菌水轻晃清洗2min,再无菌水清洗3遍,滤纸上吸干表面水分,置于分化培养基培养,配方为4.43g/lms粉+20g/l蔗糖+8g/lq琼脂+2mg/l6-ba+0.2mg/lnaa+300mg/lcef+100mg/lkan,ph=5.8。
当组培瓶中的苗生长至高度为4~5cm,具有4~5片叶时,转入生根培养基培养,配方为2.215g/lms+10g/l蔗糖+6g/l琼脂+0.1mg/liba+0.1mg/lnaa+300mg/lcef,ph=5.8。4周左右可长出发达的根系。
使用长镊子轻柔地将根系生长良好而且发达的组培苗取出,尽量保护根茎部不受伤,以清水轻柔洗去附着在根上的培养基,室温阴处移栽至灭菌基质中,基质配方为蛭石:灭菌腐殖土=1:2/v:v。移栽后的植株置于人工气候室进行培养,光照时间为昼/夜=16h/8h,温度为昼/夜=24℃/20℃,湿度为70%。
实施例3、转基因矮牵牛的鉴定及花朵香气成分检测
(1)阳性株的鉴定
采用ctab法提取以转基因烟草基因组dna,以此dna为模板,用kana抗性引物(kana-f:5’-atgattgaacaagatggattgcacgcag-3’;kana-r:5’-ctcagaagaactcgtcaagaaggcga-3’)进行pcr扩增以筛选转基因阳性植株。
(2)转基因植株香气的测定
待移栽后的转基因矮牵牛开始进入花期,在花粉阶段取6个转基因系列各3株的花朵进行香气成份检测,以相同时间接种、相同环境下生长以及相同开放程度的未转基因矮牵牛刚花朵为对照。
将0.3g的花瓣样品用液氮研麿充分,转移至1.5ml正已烷(色谱级,sigma)溶液[含有浓度为1ug/ml的内标异丁基苯(isobutylbenzene)],室温涡旋2h,13000rpm离心10min,取上清,使用0.22μm有机膜过滤,过滤后的溶液转移至2mlgc小瓶子中用于检测。
使用气相色谱-质谱联用仪(美国perkinelemer公司clarussq8型号)测定提取物中的香气成分及含量,色谱柱为hp-5色谱柱(30m×0.25mm×0.25μm)。色谱条件为:50℃3min,以6℃/min速度上升至200℃,保持1min,再以20℃/min速度上升至240℃,保持2min,共33min。质谱条件为:电子轰击(ei)离子源,质量扫描范围:40×500amu。定性分析:将获得的质谱结果在nist11.0质谱数据库(nist11.0msdatalibrary)中进行检索初步定性,再与它们的保留指数(retentionindices,ris)进行比较。定量分析:以提取物溶液中内标的浓度和对应的峰面积计算各组分相对内标的含量,不同样品中同种组分的倍数关系,为内标校正后的倍数关系。
结果表明,转基因矮牵牛与对照(未转化)矮牵牛花朵相比,在相同的培养条件下,所有检测的转基因矮牵牛花朵总香气物质的峰面积,特别是其中的苯甲酸苄酯(benzylbenzoate)和苯甲酸甲酯(methylbenzoate)的峰面积均有显著增加(图1),表明转基因矮牵牛花朵中总香气物质、苯甲酸苄酯总和苯甲酸甲酯的含量均得到显著提升。经内标校正,结果显示6个转基因系中有4个系与对照在总香气物质、苯甲酸苄酯、苯甲酸甲酯均有显著差异,其中总香气含量为对照的1.09-1.38倍,苯甲酸苄酯增加1.21-3.94倍,苯甲酸甲酯增加1.57-14.35倍(图2),表明利用这种分子技术能让转基因后的矮牵牛花朵总香气成分,特别是苯甲酸苄酯和苯甲酸甲酯含量得到了显著提高,能获得新的高香型矮牵牛种质。该技术获得的高香型矮牵牛植株在转化后代中的比例达到50%以上。
sequencelisting
<110>福建农林大学
<120>一种创制高香型矮牵牛新种质的分子方法
<130>12
<160>12
<170>patentinversion3.3
<210>1
<211>2535
<212>dna
<213>人工序列
<400>1
atggagacgtcaaagtattcctcaattaaatctctagttagcgagatcaaggaggagtat60
ttctcaagtgataatcctcatgcatttgttcctgcatctgcctatgatacagcttggtta120
gccatgattcctgctgataatgcacgtaaacaaaatcgtcccatgttcaagaattgcttg180
aactggatactcgaaaaccaaaaaagcggcggattttggggcgagatagacgaggagggt240
ttttcatctatcgatgctctacccgcaactcttgtttgcatggttgccctcaaaacatgg300
aatataggccaaaaaaatatagaaaaaggattgaagtttgtaaattccaacatagagatg360
ctttcggaaataaatgacgaggatcttcctcgacggtttgtcatggtttttccggggatg420
atcgcgcttgctcaagaagccggcatcgagcttgttttacctcagcgatcgggaggagca480
atagccaatattttcttcagacgccaacaaatactgaaaaaggaagagctggtcgatgag540
tcgcaatcttgtgagcttcctgtgttggcgtacctagaaagcttgacacccacatacaat600
gttgacccgcgccaaatagttagccatttgagcgatgatggttcgttatttcagtcaccc660
tctgcaacagtttccgcatatatggccacaggagacacgaactgtagaagatatctcgag720
tctcttgtagaaaattgtccaaatggaggagtaccagcaaggtatcctgcagacgaagag780
ctaatagagctttccatggttgatcatcttcaaaggctggggttggctgagcatttcaac840
caagagattgatgagattctcgggaaaattgacaggaatcagaagaattccgtgaagtcc900
aagccaatgaaaacaaacattttacaacccatgaaattatacaaggactccttggctttt960
cgactccttcgcatgcaaggatatgatgtaaatccagggaagttttgctggtttctgaat1020
gatgcagaaatcctaaagcatatggaggaaaactgtgaaaaattcattacagtgatgcac1080
agtgtatatacagccacagatttacaatttccaggagagtatgaattagaagaagcaaga1140
tcattttccaaaagaattcttcaaaaatcaatcaaaccaaactgggatcatgactttatg1200
cattccaagggattgcacaatgtggttaagcatgagttgaagcttccgtggatcgctcga1260
ctcgatcatcttgaccataggaagtggattgaagaatataaatccaccccaatgtggatt1320
gggagtgattctttttacaggttgccatttctagatgacaaaaagctaatgcagcttgct1380
gtcgaaaattatgagtttcgacaattgatcttcaaaaatgaattagaggaactcaaaagg1440
tggagtgtgaaatggggactcagtaacatgggatttgggagagaaaaaacaacatattta1500
tactttgctgttgctaccaacattttccagcctataaattcaactggtcgttcaattatt1560
gcaaaagctgcaataattgtcacagttgctgatgatttctatgacatggaaggttctctt1620
aatgagttggaaaccttaacagatgcaattaaaagatgggatggaaaaggactgcaagga1680
catagtaacactatctttagcgtccttgatcatttgatcgaagacattgcattgaagttc1740
gaaacacaagagagaaatgaaatgagggaaaaacttcgggatatatggcgcgaaacattt1800
gattcttggatggtggagaaaagttggagccacagtggatatataccctccatggatgag1860
tatcttaaaaccgggatgatatcaatctctgcacacatgcttgctcttctagcctcatgt1920
ttttcgaatccacgcatacaaaaggcagagctcaaacctacggaatatgagaacatcaca1980
aaattgctcatgattatagcccgattgttgaacgacactcaaagttatgagaaagaaaag2040
gcagatgggaaaatgaatcttgtgttgctccacttgaacgaaaatccagaggtctgtatc2100
gaagaatcgattgcctacgtaaacgagattgtgggactcaaatggaaagaatttctcaag2160
catgttttgatggacggttctgatgatatgccaaaatcatgcaagagaattcatctggct2220
tgtttgaaagcatttcaaatgtttttcaactcagggaacttgtttgatagcaagacagca2280
cttgtggatgacattaagaaagctatttacttacctattaatgattgcgagccgatgccg2340
ctcttgaagcctcagccattgacaattaatgggacaaccaaacacagagttcctaaagta2400
tcggcaagttggaaccgagccataaaaaatccaaagaccataagtatgatcaaacagtct2460
aatattgggaaaatatctattaatcaaactgcaaaacttcatgttccaatgaggtttagt2520
ttctgttccatctga2535
<210>2
<211>1069
<212>dna
<213>人工序列
<400>2
gagctcgcggccgcaagcttatctaataatgtatcaaaatctaaaataaaatttaggtta60
agaagtgggtgcaatttgttaggcacccacttcttaatgatccatgtgtaatgtttgtta120
ggcacgctaagctggagtgcacattatttgttggctttgtcttgatgtggtaattttatt180
tttgccaaattatcacgtatatttgcccgatcgggcattctaatatctaatctaaaaata240
taattttaagttagataataatatcttacgaaataaacatttataatatttaaaactaat300
attaacttttgtccttcaaatatttattatcgtgtcttacgtaacacacgaggtgattat360
atataaatttaaaacgaatcacagaaaaatttatgtcattaaataattattgatatatat420
tttatttaatttactataatattatctactcgaatcataatttttttaaggtattttgat480
ttacaaacggtttatttcaagtaaaaaacattttggaatgaacatggattatataacatt540
tcgaacaagcgtacaccataagaagttaattaacaataatgtgtatatgtttgtttaata600
tattaatttagaaaatgaatttatatatgatggtcgagtgattgataatataatacaaat660
atacaagtttcatttaatatgcgcgggttagtggctagttcaaattacttcatgagcttt720
tctattcaaacatttactattgcataagctgacccaactcttgtattaacccttataaat780
ttaaatgatcagtttgaccatgacagattatattaattccgattagattaattaatttat840
tataattggcaattaaaactcatttattatatattatgtatagtaataaaataattgatg900
atgttaggatggaagggacgggagatgagtgcagtaattaaattaaggccacatcctatc960
atatcccagtctataaatacagatccagatccacttcatataagcaagctatcttcccag1020
aaaaccaaaccaccttaaacaagacaaccatctcgagcccgggactagt1069
<210>3
<211>28
<212>dna
<213>人工序列
<400>3
tctataaatacagatccagatccacttc28
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
agcttgccgtaggtggcatcg21
<210>5
<211>24
<212>dna
<213>人工序列
<400>5
gctgaggcttcaagagcggcatcg24
<210>6
<211>26
<212>dna
<213>人工序列
<400>6
atggtcaagatgatcgagtcgagcga26
<210>7
<211>25
<212>dna
<213>人工序列
<400>7
ggcggattttggggcgagatagacg25
<210>8
<211>26
<212>dna
<213>人工序列
<400>8
tgacacccacatacaatgttgacccg26
<210>9
<211>27
<212>dna
<213>人工序列
<400>9
caccatggagacgtcaaagtattcctc27
<210>10
<211>27
<212>dna
<213>人工序列
<400>10
gatggaacagaaactaaacctcattgg27
<210>11
<211>28
<212>dna
<213>人工序列
<400>11
atgattgaacaagatggattgcacgcag28
<210>12
<211>26
<212>dna
<213>人工序列
<400>12
ctcagaagaactcgtcaagaaggcga26
- 还没有人留言评论。精彩留言会获得点赞!