野葡萄VyGOLS基因及其编码蛋白在干旱胁迫中的应用的制作方法
本发明涉及野葡萄vygols基因及其编码蛋白在干旱胁迫中的应用,属于植物基因工程技术领域。
背景技术:
葡萄种类繁多,具有重要的食用价值和经济价值。干旱(drought)对葡萄生长发育过程和产量品质有严重的影响,已经成为制约葡萄生长和提高果品质量的主要因素之一,尤其是近年来全球气候的变化和我国南方干旱的频频出现,使葡萄产业受到很大的威胁。在世界范围内都面临缺水问题的大背景之下,发掘抗旱葡萄资源、研究葡萄抗旱基因对提高葡萄抗旱性、培育抗旱新品种及节水栽培等都具有重要的科学价值和意义。
葡萄的抗旱性(droughtresistance)是由多基因控制的数量性状,对干旱等逆境应答和适应需要多个基因的参与,且受到多种途径的调控。在轻度干旱胁迫时,渗透调节是植物体适应水分亏缺的主要途径,植物一方面提高合成渗透调节物质相关酶基因的转录水平,促进基因的表达,增加表达产物的积累;另一方面植物增强抗氧化、解毒相关酶基因(如sod、cat、gst等)的表达水平。当胁迫强度超出渗透调节的能力时,lea蛋白及糖类的脱水保护物质积累,保护生物大分子和生物膜系统免受损害。由此,葡萄的抗旱能力取决于自身的组织结构和生理特性,归根结底在于分子水平的差异。随着葡萄全基因组序列的公布,许多与干旱胁迫相关的基因及其调控因子已经得到分离与克隆,并转化到葡萄或模式植物中并对其功能进行分析和验证。
gols是棉子糖合成的关键限速酶。目前,在拟南芥中已经鉴定出7个gols基因和三个可能的gols基因,atgols1被干旱,高盐和高温胁迫诱导表达;atgols2被干旱和高盐胁迫诱导表达;而atgols3基因仅被低温胁迫诱导表达。在拟南芥中过量表达atgols2基因使转基因植物叶片中大量积累肌醇半乳糖苷和棉子糖,并显著提高了植株抗旱能力和强氧化剂-甲基紫精(mv)的耐受性。在水稻中超表达atgols2,使转基因水稻耐旱能力显著提高,同时在干旱条件下转基因水稻株系产量显著高于对照。将一个盐芥中的肌醇半乳糖苷合成酶(tsgols2)导入拟南芥中,提高了转基因拟南芥的耐盐和耐渗透胁迫的能力(selvaraj,m.g.,etal.,(2017).overexpressionofanarabidopsisthalianagalactinolsynthasegeneimprovesdroughttoleranceintransgenicriceandincreasedgrainyieldinthefield.plantbiotechnologyjournal,15(11),1465-1477.)。用强光,高温同时处理或者过氧化氢处理拟南芥植株会使atgols1和atgols2基因mrna表达量上升。拟南芥atgols1基因的突变体atgols1受到高温胁迫后叶片中检测不到肌醇半乳糖苷和棉子糖积累,这个结果表明atgols1基因的功能可能是负责在热激胁迫下合成肌醇半乳糖苷。在烟草中超表达苜蓿肌醇半乳糖苷合成酶基因(mfgols1)提高了转基因烟草耐寒和耐渗透能力,同时转基因植株体内rfos含量显著提高。
虽然,现有技术中已经有了一些物种中gols基因的报道,但是野葡萄中的gols基因尚未有人报道,人们对于野葡萄gols基因的具体功能也缺乏认识。
技术实现要素:
本发明的目的是提供一种野葡萄vygols基因,其能够增加转基因植株中抗逆相关物质的积累和抗旱相关基因的表达,促进转基因植株抗旱性增强。
本发明还提供了野葡萄vygols蛋白,该蛋白能够促进转基因植株中积累抗逆相关物质导致转基因植株抗旱性增强。
本发明还提供了包含野葡萄vygols基因的重组表达载体,该载体携带野葡萄vygols基因,因此能够超表达vygols基因,进而增强植物抗旱性。
本发明还提供了上述的包含野葡萄vygols基因的重组表达载体的制备方法,能够制得该载体。
本发明还提供了上述的野葡萄vygols基因和重组表达载体在植物品种育种中的应用,能够获得抗旱植物品种。
为了实现上述目的,本发明所采用的技术方案是:
野葡萄vygols基因,其编码的氨基酸序列如seqidno.2所示。
本发明中利用强启动子(花椰菜花叶病毒35s启动子)驱动原理的转基因技术,将vygols基因的超量表达载体转入拟南芥中,从而获得转基因拟南芥植株;实验证明,相对于转化空载体的拟南芥植株,超量表达vygols基因导致转基因拟南芥中抗逆相关物质的积累和抗旱相关基因的表达,转基因植株抗旱性增强。
野葡萄vygols基因,其核苷酸序列如seqidno.1中的186-1196位所示。
上述的核苷酸序列为野葡萄中天然存在的序列,也可以根据该序列进行密码子优化,得到的优化序列也具有同样的效果。
野葡萄vygols蛋白,其氨基酸序列如seqidno.2所示。
野葡萄vygols蛋白是一个含336个氨基酸的蛋白,该蛋白能够促进转基因植株中积累抗逆相关物质导致转基因植株抗旱性增强。
重组表达载体,所述重组表达载体包含野葡萄vygols基因,所述野葡萄vygols基因的核苷酸序列如seqidno.1中的186-1196位所示。
本发明中的重组表达载体为植物过量表达载体,能够在植物中超表达目的基因。
重组表达载体的制备方法,包括:根据如seqidno.1中的186-1196位所示的序列设计引物,克隆所述野葡萄vygols基因,然后将所述野葡萄vygols基因连接到pcambia2300植物表达载体上,即得。
本发明中将野葡萄vygols基因开放阅读框连接至植物过量表达载体pcambia2300上,能够形成重组表达载体pcambia2300-vygols。
上述的野葡萄vygols基因在植物品种育种中的应用;具体的,在植物抗旱品种育种中的应用;更为具体的,在拟南芥抗旱品种育种中的应用。上述的的重组表达载体在植物品种育种中的应用;具体的,在植物抗旱品种育种中的应用;更为具体的,在拟南芥抗旱品种育种中的应用。
本发明通过植物基因工程技术,从燕山葡萄中分离克隆出与抗旱相关基因完整编码区段的dna片段,并验证了该基因的功能,发现超量表达之后转基因拟南芥中抗逆相关物质的积累和抗旱相关基因的表达,转基因植株抗旱性增强。因此,野葡萄vygols基因及其重组表达载体能够用于植物抗旱品种育种。
附图说明
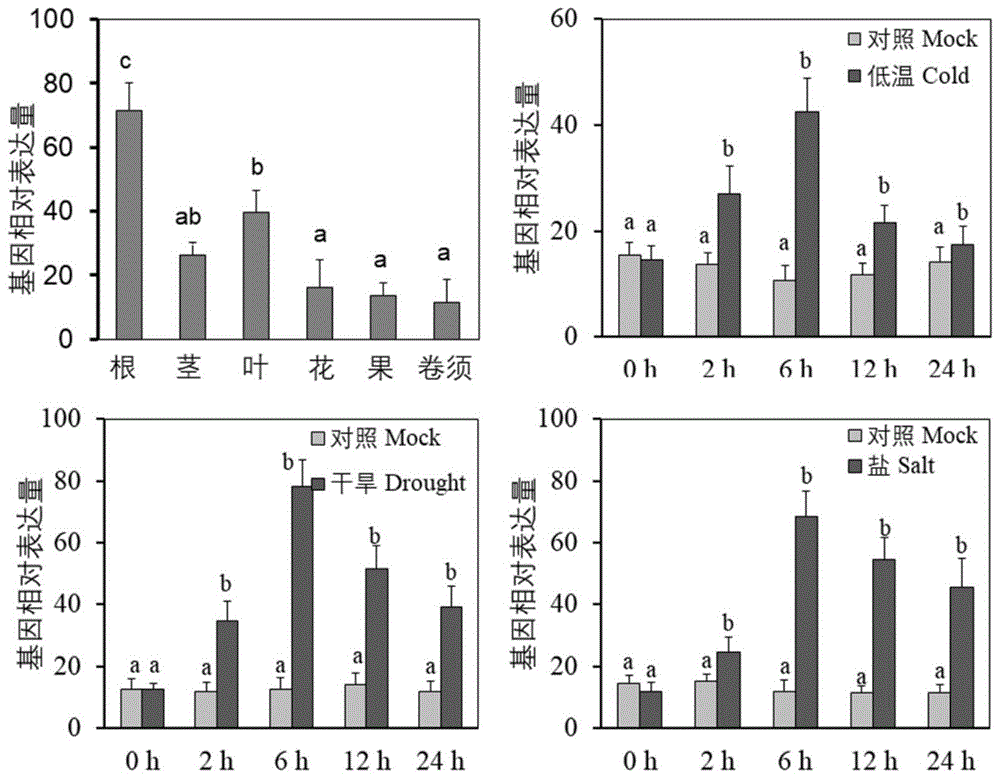
图1为本发明中野葡萄vygols基因表达特性分析图;
图2为本发明中野葡萄vygols基因过量表达载体的鉴定图;
图3为本发明中转vygols基因拟南芥植株的pcr鉴定图;
图4为本发明中转vygols基因拟南芥植株的抗旱性鉴定图;
图5为本发明中转vygols基因拟南芥植株的生理特性分析图;
图6为本发明中转基因拟南芥植株中抗旱相关基因的表达分析图。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。除特殊说明的之外,各实施例及试验例中所用的设备和试剂均可从商业途径得到。
野葡萄vygols基因的实施例1
本实施例中野葡萄vygols基因,其核苷酸序列如seqidno.1中的186-1196位所示。
野葡萄vygols蛋白的实施例1
本实施例中野葡萄vygols蛋白,其氨基酸序列如seqidno.2所示。
重组表达载体的实施例1
本实施例中重组表达载体包含野葡萄vygols基因,所述野葡萄vygols基因的核苷酸序列如seqidno.1中的186-1196位所示。
重组表达载体的制备方法的实施例1
本实施例中重组表达载体的制备方法,包括:根据如seqidno.1中的186-1196位所示的序列设计引物,克隆所述野葡萄vygols基因,然后将所述野葡萄vygols基因连接到pcambia2300植物表达载体上,即得。
野葡萄vygols基因在植物品种育种中的应用的实施例1
本实施例中野葡萄vygols基因能够增加转基因植株中抗逆相关物质的积累和抗旱相关基因的表达,促进转基因植株抗旱性增强,因此可以用于植物抗旱品种育种中的应用,具体的可以用于拟南芥抗旱品种的育种。
重组表达载体在植物品种育种中的应用的实施例1
本实施例中重组表达载体包含野葡萄vygols基因,因此可以将其转化入植物中,以得到抗旱的植物品种。
试验例1葡萄vygols基因的表达特性分析
燕山葡萄组培苗继代培养16d后,选择生长健壮表现一致的幼苗用于各种逆境处理。
干旱处理:将葡萄幼苗从培养基中拔出,置于滤纸上暴露在室温为(32±1)℃、相对湿度为55%、光周期为光照14h/黑暗10h的条件下处理,在0、2、6、12、24h取样。
低温处理:将组培苗置于温度为(4±1)℃、相对湿度为75%、光周期为光照14h/黑暗10h的条件下培养,在0、2、6、12、24h取样。
盐胁迫:在三角瓶中加入20ml100mmol·l-1的nacl溶液,在温度为(25±1)℃、相对湿度为75%、光周期为光照14h/黑暗10h的条件下培养,在0、2、6、12、24h取样。
在三角瓶中加入等体积的蒸馏水作为盐胁迫处理的对照。正常培养的组培苗作为干旱和低温处理的对照。
在大田生长8~10a的燕山葡萄,在转色期取葡萄果实,于盛花期取根系(第一新生侧根)、茎(新展开叶下第4~5片叶的茎段)、叶(新展开叶下第4~5片)、花序和卷须(新生枝条的第1个枝)等样品。用plus植物总rna提取试剂盒(天根)提取葡萄叶片总rna。普通反转录用primescriptii1ststrandcdnasynthesiskit(takara)合成cdna第一链。
具体操作步骤如下:在pcr管中加入:random6mers(50μm)1μl,dntpmixture(10mmeach)1μl,totalrna2μg,rnasefreedh2o补齐至10μl,充分混匀,瞬时离心使溶液至pcr管底部。在pcr仪上65℃反应5min,冰上急冷。
根据vygols基因序列设计实时荧光定量pcr引物,
正向引物序列为qrt-vygols-f:5'-ggggactatgtgaaaggggtt-3'(如seqidno.3所示);
反向引物序列为qrt-vygols-r:5'-ggatttggttctcaggaggg-3'(如seqidno.4所示)。
以vygapdh基因为内参,
正向引物序列为qrt-vygapdh-f:5'-cccttgtcctcccaactct-3'(如seqidno.5所示);
反向引物序列为qrt-vygapdh-r:5'-ccttctcagcactgtccct-3'(如seqidno.6所示)。
实时荧光定量pcr按照takarasybr®premixextaq™ii(perfectrealtime)说明在bio-radiq5real-timepcrdetectionsystem(bio-radlaboratories,hercμles,ca)上进行。25μl的反应体系:1μl的反转录模板;正反向引物各1μl;12.5μl的2×sybr®premixextaq™(2×);9μl的nuclease-freewater。反应程序为:95℃,30s;40cyclesof95℃for5s;57℃for30s;72℃for30s。结果采用2-δδc(t)法进行分析。
结果如图1所示,结果表明vygols基因主要在根系中表达,其次在叶里表达量较高,在茎、花、果、卷须中的表达量较低;在低温、干旱、高盐处理后2h,vygols转录本快速积累,在6h大道峰值,随后逐渐降低。
试验例2野葡萄vygols基因过量表达载体的构建
为研究葡萄vygols基因的功能,将包含有vygols基因编码区在内的共1011bp的orf片段正确插入植物过量表达载体pcambia2300-gfp上。
根据前期克隆到的vygols基因orf序列,设计可以扩增vygols基因orf的上下游引物vygols-orf-f和vygols-orf-r;根据pcambia2300-gfp载体上的酶切位点,在引物vygols-orf-f的5’端加上酶切位点xbai,具体序列为:
vygols-orf-xbai-f:5’-gggtctagaatggccccaggagtgcccgcaga-3’(如seqidno.7所示);
在引物vygols-orf-r的5’端加上酶切位点kpni,具体序列为:
vygols-orf-kpni-r:5’-gggggtacctcaagcagcagagggtgcgggaa-3’(如seqidno.8所示)。
以pmd18-t-vygols质粒为模板,用vygols-orf-xbai-f与vygols-orf-kpni-r进行扩增,回收目的条带后连接到pmd19-t克隆载体,转化top10感受态细胞,在附加amp的lb培养基上进行蓝白斑筛选,分别经过菌液pcr与质粒酶切检测,pmd19-t-vygols阳性克隆送公司测序。用xbai、kpni双酶切重组克隆载体pmd19-t-vygols与植物表达载体pcambia2300-gfp,回收线性化载体与目标片段,连接并转化top10,经kan抗生素筛选,挑取单克隆摇菌,菌液检测后提质粒酶切检测。检测结果如图2所示,m:dna分子质量标准;泳道1:vygols基因过量表达载体的双酶切鉴定;泳道2:vygols基因过量表达载体;结果表明本试验例中构建成功植物表达载体pcambia2300-vygols。将其转化入农杆菌中,用于转染植物。
试验例3葡萄vygols基因在拟南芥中的过量表达
将含有重组植物表达载体的农杆菌划线培养在lb平板(含60mg/l的gent,100mg/l的kan)上划线,置于28℃条件下培养24h;挑取单克隆在10mllb液体培养基(附加相应的抗生素)中,在28℃条件下培养24h;取5ml菌液转移至50ml新鲜的lb液体培养基中,在28℃条件下继续培养,至菌液od600达到0.6左右;转移至离心瓶或离心管中,室温条件下,转速为4000rpm离心10min,去除上清液收集菌体;重悬于渗透缓冲液(0.5×ms,5%蔗糖,0.03%silwetl-77(gehealth)),调od600至0.8;将拟南芥花序上已有的果荚去掉,花序完全浸入渗透液中10-30s(或用移液器直接将渗透液滴在花序上),立即去掉拟南芥叶或茎秆上的渗透液,将植株平放在托盘中,用塑料薄膜覆盖托盘,24h后取下薄膜,于温室中继续培养;为提高转化效率,7天之后用同样方法再次侵染;经过转化的拟南芥植株进行正常管理,待果荚现白色时进行收种子。
对上述通过卡那霉素初步筛选得到的vygols转基因植株及转化空载体植株,进一步在dna水平进行鉴定,采用改进的sds微量提取法提取总dna。分别以上述所提取的vygols转基因植株及转化空载体植株的dna为模板,在35s启动子上设计上游引物,与基因特异的下游引物组成引物对,进行pcr检测。引物如下所示:
检测引物-f:5’-gaagatgcctctgccgacagtg-3’(如seqidno.9所示);
检测引物-r:5’-agtactccgtcggctactgcca-3’(如seqidno.10所示)。反应体系(25µl)为:10×buffer2.5µl;dntps0.5µl;taq酶0.3µl;ddh2o16.2µl;primerf1.5µl;primerr1.5µl;dna2.5µl。反应程序为:94℃预变性5min;35个循环,94℃变性30s,58℃退火30s,72℃延伸1min;72℃延伸10min,4℃保存。pcr产物在1%琼脂糖凝胶上进行电泳检测。
检测结果如图3所示,m:dna分子质量标准;泳道1:以ddh2o为模板进行pcr;泳道2:以转化空载体的拟南芥dna为模板进行pcr;泳道3:以pcambia2300-vygols质粒dna为模板进行pcr;泳道4-6:以转化vygols基因的转基因拟南芥dna为模板进行pcr。从图中可以看出,本试验例成功获得了转vygols基因拟南芥植株,分别命名为oe#1、oe#2、oe#3。
试验例4转基因拟南芥植株的抗旱性鉴定
vygols转基因植株和转化空载体的拟南芥(ev表示)在ms培养基上生长7天后,转移至营养钵中,正常浇水20天使其生长成健壮的幼苗。然后停止给拟南芥幼苗浇水即进行干旱处理,直到第7天部分拟南芥植株叶片出现明显的失水萎焉症状。之后对所有植株进行复水,48小时后观察植株生长状况。
干旱处理前后及复水后拟南芥植株的表现型通过拍照记录,结果如图4所示,从图4中可以看出与转化空载体拟南芥相比,转vygols基因拟南芥植株oe#1、oe#2、oe#3的抗旱能力明显增强。
试验例5转基因拟南芥植株生理生化特性分析
失水率的测定:vygols转基因植株和转化空载体植株正常生长3周后,分别取约0.2g的莲座叶进行失水率的测定。将采取的莲座叶放置于干燥的滤纸上,每隔10min测量一次叶片的鲜重(fw),直到测至50min时失水率测定结束。将每一次测定的失水量与第一次测定的鲜重的比值作为失水率。
电解质渗漏率(电导率)的测定:将叶片装入离心管中,用超去离子水定容至10ml,室温下振荡1小时后测定溶液的电导值,记为煮前c1。随后将溶液连同叶片置于沸水中煮沸10min后,等温度降至室温后测定电导值,记为c2。将c1与c2的比值(c1/c2)作为相对电解质渗漏值。
检测结果如图5所示,(a)转基因拟南芥植株中vygols基因的表达量检测;(b)转vygols基因拟南芥植株在干旱处理18d后的存活率统计;(c)转vygols基因拟南芥叶片相对失水率;(d)转vygols基因拟南芥植株在干旱处理18d后的相对电导率。从图中可以看出,转基因拟南芥植株中vygols基因表达量较高,存活率相对于转化空载体的植株显著提高;相对于转化空载体植株,转vygols基因拟南芥植株中失水率和电导率显著降低。
试验例6转基因拟南芥抗旱相关基因表达分析
用plus植物总rna提取试剂盒提取干旱处理后的转基因拟南芥叶片总rna。普通反转录用primescriptii1ststrandcdnasynthesiskit(takara)合成cdna第一链。具体操作步骤如下:在pcr管中加入:random6mers(50μm)1μl,dntpmixture(10mmeach)1μl,totalrna2μg,rnasefreedh2o补齐至10μl,充分混匀,瞬时离心使溶液至pcr管底部。在pcr仪上65℃反应5min,冰上急冷。以拟南芥atactin为内参基因,检测转基因拟南芥植株中抗旱相关基因atcor15a、aterd15、atrd29a、atp5cs1基因的表达。所设计引物如下所示:
qrt-atactin-f:5’-cggtggttctatcttggcatc-3’(如seqidno.11所示);
qrt-atactin-r:5’-gtctttcgcttcaataacccta-3’(如seqidno.12所示);
qrt-atcor15a-f:5’-cagcggagccaagcagagcag-3’(如seqidno.13所示);
qrt-atcor15a-r:5’-catcgaggatgttgccgtcacc-3’(如seqidno.14所示);
qrt-aterd15-f:5’-ccagcgaaatggggaaacca-3’(如seqidno.15所示);
qrt-aterd15-r:5’-acaaaggtacagtggtggc-3’(如seqidno.16所示);
qrt-atrd29a-f:5’-gttactgatcccaccaaagaaga-3’(如seqidno.17所示);
qrt-atrd29a-r:5’-ggagactcatcagtcacttcca-3’(如seqidno.18所示);
qrt-atp5cs1-f:5’-cgacggagacaatggaattgt-3’(如seqidno.19所示);
qrt-atp5cs1-r:5’-gatcagaaatgtgtaggtagc-3’(如seqidno.20所示)。
实时荧光定量pcr按照takarasybr®premixextaq™ii(perfectrealtime)说明在bio-radiq5real-timepcrdetectionsystem(bio-radlaboratories,hercμles,ca)上进行。25μl的反应体系:1μl的反转录模板;正反向引物各1μl;12.5μl的2×sybr®premixextaq™(2×);9μl的nuclease-freewater。反应程序为:95℃,30s;40cyclesof95℃for5s;57℃for30s;72℃for30s。结果采用2-δδc(t)法进行分析。
检测结果如图6所示,从图6中可以看出,在干旱条件下,与转化空载体拟南芥相比,转基因拟南芥植株中抗旱相关基因表达量明显升高,表明本发明中的野葡萄vygols基因,能够增加转基因植株中抗逆相关物质的积累和抗旱相关基因的表达,促进转基因植株抗旱性增强。
<110>河南科技大学
<120>野葡萄vygols基因及其编码蛋白在干旱胁迫中的应用
<160>20
<170>siposequencelisting1.0
<211>1011
<212>dna
<213>野葡萄
<221>vygols基因
<400>1
gcgaaaccgccccctttttgttggtacccgggaaaccggccattacggccggggaggaac60
aaaggcaaagtagggtggcatccacagtgttgctggtttactttcccaaccctcctcacc120
accaactctctccttaacatttttcttgcaccaacttgaaatctcaccccaaataaacca180
caacaatggccccaggagtgcccgcagatgtgtttacagccggcggaaaggtttccaccc240
tcaacgcaggctactcaaagggggcctacgtcacatttttagctggaaacggggactatg300
tgaaaggggttgttgggttggctaagggtttgcgcaaggtgaagagcgcgtaccctcttg360
tggttgcaatgttgccggatgtgcctgaggagcaccgtgagatcttaaagtctcagggct420
gcataattcgtgaaattgagcccatctaccctcctgagaaccaaatccagtttgcaatgg480
catactacgtcatcaactattccaaactccgtatttggaatttcgaggaatacagcaaga540
tggtgtatttggatgctgatatccaagtttacgacaacatagaccaccttatggacgccc600
cggacggctacttttacgcggtaatggactgcttctgtgagaagacatggagtcacactc660
cccagtactccgtcggctactgccagcagtgcccggacaaggtgacttggcccgctgaga720
tgggttcacctccacctttgtacttcaacgctgggatgttcgtctttgagcctagccgtt780
tgacttatgaaagccttctccatactctacggatcactcctccgaccgcctttgccgagc840
aagatttcttgaacatgttcttccaacacatgtacaagcccatccctctcgtatacaact900
tggttctagcaatgctgtggcgccacccggagaacgttgagctcgaccaggtcaaggtgg960
tgcactactgtgctgctggatcaaagccatggagatacactgggaaagaagcaaacatgg1020
agagagaggacatcaagatgttggtagccaaatggtgggacatttacaatgataagtctc1080
tggatttcaaggctgaggacagtgttccagagggagaaggattctctaggccatcgatca1140
tggcttccatgcctgagcctgcaatctcctatattcccgcaccctctgctgcttgaagat1200
tacaaatctttaggagagagtgtattgaagctcagggtgtgatctatctctttttctatt1260
taataccttttccaaaggctacttggt1287
<211>336
<212>prt
<213>野葡萄
<221>vygols蛋白
<400>2
metalaproglyvalproalaaspvalphethralaglyglylys
151015
valserthrleuasnalaglytyrserlysglyalatyrvalthr
202530
pheleualaglyasnglyasptyrvallysglyvalvalglyleu
354045
alalysglyleuarglysvallysseralatyrproleuvalval
505560
alametleuproaspvalproglugluhisarggluileleulys
657075
serglnglycysileilearggluilegluproiletyrpropro
808590
gluasnglnileglnphealametalatyrtyrvalileasntyr
95100105
serlysleuargiletrpasnphegluglutyrserlysmetval
110115120
tyrleuaspalaaspileglnvaltyraspasnileasphisleu
125130135
metaspalaproaspglytyrphetyralavalmetaspcysphe
140145150
cysglulysthrtrpserhisthrproglntyrservalglytyr
155160165
cysglnglncysproasplysvalthrtrpproalaglumetgly
170175180
serproproproleutyrpheasnalaglymetphevalpheglu
185190195
proserargleuthrtyrgluserleuleuhisthrleuargile
200205210
thrproprothralaphealagluglnasppheleuasnmetphe
215220225
pheglnhismettyrlysproileproleuvaltyrasnleuval
230235240
leualametleutrparghisprogluasnvalgluleuaspgln
245250255
vallysvalvalhistyrcysalaalaglyserlysprotrparg
260265270
tyrthrglylysglualaasnmetgluarggluaspilelysmet
275280285
leuvalalalystrptrpaspiletyrasnasplysserleuasp
290295300
phelysalagluaspservalprogluglygluglypheserarg
305310315
proserilemetalasermetprogluproalailesertyrile
320325330
proalaproseralaala
335336
<211>21
<212>dna
<213>人工序列
<221>qrt-vygols-f
<400>3
ggggactatgtgaaaggggtt21
<211>20
<212>dna
<213>人工序列
<221>qrt-vygols-r
<400>4
ggatttggttctcaggaggg20
<211>19
<212>dna
<213>人工序列
<221>qrt-vygapdh-f
<400>5
cccttgtcctcccaactct19
<211>19
<212>dna
<213>人工序列
<221>qrt-vygapdh-r
<400>6
ccttctcagcactgtccct19
<211>32
<212>dna
<213>人工序列
<221>vygols-orf-xbai-f
<400>7
gggtctagaatggccccaggagtgcccgcaga32
<211>32
<212>dna
<213>人工序列
<221>vygols-orf-kpni-r
<400>8
gggggtacctcaagcagcagagggtgcgggaa32
<211>22
<212>dna
<213>人工序列
<221>检测引物-f
<400>9
gaagatgcctctgccgacagtg22
<211>22
<212>dna
<213>人工序列
<221>检测引物-r
<400>10
agtactccgtcggctactgcca22
<211>21
<212>dna
<213>人工序列
<221>qrt-atactin-f
<400>11
cggtggttctatcttggcatc21
<211>22
<212>dna
<213>人工序列
<221>qrt-atactin-r
<400>12
gtctttcgcttcaataacccta22
<211>21
<212>dna
<213>人工序列
<221>qrt-atcor15a-f
<400>13
cagcggagccaagcagagcag21
<211>22
<212>dna
<213>人工序列
<221>qrt-atcor15a-r
<400>14
catcgaggatgttgccgtcacc22
<211>20
<212>dna
<213>人工序列
<221>qrt-aterd15-f
<400>15
ccagcgaaatggggaaacca20
<211>19
<212>dna
<213>人工序列
<221>qrt-aterd15-r
<400>16
acaaaggtacagtggtggc19
<211>23
<212>dna
<213>人工序列
<221>qrt-atrd29a-f
<400>17
gttactgatcccaccaaagaaga23
<211>22
<212>dna
<213>人工序列
<221>qrt-atrd29a-r
<400>18
ggagactcatcagtcacttcca22
<211>21
<212>dna
<213>人工序列
<221>qrt-atp5cs1-f
<400>19
cgacggagacaatggaattgt21
<211>21
<212>dna
<213>人工序列
<221>qrt-atp5cs1-r
<400>20
gatcagaaatgtgtaggtagc21
- 还没有人留言评论。精彩留言会获得点赞!