靶向CD22和CD19的嵌合抗原受体及其应用的制作方法
靶向cd22和cd19的嵌合抗原受体及其应用
技术领域
[0001]
本发明涉及生物医药技术领域,特别涉及靶向cd22和cd19的嵌合抗原受体及其应用。
背景技术:
[0002]
嵌合抗原受体(chimeric antigen receptor,car)修饰的t细胞作为一种免疫治疗策略,在肿瘤治疗中受到广泛的重视和应用。car的结构一般由胞外靶向连接区(常为具有抗原识别功能的单链抗体),铰链区,跨膜区和胞内信号转导区四部分组成。目前根据胞内信号转导区加入共刺激分子的数量,将car分为一代(无共刺激分子)、二代(含一种共刺激分子)和三代(含两种共刺激分子)。目前应用最多的是二代car。
[0003]
b细胞恶性肿瘤如b细胞淋巴细胞白血病(b-all)和淋巴瘤是b淋巴细胞异常克隆性增殖所致的恶性疾病,尽管目前化疗效果显著,但仍有15%的儿童b-all和60%的成人b-all患者因对化疗药物耐药而预后不佳;淋巴瘤患者经一线方案治疗后仍有15%复发,这些患者进行造血干细胞移植后,仍有50%最终复发。因此,寻找有效的细胞免疫治疗手段来治疗b细胞恶性肿瘤一直是血液学界研究热点。
[0004]
cd19和cd22是b淋巴细胞表面特有的抗原分子。cd19几乎表达于所有的b-all和淋巴瘤细胞表面,在b系正常造血细胞表面表达,而在正常非造血组织中没有表达。cd22是一种b系分化抗原,表达于b细胞发育的各个阶段,b细胞分化为浆细胞后不再表达cd22;60%~80%的b细胞恶性肿瘤表达cd22,90%以上的弥漫大b细胞淋巴瘤(dlbcls)和滤泡淋巴瘤(fls)为cd22阳性;几乎所有的b前体细胞急性淋巴细胞白血病(b-all)表达cd22;慢性淋巴细胞白血病、毛细胞白血病(hcl)也具有高水平的cd22表达。与cd19抗原相似,cd22同样是b细胞限制性表达,不表达于其他实质细胞,亦不表达于造血干细胞,因此作为b细胞肿瘤抗原的特异性高,已经成为b细胞恶性肿瘤中的主要治疗靶点。
[0005]
目前,尽管cd19-car-t在难治、复发b-all的治疗中取得了较好疗效,但仍有患者在治疗中出现cd19抗原突变或丢失等异常,致使cd19-car-t细胞不能识别及杀伤b-all细胞,导致疾病复发。cd22与cd19在肿瘤细胞表面具有广泛的共表达,且在cd19抗原丢失后cd22仍然保留。因此,针对cd19、cd22双靶点的car-t细胞可以有效避免抗原变异,减少复发,提高抗b系恶性肿瘤的疗效。
[0006]
但是经发现,如果将靶向cd19和cd22的抗原结合部分通过简单连接的方式插入到载体中,其表达后的杀伤效果不佳,因此需要寻找一种cd19和cd22抗原结合部分的特定连接方式来提高其杀伤肿瘤细胞的效果。
技术实现要素:
[0007]
本发明的一个方面,是针对现有技术中cd19car-t治疗期间因b-all的逃避机制等而产生复发或无效,提供了一种同时靶向cd22和cd19的双靶点嵌合抗原受体及其应用。
[0008]
本发明提供的技术方案为:
[0009]
编码靶向cd22和cd19的嵌合抗原受体的核酸分子,所述嵌合抗原受体包含胞外区、跨膜区和胞内信号转导区,其编码的所述胞外区包含cd22和cd19结合结构域,所述cd22和cd19结合结构域由cd22的抗体单链可变区片段和cd19的抗体单链可变区片段组成;
[0010]
所述cd22的抗体单链可变区片段和cd19的抗体单链可变区片段按照seq id no.9所示的氨基酸序列、seq id no.10所示的氨基酸序列、seq id no.11所示的氨基酸序列或seq id no.12所示的氨基酸序列的顺序排列。
[0011]
在本发明中,cd22
+
肿瘤细胞和cd19
+
肿瘤细胞与seq id no.1所示的19-22的car、seq id no.2所示的22-19的car、seq id no.3所示的19
╳
22的car或seq id no.4所示的22
╳
19的car结合后可以激活相应的car-t细胞,产生细胞毒效应;而cd22和cd19都不表达的细胞不能激活car-t细胞产生应答。因此,以cd19scfv-cd22scfv(seq id no.1所示)、cd22scfv-cd19scfv(seq id no.2所示)、cd19v
l-cd22v
l-cd22v
h-cd19v
h
(seq id no.3所示)和cd22v
l-cd19v
l-cd19v
h-cd22v
h
(seq id no.4所示)为抗原识别区制备的car-t细胞在识别并杀伤cd22
+
肿瘤细胞和cd19
+
肿瘤细胞的同时,对不表达cd19和cd22的细胞不产生脱靶效应。
[0012]
在本发明中,发明人还发现,cd22scfv和cd19scfv的连接、排列顺序对其组合后产生的杀伤肿瘤细胞的作用有很大影响。例如,在本发明的一个实施方式中,发明人验证了22-19car-t这种连接方式的杀伤效果更为显著。
[0013]
本发明所述cd22scfv及cd19scfv的序列可以根据seq idno.1-4中的记载,按照常规方法制得。例如,专利号为zl201510233748.0的专利、申请号为201810549259.x的专利中记载的方法。
[0014]
在本发明中,可以对所述cd19scfv-cd22scfv、cd22scfv-cd19scfv、cd19v
l-cd22v
l-cd22v
h-cd19v
h
和cd22v
l-cd19v
l-cd19v
h-cd22v
h
的氨基酸序列以合适的方式进行随机或者工程化的点突变,其目的可以为,例如,获得更好的亲和力和/或解离性质,而这些突变后的氨基酸序列均包含在本发明的保护范围之内。
[0015]
在本发明中,所述cd22scfv及cd19scfv的同种或不同抗体的轻重链之间通过连接肽相连,任意合适长度或合适性质的连接肽或连接肽的组合均可实现本发明的目的。
[0016]
在本发明中,所述核酸分子可编码信号肽。信号肽可引导抗原识别区及铰链区转移到胞外。任意合适的信号肽或信号肽的组合均可实现本发明的目的。
[0017]
作为优选,在本发明的一个实施方式中,本发明核酸分子编码的所述胞外区还包含构建在所述的嵌合抗原受体氨基末端的信号肽或与所述信号肽具有90-99%同一性的氨基酸序列,所述信号肽为cd8α中的信号肽序列或gm-csf。
[0018]
更优选地,所述信号肽为如seq id no.13所示的信号肽。
[0019]
在本发明的一个实施方式中,本发明核酸分子编码的所述cd22和cd19结合结构域通过铰链区与其编码的所述跨膜区连接。任意合适的铰链区序列均可实现本发明的目的。作为优选,在本发明的一个实施方式中,所述铰链区为cd8α。
[0020]
在本发明中,所述核酸分子还编码跨膜结构域。任意合适的跨膜结构域均能实现本发明的目的。作为优选,在本发明的一个实施方式中,所述跨膜区为选自以下蛋白质的跨膜结构域或与所述蛋白质具有90-99%同一性的氨基酸序列:t细胞受体的α、β或ζ链、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137或cd154。
[0021]
在本发明中,所述核酸分子编码的所述胞内信号转导区还包含共刺激因子。
[0022]
作为优选,所述共刺激因子为通过选自以下蛋白质或与所述蛋白质具有90-99%同一性的氨基酸序列获得的功能性信号结构域的一种或几种:mhc i类分子、tnf受体蛋白、免疫球蛋白样蛋白质、细胞因子受体、整联蛋白、淋巴细胞活化信号分子、活化nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、lfa-1、4-1bb、b7-h3、cd278、gitr、baffr、light、hvem、kirds2、slamf7、nkp80、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49α、ia4、cd49d、itga6、vla6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11α、itgam、cd11b、itgax、cd11c、cd29、itgb1、itgb2、cd18、itgb7、nkg2d、nkg2c、tnfr2、cd226、cd84、cd96、ceacam1、crtam、cd229、cd160、psgl1、cd100、cd69、slamf6、slam、blame、cd162、ltbr、lat、gads或slp-76。
[0023]
更优选地,在本发明的一个实施方式中,所述共刺激因子为cd28或4-1bb或与其具有90-99%同一性的氨基酸序列。
[0024]
同时,本发明核酸分子还编码任意合适的胞内信号结构域。可以为cd3ζ胞内信号结构与其具有90-99%同一性的氨基酸序列。
[0025]
作为优选,本发明核酸分子所编码的嵌合抗原受体是以cd19scfv-cd22scfv、cd22scfv-cd19scfv、cd19v
l-cd22v
l-cd22v
h-cd19v
h
和cd22v
l-cd19v
l-cd19v
h-cd22v
h
抗原识别区、cd8α铰链区和跨膜区、以及4-1bb和cd3ζ胞内信号结构域串联而成的结构为信号传导结构域,其序列如seq id no.5-8所示。
[0026]
另外,在上述抗原识别区、铰链区、跨膜区以及胞内信号区之间合适的位置可插入任意肽链作为间隔区,所述肽链可以为寡肽或多肽。
[0027]
对于上述核酸分子的制备方法,可基于上述抗原识别区、铰链区、跨膜区以及胞内信号区等结构域的碱基序列,通过化学合成或pcr扩增等已知技术制备。通常,可以对编码上述结构域的氨基酸的密码子进行优化,以优化其在宿主细胞中的表达。上述碱基序列的信息可通过检索已知文献或ncbi(https://www.ncbi.nlm.nih.gov/)等数据库来获得。
[0028]
在本发明的一个实施方式中,发明人所用的小鼠抗人cd22单克隆抗体杂交瘤细胞株(hib22)和小鼠抗人cd19单克隆抗体杂交瘤细胞株(hib19)是由申请人——中国医学科学院血液病医院(中国医学科学院血液学研究所)研制的,用该杂交瘤生产的单克隆抗体已商品化,可分别用于cd22阳性和cd19阳性的急性淋巴细胞白血病及淋巴瘤的检测和诊断。
[0029]
本发明的另一个方面,是提供了一种嵌合抗原受体,所述嵌合抗原受体由上述核酸分子编码。
[0030]
上述嵌合抗原受体的胞外区包含cd22和cd19结合结构域,所述cd22和cd19结合结构域由cd22的抗体单链可变区片段和cd19的抗体单链可变区片段组成;
[0031]
所述cd22的抗体单链可变区片段和cd19的抗体单链可变区片段按照seq id no.9所示的氨基酸序列、seq id no.10所示的氨基酸序列、seq id no.11所示的氨基酸序列或seq id no.12所示的氨基酸序列的顺序排列。
[0032]
作为优选,本发明嵌合抗原受体是以cd19scfv-cd22scfv、cd22scfv-cd19scfv、cd19v
l-cd22v
l-cd22v
h-cd19v
h
或cd22v
l-cd19v
l-cd19v
h-cd22v
h
抗原识别区、cd8α铰链区和跨膜区、以及4-1bb和cd3ζ胞内信号结构域串联而成的结构为信号传导结构域,氨基酸序列如序列表seq id no.1-4所示。
[0033]
本发明的另一个方面,是提供了一种载体,所述载体包含上述核酸分子。
[0034]
在本发明中,上述载体可以为直链载体,也可以为环状载体。可以为质粒等非病毒载体,也可以为病毒载体,还可以为利用转座子的载体。所述载体中可含有启动子、终止子等调控序列,以及耐药基因、报告基因等标记序列。另外,上述载体也可包含编码自杀基因的序列,可根据治疗过程,通过给予激活自杀基因的物质,从而控制体内car-t细胞的数目。
[0035]
作为上述病毒载体,可以为逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体等。在本发明的一个实施方式中,使用的是慢病毒表达载体。
[0036]
本发明的另一个方面,是提供了一种细胞,所述细胞包含上述核酸分子、上述嵌合抗原受体或上述载体。
[0037]
在本发明的一个实施方式中,上述细胞为人的t细胞。所述t细胞可以来自血液、骨髓等体液,也可以来自脾脏、胸腺、淋巴等组织,或者原发肿瘤、转移性肿瘤、癌性腹水等癌症组织,经分离、纯化后得到。同时,所述t细胞可以为cd4
+
t细胞、cd8
+
t细胞、αβt细胞或γδt细胞。所述t细胞可以以合适的方式替换为nk细胞,其也视为包含在本发明的保护范围之内。
[0038]
本发明的另一个方面,是提供了一种上述核酸分子在制备抗b细胞血液肿瘤药物中的应用。
[0039]
本发明的另一个方面,是提供了一种上述嵌合抗原受体在制备抗b细胞血液肿瘤药物中的应用。
[0040]
本发明的另一个方面,是提供了一种上述载体在制备抗b细胞血液肿瘤药物中的应用。
[0041]
本发明的另一个方面,是提供了一种上述细胞在制备抗b细胞血液肿瘤药物中的应用。
[0042]
作为优选,上述应用为在制备患者cd19和cd22广泛共表达或经cd19car-t治疗后因抗原变异而复发或无效的抗b细胞血液肿瘤药物中的应用。
[0043]
上述无效是指患者经cd19car-t治疗后,因出现cd19抗原丢失、突变等,导致患者对cd19car-t没有反应性,出现治疗无效。
[0044]
只要其在病理过程中表达cd19和cd22,上述b细胞血液肿瘤包括但不限于b细胞淋巴瘤、急性淋巴细胞白血病(all)等。作为优选,上述b细胞血液肿瘤为b细胞淋巴瘤或急性b淋巴细胞白血病。
[0045]
本发明的另一个方面,是提供了一种药物组合物,所述药物组合物包含上述核酸分子、上述嵌合抗原受体、上述载体或上述细胞,以及药学上接受的载体。
[0046]
本发明药物组合物除包含上述成分以外,还可包含任意药学上允许的添加剂,例如,生理盐水、细胞培养基、葡萄糖、注射用水、甘油、乙醇以及它们的组合物、稳定剂、表面活性剂、防腐剂、等渗剂等。
[0047]
同样,本发明药物组合物也可以和其他合适的抗癌剂联合应用。例如,长春新碱、柔红霉素、门冬酰胺酶、环磷酰胺、泼尼松等。
[0048]
作为优选,本发明药物组合物还包含编码cd19和cd22嵌合抗原受体的核酸分子、cd19和cd22嵌合抗原受体、含有编码cd19和cd22嵌合抗原受体的核酸分子的载体或含有cd19和cd22嵌合抗原受体的细胞。
cd22v
h-cd8α-4-1bb-cd3ζ的dna片段(2233bp)和载体片段(7234bp);
[0058]
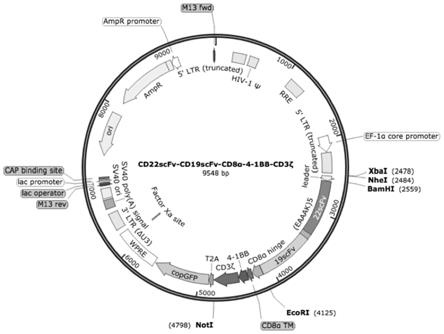
图2为本发明实施例中以cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ慢病毒表达载体为例的示意图,其中,逆时针序列是正向基因片段,顺时针序列为反向基因片段;
[0059]
图3为利用流式细胞术检测本发明实施例中构建的双靶点cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζ、cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ、cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ和cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ修饰t细胞中car分子的表达结果图(分别以19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t表示),同时展示单靶点cd19scfv-cd8α-4-1bb-cd3ζ和cd22scfv-cd8α-4-1bb-cd3ζ修饰t细胞中car分子的表达结果图(分别以19car-t和22car-t表示),以比较单靶点和双靶点的car-t的功能,gfp为载体携带的标志蛋白的表达,f(ab')2为兔抗鼠igg标记cd22scfv和cd19scfv在t细胞表面的表达;
[0060]
图4为利用流式细胞术检测本发明实施例中所应用的靶细胞:burkitt淋巴瘤细胞系namalwa,感染cd19抗原分子的慢性粒细胞白血病细胞系mv4-11-cd19、感染cd22抗原分子的慢性粒细胞白血病细胞系mv4-11-cd22以及野生型mv4-11细胞中cd19和cd22靶抗原分子的表达结果图,其中,a为cd19靶抗原分子表达阳性率;b为cd22靶抗原分子表达阳性率;
[0061]
图5为利用流式细胞术检测本发明实施例中t细胞与靶细胞共培养后残留的肿瘤细胞存活率结果图,其中,vector-t为转染空载体的t细胞的对照组;19car-t为cd19scfv-cd8α-4-1bb-cd3ζ修饰t细胞的实验组,22car-t为cd22scfv-cd8α-4-1bb-cd3ζ修饰t细胞的实验组,19-22car-t为cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζ修饰t细胞的实验组,22-19car-t为cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ修饰t细胞的实验组,19
╳
22car-t为cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ修饰t细胞的实验组,22
╳
19car-t为cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ修饰t细胞的实验组;a和b分别为当靶细胞是namalwa细胞系时,将vector-t、19car-t、22car-t、19-22car-t及22-19car-t分别以效靶比1:8、1:4、1:2及1:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图,以及按效靶比1:1共培养48小时后残留的肿瘤细胞存活率流式示意图;c和d分别为靶细胞是mv4-11-cd19细胞系时,将vector-t、19car-t、22car-t、19-22car-t及22-19car-t分别以效靶比1:8、1:4、1:2及1:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图,以及按效靶比1:1共培养48小时后残留的肿瘤细胞存活率流式示意图;e和f分别为当靶细胞是mv4-11-cd22细胞系时,将vector-t、19car-t、22car-t、19-22car-t及22-19car-t分别以效靶比1:8、1:4、1:2及1:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图,以及按效靶比1:1共培养48小时后残留的肿瘤细胞存活率流式示意图;g和h分别为当靶细胞是野生型mv4-11细胞系时,将vec-t、19-22car-t及22-19car-t分别以效靶比1:8、1:4、1:2及1:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图,以及按效靶比1:1共培养48小时后残留的肿瘤细胞存活率流式示意图;i为当靶细胞是mv4-11-cd19和mv4-11-cd22按1:1比例混合时,将vector-t、19
╳
22car-t及22
╳
19car-t分别以效靶比1:2、1:1及2:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图;j为当靶细胞是mv4-11时,将vecor-t、19
╳
22car-t及22
╳
19car-t分别以效靶比1:2、1:1及2:1与靶细胞共培养24小时后残留的肿瘤细胞存活率结果图;
[0062]
图6为本发明实施例中vecor-t和car-t对namalwa、mv4-11-cd19、mv4-11-cd22和
mv4-11(效靶比1:1)杀伤作用的脱颗粒检测结果图,a中car-t分别为19car-t、22car-t、19-22car-t及22-19car-t,b中car-t分别为19
╳
22car-t和22
╳
19car-t;
[0063]
图7为本发明实施例中vecor-t、19car-t、22car-t、19-22car-t和22-19car-t分别与四种靶细胞namalwa、mv4-11-cd19、mv4-11-cd22和mv4-11按效靶比1:1共培养48小时后,t细胞释放的细胞因子tnf-α(a)il-2(b)和ifn-γ(c)水平结果图;
[0064]
图8为利用流式细胞术检测b-all患者骨髓单个核细胞(bmmcs)cd22和cd19靶抗原分子的表达结果图,其中p1~p4表示患者编号;
[0065]
图9为本发明实施例中22-19car-t和19-22car-t与b-all患者的bmmcs按效靶比1:4共培养48小时后流式检测残留的肿瘤细胞细胞存活率结果图;
[0066]
图10为本发明实施例中22-19car-t和19-22car-t对all患者的bmmcs杀伤作用的脱颗粒检测结果图;
[0067]
图11为本发明实施例中22-19car-t和19-22car-t在小鼠体内效果的评价结果图,选用6-8周的nod/scid雌性小鼠并随机分为两组,第0天经尾静脉注射5
×
106的namalwa细胞,第5天、第9天和第12天分别经尾静脉注射1
×
107的vec-t细胞或car-t细胞(如a所示),注射t细胞后每周监测小鼠体重变化(如b所示),肿瘤负荷图如图c所示,小鼠生存曲线如d所示,用spss软件计算生存期。
[0068]
序列说明
[0069]
seq id no.1为本发明cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζ的氨基酸序列;
[0070]
seq id no.2为本发明cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ的氨基酸序列;
[0071]
seq id no.3为本发明cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ的氨基酸序列;
[0072]
seq id no.4为本发明cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ的氨基酸序列;
[0073]
seq id no.5为本发明cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζ的核酸序列;
[0074]
seq id no.6为本发明cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ的核酸序列;
[0075]
seq id no.7为本发明cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ的核酸序列;
[0076]
seq id no.8为本发明cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ的核酸序列;
[0077]
seq id no.9为本发明cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζ抗原识别区的氨基酸序列;
[0078]
seq id no.10为本发明cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζ抗原识别区的氨基酸序列;
[0079]
seq id no.11为本发明cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ抗原识别区的氨基酸序列;
[0080]
seq id no.12为本发明cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ抗原识别区的氨基酸序列;
[0081]
seq id no.13为本发明靶向cd19和cd22的嵌合抗原受体中信号肽的氨基酸序列;
[0082]
seq id no.14为本发明靶向cd19和cd22的嵌合抗原受体中cd8α-4-1bb-cd3ζ的氨
基酸序列。
具体实施方式
[0083]
本发明公开了靶向cd22和cd19的嵌合抗原受体及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明,并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内容进行改动或适当变更与组合,来实现和应用本发明技术。
[0084]
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。
[0085]
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
[0086]
实施例1:双靶点嵌合抗原受体载体的构建
[0087]
1.采用bamh i、ecor i核酸内切酶酶切发明人前期构建的含有cd8α-4-1bb-cd3ζ片段的质粒,获得cd8α-4-1bb-cd3ζ片段,其氨基酸序列如seq id no.5所示。所述含有cd8α-4-1bb-cd3ζ片段的质粒可通过现有技术中任意合适的方法制得,例如,专利号为zl201510233748.0的专利。
[0088]
2.将合成得到的cd 22scfv-cd 19scfv片段、cd 19scfv-cd22scfv、cd19v
l-cd22v
l-cd22v
h-cd19v
h
及cd22v
l-cd19v
l-cd19v
h-cd22v
h
片段分别与目的载体进行连接,将构建的cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζcar(22-19car)、cd19scfv-cd22scfv-cd8α-4-1bb-cd3ζcar(19-22car)、cd19v
l-cd22v
l-cd22v
h-cd19v
h-cd8α-4-1bb-cd3ζ(19
╳
22car-t)及cd22v
l-cd19v
l-cd19v
h-cd22v
h-cd8α-4-1bb-cd3ζ(22
╳
19car-t)目的载体用核酸内切酶nheⅰ和notⅰ进行酶切鉴定。结果如图1所示,酶切结果表明阳性克隆含有目的条带且测序鉴定正确。以cd22scfv-cd19scfv-cd8α-4-1bb-cd3ζcar载体示意图为例,如图2所示。
[0089]
实施例2:双靶点嵌合抗原受体慢病毒修饰t细胞的制备
[0090]
1.采用endofree plasmid maxi质粒抽提试剂盒(qiagen公司)分别提取22-19car、19-22-car、19
╳
22car及22
╳
19car表达质粒和包装质粒prsv-rev、pmdlg-prre、pmd.2g。每种car质粒与包装质粒(四质粒)用12.2:4.11:8.75:3.5比例用pei转染试剂(polyscience公司)进行转染(具体方法见pei转染试剂说明书)。转染后12小时更换新鲜培养液,之后24小时、48小时分别收取病毒上清,于4℃,3000rpm,离心15分钟,经0.45μm滤器过滤后,采用50000g,4℃,1.5小时超速离心后浓缩10倍,后转入-80℃保存。
[0091]
2.t细胞的制备:取新鲜健康人外周血10ml,采用rosettesep t cell enrichment cocktail(stemcell公司)和ficoll-paque plus(ge healthcare公司)提取t细胞(具体步骤按照rosettesep t cell enrichment cocktail说明书)。按细胞:磁珠=1:1比例加入抗cd3/cd28磁珠(gibco公司),培养24小时即为转染前的t细胞。
[0092]
3.慢病毒感染t细胞及感染后t细胞的培养:从-80℃中取出病毒上清,室温下融化,按每1
×
106t细胞加入100μl病毒上清,加入polybrene至终浓度为8μg/ml。32℃,1800rpm,离心1.5小时,转入5%co2,37℃孵箱培养。
[0093]
4.流式细胞术检测car修饰t细胞的阳性率:收集细胞,标记兔抗鼠igg f(ab')2抗
体,流式细胞术分析t细胞f(ab')2和gfp的表达。结果如图3所示,由图中可以看出,car-t的阳性率为70%以上。
[0094]
实验例1:嵌合抗原受体22-19car、19-22-car、19
╳
22car及22
╳
19car慢病毒修饰t细胞对白血病细胞的杀伤作用
[0095]
1.血液肿瘤细胞系中cd22的表达水平:
[0096]
namalwa、mv4-11细胞系均购自美国atcc,mv4-11-cd19和mv4-11-cd22为mv4-11细胞系分别感染cd19和cd22后所筛选的单克隆细胞株。分别培养后,各吸取5
×
105细胞悬液,pbs洗2次后,分别标记pe抗人cd19单抗和apc抗人cd22单抗(biolegend公司),以标记pe-isotype和apc-isotype为对照组,冰上孵育30分钟。运用流式细胞术检测各种细胞系cd19和cd22的表达水平,结果如图4所示。其中,a为cd19靶抗原分子表达阳性率;b为cd22靶抗原分子表达阳性率;namalwa、mv4-11-cd19的cd19阳性率均为95%以上,namalwa、mv4-11-cd22的cd22阳性率均为95%以上,而野生型mv4-11几乎不表达cd19和cd22。
[0097]
2.car修饰的t细胞与namalwa、mv4-11-cd19、mv4-11-cd22和野生型mv4-11细胞系共培养后流式检测残留的肿瘤细胞:
[0098]
将上述细胞按2
×
105细胞/孔接种24孔培养板,分别加入2.5
×
104(e:t=1:8)、5
×
104(e:t=1:4)、1
×
105(e:t=1:2)、2
×
105(e:t=1:1)、4
×
105(e:t=2:1)、浓度的car-t细胞,并重复将转染不含car的空载体t细胞(vector-t)设为对照组,于孵箱中共培养。将共培养后的细胞用pe抗人cd19单抗和apc抗人cd22单抗(biolegend公司)标记namalwa、mv4-11-cd19、mv4-11-cd22和野生型mv4-11细胞系,用pe-cy7抗人cd3单抗(biolegend公司)标记t细胞,流式细胞术检测残留细胞。结果如图5所示,1)与vecor-t相比,19car-t,22car-t、19-22car-t以及22-19car-t均能明显杀伤cd19
+
cd22
+
靶细胞namalwa(图5的a、b);2)与vecor-t和22car-t相比,19car-t、19-22car-t以及22-19car-t均可明显杀伤mv4-11-cd19靶细胞(图5的c、d);3)与vecor-t和19car-t相比,22car-t、19-22car-t以及22-19car-t均可明显杀伤mv4-11-cd22靶细胞(图5的e、f);4)与vecor-t相似,19-22car-t以及22-19car-t对cd19/cd22双阴性靶细胞mv4-11没有杀伤作用(图5的g、h);5)与vecor-t相比,19
╳
22car-t和22
╳
19car-t均可明显杀伤mv4-11-cd19靶细胞和mv4-11-cd22靶细胞(图5的i);6)与vecor-t相似,19
╳
22car-t和22
╳
19car-t对cd19/cd22双阴性靶细胞mv4-11没有杀伤作用(图5的j)。结果证实19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t有明显的双靶点优势,对cd19
+
、cd22
+
及cd19
+
/cd22
+
靶细胞有高效的特异性杀伤作用。上述实验中,22-19car-t的杀伤效果更为显著。
[0099]
3.脱颗粒实验分析car修饰的t细胞的激活:
[0100]
将car-t及vecor-t细胞分别与namalwa、mv4-11-cd19、mv4-11-cd22和野生型mv4-11细胞系按照效靶比1:1进行共培养,并在共培养体系中加入anti-cd107a抗体和monensin;4h后应用流式细胞仪检测gfp
+
细胞表面cd107a的表达水平。结果如图6的a、b所示,1)与靶细胞namalwa(cd19
+
cd22
+
)共培养后,19car-t、22car-t、19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t组脱颗粒水平均在10%以上,vecor-t的脱颗粒水平在2%以下;2)与靶细胞mv4-11-cd19共培养后,19car-t,19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t组脱颗粒水平均在25%以上,而vecor-t和22car-t的脱颗粒水平在2%以下;3)与靶细胞mv4-11-cd22共培养后,22car-t,19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t组脱颗粒水平均在15%以上,而vecor-t和19car-t的脱颗粒水平在2%以下;4)与野生型mv4-11共培养后,vecor-t、19car-t、22car-t、19-22car-t、19
╳
22car-t及22
╳
19car-t的脱颗粒水平均在2%以下,证明19-22car-t、22-19car-t、19
╳
22car-t及22
╳
19car-t可以显著且特异性激活cd19
+
或cd22
+
的靶细胞。
[0101]
4.elisa检测淋巴瘤细胞系与car-t细胞共培养上清中细胞因子ifn-γ、tnf-α和il-2的水平:
[0102]
分别将namalwa、mv4-11-cd19、mv4-11-cd22和野生型mv4-11细胞系按照2
×
105细胞/孔接种24孔板。按每孔2
×
105细胞分别加入car-t、vecor-t细胞,补充培养液至1ml于孵箱中共培养24小时后。采用人ifn-γ、tnf-α和il-2elisa检测试剂盒(r&d公司),对共培养上清进行检测(具体步骤见elisa检测试剂盒说明书)。结果如图7所示,1)与cd19
+
cd22
+
靶细胞namalwa共培养后,与vecor-t相比,19car-t,19-22car-t以及22-19car-t组三种因子的释放水平均明显升高;19-22car-t和22-19car-t组tnf-α的分泌水平明显高于19car-t组,19-22car-t和22-19car-t组il-2的分泌水平明显高于22car-t组。2)与mv4-11-cd19共培养后,19car-t、19-22car-t以及22-19car-t组三种因子的释放水平明显较vecor-t和22car-t的释放水平高。3)与mv4-11-cd22共培养后,22car-t、19-22car-t以及22-19car-t组tnf-α和ifn-γ的释放水平明显较vecor-t和19car-t的释放水平高;而il-2的分泌水平可以看出19-22car-t和22-19car-t组优于22car-t组。4)与野生型mv4-11共培养后,vecor-t、19car-t、22car-t、19-22car-t的三种因子的释放水平均较低。证明19-22car-t和22-19car-t可以特异性的激活cd19
+
、cd22
+
及cd19
+
cd22
+
的靶细胞并释放细胞因子,且细胞因子的释放水平优于19car-t或22car-t。
[0103]
5.all患者的骨髓单个核细胞(bmmcs)cd19和cd22的表达水平:
[0104]
病人标本均来自中国医学科学院血液病医院,并征得患者的知情同意。采用ficoll梯度离心分离出bmmcs后,各吸取5
×
105细胞悬液,pbs洗2次后,标记pe抗人cd19单抗、apc抗人cd22单抗(biolegend公司)、pe-isotype以及apc-isotype(对照组),冰上孵育30分钟。运用流式细胞术检测各患者bmmcs表达cd19和cd22的比例和强度,如图8所示,其中p1~p4代表1~4号患者。
[0105]
6.car修饰的t细胞与all患者的bmmcs共培养后流式检测残留的肿瘤细胞:
[0106]
将细胞按4
×
105细胞/孔接种24孔培养板,分别加入1
×
105(e:t=1:4)的car修饰的t细胞,转染不含car的空载体t细胞(vec-t)设为对照组,于孵箱中共培养48h。将共培养后的细胞用pe抗人cd19单抗、apc抗人cd22单抗(biolegend公司)标记all患者的白血病细胞,用apc-cy7抗人cd3单抗(biolegend公司)标记t细胞,流式细胞术检测残留细胞。结果如图9所示,结果显示,car-t与cd19
+
/cd22
+
的1-4号患者bmmcs共培养48小时后,19-22car-t组分别存留cd19
+
/cd22
+
细胞为3.03%、0.24%、1.34%、2.87%,22-19car-t组分别存留cd19
+
/cd22
+
细胞为4.10%、0.45%、1.68%、3.89%,对照组存留为46.58%、63.95%、23.76%、44.88%。由上述结果可以说明,car-t对cd19
+
/cd22
+
的白血病原代bmmcs具有杀伤作用。
[0107]
7.car修饰的t细胞与all患者的bmmcs共培养后脱颗粒实验分析car修饰的t细胞的激活:
[0108]
将car-t及vecor-t细胞分别与1~4号患者的bmmcs按照效靶比1:1进行共培养,并在共培养体系中加入anti-cd107a抗体和monensin;4h后应用流式细胞仪检测cd3
+
细胞表
面cd107a的表达水平。结果如图10所示,结果显示,car-t与1~4号患者共培养体系中,19-22car-t细胞激活百分率分别为35.53%、40.37%、31.37%、30.20%;22-19car-t细胞激活百分率分别为51.21%、33.04%、18.01%、50.23%。而vec-t与1~4号患者共培养体系中,t细胞激活百分率分别为3.07%、1.73%、3.43%、2.40%。由上述结果可以说明,car-t与vecor-t的激活有显著差异。
[0109]
8.car修饰的t细胞在cd19
+
/cd22
+
淋巴瘤小鼠模型中的作用:
[0110]
选取6-8周的nod/scid雌性小鼠并随机分为两组,经过尾静脉注射namalwa细胞5
×
106/只;移植后的第5天、第9天和第12天分别经尾静脉注射1
×
107的vecor-t细胞或car-t细胞(见图11的a),与对照组相比,小鼠体重并未因注射car-t发生明显下降,提示car-t的治疗对小鼠无明显的毒副作用(见图11的b)。vecor-t组、19-22car-t组和22-19car-t组中位生存期分别为25天、36天和37天,肿瘤负荷图如图11的c所示,car-t组肿瘤负荷明显低于vec-t组,生存曲线如图11的d所示,计算两组生存期差异发现:19-22car-t组和22-19car-t组均可以显著延长小鼠的生存期,与对照组相比有显著的统计学差异(p=0.0011)。结合中位生存期和肿瘤负荷结果图发现,22-19car-t的治疗效果略优于19-22car-t。
[0111]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1