一种新型抗过敏肽及其制备方法与流程
本发明涉及生物研究相关
技术领域:
,具体为一种新型抗过敏肽及其制备方法。
背景技术:
:过敏性疾病包括各种各样的疾病,如食物过敏、特应性皮炎、哮喘和过敏性鼻结膜炎等,虽然过敏性疾病不像许多复杂的疾病那样是一种严重的疾病,但其危害不应低估,对整个社会而言,过敏时的病人工作效率低下,给各国造成巨大的经济损失,需要利用相应的抗过敏药进行治疗,前市场上的抗过敏药物在以尽可能减少其缺陷为目的不断更新换代,保证其安全性,如何获得更加天然安全的抗过敏基质用于研发抗过敏药物是重中之重,目前国内外已有相关研究,已报道的抗过敏天然产物包括植物来源的活性物质:黄酮类、萜类、醌类、生物碱类、苯丙素类、肽类;动物来源的活性物质:研究报道,从鲍鱼的胃肠道消化液里分离纯化的多肽能够抑制hmc-1细胞的细胞因子分泌,song等研究发现海参的提取物具有一定的抗炎症、抗食物过敏的功效;微生物来源的活性物质:益生菌、双歧杆菌、嗜热链球菌等;海洋藻类:海藻多酚、海藻多糖、藻蓝蛋白等,但也存在一定的不足,如植物中提取的抗过敏成分,由于受分离分析等技术手段的条件制约以及原料成本问题,面临提取困难、成分复杂等一系列问题,多停留在溶剂提取物的层次上。目前关于动物来源的抗食物过敏活性物质的报道仍然较少,而肽类因其成分明确,工艺成熟,抗过敏效果较强,因此在食品工业中有着无可比拟的优势。如马涛等研究发现小麦肽、大豆肽、乌鸡肽、胶原肽等具有良好的抗过敏活性;已有研究证实食源性短链活性肽(2-20个残基)对于机体具有激素样的生理调节功能;目前的研究也提供了食源性免疫调节肽对抵御ige介导的过敏性疾病的重要发现,并认为食源性免疫调节肽是目前最具前景的抗过敏策略之一;如今鱼类加工产生大量加工副产物,以大西洋鲑鱼为例,其市场价格昂贵,国产量小,主要依靠进口,进口量及成本开销巨大,目前大西洋鲑主要以新鲜冷冻切片出售,加工过程中产生大量副产物,若未充分利用,将造成严重资源浪费以及间接的经济损失。那么对大西洋鲑鱼副产物综合加工利用有一定现实意义,而目前所存在的问题是由于大西洋鲑鱼油脂含量高、色泽重、腥味大,给其副产物的综合利用带来了一定困难,由于大西洋鲑鱼蛋白质含量明显高于其他鱼类,且具有良好的氨基酸组成,可以作为优质的生物活性肽来源,所以考虑从酶解肽的角度入手,目前关于鱼副产物酶解肽的研究都集中在抗氧化肽、降压肽、免疫调节肽和抑菌肽等,其中免疫调节肽是研究热点之一,若从鱼下脚料中提取制得具有抗过敏活性的免疫调节肽,将有广阔市场前景。技术实现要素:本发明的目的在于提供一种新型抗过敏肽及其制备方法,以解决上述
背景技术:
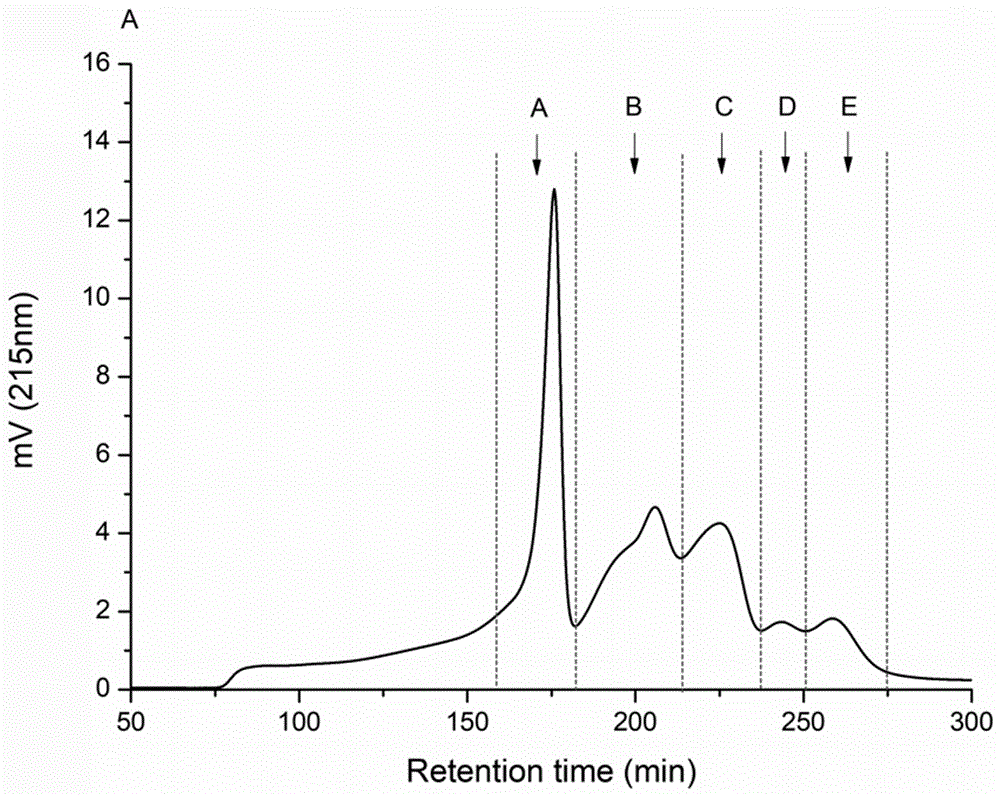
中提到的如何从大西洋蛙鱼加工过程中产生的副产物内提取制得具有抗过敏活性的免疫调节肽的问题。为实现上述目的,本发明提供如下技术方案:一种新型抗过敏肽及其制备方法,包括如下步骤:s1、大西洋鲑内脏酶解产物的制备:将12%底物在蒸馏水(w/v)和胃蛋白酶中混合,然后使用1mhcl将ph调节至2.0,37℃保温8h释放抗过敏肽,100℃加热15min灭活胃蛋白酶,冷却后,使用0.45μm滤膜进行抽滤,去除未水解的蛋白质,将酶解液清液冻干并保存于-20℃直至使用;s2、抗过敏活性测定:取4个ep管,分别标上a、b、c、d,之后步骤如下:a、b管加入100l缓冲液,c、d管加入100μl样品液,a、c管加入50μl透明质酸酶液(500u/ml,缓冲液配制),b、d管加入50μl缓冲液,37℃孵育20min后,加入20μl2.5mol/lcacl2溶液,37℃孵育20min,然后在各管加入50μl透明质酸(3mg/ml,缓冲液配制),100μl缓冲液,250μl去离子水,37℃孵育40min,室温放置10min,之后在每管加入110μl碱性硼酸盐溶液,沸水加热5min终止反应,冰水浴20min,最后在每管加入1.5mlp-二甲氨基苯甲醛,37℃孵育20min,于585nm处测定吸光值,并计算出抑制率;s3、抗过敏肽初步分离纯化研究:以透明质酸酶抑制率为抗过敏指标,探究不同分子量的肽段的抗过敏活性,采用两种不同的超滤膜(mw10.0,3.0kda)将目标水解液分成了三个组分(ⅰ,ⅱ,ⅲ),分别为ⅰ(mw>10kda),ⅱ(3kda<mw<10kda),ⅲ(mw<3kda),各组分显示出不同的抗过敏活性,其中ⅲ(mw<3.0kda)组分过敏活性最强,对透明质酸酶活性的抑制率高达66.24%,选用ⅲ进行进一步分离纯化;s4、凝胶层析分离纯化抗过敏肽:采用sephadexg-15葡聚糖凝胶层析对组分ⅲ进行进一步的分离纯化,采用sephadexg-15作为凝胶填料,将其进行预处理后装于规格为16×900mm的玻璃层析柱中,在1ml/min的流速下用超纯水进行洗脱,于214nm处检测并收集各洗脱峰对应的洗脱溶液,冷冻干燥后测定各组分的抗过敏活性,选择抗过敏活性最强的组分进行下一步的纯化;s5、反相高效液相色谱分离纯化抗过敏肽:将样品(10mg/ml)用0.22μm注射器过滤,样品自动注入安捷伦反相高效液相色谱柱(pursuit10c18,250×21.2mm),进一步纯化,以1.0ml/min的流速进行分离,得到c1-c6六个组分,线性梯度为0-50%洗脱液b,分离时间为25min,在215nm处检测各组分的洗脱峰,收集透明质酸酶抑制活性最强的峰并冻干;s6、lc-ms/ms鉴定抗过敏肽:利用lc-ms/ms对s5中抗过敏性最高的组分进行鉴定,得到一序列为tpevhiavdkf,mh+为1255.67da经合成后验证具有抗过敏作用的肽段,通过对该鉴定出的序列tpevhiavdkf进行化学合成,然后采用抗dnp-ige/dnp-bsa体系构建rbl细胞致敏-激发模型,测定合成肽对rbl细胞脱颗粒释放β-氨基己糖苷酶(β-hex)的抑制效果,通过测定β-hex(rbl-2h3细胞脱颗粒标志物)在培养基中的释放,评价纯化肽的抗过敏作用。优选的,s1中,胃蛋白酶与底物的混合比率为1:100(w/w)。优选的,s2中所述的缓冲液配备方式为:取16.406g无水醋酸钠和8.766g氯化钠溶于800ml蒸馏水中,用冰乙酸调ph值为4.6,并定容1000ml,制得含0.15m氯化钠的0.2m醋酸钠缓冲液,其中离子强度为0.15m。优选的,s2中所述的碱性硼酸盐溶液包括17.3gh3bo3和7.8gkoh,且定容至100ml,所述碱性硼酸盐溶液用前每10ml加入1ml0.8g/mlk2co3。优选的,s2中所述的p-二甲氨基苯甲醛包括20gp-二甲氨基苯甲醛,25ml浓盐酸和75ml冰乙酸,且p-二甲氨基苯甲醛用前立即用4倍体积的冰乙酸进行稀释。优选的,s2中抑制率=[(a-b)-(c-d)]/(a-b)×100,其中,a:对照溶液吸光值(用缓冲液代替样品);b:对照空白溶液吸光值(用缓冲液代替样品及透明质酸液);c:样品的吸光值;d:样品空白的吸光值(用缓冲液代替酶液及透明质酸液)。优选的,s5的实验条件为:洗脱液a,超纯水中0.1%tfa(v/v);洗脱液b,乙腈中0.1%tfa(v/v)。优选的,s6中需要对rbl细胞进行培养,培养方法为:在rbl-2h3细胞内加入10%的胎牛血清(fbs)、1:100(v/v)三抗(青霉素、链霉素、两性霉素)的培养基进行细胞培养,并将细胞放置在37℃的5%co2培养箱中培养。优选的,s6中,β-氨基己糖苷酶(β-hex)的测定方法为:在96孔板(2.5×105细胞/ml)中培养的100μlrbl-2h3细胞用100μl抗dnp-ige(终浓度:1ug/ml)致敏过夜,用台式液清洗两遍后,加入不同浓度的样品(用台式液溶解稀释),37℃孵育1h,然后加入100μldnp-bsa(终浓度:10μg/ml)作抗原进行刺激,37℃孵育1h,取一个新的96孔板,在每个孔中加入50μlpnag(1mmpnag溶解于柠檬酸缓冲液中),将培养后的细胞上清液(30μl)转移到96孔板上,37℃孵育1h,然后在每个孔中加入100μl碳酸钠缓冲液,终止反应,测定波长405nm,阳性对照品为富马酸酮替芬,用酶标仪测定。本发明提供了一种新型抗过敏肽及其制备方法,具备以下有益效果:(1)本发明通过采用酶解技术对大西洋鲑副产物进行酶解处理,采用不同的体外评价方法以及连续色谱技术制备纯化出具有抗过敏作用的活性肽并鉴定。实现了将工业鱼副产物和活性肽有机地结合起来,在拟获取抗过敏活性肽的同时为工业鱼下脚料加工处理开辟了新的高值充分利用道路,使之在抗过敏领域发挥作用。(2)本发明通过从大西洋鲑副产品中获得了天然的抗过敏活性肽,适应抗过敏药市场的现状及发展需求,也同时实现了对大西洋鲑工业副产品的高值加工利用,相比现有的天然抗过敏活性物质,活性肽通过酶解的方式更易获得,避免了提取困难、成分复杂等因素,其抗过敏作用相对较强,安全性更高,是可在抗过敏领域发挥作用的潜在来源。附图说明图1为本发明酶解液mw<3kda的sephadexg-15凝胶色谱图;图2为本发明在1mgml−1蛋白质浓度下从sephadexg-15中收集的每个组分的透明质酸酶抑制率分布图;图3为本发明sephadexg-15组分c的rp-hplc图;图4为本发明在1mgml−1蛋白质浓度下从rp-hplc收集的每个组分的透明质酸酶抑制率分布图;图5为本发明tpevhiavdkf的二级质谱图;图6为本发明合成肽对β-氨基己糖苷酶释放的抑制率分布图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。如图1-6所示,本发明提供一种技术方案:一种新型抗过敏肽及其制备方法,包括如下步骤:s1、大西洋鲑内脏酶解产物的制备:将12%底物在蒸馏水(w/v)和胃蛋白酶中混合,然后使用1mhcl将ph调节至2.0,37℃保温8h释放抗过敏肽,100℃加热15min灭活胃蛋白酶,冷却后,使用0.45μm滤膜进行抽滤,去除未水解的蛋白质,将酶解液清液冻干并保存于-20℃直至使用;s2、抗过敏活性测定:取4个ep管,分别标上a、b、c、d,之后步骤如下:a、b管加入100l缓冲液,c、d管加入100μl样品液,a、c管加入50μl透明质酸酶液(500u/ml,缓冲液配制),b、d管加入50μl缓冲液,37℃孵育20min后,加入20μl2.5mol/lcacl2溶液,37℃孵育20min,然后在各管加入50μl透明质酸(3mg/ml,缓冲液配制),100μl缓冲液,250μl去离子水,37℃孵育40min,室温放置10min,之后在每管加入110μl碱性硼酸盐溶液,沸水加热5min终止反应,冰水浴20min,最后在每管加入1.5mlp-二甲氨基苯甲醛,37℃孵育20min,于585nm处测定吸光值,并根据公式计算出抑制率;其中公式为:抑制率=[(a-b)-(c-d)]/(a-b)×100,a:对照溶液吸光值(用缓冲液代替样品);b:对照空白溶液吸光值(用缓冲液代替样品及透明质酸液);c:样品的吸光值;d:样品空白的吸光值(用缓冲液代替酶液及透明质酸液),缓冲液配备方式为:取16.406g无水醋酸钠和8.766g氯化钠溶于800ml蒸馏水中,用冰乙酸调ph值为4.6,并定容1000ml,制得含0.15m氯化钠的0.2m醋酸钠缓冲液,其中离子强度为0.15m;碱性硼酸盐溶液包括17.3gh3bo3和7.8gkoh,且定容至100ml,所述碱性硼酸盐溶液用前每10ml加入1ml0.8g/mlk2co3;p-二甲氨基苯甲醛包括20gp-二甲氨基苯甲醛,25ml浓盐酸和75ml冰乙酸,且p-二甲氨基苯甲醛用前立即用4倍体积的冰乙酸进行稀释;s3、抗过敏肽初步分离纯化研究:以透明质酸酶抑制率为抗过敏指标,探究不同分子量的肽段的抗过敏活性,采用两种不同的超滤膜(mw10.0,3.0kda)将目标水解液分成了三个组分(ⅰ,ⅱ,ⅲ),,分别为ⅰ(mw>10kda),ⅱ(3kda<mw<10kda),ⅲ(mw<3kda),各组分显示出不同的抗过敏活性,如表1所示;其中ⅲ(mw<3.0kda)组分过敏活性最强,对透明质酸酶活性的抑制率高达66.24%,选用ⅲ进行进一步分离纯化;表1超滤分离三组分ⅰ、ⅱ、ⅲ的抗过敏活性组分分子量(kda)抗过敏活性(%)*svh-ⅰ>1026.86±0.11csvh-ⅱ3~1039.41±0.36bsvh-ⅲ<366.24±0.87as4、凝胶层析分离纯化抗过敏肽:采用sephadexg-15葡聚糖凝胶层析对组分ⅲ进行进一步的分离纯化,采用sephadexg-15作为凝胶填料,将其进行预处理后装于规格为16×900mm的玻璃层析柱中,在1ml/min的流速下用超纯水进行洗脱,于214nm处检测并收集各洗脱峰对应的洗脱溶液,冷冻干燥后测定各组分的抗过敏活性,选择抗过敏活性最强的组分进行下一步的纯化,结果显示经sephadexg-15分离后,得到a、b、c、d、e五个组分,其中图1为酶解液mw<3kda的sephadexg-15凝胶色谱图,图2为在1mgml−1蛋白质浓度下从sephadexg-15中收集的每个组分的透明质酸酶抑制率,根据图2所示,c组分抗过敏活性最高,透明质酸酶抑制率为76.65%,选择c组分进行rp-hplc纯化;s5、反相高效液相色谱分离纯化抗过敏肽:将样品(10mg/ml)用0.22μm注射器过滤,样品自动注入安捷伦反相高效液相色谱柱(pursuit10c18,250×21.2mm),进一步纯化,实验条件为:流动相(洗脱液a,超纯水中0.1%tfa(v/v));洗脱液b,乙腈中0.1%tfa(v/v)),以1.0ml/min的流速进行分离,得到c1-c6六个组分,线性梯度为0-50%洗脱液b,分离时间为25min,在215nm处检测各组分的洗脱峰,收集透明质酸酶抑制活性最强的峰并冻干,如图3和图4所示,其中图3为sephadexg-15组分c的rp-hplc图,图4为在1mgml−1蛋白质浓度下从rp-hplc收集的每个组分的透明质酸酶抑制率,结果显示经rp-hplc分离后,得到c1-c6六个组分,其中c6组分抗过敏活性最高,透明质酸酶抑制率为89.4%,选择c6组分进行质谱鉴定;s6、lc-ms/ms鉴定抗过敏肽:利用lc-ms/ms对s5中抗过敏性最高的组分进行鉴定,得到一序列为tpevhiavdkf,如图5所示,mh+为1255.67da经合成后验证具有抗过敏作用的肽段,通过对该鉴定出的序列tpevhiavdkf进行化学合成,然后采用抗dnp-ige/dnp-bsa体系构建rbl细胞致敏-激发模型,测定合成肽对rbl细胞脱颗粒释放β-氨基己糖苷酶(β-hex)的抑制效果,通过测定β-hex(rbl-2h3细胞脱颗粒标志物)在培养基中的释放,评价纯化肽的抗过敏作用;首先对rbl细胞进行培养,培养方法为:在rbl-2h3细胞内加入10%的胎牛血清(fbs)、1:100(v/v)三抗(青霉素、链霉素、两性霉素)的培养基进行细胞培养,并将细胞放置在37℃的5%co2培养箱中培养,然后对β-氨基己糖苷酶(β-hex)测定,在96孔板(2.5×105细胞/ml)中培养的100μlrbl-2h3细胞用100μl抗dnp-ige(终浓度:1ug/ml)致敏过夜,用台式液清洗两遍后,加入不同浓度的样品(用台式液溶解稀释),37℃孵育1h,然后加入100μldnp-bsa(终浓度:10μg/ml)作抗原进行刺激,37℃孵育1h,取一个新的96孔板,在每个孔中加入50μlpnag(1mmpnag溶解于柠檬酸缓冲液中),将培养后的细胞上清液(30μl)转移到96孔板上,37℃孵育1h,然后在每个孔中加入100μl碳酸钠缓冲液,终止反应,测定波长405nm,阳性对照品为富马酸酮替芬,用酶标仪测定;如图6所示,结果表明合成肽对β-氨基己糖苷酶释放的ic50=1.39mg/ml,验证结果表明分离鉴定的肽作为一种天然来源对rbl-2h3细胞脱颗粒有一定的抑制效果。尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1