桃金娘三萜内酯A及其提取方法和应用与流程
本发明涉及药物化学技术领域,尤其是桃金娘三萜内酯a及其提取方法和应用。
背景技术:
桃金娘属于桃金娘科,生长在亚洲的南部及东南部,尤其是在中国的南部比如广东、湖南和广西。据报道,这种植物的提取物具有多种生物活性,有些具有抗菌、抗肝炎的作用,桃金娘叶的提取物也表现出抗炎的作用。以前有报道称,桃金娘的化学成分主要含有三萜和间苯三酚类化合物,但关于桃金娘活性成分及生物活性的研究仍然较少,为进一步寻找该植物的活性成分,对其进行深入研究是非常有必要的。
技术实现要素:
本发明提供了一种桃金娘三萜内酯a及其提取方法和应用,是从桃金娘植物的叶子中分离提取得到一个新的化合物桃金娘三萜内酯a,并发现其表现出潜在的α-葡萄糖苷酶的抑制活性。
为实现上述目的,本发明的技术方案为:
本发明提供了具有化学式i的桃金娘三萜内酯a:
本发明还提供了具有化学式i的桃金娘三萜内酯a的提取方法,包括以下步骤:
s1.干燥的桃金娘叶粉,用体积浓度为70~95%的乙醇溶液浸提至提取液无色,合并所得的浸出液,减压浓缩得浸膏;
s2.浸膏用水分散,然后用乙酸乙酯萃取,减压回收溶剂,得到乙酸乙酯萃取物;
s3.乙酸乙酯部位采用硅胶柱色谱分离,氯仿-甲醇梯度洗脱,洗脱浓度按体积比计,依次为:1:0、9:1、8:2、2:1、1:1、0:1,薄层色谱检测合并相同流分,得到六个组分fr.a-fr.f;
s4.取组分fr.b进一步用mci柱色谱分离,洗脱液为70-90%的甲醇溶液,分离得到fr.b1组分;
s5.取组分fr.b1采用硅胶柱色谱分离,氯仿-甲醇梯度洗脱,洗脱浓度按体积比计,依次为:50:1、20:1、0:1,薄层色谱检测得到10个组分fr.b1-1~fr.b1-10;
s6.取fr.b1-2,经制备液相色谱,以甲醇-水梯度洗脱,以体积比计,依次为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,流速为1-10.0ml/min,依次分离得到8个组分fr.b1-2-1~fr.b1-2-8;
s7.取fr.b1-2-3经高效液相色谱,以乙腈-水按照体积比32:68、流速为1.0ml/min洗脱,得到具有化学式i的桃金娘三萜内酯a。
本发明提供了具有化学式i的桃金娘三萜内酯a在制备治疗糖尿病药物方面的应用。
本发明进一步提供了具有化学式i的桃金娘三萜内酯a在制备葡萄糖苷酶抑制剂方面的应用。更进一步的,所述葡萄糖苷酶为α-糖苷酶。
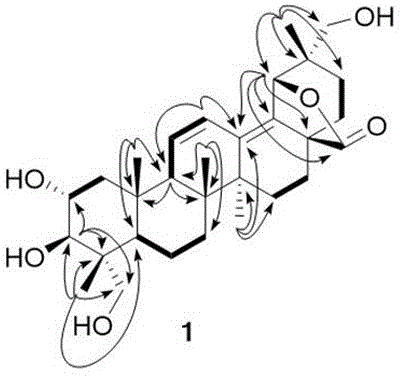
本发明从桃金娘植物叶子中分离得到一种新的三萜:桃金娘三萜内酯(rhodotomosidea),其结构被鉴定为2α,3β,23α,29-tetrahydroxyolean-11,13(18)-dien-28,19β-olide。
试验证明,桃金娘三萜内酯a对α-葡萄糖苷酶有较强的抑制作用,ic50值为0.213±0.016mg/ml,由于其对α-葡萄糖苷酶具有较好的抑制活性,因此可将其应用于制备治疗糖尿病药物和制备葡萄糖苷酶抑制剂,为制备治疗糖尿病的药物提供了更多选择。
附图说明
图1a为桃金娘三萜内酯a的hmbc谱图;图1b为桃金娘三萜内酯a的cosy-roesy联解图谱。
图2a是化合物1和阿卡波糖的质量浓度-酶活性曲线;图2b是化合物1和阿卡波糖的反应时间-酶活性曲线。
图3是桃金娘三萜内酯a的1hnmr(recordedinpyridine-d5)谱图。
图4是桃金娘三萜内酯a的13cnmr(recordedinpyridine-d5)谱图。
图5是桃金娘三萜内酯a的hsqc(recordedinpyridine-d5)谱图。
图6是桃金娘三萜内酯a的hmbc(recordedinpyridine-d5)谱图。
图7是桃金娘三萜内酯a的1h-1hcosy(recordedinpyridine-d5)谱图。
图8是桃金娘三萜内酯a的roesy(recordedinpyridine-d5)谱图。
图9是桃金娘三萜内酯a的esi谱图。
图10是桃金娘三萜内酯a的hreims谱图。
图11是桃金娘三萜内酯a的o.r.谱图。
图12是桃金娘三萜内酯a的uv谱图。
图13是桃金娘三萜内酯a的ir谱图。
具体实施方式
以下结合具体实施例对本发明作进一步说明,但本发明的保护范围不限于以下实施例。
1、仪器与材料
红外光谱测量仪(brukertensor27);紫外分光度计(岛津uv2401pc);四极杆液质联用仪(lc-ms8030,岛津,日本);液相色谱-质谱联用技术(exavtie,thermofisherscientific);核磁共振扫描仪(brukerdrx-500mhz);核磁共振扫描仪(avanceiii600mhz);combiflashrf(rf200,teledyneisco,inc.,usa);高效液相色谱仪(agilentlc1260infinity,agilent);旋转蒸发器(re-52a,上海亚荣生化仪器厂);电子天平(bs400s,北京赛多利斯有限公司);层析用硅胶(青岛海洋化工厂,100-200目,200-300目);采用硅胶gf254预涂玻璃进行薄层色谱(青岛海洋化工股份有限公司);色谱柱(rp-18,merk);mci填充材料为mci-gelchp-20p(日本三菱);rp柱(zorbaxsb-c18,5μm,9.4×250mm,agilent,usa);氯仿,石油醚,乙酸乙酯,甲醇(ar,均购自中国西龙科技有限公司);α-糖苷酶(g0660-750un,sigma,germany);葡萄糖苷酶抑制剂(109a032,北京solarbio科技有限公司);4-pnpg(n0493,东京化学工业有限公司)。
2、植物材料
桃金娘叶采集于广西平南县,经桂林医学院药学院黄德青副教授鉴定为桃金娘叶。凭证样本(编号:2016082501)存放于桂林医学院药学院中药与天然产物研究所。
实施例1
桃金娘三萜内酯a的提取:
s1.干燥的桃金娘叶粉20kg,用体积浓度为95%的乙醇溶液浸提至提取液无色,合并所得的浸出液,减压浓缩得浸膏;
s2.浸膏用水分散,然后用乙酸乙酯萃取,减压回收溶剂,得到乙酸乙酯萃取物;
s3.乙酸乙酯部位采用硅胶(100–200目)柱色谱分离,氯仿-甲醇梯度洗脱,洗脱浓度按体积比计,依次为:1:0、9:1、8:2、2:1、1:1、0:1,薄层色谱检测合并相同流分,得到六个组分fr.a-fr.f;
s4.取组分fr.b(342g)进一步用mci柱色谱分离,洗脱液为90%的甲醇溶液,分离得到fr.b1组分(187g);
s5.取组分fr.b1采用硅胶(100–200目)柱色谱分离,氯仿-甲醇梯度洗脱,洗脱浓度按体积比计,依次为:50:1、20:1、0:1,薄层色谱检测得到10个组分fr.b1-1~fr.b1-10;
s6.取fr.b1-2,经制备液相色谱,以甲醇-水梯度洗脱,以体积比计,依次为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,依次分离得到8个组分fr.b1-2-1~fr.b1-2-8;
s7.取fr.b1-2-3经高效液相色谱,以乙腈-水按照体积比32:68、流速为1.0ml/min洗脱,得到具有化学式i的桃金娘三萜内酯a(4.1mg)(化合物1);
s8.取fr.b1-2-5(864.9mg),经半制备高效液相色谱仪,以甲醇-水洗脱,体积比70:30,流速为3.0ml/min,依次得到化合物2-4(37.8mg、404.3mg、4.1mg);
s9.取组分fr.a(147g),采用硅胶(100-200目)柱色谱分离,石油醚-乙酸乙酯梯度洗脱,体积比为1:0、20:1、10:1、5:1、0:1,薄层色谱检测合并相同组分,得到8个组分(fr.a1-fr.a8);取组分fr.a5(31.0g),经制备型液相色谱,以纯甲醇(流速为10.0ml/min)和半制备液相色谱,以甲醇-水(v/v74:26、流速为3.0ml/min)进一步分离得到fr.a5-1和fr.a5-2;取组分fr.a5-1(67.4mg),经半制备高效液相色谱仪,以甲醇-水(v/v65:35、流速为3.0ml/min)分离得到化合物5(26.2mg)和化合物6(8.9mg);取组分fr.a5-2(17.1mg),经高效液相色谱仪,以乙腈-水(v/v55:45、流速为1.0ml/min)分离得到化合物7(15.5mg)。
实施例2
桃金娘三萜内酯a的鉴定:
实施例1分离得到的一种新的三萜(化合物1)和六种已知的三萜(化合物2-7)。与文献进行比较,已知的化合物2-7被鉴定为2α,3β,19α,23-tetrahydroxyurs-12-en-28-oicacid(2)、积雪草酸(3)、猕猴桃酸(4)、28-norlup-20(29)-en-3β-hydroxy-17β-hydroperoxide(5)、28-norlup-20(29)-ene-3β、17β-diol(6)、桦木酸(7)。
化合物1黄色无定形粉末
通过对化合物1的1h和13c核磁共振光谱数据的仔细研究,发现其与报道的从诃子中分离出来的termichebulolide非常相似。termichebulolide和化合物1的主要区别在于termichebulolide的29位甲基上的一个氢被羟基取代,变成了化合物1的氧化亚甲羟基,δh3.95(d,j=10.3hz,1h,h-29)和3.58(d,j=10.3hz,1h,h-29)与c-19,c-20,c-21,c-30的hmbc相关(图1)性证实了这一点。roesy中h-19和h-29的相关性显示h-29为α构型。因此化合物1的结构被鉴定为2α,3β,23α,29-tetrahydroxyolean-11,13(18)-dien-28,19β-olide,并被命名为rhodotomosidea。
rhodotomosidea(1)
黄色粉末,
实施例3
桃金娘三萜内酯a的活性测定
测定桃金娘三萜内酯a和阿卡波糖(阳性对照)对α-葡萄糖苷酶的抑制活性,以桃金娘三萜内酯a的1%dmso溶液作为储备液,以储备液为母液,配制不同浓度的储备液缓冲溶液(磷酸盐缓冲液、ph=6.9)供试验使用。在96孔板中加入50μl不同浓度的化合物(0.001、0.01、0.05、0.1、0.2、0.5mg/ml)和100μl0.5u/ml的α-葡萄糖苷酶。在25℃下孵育15min,然后向96孔板中加入50μl5mm的4-pnpg,然后在25℃下孵育10min。在405nm波长处检测吸光度(1、5、10、15、20min)。α-葡萄糖苷酶抑制率(%)=[(a标-a样)/a标]×100%。a标是不含化合物/阳性药的酶的吸光度值,a样是含有化合物/阳性药的酶的吸光度值。ic50为抑制50%酶活性时所需的抑制剂浓度,结果见图2。
试验结果显示,当浓度为0.001、0.01、0.05、0.1、0.2、0.5mg/ml时,抑制率随浓度的增加而逐渐增大,抑制效果表现为剂量依赖型,与阿卡波糖类似,其结果如图2a所示。桃金娘三萜内酯a和阿卡波糖的抑制率分别为77.82%和65.75%,ic50值分别为0.213±0.016和0.017±0.004mg/ml。初级酶动力学实验中,在桃金娘三萜内酯a浓度为0.5mg/ml的条件下测定酶的抑制活性,反应时间分别为1、5、10、15、20min,可以看出桃金娘三萜内酯a可以快速抑制酶的活性,抑制率可以在1min内达到最大值,然后下降,结果如图2b所示。因此,化合物1表现出潜在的α-葡萄糖苷酶的抑制活性。
- 还没有人留言评论。精彩留言会获得点赞!