马克斯克鲁维酵母醛酮还原酶KmAKR突变体及其应用的制作方法
(一)技术领域
本发明涉及一个源自马克斯克鲁维酵母的醛酮还原酶kmakr的突变体构建,开发醛酮还原酶重组菌及酶在阿托伐他汀和瑞舒伐他汀、匹伐他汀等“超级他汀”侧链双手性二醇6-取代-(3r,5r/s)-二羟基己酸叔丁酯手性生物催化合成方面的应用。
(二)
背景技术:
阿托伐他汀和瑞舒伐他汀、匹伐他汀等“超级他汀”是治疗心脑血管疾病的重大降脂药品种,具有高效的降脂疗效、长期安全性和临床益处,显著降低心脑血管疾病的发病率和死亡率。迄今为止,阿托伐他汀钙的累计销售额已突破1000亿美元,是人类制药工业史上最成功的单一药物品种。
他汀药物大多含有6-取代-(3r,5r/s)-二羟基己酸叔丁酯结构,既是重要的药效基团又是关键合成前体。6-氰基-(3r,5r)-二羟基己酸叔丁酯是阿托伐他汀钙的关键手性二醇中间体。6-氯-(3r,5s)-二羟基己酸叔丁酯是瑞舒伐他汀、匹伐他汀等“超级他汀”药物的合成前体。由于6-取代-(3r,5r/s)-二羟基己酸叔丁酯具有两个手性中心,因此,研究光学纯6-取代-(3r,5r/s)-二羟基己酸叔丁酯的手性合成方法学和合成技术具有重要意义。已有文献报道的6-取代-(3r,5r/s)-二羟基己酸叔丁酯合成方法主要包括化学催化6-取代-(5r/s)-羟基-3-羰基己酸叔丁酯不对称还原和氧化还原酶差向选择性还原6-取代-(5r/s)-羟基-3-羰基己酸叔丁酯。硼烷等化学催化剂催化还原工艺存在能耗高、转化率低、差向选择性低和生产成本高等缺陷。与化学催化剂相比,酶作为绿色天然生物催化剂,在催化化学反应中具有优越的化学选择性、立体选择性和区域选择性等优点,且反应条件温和、副产物少、环境友好。但许多酶分子在催化非天然底物时,往往存在活力较低、稳定性差、底物产物抑制等问题,亟需对酶分子实施分子改造。
得益于蛋白质工程的科技进步,生物催化已广泛应用于工业化生产。在我们前期发明(cn201710282633.x,cn201910155559.4)的基础上,本发明通过建立高通量筛选模型,构建大容量突变体文库,筛选获得具有鲁棒性的超级突变体,其中“最佳”突变体kmakr-w297h/y296w/k29h/y28a/t63m催化性能最强,进一步分析了突变体催化性能提升的分子机理,优化反应工艺参数,构建kmakr-w297h/y296w/k29h/y28a/t63m催化合成6-取代-(3r,5r/s)-二羟基己酸叔丁酯工艺。
(三)
技术实现要素:
本发明目的是针对现有醛酮还原酶对6-取代-(5r/s)-羟基-3-羰基己酸叔丁酯不对称还原活性不高及底物投料量低的问题,提供一种立体选择性醛酮还原酶系列突变体及利用该醛酮还原酶突变体的重组菌或其粗酶液作为催化剂,不对称还原合成6-氰基-(3r,5r)-二羟基己酸叔丁酯、6-氯-(3r,5s)-二羟基己酸叔丁酯等手性醇化合物,催化剂活性较kmakr-w297h/y296w/k29h/y28a提高了4.1倍,底物投料量提高至450g/l,这是所有文献报道中的最高水平。
本发明采用的技术方案是:
本发明提供一种马克斯克鲁维酵母醛酮还原酶kmakr突变体,所述醛酮还原酶突变体是将seqidno.2所示氨基酸序列第63位点进行定点饱和突变获得的,优选突变体为下列之一:(1)第63位苏氨酸突变为丙氨酸;(2)第63位苏氨酸突变为亮氨酸;(3)第63位苏氨酸突变为蛋氨酸。seqidno.2所示氨基酸序列对应的编码基因核苷酸序列为seqidno.1所示。
本发明还提供一种所述醛酮还原酶kmakr突变体在不对称还原羰基化合物制备手性醇中的应用,具体所述的应用方法为:将含醛酮还原酶kmakr突变体基因的工程菌经诱导培养获得的菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的菌体混合,以混合菌体或混合菌体提取的粗酶液为催化剂,以羰基化合物为底物,以葡萄糖为辅底物,以ph7.0、100mm的pbs缓冲液为反应介质构成转化体系,在30-35℃、400~600rpm条件下进行反应,反应结束,反应液分离纯化,获得手性醇化合物。
进一步,所述转化体系中,底物终浓度30~450g/l(优选200~400g/l),葡萄糖终浓度30~450g/l(优选200~400g/l),催化剂用量以混合菌体总量干重计为0.1~20gdcw/l(dcw细胞干重,优选20gdcw/l),所述混合菌体中含醛酮还原酶突变体基因的工程菌经诱导培养获得的湿菌体与含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体以干重比1.0~5.0:1(w/w),优选3.5:1混合。所述葡萄糖脱氢酶基因(genbankno.km817194.1)来自exiguobacteriumsibiriumdsm17290。
进一步,羰基化合物为下列之一:4-氯-3-羰基丁酸乙酯、6-氯-(5s)-羟基-3-羰基己酸叔丁酯、3-羰基丁酸乙酯、4-溴-3-羰基丁酸丙酯、4,4,4,-三氟-3-羰基丁酸乙酯、6-氰基-(5r)-羟基-3-羰基己酸叔丁酯、3-羰基丁酸叔丁酯、苯乙酮,优选6-氯-(5s)-羟基-3-羰基己酸叔丁酯、3-羰基丁酸乙酯、6-氰基-(5r)-羟基-3-羰基己酸叔丁酯。
本发明所述羰基化合物为6-氰基-(5r)-羟基-3-羰基己酸叔丁酯时,所述醛酮还原酶kmakr突变体在不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯的方法为:将含醛酮还原酶突变体基因的工程菌经诱导培养获得的菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的菌体混合,以混合菌体为催化剂,以6-氰基-(5r)-羟基-3-羰基己酸叔丁酯为底物,以葡萄糖为辅底物,以ph7.0、100mm的pbs缓冲液为反应介质构成转化体系,在30℃、400~600rpm条件下进行反应,反应结束,反应液分离纯化,获得6-氰基-(3r,5r)-二羟基己酸叔丁酯。
本发明所述底物为6-氯-(5s)-羟基-3-羰基己酸叔丁酯时,所述醛酮还原酶kmakr突变体在不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯制备6-氯-(3r,5s)-二羟基己酸叔丁酯中的方法为:将含醛酮还原酶kmakr突变体基因的工程菌经诱导培养获得的菌体和含葡萄糖脱氢酶基因的工程菌经诱导培养获得的菌体混合,以混合菌体为催化剂,以6-氯-(5s)-羟基-3-羰基己酸叔丁酯为底物,以葡萄糖为辅底物,以ph7.0、100mm的pbs缓冲液为反应介质构成转化体系,在30℃、400~600rpm条件下进行反应,反应结束,反应液分离纯化,获得6-氯-(3r,5s)-二羟基己酸叔丁酯。
进一步,所述湿菌体按如下方法制备:将携带醛酮还原酶突变体基因的大肠杆菌工程菌接种到含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃培养10h,以体积浓度1.5%的接种量接种到新鲜的含终浓度50μg/ml卡那霉素的lb液体培养基中,37℃、180rpm培养2h,再向培养液中加入终浓度为0.15mm异丙基硫代半乳糖苷(isopropylβ-d-thiogalactoside,iptg),28℃培养12h后,4℃、8000rpm离心10min,获得含醛酮还原酶突变体的湿菌体;所述含葡萄糖脱氢酶基因的工程菌经诱导培养获得的湿菌体制备方法同含醛酮还原酶基因的湿菌体。
本发明所述粗酶液按如下方法制备:按照湿菌体总量100g/l的用量重悬于ph7.0、100mmpbs缓冲液中,在冰水混合物上超声破碎6min,超声破碎条件:功率为400w,破碎1s、暂停1s,取破碎混合液,获得粗酶液。
本发明醛酮还原酶kmakr及醛酮还原酶kmakr突变体碱基序列全长均为933bp,从第一个碱基起至第933个碱基止,起始密码子为atg,终止密码子为tga。
本发明所述醛酮还原酶kmakr突变体的获取是采用定点饱和突变技术,使用该技术对kmakr-w297h/y296w/k29h/y28a醛酮还原酶基因(seqidno.1)进行突变,将获得的突变质粒以热击方式导入e.colibl21(de3)感受态细胞,对获得菌株进行接种、转接、培养、诱导培养、菌体回收,利用重悬菌液催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原,制备光学纯6-氰基-(3r,5r)-二羟基己酸叔丁酯,具体方法如下:第一步将对照菌活化,获得了对照菌e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a,提取质粒pet28a(+)-kmakr-w297h/y296w/k29h/y28a,并保存于-20℃。第二步通过swiss-model与kmakr-w297h/y296w/k29h/y28a比较,获得同源建模的模板蛋白晶体结构,利用modeller9.19同源建模,并进行分子对接,选择合适的突变位点,选择的位点主要是位于活性中心附近的氨基酸残基以及活性中心loop环上的氨基酸残基,设计突变的引物,以pet28a(+)-kmakr-w297h/y296w/k29h/y28a为模板质粒,进行定点饱和突变,获得突变质粒,并转化,进行优势突变菌的筛选,获得醛酮还原酶突变体kmakr-y296w/w297h/k29h/y28a/t63a(记为m5-a、kmakr-y296w/w297h/k29h/y28a/t63l(记为m5-l)、kmakr-y296w/w297h/k29h/y28a/t63m(记为m5-m),将优势突变体送样测序并保存。
本发明醛酮还原酶突变体和葡萄糖脱氢酶基因工程菌的接种、转接、诱导、菌体回收,培养基可为本领域任何可使菌体生长并产生本发明的培养基,优选lb培养基:胰蛋白胨10g/l,酵母提取物5g/l,nacl10g/l,蒸馏水溶解,调节ph7.0。培养方法和培养条件没有特殊的限制,培养方法和条件可以根据宿主类型和培养方法等因素的不同按本领域普通知识进行适当的选择。
与现有技术相比,本发明主要的有益效果主要体现在:本发明构建的醛酮还原酶突变体m5-a、m5-l、m5-m的比酶活较对照组醛酮还原酶分别增加了1.1倍、3.2倍、4.1倍。其中突变体kmakr-y296w/w297h/k29h/y28a/t63m最大底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯投料量可达到450g/l,产物浓度随时间的推移而逐渐升高,7.0h内可反应完成,底物转化率大于99%,产物dep值始终保持在99.5%以上。时空产率达到1224.3g/ld。而利用对照组kmakr-w297h/y296w/k29h/y28a催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯时最大底物投料量可达到200g/l,因此醛酮还原酶突变体kmakr-y296w/w297h/k29h/y28a/t63a、kmakr-y296w/w297h/k29h/y28a/t63l、kmakr-y296w/w297h/k29h/y28a/t63m更具工业应用前景。
(四)附图说明
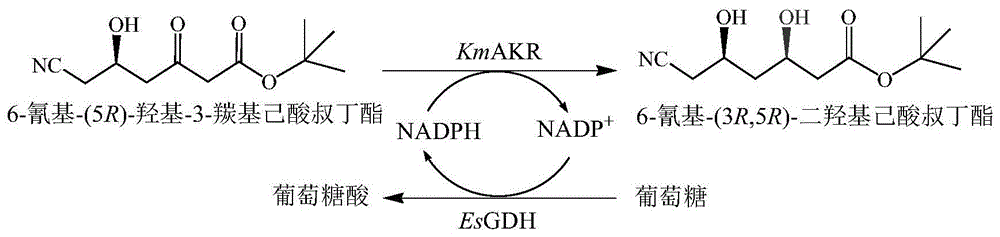
图1是醛酮还原酶与葡萄糖脱氢酶esgdh偶联催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯不对称还原制备6-氰基-(3r,5r)-二羟基己酸叔丁酯的反应示意图。
图2是醛酮还原酶与葡萄糖脱氢酶esgdh偶联催化6-氯-(5s)-羟基-3-羰基己酸叔丁酯不对称还原制备6-氯-(3r,5s)-二羟基己酸叔丁酯的反应示意图
图3醛酮还原酶突变体上清液和纯酶的sds-page电泳图。泳道1:对照kmakr-w297h/y296w/k29h/y28a上清液;泳道2:对照kmakr-w297h/y296w/k29h/y28a纯酶;泳道3:kmakr-w297h/y296w/k29h/y28a/t63a上清液;泳道4:kmakr-w297h/y296w/k29h/y28a/t63a纯酶;泳道5:kmakr-w297h/y296w/k29h/y28a/t63l上清液;泳道6:kmakr-w297h/y296w/k29h/y28a/t63l纯酶;泳道7:kmakr-w297h/y296w/k29h/y28a/t63m上清液;泳道8:kmakr-w297h/y296w/k29h/y28a/t63m纯酶;m:标准蛋白分子。
图4是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a偶联esgdh不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯时间进程图。
图5是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a偶联esgdh不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯时间进程图。
图6是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63l偶联esgdh不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯时间进程图。
图7是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63m偶联esgdh不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯时间进程图。
图8是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a偶联esgdh不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯制备6-氯-(3r,5s)-二羟基己酸叔丁酯时间进程图。
图9是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63l偶联esgdh不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯制备6-氯-(3r,5s)-二羟基己酸叔丁酯时间进程图。
图10是利用醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63m偶联esgdh不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯制备6-氯-(3r,5s)-二羟基己酸叔丁酯时间进程图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:醛酮还原酶突变体文库的构建及筛选
马克斯克鲁维酵母醛酮还原酶突变体文库的制备通过1轮定点饱和突变来实现,引物设计如表1,以e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a(构建参见专利申请cn201910072740.9)中载体pet28a(+)-kmakr-w297h/y296w/k29h/y28a为模板,以表1中thr63-f和thr63-r为引物,经饱和突变pcr,将seqidno.2所示醛酮还原酶kmakr-w297h/y296w/k29h/y28a氨基酸序列的第63位苏氨酸突变为其余19种氨基酸,并转化,涂平板,通过优势菌株筛选(表2),获得醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a(记为m5-a,即seqidno.2所示氨基酸第63位苏氨酸突变为丙氨酸)、kmakr-w297h/y296w/k29h/y28a/t63l(记为m5-l,即seqidno.2所示氨基酸第63位苏氨酸突变为亮氨酸)和kmakr-w297h/y296w/k29h/y28a/t63m(记为m5-m,即seqidno.2所示氨基酸第63位苏氨酸突变为蛋氨酸)。同时,以pet28a(+)-kmakr-w297h/y296w/k29h/y28a为模板,对22位点和95位点进行定点饱和突变,但均未获得活力提高的突变菌株。
pcr反应体系(50μl):1μl正向引物(100μm),1μl反向引物(100μm),25μl2×phanta缓冲液,1μldntp混合物(各10mm),1μl质粒模板,1μldna聚合酶和21μl超纯水。根据phantasuper-fidelitydna聚合酶手册设置的pcr程序如下:95℃预变性5min,然后29个循环(95℃变性15s,55℃退火15s,72℃延伸7s),72℃终延伸10min,16℃保温。将得到的重组质粒转移到大肠杆菌bl21(de3)感受态细胞中,并将克隆子在37℃培养12h。然后挑出克隆并转接到10ml含50μg/ml卡那霉素的lb液体培养基中,并在37℃,180rpm培养10h。对获得的突变体进行优势突变体的筛选,筛选条件如下:以干重25g/l(醛酮还原酶突变体和葡萄糖脱氢酶菌体干重比3.5:1(w/w)的量加入ph7.0的pbs(100mm)重悬细胞,再加入终浓度50g/l6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,50g/l的葡萄糖构成转化体系10ml,在35℃、600rpm条件下进行反应,反应结束,取样检测6-氰基-(3r,5r)-二羟基己酸叔丁酯浓度,筛选获得优势菌株。将获得优势菌株送杭州擎科生物技术有限公司测序,并保存在-80℃冰箱。
表1醛酮还原酶定点饱和突变引物设计
实施例2:对照组醛酮还原酶、突变体和葡萄糖脱氢酶的诱导表达
葡萄糖脱氢酶基因工程菌:将来自e.sibiriumdsm17290葡萄糖脱氢酶基因(genbankno.km817194.1)插入到pet28b(+)构建重组表达载体,并将此表达载体转入e.colibl21(de3)制得e.colibl21(de3)/pet28b(+)-esgdh。
将实施例1出发菌株e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a和实施例1筛选的醛酮还原酶突变菌株以及e.colibl21(de3)/pet28b(+)-esgdh分别接种到含有终浓度50μg/ml卡那霉素的lb液体培养基中,37℃培养10h,以体积浓度1.5%(v/v)的接种量接种到新鲜的含有终浓度50μg/ml卡那霉素的lb液体培养基中,37℃、180rpm培养2h,再向培养液中加入终浓度为0.15mmiptg,28℃培养12h后,4℃、8000rpm离心10min,获得相应的湿菌体细胞。以上获得的细胞产有相应的蛋白,可用于蛋白纯酶液的制备,也可用于粗酶液催化不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯制备6-氰基-(3r,5r)-二羟基己酸叔丁酯以及催化不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯制备6-氯-(3r,5s)-二羟基己酸叔丁酯。
实施例3:突变文库筛选
将实施例2诱导表达的突变株湿菌体及葡萄糖脱氢酶湿菌体以干重比3.5:1(w/w)混合成混合菌体,加入ph7.0、100mmpbs缓冲液中重悬,获得突变株混合菌液。同样条件下,用对照菌株e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a替换突变体菌株湿菌体制备对照株混合菌液。
分别将突变株混合菌液和对照株混合菌液作为催化剂,以6-氰基-(5r)-羟基-3-羰基己酸叔丁酯为底物,以葡萄糖为辅助底物,不添加外源性nadph或nadp+,利用菌体细胞内源性nadph,建立起辅酶循环系统。反应体系选择为10ml,催化剂用量以混合菌体总干重计20g/l,底物终浓度30g/l,葡萄糖终浓度30g/l,ph7.0、100mmpbs缓冲液为反应介质构建转化体系,30℃、600rpm反应20min取样,取反应液100μl加入900μl无水乙醇沉淀蛋白,即反应液稀释10倍,-20℃过夜,12000rpm离心3min,取上清,过0.22μm微滤膜,作为液相样品,hplc检测6-氰基-(5r)-羟基-3-羰基己酸叔丁酯、6-氰基-(3r,5r)-二羟基己酸叔丁酯、6-氰基-(3s,5r)-二羟基己酸叔丁酯的生成量及dep值。以产物6-氰基-(3r,5r)-二羟基己酸叔丁酯和dep为指标,筛选优势突变体,实验结果示于表2。
液相检测条件:色谱柱
表2kmakr-w297h/y296w/k29h/y28a及其突变体的催化性能和立体选择性
实施例4:醛酮还原酶母本及其突变体的纯化
将实施例3获得的优势突变体(表2中kmakr-w297h/y296w/k29h/y28a/t63a,kmakr-w297h/y296w/k29h/y28a/t63l,kmakr-w297h/y296w/k29h/y28a/t63m),根据实施例2所述方法获得醛酮还原酶突变体湿菌体,分别在8000rpm,4℃下离心10min收集菌体,并用0.9%(w/v)盐水洗涤两次。按照湿菌体总量100g/l的量加入ph7.0、100mmpbs缓冲液中重悬,在冰水混合物上超声破碎6min,超声破碎条件:功率为400w,破碎1s、暂停1s,获得突变株粗酶液。通过在8000rpm,4℃下离心10min收集上清液(电泳图见图3所示),将其通过0.45μm膜微过滤后,采用ni亲和柱纯化突变体蛋白。
使用镍亲和柱(1.6×10cm,bio-rad公司,美国)纯化突变体蛋白,具体操作如下:①用缓冲液a(含0.3mnacl、20mm咪唑的ph8.0、20mmpbs缓冲液)进行预平衡。②用缓冲液a以1.0ml/min的流速洗去未结合的杂质,直至电导率稳定。③然后用缓冲液b(含0.3mnacl、500mm咪唑的ph8.0、20mmpbs缓冲液)洗脱目的蛋白。将收集的洗脱液用20mmpbs缓冲液(ph7.0)透析过夜。所有纯化步骤均在4℃下进行。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)鉴定蛋白质大小。对照菌株e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a的醛酮还原酶纯酶采用相同条件收集,电泳结果示于图3,突变菌株的目标酶表达量较e.colibl21(de3)/pet28a(+)-kmakr-w297h/y296w/k29h/y28a菌株的酶表达量没有显著变化,因此,突变体的酶活提高不是酶的表达量增加引起的,与酶自身比活力增加有关。
实施例5:母本醛酮还原酶及其突变体酶比酶活的测定
酶活单位(u)定义为:在35℃、ph7.0条件下,每分钟每生成1微摩尔6-氰基-(3r,5r)-二羟基己酸叔丁酯所需的酶量定义为一个酶活单位,u。比酶活定义为每毫克酶蛋白所具有的活力单位数,u/mg。
酶活检测标准条件:5mm6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,0.25mmnadph,适量酶液,35℃、ph7.0,500rpm条件下反应3min,样品处理并进行hplc检测分析。
蛋白浓度用二喹啉甲酸蛋白测定试剂盒(南京凯基生物科技发展有限公司,南京)测定。
表3醛酮还原酶及其突变体的相对酶活和差向对应异构体选择性(dep)值
实施例6:醛酮还原酶对照组kmakr-w297h/y296w/k29h/y28a不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶对照组kmakr-w297h/y296w/k29h/y28a湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的双酶偶联体系中,将湿菌体kmakr-w297h/y296w/k29h/y28a和葡萄糖脱氢酶esgdh湿菌体催化6-氰基-(5r)-羟基-3-羰基己酸叔丁酯生成6-氰基-(3r,5r)-二羟基己酸叔丁酯。
以干重比3.5:1(w/w)混合成混合菌体,在50ml反应体系中,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为20gdcw/l,当底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的投料量为170g/l,葡萄糖浓度为255g/l,以ph7.0、100mm的pbs缓冲液为反应介质构成转化体系,在30℃、600rpm条件下反应,4.5h能完全转化成产物6-氰基-(3r,5r)-二羟基己酸叔丁酯,底物转化率大于99%,产物dep值始终保持在99.5%以上。产物的浓度为549mm,时空产率达到670.5g/ld。
实施例7:醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的的双酶偶联体系中,将湿菌体kmakr-w297h/y296w/k29h/t63a和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为20gdcw/l,底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的投料量为200g/l,葡萄糖浓度为200g/l,ph7.0、100mmpbs缓冲液为反应介质构建转化体系50ml,30℃、400rpm反应,反应进程曲线如图5所示,底物在2.5h能完全转化成产物6-氰基-(3r,5r)-二羟基己酸叔丁酯,且产物的累积量达到549.3mm,产物dep值>99.5%,时空产率达到1207.7g/ld。继续增加底物浓度到300g/l时,6-氰基-(5r)-羟基-3-羰基己酸叔丁酯能完全转化成6-氰基-(3r,5r)-二羟基己酸叔丁酯,且在反应时间为6.0h,反应达到终点,底物的转化率大于99%,产物dep值>99.5%。
实施例8:醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63l不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯
同实施例7的方法通过发酵获得醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63l湿菌体和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,在50ml反应体系中,混合菌体先用ph7.0、100mmpbs缓冲液重悬,反应体系中混合菌体的投加总干重量为20gdcw/l,将底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的初始投料量设定为300g/l,葡萄糖的浓度为300g/l,ph7.0、100mmpbs缓冲液为反应介质构建转化体系,30℃、600rpm反应。反应进程曲线如图6所示,产物浓度随时间的推移而逐渐升高,5.0h反应完成,可完全转化成740.3mm的产物,产物dep值>99.5%,时空产率可达1152.2g/ld。将底物浓度提高为370g/l,6-氰基-(5r)-羟基-3-羰基己酸叔丁酯能完全转化成6-氰基-(3r,5r)-二羟基己酸叔丁酯,且在反应时间为6.5h,反应达到终点,可完全转化成799.2mm的产物,产物dep值>99.5%。
实施例9:醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63m不对称还原6-氰基-(5r)-羟基-3-羰基己酸叔丁酯
同实施例7的方法通过发酵获得醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63m湿菌体和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,在50ml反应体系中,混合菌体先用ph7.0、100mmpbs缓冲液重悬,反应体系中混合菌体的投加总干重量为20gdcw/l,将底物6-氰基-(5r)-羟基-3-羰基己酸叔丁酯的初始投料量设定为400g/l,葡萄糖的浓度为400g/l,ph7.0、100mmpbs缓冲液为反应介质构建转化体系,30℃、600rpm反应。反应进程曲线如图7所示,产物浓度随时间的推移而逐渐升高,5.5h反应完成,可完全转化成829.6mm的产物,产物dep值>99.5%,时空产率可达1427.2g/ld。继续增加底物的浓度,在同样的反应体系中加入终浓度450g/l的6-氰基-(5r)-羟基-3-羰基己酸叔丁酯,反应条件与上述方法相同,产物浓度随时间的推移而逐渐升高,7.0h内反应完成,底物转化率大于99%,产物dep值始终保持在99.5%以上。产物的浓度为881.1mm,产物dep值>99.5%,时空产率达到1224.3g/ld。
实施例10:醛酮还原酶kmakr-w297h/y296w/k29h/y28a/t63a不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶对照组kmakr-w297h/y296w/k29h/y28a/t63a湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的双酶偶联催化体系中,将湿菌体kmakr-w297h/y296w/k29h/y28a/t63a和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为20gdcw/l,当底物6-氯-(5s)-羟基-3-羰基己酸叔丁酯的投料量为300g/l,葡萄糖浓度为300g/l时,底物在30℃、600rpm反应5h能完全转化成产物6-氯-(3r,5s)-二羟基己酸叔丁酯,底物转化率大于99%,产物dep值始终保持在99.5%以上。产物的浓度为632.9mm,时空产率达到720.2g/ld。
实施例11:醛酮还原酶kmakr-w297h/y296w/k29h/y28a/t63l不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶对照组kmakr-w297h/y296w/k29h/y28a/t63l湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的双酶偶联催化体系中,将湿菌体kmakr-w297h/y296w/k29h/y28a/t63l和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为20gdcw/l,当底物6-氯-(5s)-羟基-3-羰基己酸叔丁酯的投料量为350g/l,葡萄糖浓度为350g/l时,底物在30℃、600rpm反应4h能完全转化成产物6-氯-(3r,5s)-二羟基己酸叔丁酯,底物转化率大于99%,产物dep值始终保持在99.5%以上。产物的浓度为738.4mm,时空产率达到1050.4g/ld。
实施例12:醛酮还原酶kmakr-w297h/y296w/k29h/y28a/t63m不对称还原6-氯-(5s)-羟基-3-羰基己酸叔丁酯
根据实施例2的描述,通过发酵获得醛酮还原酶对照组kmakr-w297h/y296w/k29h/y28a/t63m湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的双酶偶联催化体系中,将湿菌体kmakr-w297h/y296w/k29h/y28a/t63m和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为20gdcw/l,当底物6-氯-(5s)-羟基-3-羰基己酸叔丁酯的投料量为400g/l,葡萄糖浓度为400g/l时,底物在30℃、600rpm反应4h能完全转化成产物6-氯-(3r,5s)-二羟基己酸叔丁酯,底物转化率大于99%,产物dep值始终保持在99.5%以上。产物的浓度为843.8mm,时空产率达到1188.2g/ld。
实施例13:醛酮还原酶kmakr-w297h/y296w/k29h/y28a/t63a、kmakr-w297h/y296w/k29h/y28a/t63l、kmakr-w297h/y296w/k29h/y28a/t63m不对称还原系列羰基化合物
根据实施例2的描述,通过发酵获得醛酮还原酶突变体kmakr-w297h/y296w/k29h/y28a/t63a、kmakr-w297h/y296w/k29h/y28a/t63l、kmakr-w297h/y296w/k29h/y28a/t63m湿菌体和葡萄糖脱氢酶esgdh湿菌体。在建立的双酶偶联催化体系中,分别将醛酮还原酶突变体湿菌体和葡萄糖脱氢酶esgdh湿菌体以干重比3.5:1(w/w)混合成混合菌体,先将混合菌体用ph7.0、100mm的pbs缓冲液重悬,转化体系中混合菌体加入干重量为4.0gdcw/l,总体系为10ml,系列羰基化合物底物投料量50g/l、葡萄糖浓度50g/l、35℃,600rpm反应12h,进行转化率的检测。转化率检测方法参照文章(enzym.microb.technol.,2017,107:32–40)方法。结果示于表4。
表4醛酮还原酶kmakr突变体催化系列羰基化合物不对称还原反应的结果
序列表
<110>浙江工业大学
<120>马克斯克鲁维酵母醛酮还原酶kmakr突变体及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>933
<212>dna
<213>未知(unknown)
<400>1
atgacaaaccaaaagttctttactttatccaatgggaacaagattccagctgttgctgtt60
gttggtacaggtaccaagtgggcacacgctgaagaaaccgatgctactttctctcaagaa120
ttgactgatatcgtaaagctatctttagacactgttccaggaattgttcacattgatgca180
gccgagacctacaagacttatccagagttgggtgctgctttgaaggaaacaaagaagccc240
agggaagagattttcattacagacaagttttcttccttgcacaagatttcggaagatcct300
aagtctgctttagaaaccgctttgaagaagctaggagttgattatgttgacttatacttg360
attcattctccatttttcgacaaggacttgaatattgatctagagaccgcttggaagcaa420
ttggaagaactatataaatccggaaaggcaaagaacattggtgtctcaaactttactgtt480
gaggatttgaaaaaagttttggccattgctgaaattaaacctcaagtgaatcaaatcgag540
ttttctccattcttgcaaaaccagaccccaggtatcgtggagtttagccaaaagaacgat600
attttactagaagcctattctccattaggtcctctccaaaagaagccagctgatgctgac660
caacaaccattctatcaatatctgaaggaactttctgaaaagtataacaaaactgaagct720
caagttttgttgttgtgggtgtacaagcgcggtatcttgccagttaccacttctgccaag780
atcgagagaatcaagcaagcccaagacatcttcagctttgatcttactgaagaagaggta840
aagaaaattaccgatttgggtttacaacatgaacctgttagattgtggcatgttgatttc900
tacaccaagtacaactccgaagcccaaaaatga933
<210>2
<211>310
<212>prt
<213>未知(unknown)
<400>2
metthrasnglnlysphephethrleuserasnglyasnlysilepro
151015
alavalalavalvalglythrglythrlystrpalahisalagluglu
202530
thraspalathrpheserglngluleuthraspilevallysleuser
354045
leuaspthrvalproglyilevalhisileaspalaalagluthrtyr
505560
lysthrtyrprogluleuglyalaalaleulysgluthrlyslyspro
65707580
argglugluilepheilethrasplyspheserserleuhislysile
859095
sergluaspprolysseralaleugluthralaleulyslysleugly
100105110
valasptyrvalaspleutyrleuilehisserprophepheasplys
115120125
aspleuasnileaspleugluthralatrplysglnleuglugluleu
130135140
tyrlysserglylysalalysasnileglyvalserasnphethrval
145150155160
gluaspleulyslysvalleualailealagluilelysproglnval
165170175
asnglnileglupheserpropheleuglnasnglnthrproglyile
180185190
valglupheserglnlysasnaspileleuleuglualatyrserpro
195200205
leuglyproleuglnlyslysproalaaspalaaspglnglnprophe
210215220
tyrglntyrleulysgluleuserglulystyrasnlysthrgluala
225230235240
glnvalleuleuleutrpvaltyrlysargglyileleuprovalthr
245250255
thrseralalysilegluargilelysglnalaglnaspilepheser
260265270
pheaspleuthrgluglugluvallyslysilethraspleuglyleu
275280285
glnhisgluprovalargleutrphisvalaspphetyrthrlystyr
290295300
asnserglualaglnlys
305310
- 还没有人留言评论。精彩留言会获得点赞!