基于重组酶的环介导扩增方法与流程
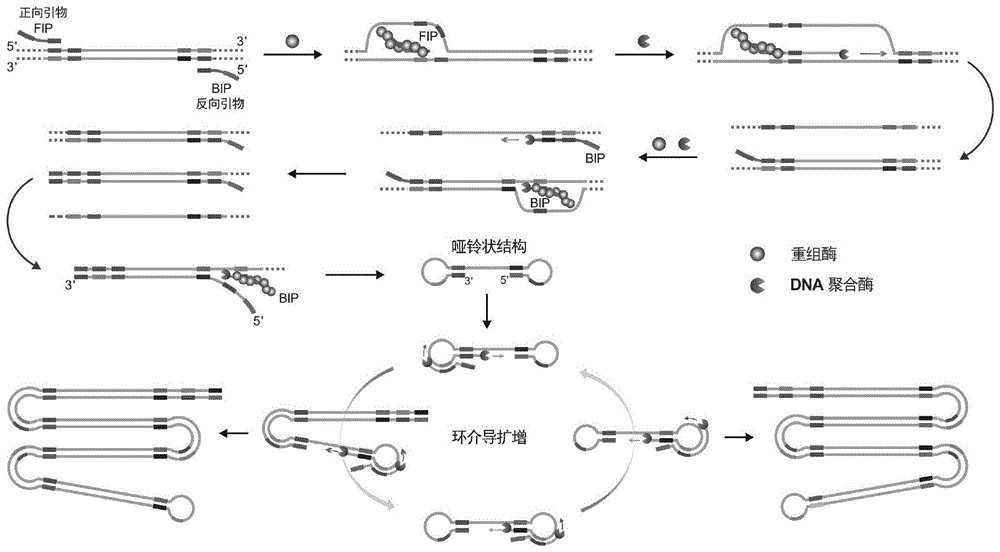
本发明属于分子生物学技术领域,涉及核酸扩增方法,具体涉及一种利用重组酶和单对引物打开双链dna进行延伸产生哑铃状结构中间体的方法及由此实现核酸环介导扩增的方法。
背景技术:
在核酸检测领域,一般需要确定特定基因序列或一部分基因片段是否存在于待检测样本中。由于样本中的核酸序列通常是微量的,为了能达到检测目的,通常需要对目标序列进行扩增。目前,最广泛应用的核酸扩增方法是聚合酶链式反应(pcr),指数式的扩增方式使其具有高灵敏度的优点。然而pcr方法也存在下述明显的问题:依赖大型的控温仪器,需要在专业的实验室进行。
针对pcr方法的上述缺点,现在已经开发出许多核酸等温扩增方法如lamp(环介导等温扩增)、rpa(重组酶聚合酶扩增)、rca(滚环扩增)、nasba(核酸依赖性扩增检测技术)、expar(恒温指数扩增)、hda(恒温指数扩增)、sda(链置换扩增)、cpa(交叉引物恒温扩增)、mda(多重置换扩增)。等温扩增方法对于精密的变温设备的依赖小,不需要固定的反应场所,在poct领域具有广泛的应用前景。对这些已知的等温扩增方法,一些方法需要在恒温步骤之前进行高温预变性,另外一些方法还存在引物设计或反应成分复杂的问题。例如在sda(链置换扩增)方法中,需要先将除了聚合酶的体系在90度以上变性再加入聚合酶进行扩增。在rpa(重组酶聚合酶扩增)方法中,整个体系的运转需要5个酶的密切配合(uvsx,uvsy,gp32,bsu聚合酶,肌酸激酶),另外还需要加入atp和磷酸肌酸不断给体系提供能量。在lamp(环介导等温扩增)方法中,为了形成哑铃状结构,需要针对模板的6个区域设计两对引物才能实现扩增,引物多,增加了设计难度及体系复杂度,且易导致非特异扩增的发生。
因此,开发一种操作简便、体系简单、扩增高效的等温扩增技术对基因检测的普及具有重要意义。
技术实现要素:
本发明结合重组酶和环介导扩增技术,提供一种设计简单、操作简便、扩增高效、仪器依赖程度低的等温扩增方法。
实现以上目的的技术方案如下:
基于重组酶和单对引物的环介导扩增哑铃状结构形成方法,其技术方案为:利用重组酶和一对单链引物形成的复合物打开双链dna后使引物与模板链互补配对,通过聚合酶的延伸及单链置换作用获得哑铃状结构;单链引物的3’端片段与模板序列互补配对,5’端片段与引物延伸后的下游一段序列互补配对。具体工作原理:针对dna中的待扩增靶序列设计一对引物(正向引物和反向引物),引物由两部分构成,3’端片段与模板互补配对,5’端片段与延伸后的下游一段序列互补。在重组酶存在的情况下,正向引物(反向引物)与重组酶结合形成复合物,此复合物扫描双链dna,当遇到与引物3’端片段同源的区域时,双链dna被解开,引物的3’端与其互补链配对,在具有链置换活性的聚合酶的作用下,引物3’端延伸的同时将模板其中一条链置换下来,引物延伸形成的双链dna可以被反向引物(正向引物)-重组酶复合物识别,以同样的方式将反向引物(正向引物)的3’端侵入双链dna模板进行延伸形成新的短双链dna(正、反向引物扩增的片段,包含正、反向引物5’端片段),新形成的短双链dna再被反向引物(正向引物)-重组酶复合物识别,反向引物(正向引物)3’端侵入延伸后将一条单链dna置换出来,这条单链dna的5’末端片段(序列与反向引物5’端片段相同)与下游的一段序列互补形成茎环结构,同时3’末端片段(序列与正向引物5’端片段互补)与上游的一段序列互补形成茎环结构,由此便可形成两端茎环的哑铃状结构。
本发明所述的基于重组酶和单对引物的环介导扩增哑铃状结构形成方法可应用于所有依赖哑铃状结构发生环介导扩增的扩增方法,从而形成新的环介导扩增方法(rala)。
基于重组酶和单对引物的环介导扩增方法(rala),利用本发明所述的基于重组酶和单对引物形成的环介导扩增哑铃状结构可引发下游环介导扩增的进行,对靶序列信息进行放大检测。首先哑铃状结构3’末端以自身作为模板延伸将5’末端的茎环结构补齐为双链,形成带有一个单链环的的长双链结构,此时引物可以与单链的环序列配对进行延伸置换出自身延伸产物并在3’末端形成新的茎环结构,新的茎环结构又以自身作为模板延伸形成带有单链环的更长双链dna,而置换出的单链dna形成与前一种哑铃状结构序列互补的新的哑铃状结构,这两种哑铃状结构交替产生的同时形成大量串联重复的带有单链环的双链dna。针对扩增过程中产生的大量单链环序列,还可以设计额外的环引物以加速整个扩增过程,从而实现靶序列的高效扩增。
本发明所述的重组酶是一种可以和单链dna形成复合物、识别并解开与复合物中单链dna同源的双链dna并使单链dna与其中一条模板链互补配对的酶。
本发明所述的聚合酶是一种既不具有5’-3’外切酶活性也不具有3’-5’的外切酶活性,而具有链置换活性的嗜温聚合酶。
本发明所述的基于重组酶和单对引物的环介导扩增哑铃状结构形成方法及相应的环介导扩增方法(rala)仅需要一对引物即可形成哑铃状结构,引物设计简单,可有效降低体系复杂度和非特异扩增的风险。
本发明所述方法既可进行双链dna的检测,也可以进行单链dna的检测。
本发明所述引物的3’端片段长度不能低于16个核苷酸。
本发明所述方法的反应温度为等温条件,具体可以是37℃-70℃范围内任意恒定的温度。
如本文所用,下列词语/术语具有下列含义,除非另外说明。
“dna”:脱氧核糖核酸。是一类带有遗传信息的生物大分子,由4种主要的脱氧核糖核苷酸通过3’,5’-磷酸二酯键连接而成,是遗传信息的载体。
“pcr”:聚合酶链式反应。是体外酶促合成特异dna片段的一种方法,由高温变性、低温退火及适温延伸等几步反应组成的一个周期,循环进行,使目的dna得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点。
“靶序列”:需要检测的分析物,包括dna和rna序列。
“复合物”:重组酶与单链dna形成的一种形态类似于双链dna的复合物,重组酶缠绕单链dna呈螺旋状延伸。
“嗜温”或“嗜温聚合酶”:相对于如taqdna聚合酶这类嗜热酶而言。此处,嗜温酶指工作温度范围在15-70℃区间内的不耐高温的酶,如bsmdna聚合酶(thermofishertm,30-63℃)、bstdna聚合酶(neb,<70℃)、t4dna连接酶(neb,推荐反应温度16℃、20-25℃)、t4多聚核苷酸激酶(neb,推荐最适反应温度37℃)等。
“等温”或“等温条件”:针对所用嗜温酶的工作温度而言,可指嗜温酶工作温度范围中某一恒定的温度条件,也可指在工作温度范围内处于动态变化的温度条件。
本发明所公开的方法关键在于利用重组酶和单对引物识别并解开双链dna并进行延伸,得到哑铃状结构从而引发下游环介导扩增反应的进行。单链和双链dna都可以作为此扩增方法的模板。此方法引物设计简单、扩增反应高效。本发明具有明显优于现有技术的优点,其主要优点包括:
1.新颖性。现有的lamp技术引物设计比较复杂,且较多的引物容易导致非特异扩增的发生。本发明结合重组酶同源识别双链dna的能力,避免了环介导扩增对外引物的依赖,仅需一对引物即可完成哑铃结构的形成及下游的环介导扩增,引物设计简单,可有效降低体系复杂度和非特异扩增的风险。
2.通用性。本发明所涉及的rala扩增方法,针对不同的模板,只需要合理设计引物就能实现扩增,是一种通用的方法。
3.实用性。本发明所有反应成分简单易得,在等温条件下进行,不依赖复杂控温设备,反应快速高效,适用于几乎所有核酸模板的扩增分析,尤其在poct领域具有很大的实用价值。
4.经济性。本发明中所涉及的试剂、蛋白和酶,来源广泛且易于获得。
附图说明
图1是本发明基于重组酶和单对引物的哑铃状结构形成方法及相应的环介导扩增方法(rala)的原理图。
图2是具体实施例1的结果图。
图3是具体实施例2的结果图。
图4是具体实施例3的结果图。
具体实施方式
下面结合附图,通过实例进一步说明本发明。本领域的技术人员应理解,这些实例仅用于说明本发明,而不用于限制本发明的范围。
实施例1、基于重组酶的环介导扩增反应可行性示例
为了验证基于重组酶的环介导扩增机理,本实施例以braf基因作为扩增模板,将braf基因的片段克隆到质粒t1上,并对重组质粒进行测序验证,最终以重组质粒作为扩增反应的模板。依据本发明rala反应的技术方案,针对braf基因片段设计一对引物,引物的3’端片段大于16个核苷酸。设计4组平行反应,所有反应均加入一对引物、dntp、bsm聚合酶和相应的反应buffer。实验组加入耐热型重组酶tthreca(来源于嗜热栖热菌,能耐受90℃以上的高温,已有研究报道用tthreca增加pcr的特异性)、atp和108拷贝的重组质粒,对照组1加入重组酶tthreca和108拷贝的重组质粒,对照组2加入atp和108拷贝的重组质粒,对照组3加入108拷贝的重组质粒,对照组4加入重组酶tthreca和atp但不加模板。
(1)靶序列braf基因片段如下:
5’-ttacacgccaagtcaatcatccacagagacctcaagagtaataatatatttcttcatgaagacctcacagtaaaaataggtgattttggtctagctacagtgaaatctcgatggagtgggtcccatcagtttgaacagttgtctggatccattttgtggatggcaccagaagtcatcagaatgcaagataaaaatccatacagctttcagtcagatgtatatgcatttggaattgttctgtatgaattgatgactggacagttaccttattcaaacatcaacaacagggaccag-3’
正向引物(fip):
5’-agacaactgttcaaactgatgggtaaaaataggtgattttggtctagc-3’
反向引物(bip):
5’-tccattttgtggatggcaccgcatatacatctgactgaaagc-3’
(2)反应体系及反应条件
最终将反应体系用灭菌去离子水补足至25μl。
rala反应条件是:60℃反应110min。
(3)检测方法
利用实时荧光pcr仪,设置sybrgreeni通道在110min内进行实时记录,得到实时荧光曲线图。
(4)检测结果
如附图2所示,在4个平行反应中,只有实验组产生了荧光信号,而3个对照组均没有产生荧光信号,即只有当tthreca和atp同时加入时才能发生rala反应(附图2a)。琼脂糖凝胶电泳也证明只有tthreca和atp同时加入才能出现环介导扩增的特征性梯状条带(附图2b)。将产物通过酶切得到预期长度的酶切产物(附图2c;泳道1:rala反应产物;泳道2:rala反应酶切产物。),将酶切产物克隆测序验证了是正确扩增的靶序列(附图2d)。
实施例2、核酸的荧光定量检测
在验证了rala方法可行性的基础上,本实施例根据扩增产生的单链环设计额外的环引物对整个反应进行加速,以提高整个rala反应的效率。以实施例1中的重组质粒梯度稀释作为待检测的模板,证明rala反应可应用于靶核酸荧光定量检测。
(1)环引物序列如下:
lf:acccactccatcgagatttc
lb:gcaagataaaaatccataca
(2)反应体系及反应条件
(3)检测方法
利用实时荧光pcr仪,设置sybrgreeni通道在60min内进行实时记录,得到实时荧光曲线图。将达到荧光阈值经历的时间(tt值)作为纵坐标,模板数量的对数值作为横坐标进行作图。
(4)检测结果
如附图3所示,加入了模板的反应均出现了荧光信号,并且随着模板浓度的降低,荧光信号出现的时间靠后。达到荧光阈值经历的时间与模板数量的对数值在102到108的模板数量范围了具有很好的线性关系,可以对模板进行精确定量。
实施例3、核酸的快速定性检测
以实施例1中的108拷贝的重组质粒作为待检测模板。反应结束加入sybrgreeni,在手持式紫外仪下观察荧光变化,或者预先在反应体系中加入一种离子指示剂羟基萘酚蓝(hnb),反应结束后肉眼观察颜色变化进行结果判定。
(1)反应体系及反应条件
(2)检测方法
利用荧光信号定性检测时,在rala反应结束后向体系中加入100x的sybrgreeni,然后将反应管用手持紫外仪照射,观察管中荧光的产生。通过比色方法进行定性检测时,预先在反应混合液中加入120μm的羟基萘酚蓝溶液,反应结束后直接观察管中颜色的变化。
(3)检测结果
如附图4所示,利用荧光信号进行定性检测时,加入了模板的反应管在手持紫外仪的照射下才能看到绿色荧光,而没有加入模板的阴性对照没有产生荧光(附图4a)。利用比色方法进行定性检测时,反应结束后可见加入了模板的反应管中的颜色由紫色变成了浅蓝色,而没加模板的阴性对照颜色仍然呈现紫色,整个反应15min以内就可以产生信号(附图4b)。
- 还没有人留言评论。精彩留言会获得点赞!