一种饲料用葡萄糖氧化酶复配酶体系及其酶活测定方法及用途与流程
技术领域:
:本发明涉及酶制剂检测和应用领域,具体涉及一种饲料用葡萄糖氧化酶复配酶体系及其酶活测定方法及用途。
背景技术:
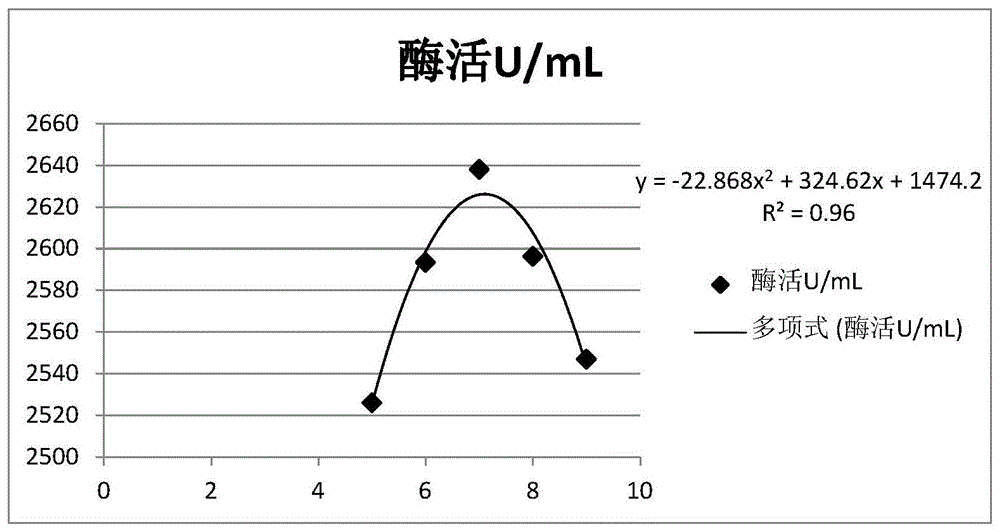
::葡萄糖氧化酶(glucoseoxidase,god),其系统命名为β-d-葡萄糖氧化还原酶:氧1-氧化还原酶(ec1.1.3.4),广泛分布与动植物体内,主要来源为黑曲霉(aspergillusniger)和青霉(penicillium),属胞内酶,它能高度专一性地催化β-d-葡萄糖与氧反应,使葡萄糖氧化生成葡萄糖酸和过氧化氢。该酶最早发现于1904年,由于当时没有认识到其商业价值而没有被广泛应用,直到1928年muller从黑曲霉中发酵得到god;1960年kusai等和1964年pazur等分别从青霉菌和黑曲霉中提纯得到葡萄糖氧化酶。我国自1986年开始研究葡萄糖氧化酶的制备提纯工艺,1998年正式投入生产。1999年农业部将其定为12种允许使用的饲料酶制剂添加剂之一,但是酶活力定义和检测方法没有国家标准,个别省份有地方标准比如河北省地方标准db13/t1444-2011《饲料添加剂葡萄糖氧化酶》,大多生产企业采用自己的企业标准。目前葡萄糖氧化酶活力主要的检测方法有滴定法、分光光度法、电化学法、测压法、凝胶电泳法和傅里叶变换红外光谱法;其中电化学法、测压法、凝胶电泳法和傅里叶变换红外光谱法及连续分光光度法由于其操作繁杂、仪器依赖和试剂缺乏等方面存在的问题,未被大量推广使用;滴定法和普通分光光度法则应用较多。普通分光光度法的原理是在有氧的情况下,葡萄糖氧化酶催化β-d-葡萄糖产生葡萄糖酸和过氧化氢。随后,辣根过氧化物酶(hrp)催化过氧化氢与显色底物发生反应,然后用分光光度计检测生成的有色物质。目前利用此原理进行god酶活力检测的方法主要有靛红褪色法、醌亚胺法、邻苯二胺法和邻联茴香胺法等。虽然分光光度法非常灵敏,但是存在显色物质不稳定,数据重复性不好,标准曲线线性范围较窄和检测酶活力较低不适合进行推广和制定标准。滴定法的原理是葡萄糖氧化酶催化β-d-葡萄糖产生葡萄糖酸,再通过酸碱滴定法可以间接测定出葡萄糖酸的产量,然后根据葡萄糖酸的产生量计算出god的酶活力;此法简单易行、成本低,采用较多比如河北省地方标准db13/t1444-2011就是采用此原理制定;但是存在滴定终点判定难、检测酶活力的温度低酶活低、灵敏度低、误差大。因此,建立一种快速、灵敏、检测成本低的god检测方法是一切迫切需求。技术实现要素::为了解决上述问题,本发明的目的之一是提供一种饲料用葡萄糖氧化酶复配酶体系。通过在葡萄糖氧化酶中复配过氧化氢酶,更有效地发挥葡萄糖氧化酶的酶活力。本发明的目的之二是提供一种定性和定量测定葡萄糖氧化酶活力的方法,通过在葡萄糖氧化酶中配伍过氧化氢酶,去除大量因葡萄糖氧化酶催化葡萄糖而生成的过氧化氢,从而解除大量过氧化氢对于葡萄糖氧化酶活性的严重抑制,进而提高god活力及检测出此时的god活力。该测定方法有效克服了god酶活力检测体系的缺点,具有快速可靠,操作简单,成本低,灵敏准确的优点,拓宽了检测体系的适用范围。本发明的目的之三是提供所述葡萄糖氧化酶和过氧化氢酶配伍后在饲料中的用途。通过葡萄糖氧化酶和过氧化氢酶的合理配伍,更有效地发挥葡萄糖氧化酶在饲料中的酶解功能,从而显著提高机体对于饲料的干物质消化率。为了实现上述目的,本发明采用的技术方案如下:第一方面,本发明提供了一种饲料用葡萄糖氧化酶复配酶,所述复配酶由葡萄糖氧化酶与过氧化氢酶按照酶活配比(5.0-11.0):1组成。优选地,所述葡萄糖氧化酶与过氧化氢酶的酶活配比为(6.0-9.0):1。更优选地,所述葡萄糖氧化酶与过氧化氢酶的酶活配比为(6.0-8.0):1。第二方面,本发明提供了上述饲料用葡萄糖氧化酶复配酶在测定葡萄糖氧化酶活力中的用途,步骤如下:(1)将葡萄糖氧化酶稀释至浓度为12.6-14.4u/ml,记录稀释倍数f;等体积加入过氧化氢酶液,混合,得到待测混合酶液,所述葡萄糖氧化酶液与过氧化氢酶液的酶活配比为(5.0-11.0):1;(2)将葡萄糖磷酸盐缓冲液,于37℃预热5.0-10.0min,与所述待测酶液按照体积比25:1混合,于37℃振荡反应57-63min取出;向混合溶液中按照体积比26:20加入0.1mol/l的氢氧化钠溶液,终止反应;加酚酞指示剂,用0.020-0.030mol/l的盐酸溶液滴定至红色恰好退去并且ph为8.95-9.00为滴定终点,记录所消耗的盐酸体积a;(3)取与所述步骤(2)相同体积的葡萄糖磷酸盐缓冲液,在与所述步骤(2)相同预热温度和时间下进行预热,并与0.1mol/l的氢氧化钠溶液按照体积比25:20混合,摇匀混合,并向混合液中按照体积比45:1加入所述待测酶液,加酚酞指示剂,用与所述步骤(2)相同浓度的盐酸溶液滴定至红色恰好退去并且ph达到与所述步骤(2)ph相同时为滴定终点,记录所消耗的盐酸毫升数b;式中:a----滴定样品反应后消耗的盐酸(ml);b----反应前消耗的盐酸(ml);n----盐酸摩尔浓度(mol/l);f----稀释倍数,1000—换算系数,t----反应时间(按min计);所述步骤(2)和(3)中,葡萄糖磷酸盐缓冲液组成为:葡萄糖20g/l,余量为0.06mol/l,ph5.6磷酸缓冲溶液。所述步骤(1)中,配置浓度为12.6-14.4u/ml的葡萄糖氧化酶,即混合酶液中,葡萄糖氧化酶液的终浓度为6.3-7.2u/ml时,通过检测数据,同时结合回归分析表明,葡萄糖氧化酶液在该酶活浓度的检测范围内,相对标准偏差rsd<2%,达到检测精度要求。需要说明的是,在测定葡萄糖氧化酶酶活之前,稀释之前的葡萄糖氧化酶酶活是根据已知的酶活标注值或估算的最大酶活值为准。所述步骤(1)中,葡萄糖氧化酶稀释至浓度可以为12.6u/ml、12.7u/ml、12.8u/ml、12.9u/ml、13.0u/ml、13.1u/ml、13.2u/ml、13.3u/ml、13.4u/ml、13.5u/ml、13.6u/ml、13.7u/ml、13.8u/ml、13.9u/ml、14.0u/ml、14.1u/ml、14.2u/ml、14.3u/ml、14.4u/ml。优选地,所述步骤(1)中,葡萄糖氧化酶稀释至浓度为13.0-13.8u/ml。更优选地,所述步骤(1)中,葡萄糖氧化酶稀释至浓度为13.2-13.4u/ml。更优选地,所述步骤(1)中,葡萄糖氧化酶稀释至浓度为13.36u/ml。通过回归分析表明,葡萄糖氧化酶在13.36u/ml,即所述待测混合酶液中葡萄糖氧化酶浓度为6.68u/ml,中为更优浓度。优选地,所述步骤(1)中,配置过氧化氢酶液所用溶剂为磷酸氢二钠-磷酸二氢钠缓冲溶液,所述磷酸氢二钠-磷酸二氢钠缓冲溶液组成为:无水磷酸二氢钠2.33g/l、十二水合磷酸氢二钠9.7g/l,余量为蒸馏水,ph7.0。所述步骤(1)中,葡萄糖氧化酶可为固体粉末或为发酵后的发酵酶液。所述步骤(1)中,葡萄糖氧化酶为发酵后的发酵酶液,则直接加水稀释至酶活浓度为12.6-14.4u/ml。所述步骤(1)中,葡萄糖氧化酶为固体粉末,加水后经过浸提,过滤,再稀释,使酶液浓度控制在12.6-14.4u/ml,作为待测酶液;所述过滤选用中性快速滤纸进行过滤,所述中性快速滤纸的孔径为20-25μm,滤速<35s;所述浸提条件为:于4-8℃条件下,浸提15-16小时。优选地,所述步骤(2)中,振荡反应时间为60min。优选地,所述步骤(2)中,震荡反应的转速为150-180rpm。其中,所述步骤(2)和(3)中,葡萄糖磷酸盐缓冲液的预热时间可以为5.0min、5.5min、6.0min、6.5min、7.0min、7.5min、8.0min、8.5min、9.0min、9.5min、10.0min。优选地,所述步骤(2)和(3)中,葡萄糖磷酸盐缓冲液的预热时间为5.0-6.0min。更优选地,所述步骤(2)和(3)中,葡萄糖磷酸盐缓冲液的预热时间为5.0min。优选地,所述步骤(2)和(3)中,酚酞指示剂组成为:酚酞10g/l,余量为浓度为90%的乙醇。其中,所述步骤(2)和(3)中,盐酸的浓度为0.020mol/l、0.021mol/l、0.022mol/l、0.023mol/l、0.024mol/l、0.025mol/l、0.026mol/l、0.027mol/l、0.028mol/l、0.029mol/l、0.030mol/l。优选地,所述步骤(2)和(3)中,盐酸的浓度为0.025mol/l。其中,所述步骤(2)和(3)中,滴定终点的ph值可以为8.95、8.96、8.97、8.98、8.99、9.00。优选地,所述步骤(2)和(3)中,滴定终点的ph值为8.98。优选地,所述步骤(2)和(3)中,酚酞指示剂加入量为1滴。优选地,所述步骤(2)和(3)中,磷酸缓冲溶液组成为0.06mol/l的nah2po4·2h2o溶液与0.06mol/l的na2hpo4·12h2o溶液按照体积比20:1混合或0.06mol/l的nah2po4·2h2o溶液或0.06mol/l的na2hpo4·12h2o溶液。优选地,所述一种用于饲料添加剂的葡萄糖氧化酶活力检测方法,包括以下步骤:(1)将葡萄糖氧化酶稀释至浓度为12.6-14.4u/ml,记录稀释倍数f;等体积加入过氧化氢酶液,混合,得到待测混合酶液,所述葡萄糖氧化酶液与过氧化氢酶液的酶活配比为1:6.0-8.0;(2)取葡萄糖磷酸盐缓冲液25.00ml,于37℃预热5-10min,向其中加入所述待测酶液1.00ml混合,于37℃振荡反应60min取出;向混合溶液中加入0.1mol/l的氢氧化钠溶液20.00ml,终止反应;加酚酞指示剂,用0.020-0.030mol/l的盐酸溶液滴定至红色恰好退去并且ph为8.95-9.00为滴定终点,记录所消耗的盐酸体积a;(3)取与所述步骤(2)相同体积的葡萄糖磷酸盐缓冲液,在与所述步骤(2)相同预热温度和时间下进行预热,并与0.1mol/l的氢氧化钠溶液按照体积比25:20混合,摇匀混合,并向混合液中加入所述待测酶液1.00ml,加酚酞指示剂,用与所述步骤(2)相同浓度的盐酸溶液滴定至红色恰好退去并且ph达到与所述步骤(2)ph相同时为滴定终点,记录所消耗的盐酸毫升数b;式中:a----滴定样品反应后消耗的盐酸(ml);b----反应前消耗的盐酸(ml);n----盐酸摩尔浓度(mol/l);f----稀释倍数,1000—换算系数,t----反应时间(按min计);所述步骤(2)和(3)中,葡萄糖磷酸盐缓冲液组成为:葡萄糖20g/l,余量为0.06mol/l,ph5.6磷酸缓冲溶液。方法原理:葡萄糖氧化酶活力检测原理:葡萄糖氧化酶是一种需氧脱氢酶,能催化葡萄糖生成葡萄糖酸和过氧化氢。用过量的氢氧化钠中和产生的葡萄糖酸,再用盐酸返滴定,即可求得葡萄糖酸的产量,根据产葡萄糖酸量表示酶活力高低。葡萄糖氧化酶催化葡萄糖的过程中,会产生大量过氧化氢,可严重抑制葡萄糖氧化酶(god)的活性,从而抑制反应的顺利进行;此时加入过氧化氢酶(cat),cat以过氧化氢为专一底物,通过催化一对电子的转移而最终将其降解为水和氧气。可有效去除反应过程中生成的过氧化氢从而提高葡萄糖氧化酶(god)活力,进而保障反应的连续顺利进行,所以葡萄糖氧化酶(god)和过氧化氢酶(cat)的合理配伍,去除大量过氧化氢提高god活力及检测出此时的god活力,确定最佳配伍。第三方面,本发明提供了饲料用葡萄糖氧化酶复配酶在饲料中的用途。优选地,所述葡萄糖氧化酶复配酶中,葡萄糖氧化酶的添加量为10-160u/kg配合饲料。更优选地,所述葡萄糖氧化酶复配酶中,葡萄糖氧化酶的添加量为80-130u/kg配合饲料。所述葡萄糖氧化酶复配酶中,葡萄糖氧化酶的添加量可以为10u/kg、20u/kg、30u/kg、40u/kg、50u/kg、60u/kg、70u/kg、80u/kg,85u/kg,90u/kg,95u/kg,100u/kg,105u/kg,110u/kg,115u/kg,120u/kg,125u/kg,130u/kg、140u/kg、150u/kg、160u/kg。更优选地,所述葡萄糖氧化酶的添加量为90-110u/kg配合饲料。更优选地,所述葡萄糖氧化酶的添加量为100u/kg配合饲料。有益效果本发明测定葡萄糖氧化酶(god)的原理:葡萄糖氧化酶能氧化β-d-葡萄糖生成葡萄糖酸和过氧化氢,大量过氧化氢的产生可严重抑制(god)的活性,从而抑制反应的顺利进行;过氧化氢酶(cat)以过氧化氢为专一底物,通过催化一对电子的转移而最终将其降解为水和氧气。相比于现有技术中,通过过氧化氢显色反应的方法测定葡萄糖氧化酶酶活,其在测定过程中同样无法缓解大量过氧化氢对于葡萄糖氧化酶的抑制作用。本发明中,葡萄糖氧化酶(god)和过氧化氢酶(cat)的合理配伍,可有效去除反应过程中生成的过氧化氢从而提高葡萄糖氧化酶(god)活力,进而保障反应的连续顺利进行。过氧化氢酶(cat)的活力测定按照qb/t4614-2013工业用过氧化氢酶制剂(硫代硫酸钠滴定法)进行。本发明提供的定性和定量测定葡萄糖氧化酶活力的方法,通过反复验证,建立了较为实用可靠的酶活力检测体系。附图说明图1为本发明实验例4的god/cat比例范围内的回归分析图;图2为本发明实施例4的god组dmd干物质消化率提高值(%)的回归分析图。具体实施方式下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。以下结合具体实施例对本发明进行进一步说明。实施例1葡萄糖氧化酶的测定方法(1)对待测葡萄糖氧化酶样品进行预处理,取固体葡萄糖氧化酶样品10.0000g置于锥形瓶中,准确加入适量蒸馏水稀释,使酶液浓度控制在13.36u/ml范围内,搅拌均匀后于4-8℃冰箱中浸提15-16小时,用中性快速滤纸过滤,所述中性快速滤纸的孔径为20-25μm,滤速<35s,滤液作为测定酶液;准确量取液体样品,用适量蒸馏水稀释,使酶液浓度控制在13.36u/ml范围内,记录两次稀释的总稀释倍数f;同时配置过氧化氢酶液,将所述葡萄糖氧化酶液与过氧化氢酶液按照体积比1:1混合,得到待测酶液,所述葡萄糖氧化酶液与过氧化氢酶液的酶活配比为6.4:1;其中,配置过氧化氢酶液所用溶剂为磷酸氢二钠-磷酸二氢钠缓冲溶液,所述磷酸氢二钠-磷酸二氢钠缓冲溶液组成为:无水磷酸二氢钠2.33g/l、十二水合磷酸氢二钠9.7g/l,余量为蒸馏水,ph7.0。(2)配制2%葡萄糖磷酸盐缓冲液(20g/l):称取20g无水葡萄糖,用0.06mol/lph5.6磷酸缓冲溶液溶解,定容至1000ml。配制磷酸缓冲溶液(0.06mol/lph5.6):nah2po4·2h2o溶液:称取nah2po4·2h2o9.36g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;na2hpo4·12h2o溶液:称取na2hpo4·12h2o21.48g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;用nah2po4·2h2o溶液和na2hpo4·12h2o溶液按20:1比例混合。配制标准氢氧化钠滴定溶液0.1mol/l和标准盐酸滴定溶液0.025mol/l。酚酞指示剂(10g/l):称取酚酞1g溶于100ml90%乙醇中。(3)取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热5.0分钟,准确加入上述待测酶液1.00ml,立即置恒温摇床上,37℃、150rpm振荡反应60分钟取出(准确计时);立即准确加入0.1mol/l的氢氧化钠溶液20ml终止反应;加酚酞指示剂1滴,用0.025mol/l(0.020~0.03mol/l)的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示8.98(8.95~9.00范围内)为滴定终点,记录所消耗的盐酸毫升数a。(4)设空白对照,取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热5分钟,准确加入0.1mol/l的氢氧化钠溶液20ml,摇匀,准确加入上述测定酶液1.00ml,加酚酞指示剂1滴,用0.025mol/l(0.020~0.03mol/l)的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示8.98(8.95~9.00范围内)为滴定终点,记录所消耗的盐酸毫升数b。式中:a----滴定样品反应后消耗的盐酸(ml);b----反应前消耗的盐酸(ml);n----盐酸摩尔浓度(mol/l);f----稀释倍数,1000—换算系数,t----反应时间(按min计);其中,步骤(3)(4)中,葡萄糖磷酸盐缓冲液组成为:葡萄糖20g/l,余量为0.06mol/l,ph5.6磷酸缓冲溶液。其中,步骤(3)和(4)中,酚酞指示剂组成为:酚酞10g/l,余量为浓度为90%的乙醇。实施例2葡萄糖氧化酶的测定方法(1)对待测葡萄糖氧化酶样品进行预处理,取固体葡萄糖氧化酶样品10.0000g置于锥形瓶中,准确加入适量蒸馏水稀释,使酶液浓度控制在13.20u/ml范围内,搅拌均匀后于4-8℃冰箱中浸提15-16小时,用中性快速滤纸过滤,所述中性快速滤纸的孔径为20-25μm,滤速<35s,滤液作为测定酶液;准确量取液体样品,用适量蒸馏水稀释,使酶液浓度控制在13.20u/ml范围内,记录两次稀释的总稀释倍数f;同时配置过氧化氢酶液,将所述葡萄糖氧化酶液与过氧化氢酶液按照体积比1:1混合,得到待测酶液,所述葡萄糖氧化酶液与过氧化氢酶液的酶活配比为7.0:1;其中,配置过氧化氢酶液所用溶剂为磷酸氢二钠-磷酸二氢钠缓冲溶液,所述磷酸氢二钠-磷酸二氢钠缓冲溶液组成为:无水磷酸二氢钠2.33g/l、十二水合磷酸氢二钠9.7g/l,余量为蒸馏水,ph7.0。(2)配制2%葡萄糖磷酸盐缓冲液(20g/l):称取20g无水葡萄糖,用0.06mol/lph5.6磷酸缓冲溶液溶解,定容至1000ml。配制磷酸缓冲溶液(0.06mol/lph5.6):nah2po4·2h2o溶液:称取nah2po4·2h2o9.36g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;na2hpo4·12h2o溶液:称取na2hpo4·12h2o21.48g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;用nah2po4·2h2o溶液和na2hpo4·12h2o溶液按20:1比例混合。配制标准氢氧化钠滴定溶液0.1mol/l和标准盐酸滴定溶液0.020mol/l。酚酞指示剂(10g/l):称取酚酞1g溶于100ml90%乙醇中。(3)取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热6.0分钟,准确加入上述待测酶液1.00ml,立即置恒温摇床上,37℃、150rpm振荡反应60分钟取出(准确计时);立即准确加入0.1mol/l的氢氧化钠溶液20ml终止反应;加酚酞指示剂1滴,用0.020mol/l的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示8.97为滴定终点,记录所消耗的盐酸毫升数a。(4)设空白对照,取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热6.0分钟,准确加入0.1mol/l的氢氧化钠溶液20ml,摇匀,准确加入上述测定酶液1.00ml,加酚酞指示剂1滴,用0.020mol/l的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示8.97为滴定终点,记录所消耗的盐酸毫升数b。计算样品中葡萄糖氧化酶活力单位(u/g或u/ml)计算公式同实施例1;其中,步骤(3)(4)中,葡萄糖磷酸盐缓冲液组成同实施例1;其中,步骤(3)和(4)中,酚酞指示剂组成同实施例1。实施例3葡萄糖氧化酶的测定方法(1)对待测葡萄糖氧化酶样品进行预处理,取固体葡萄糖氧化酶样品10.0000g置于锥形瓶中,准确加入适量蒸馏水稀释,使酶液浓度控制在13.80u/ml范围内,搅拌均匀后于4-8℃冰箱中浸提15-16小时,用中性快速滤纸过滤,所述中性快速滤纸的孔径为20-25μm,滤速<35s,滤液作为测定酶液;准确量取液体样品,用适量蒸馏水稀释,使酶液浓度控制在13.80u/ml范围内,记录两次稀释的总稀释倍数f;同时配置过氧化氢酶液,将所述葡萄糖氧化酶液与过氧化氢酶液按照体积比1:1混合,得到待测酶液,所述葡萄糖氧化酶液与过氧化氢酶液的酶活配比为8.0:1;其中,配置过氧化氢酶液所用溶剂为磷酸氢二钠-磷酸二氢钠缓冲溶液,所述磷酸氢二钠-磷酸二氢钠缓冲溶液组成为:无水磷酸二氢钠2.33g/l、十二水合磷酸氢二钠9.7g/l,余量为蒸馏水,ph7.0。(2)配制2%葡萄糖磷酸盐缓冲液(20g/l):称取20g无水葡萄糖,用0.06mol/lph5.6磷酸缓冲溶液溶解,定容至1000ml。配制磷酸缓冲溶液(0.06mol/lph5.6):nah2po4·2h2o溶液:称取nah2po4·2h2o9.36g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;na2hpo4·12h2o溶液:称取na2hpo4·12h2o21.48g,加水溶解,定容至1000ml,摇匀,调ph值至5.6;用nah2po4·2h2o溶液和na2hpo4·12h2o溶液按20:1比例混合。配制标准氢氧化钠滴定溶液0.1mol/l和标准盐酸滴定溶液0.030mol/l。酚酞指示剂(10g/l):称取酚酞1g溶于100ml90%乙醇中。(3)取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热5.5分钟,准确加入上述待测酶液1.00ml,立即置恒温摇床上,37℃、150rpm振荡反应60分钟取出(准确计时);立即准确加入0.1mol/l的氢氧化钠溶液20ml终止反应;加酚酞指示剂1滴,用0.030mol/l的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示9.00为滴定终点,记录所消耗的盐酸毫升数a。(4)设空白对照,取2%葡萄糖磷酸盐缓冲溶液25.00ml置于250ml锥形瓶中,于恒温摇床37℃、150rpm预热5.5分钟,准确加入0.1mol/l的氢氧化钠溶液20ml,摇匀,准确加入上述测定酶液1.00ml,加酚酞指示剂1滴,用0.030mol/l的盐酸溶液滴定剩余的氢氧化钠,滴定至红色恰好退去并且ph计显示9.00为滴定终点,记录所消耗的盐酸毫升数b。计算样品中葡萄糖氧化酶活力单位(u/g或u/ml)计算公式同实施例1;其中,步骤(3)(4)中,葡萄糖磷酸盐缓冲液组成同实施例1;其中,步骤(3)和(4)中,酚酞指示剂组成同实施例1。实验例1单一添加不同浓度葡萄糖氧化酶对于酶活力检测的影响为了探究不同god浓度对于酶活测定的影响,分别配置不同浓度的god浓度进行酶活测定。需要说明的是,god的不同添加浓度对于复配酶体系即god/cat以及对于单一添加god在god酶活测定中的影响相近,因此仅以单一添加不同浓度的god对于god酶活测定的影响来进行实验例表征。待测葡萄糖氧化酶估算酶活为2650u/ml。分组如下:实验组:分别加水配置浓度为6.3u/ml、6.4u/ml、6.5u/ml、6.6u/ml、6.7u/ml、6.8u/ml、6.9u/ml、7.0u/ml、7.1u/ml、7.2u/ml的葡萄糖氧化酶液,记录不同的稀释倍数;对照组:对照组1,加水配置浓度为6.0u/ml的葡萄糖氧化酶液,记录稀释倍数;对照组2,加水配置浓度为7.5u/ml的葡萄糖氧化酶液,记录稀释倍数;以上实验组和对照组的葡萄糖氧化酶预处理方式与实施例1步骤(1)相近,唯一不同的是葡萄糖氧化酶的浓度不同。实验组分别按照实施例1中步骤(2)、(3)、(4)的过程(唯一不同的是添加的是单一葡萄糖氧化酶酶液1ml),测定葡萄糖氧化酶的酶活,酶活计算公式同实施例1。不同浓度葡萄糖氧化酶的酶活测定值、平均值、标准偏差以及相对标准偏差如表1和图1所示。对照组1、2分别按照实施例1中步骤(2)、(3)、(4)的过程测定葡萄糖氧化酶的酶活(唯一不同的是添加的是单一葡萄糖氧化酶酶液1ml),每个对照组各重复测定5次,酶活计算公式同实施例1。酶活测定值、平均值、标准偏差以及相对标准偏差如表3、4。通过做回归分析表明,实验组在葡萄糖氧化酶的浓度在6.3-7.2u/ml的检测范围内,相对标准偏差rsd=1.9%,标准偏差为49.53,其测定酶活数值稳定、准确。在葡萄糖氧化酶的浓度为6.68u/ml时,酶活检测值最大2653u/ml;相关系数r2=0.9661(表2所示,通过回归分析,得出酶活的最优浓度和对应的检测酶活最大值)。酶活大是酶催化效率高的重要指标,酶活数据大,越能反应测定的精准度高,说明该方法对酶的活性敏感。而相较于对照组,当酶活浓度分别为6.0u/ml以及7.5u/ml时,其在分别重复测定5次获得酶活结果中,其标准偏差高达127.63,相对标准偏差也高达5.83%和5.75%。说明酶活在该浓度下,数值测定并不稳定,酶活测定的重复性较差。表1实验组不同浓度葡萄糖氧化酶的酶活测定稀释到单位u/ml酶活u/ml6.325656.426026.526406.626556.726566.826506.926207.025887.125417.22519平均值2604标准偏差49.53相对标准偏差(%)1.90表2检测范围内葡萄糖氧化酶回归分析表3浓度为6.0u/ml的葡萄糖氧化酶的酶活测定稀释到单位u/ml酶活u/ml6.020496.021756.023686.022606.02098平均值2190标准偏差127.63相对标准偏差(%)5.83表4浓度为7.5u/ml的葡萄糖氧化酶的酶活测定实验例2葡萄糖磷酸盐缓冲液预热时间对于单一添加葡萄糖氧化酶酶活测定的影响为了说明葡萄糖磷酸盐缓冲液的不同预热时间对于单一添加god酶活的影响,分别测定在不同预热时间条件下所测定的god酶活。需要说明的是,葡萄糖磷酸盐缓冲液的预热时间对于复配酶体系即god/cat以及对于单一添加god在god酶活测定中的影响相近,因此仅以不同预热时间对单一添加god的酶活测定数据来表征。待测葡萄糖氧化酶估算酶活为2650u/ml。实验方法:(1)固体葡萄糖氧化酶的预处理,用蒸馏水配置浓度为6.68u/ml的葡萄糖氧化酶液,于4℃条件下(搅拌摇匀,冰箱条件下4-8℃)浸提15-16小时,用中性快速滤纸过滤,滤液经蒸馏水稀释,使酶液浓度控制在6.68u/ml(记录稀释倍数f),作为待测酶液;(2)同实施1步骤(2);(3)(4)同实施1步骤(3)(4),唯一不同的是添加的是单一葡萄糖氧化酶酶液1ml,且葡萄糖磷酸盐缓冲液的预热时间按照如下分组:将实验分为10组,其中实验组1、2、3、4、5、6以及对照组1、2、3、4。其中实验组1、2、3、4、5、6分别对应步骤(3)(4)中葡萄糖磷酸盐缓冲液的预热时间为5.0min、6.0min、7.0min、8.0min、9.0min、10.0min,对照组1、2、3、4分别对应步骤(3)(4)中葡萄糖磷酸盐缓冲液的预热时间为1.0min、2.0min、3.0min、4.0min。(其中实验组,步骤(3)(4)中,葡萄糖磷酸盐缓冲液的预热时间相同,对照组步骤(3)(4)葡萄糖磷酸盐缓冲液的预热时间相同)实验组中,通过不同预热时间测得的酶活测定值、平均值、标准偏差以及相对标准偏差详见表5,对照组中,通过不同预热时间测得的酶活测定值、平均值、标准偏差以及相对标准偏差详见表6.表5实验组不同预热时间对于葡萄糖氧化酶的酶活测定的影响分组预热时间min酶活u/ml实验组15.02656实验组26.02650实验组37.02620实验组48.02628实验组59.02634实验组610.02641平均值2638标准偏差13.58相对标准偏差(%)0.51误差(注:表5中标准偏差和相对标准偏差是将实验组所有数值进行拟合之后得到的偏差值)表6对照组不同预热时间对于葡萄糖氧化酶的酶活测定的影响分组预热时间min酶活u/ml对照组11.02470对照组22.02510对照组33.02540对照组44.02570平均值2523标准偏差42.72相对标准偏差(%)1.69误差%2.76(注:表6中标准偏差和相对标准偏差是将对照组组所有数值进行拟合之后得到的偏差值)检测数据说明:实验组,葡萄糖磷酸盐缓冲液的预热时间为5.0-10.0分钟,酶活(也就是酶蛋白)启动充分,平均值2638u/ml,标准偏差sd13.58%;相对标准偏差0.51%;而对照组,预热1-4分钟,平均酶活2523u/ml,标准偏差sd42.72%;相对标准偏差1.69%。误差(%)4.59%。而现有技术如河北省地方标准db13/t1444-2011中,在测定葡萄糖氧化酶酶活的过程中,其对于葡萄糖磷酸盐缓冲液的预热时间均为3.0min,现有技术关于葡萄糖氧化酶酶活的测定也以此预热时间为指导,而本发明发现葡萄糖磷酸盐缓冲液对于预热3min,其启动酶活不够,检测数据偏低,而预热5.0-10.0min则对于酶活的检测性能具有显著的提高。实验例3判定滴定终点指标对于单一添加葡萄糖氧化酶酶活测定的影响为了说明不同滴定终点的判定指标对于god酶活测定的影响,特别设置此实验例。需要说明的是,滴定终点的判定指标对于复配酶体系即god/cat以及对于单一添加god在god酶活测定中的影响相近,因此仅以不同滴定终点的判定指标对单一god酶活测定数据来表征。待测葡萄糖氧化酶估算酶活为2650u/ml。分别设置实验组和对照组,均测定不同浓度葡萄糖氧化酶的酶活,即葡萄糖氧化酶的浓度分别为6.3u/ml、6.4u/ml、6.5u/ml、6.6u/ml、6.7u/ml、6.8u/ml、6.9u/ml、7.0u/ml、7.1u/ml、7.2u/ml,记录不同的稀释倍数。以上葡萄糖氧化酶的预处理方式与实施例1步骤(1)相近,唯一不同的是葡萄糖氧化酶的浓度不同。其中,实验组:分别按照如上浓度配置葡萄糖氧化酶,按照实施例1步骤(2)-(4)方法,测定不同浓度葡萄糖氧化酶的酶活,与实施例1步骤(3)(4)不同的是,添加的是单一葡萄糖氧化酶酶液1ml,且其中步骤(3)(4)中,判定盐酸溶液滴定终点的指标为:红色恰好退去并且ph计显示8.98为滴定终点;经酶活测定,计算出实验组测定酶活的平均值、标准偏差以及相对标准偏差,详见表7。对照组:分别按照如上浓度配置葡萄糖氧化酶,同样按照实施例1步骤(2)-(4)方法,测定不同浓度葡萄糖氧化酶的酶活,与实施例1步骤(3)(4)不同的是,添加的是单一葡萄糖氧化酶酶液1ml,且判定盐酸溶液滴定终点的指标仅为:红色恰好退去,并不进行ph的监控;经酶活测定,计算出实验组测定酶活的平均值、标准偏差以及相对标准偏差,详见表8。(其中实验组的步骤(3)(4)滴定终点ph值相同,对照组步骤(3)(4)滴定终点的方法相同)表7实验组滴定法对于酶活测定的影响表8对照组滴定法对于酶活测定的影响稀释到单位u/ml酶活u/ml6.322216.423476.525406.624326.722706.820906.923507.023747.123557.22556平均值2354标准偏差140.00相对标准偏差(%)5.95试验数据表明:双指标判定终点(红色恰好退去并且ph计显示8.98为滴定终点)酶活平均值为2604u/ml、标准偏差sd为49.53、相对标准偏差rsd为1.90%;单指标判定终点(红色恰好退去)酶活平均值酶活2354u/ml、标准偏差sd为140、相对标准偏差rsd为5.95%;由此可以看出双指标判定终点显著优于单指标判定终点。实验例4god/cat不同酶活配比对于god酶活测定的影响为了探究不同god/cat酶活配比对于酶活测定的影响,分别配置不同酶活配比例来测定葡萄糖氧化酶的酶活。实验例进行以下分组:实验组:god/cat酶活配比例分别为:5.0:1,6.0:1,7.0:1,8.0:1,9.0:1,10.0:1,11.0:1。对照组:god/cat酶活配比例分别为:3.0:1,4.0:1,12.0:1其中,待测葡萄糖氧化酶估算酶活为2550u/ml。实验方法:按照本发明实施例1“葡萄糖氧化酶的测定方法”的步骤(1)(2)(3)(4)测定葡萄糖氧化酶的酶活,唯一不同的是步骤(1)中,处理的葡萄糖氧化酶与过氧化氢酶的酶活比分别按照上述实验组和对照组的分组进行测定。测定结果如表9所示:表9不同god/cat比例对于酶活测定的影响通过对比实验组和对照组可以看出,实验组中,酶活测定值高,说明酶活较高,酶活高是酶催化效率高的重要指标,酶活数据大,越能反应测定的精准度高,说明该方法对酶的活性敏感。此外,参照附图1,针对实验组1-5进行god/cat比例范围内的回归分析,其相关系数达到0.96,数据之间的相关性较高。实施例4god/cat在肉鸡配合饲料中的用途及影响(一)god的不同添加比例在肉鸡配合饲料中的影响为了说明god的不同添加比例在肉鸡配合饲料中的影响,因此模拟在肉鸡4-6周龄阶段,在配合料中添加不同比例的单一god,通过利用体外肉鸡仿生消化过程,测定干物质消化率,以此来探究god的不同添加比例在饲料中的影响,其中,肉鸡的基础饲粮组成及营养水平详见表10,将饲料中的酶组合进行以下分组:实验组:god添加量分别为10u/kg,20u/kg,40u/kg,80u/kg,160u/kg,130u/kg;对照组:god添加量为0u/kg,并且重复五次实验。干物质消化率的实验方法:仿生消化操作过程中透析袋的型号和前处理、胃缓冲液和小肠缓冲液的配制和仪器运行参数等试验操作参照文献《单胃动物仿生消化系统操作手册》。其中,仿生消化法测干物质消化率胃缓冲液:称取2.17g氯化钠和1.57g氯化钾溶于2000ml去离子水中,用2mol·l-1的盐酸在41℃下调节ph至2.0。小肠前段缓冲液:称取9.35g无水磷酸氢二钠,40.09g无水磷酸二氢钠,11.13g氯化钠和3.09g氯化钾,青霉素1600000u于2000ml去离子水中,用1mol·l-1的盐酸或1mol·l-1的氢氧化钠在41℃下调节ph至6.50。小肠后段缓冲液:称取48.77g无水磷酸氢二钠,6.77g无水磷酸二氢钠,10.03g氯化钠和2.79g氯化钾,青霉素160万u于2000ml去离子水中,用1mol·l-1的盐酸或1mol·l-1的氢氧化钠在41℃下调节ph至7.99。模拟鸡胃液(胃蛋白酶活性1550u·ml-1):称取387.5ku的胃蛋白酶(sigma,p7000)溶解于250mlph2.0的盐酸缓冲溶液中(41℃下标定ph),缓慢搅拌至溶解(临用前配制)。模拟鸡小肠液(淀粉酶活性401.46u·ml-1,胰蛋白酶活性49.28u·ml-1,糜蛋白酶活性11.31u·ml-1):量取淀粉酶(sigma,a3306)110.40ku、称取胰蛋白酶(amersco,0785)13.55ku、糜蛋白酶(amersco,0164)3.11ku溶解于25ml去离子水中,缓慢搅拌直至溶解(临用前配制)。配制含淀粉酶(活性为401.46u·ml-1)、胰蛋白酶(活性为49.28u·ml-1)、糜蛋白酶(活性为11.31u·ml-1)的模拟鸡小肠液。将肉鸡的基础饲粮以及相应比例god混合投入到仿生消化器内,在实验组和对照组中,每组基础饲粮的添加量均为2.0000±0.0002g,将仿生消化管固定在已预热的sds-ⅲ上,依次连通事先配制的胃段缓冲液、小肠前段缓冲液和小肠后段缓冲液,41℃条件下,胃段消化4h后,通过sds-ⅲ的加酶管在每个消化管中精确补加2ml模拟小肠液,继续进行7.5h的小肠前段消化和7.5h的小肠后段消化。消化过程结束后,将消化残渣无损转移到已绝干恒重的培养皿中,放在65℃烘箱中烘干至无水痕后,调到105℃烘干至恒重,计算干物质消化率。表10基础饲粮组成及营养水平(%,风干基础)实验结果:表11god的添加量对于肉鸡干物质消化率(%)的影响参照附图2的god组dmd干物质消化率提高值(%)的回归分析图,以及得出的回归方程(y=-8e-05x2+0.016x-0.164),通过计算得到,在肉鸡配合料(4-6周)中进行的过程中,根据干物质消化率提高值,优选地god添加量是100u/kg;干物质消化率最大提高值为0.6358%。(二)god/cat的不同比例在肉鸡配合饲料中的影响为了探究god/cat配比在饲料应用中的影响,因此在模拟肉鸡4-6周龄阶段,在配合料中添加不同的酶或酶组合,通过利用体外肉鸡仿生消化过程,测定干物质消化率,以此来探究酶在饲料中的影响,其中,肉鸡的基础饲粮组成及营养水平详见表10,将饲料中的酶组合进行以下分组:空白对照组:不添加god和god/cat配伍酶组合;对照组:单一添加god,添加量为100u/kg配合饲料;实验组:添加god/cat复配酶组合,其中god添加量是100u/kg配合饲料,god和cat的酶活配比为6.40:1。以上分组,每组五个重复。干物质消化率的实验方法,同(一)god的不同添加比例在肉鸡配合饲料中的影响的操作步骤,肉鸡的基础饲粮组成及营养水平详见表10。其中在实验组和对照组中,每组基础饲粮的添加量均为2.0000±0.0002g。实验结果:在添加不同分组下,肉鸡干物质消化率的影响详见下表12。表12添加不同的酶或酶组合对于肉鸡干物质消化率(%)的影响通过上表可以看出,在肉鸡配合料(粉料)中添加god/cat复配酶(配比6.40:1),较空白对照组的干物质消化率显著提高0.9727%,较单一添加god的干物质消化率显著提高0.3716%,经过god/cat空白对照、god/cat-god的配对t检验,差异显著,并且god/cat组合god组均呈正态分布(参照表13、14)。表13god/cat组的正态性检验注:kolmogorov-smirnov是k-s检验;指统计软件spss中检验频数分布的正态性检验;shapiro-wilk是s-w检验(夏皮罗-威尔克检验)是一种在频率上统计检验中检验正态性的方法;“*.”表示真实显著水平的下限。表14god组的正态性检验a.lilliefors显著水平修正表15成对样本检验通过对god/cat复配酶与单一添加god在干物质消化率中的比较,结合god/cat组和god组的正态性检验并进行成本样本检验,god/cat组较god组的干物质消化率提高量极为显著,详见表15。(三)god/cat的不同比例在肉鸡配合饲料中的影响通过改变god/cat的酶活配比,继续进行对照实验的比较,分组如下:空白对照组:不添加god和god/cat配伍酶组合;对照组:单一添加god,添加量为100u/kg配合饲料;实验组:添加god/cat配伍酶组合,god添加量是100u/kg配合饲料,肉鸡配合料(粉料)中添加god和cat酶活配比为7.87:1。以上分组,每组五个重复。干物质消化率的实验方法,同(一)god的不同添加比例在肉鸡配合饲料中的影响的操作步骤,肉鸡的基础饲粮组成及营养水平详见表10。其中在实验组和对照组中,每组基础饲粮的添加量均为2.0000±0.0002g。实验结果:不同分组下对于肉鸡干物质消化率的影响详见下表16。表16不同分组下对于肉鸡干物质消化率(%)的影响通过上表16可以看出,在肉鸡配合料(粉料)中添加god/cat复配酶(配比1:7.87),较空白对照组的干物质消化率显著提高0.9636%,较单一添加god的干物质消化率显著提高0.3624%,经过god/cat-空白对照、god/cat-god的配对t检验,差异显著,并且god/cat组合god组均呈正态分布。通过对god/cat复配酶与单一添加god在干物质消化率中的比较,结合god/cat组和god组的正态性检验并进行成本样本检验,结果显著,god/cat组较god组的干物质消化率提高量极为显著,详见表17。表17成对样本检验需要说明的是,针对于实验例1中,god/cat不同酶活配比对于god酶活测定的影响,其中god/cat的配比在(5.0-11.0):1范围内,特别是(6.0-9.0):1范围内,均为酶活配比优选范围内。对于其中的god/cat配比6.7:1对应的酶活最高值,而在肉鸡配合饲料的干物质消化率实验中,god/cat的配比6.40:1优于7.87:1的情况,此处需要说明的是由于酶活测定与复配酶在饲料中反应的缓冲体系不同,特别是饲料的不同成分对于酶活反应的影响,因此可以理解测定酶活最大值和最高干物质消化率所对应的god/cat的配比会存在不同,但都属于god/cat的配比的优选范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1