靶向前列腺癌的重组溶瘤腺病毒及其构建方法和应用与流程
本发明涉及生物技术领域,具体地说,是关于一种靶向前列腺癌的重组溶瘤腺病毒及其构建方法和应用。
背景技术:
对于早期前列腺癌,多采用外科手术的方法切除肿瘤,效果也较好。然而由于前列腺癌相较其它癌症发病隐匿,生长较为缓慢,潜伏期和平均倍增时间较长等特点,多数前列腺癌病人就诊时病变已至晚期阶段。此时手术的方法已不可行,多采用以降低雄激素水平为主的内分泌治疗方式。这种方式初期是有效的,但随着治疗的进行,前列腺癌会慢慢进展为雄激素非依赖性,对这一治疗手段不再敏感。
除此之外还有传统的放化疗手段,但都存在疗效差,副作用高的缺点,除可一定程度上缓解患者的症状之外,不能有效的延长患者的生存时间。
多西他赛(docetaxel),又称多西紫杉醇,是紫杉烷类的成员,是一类与微管蛋白结合的细胞毒性化学治疗剂,从而稳定微管并引起细胞周期停滞和凋亡。多西他赛是一种经典的广谱抗肿瘤药物,广泛用于多种癌症的治疗,己成为治疗晚期前列腺癌的一线化疗药物。然而因患者自身耐受差、药物选择性弱等原因亦导致化疗失败或复发,使其疗效欠佳。
血管新生(angiogenesis)是一项牵涉颇广的生理机能。除某些正常生理情况外,很多病理情况也涉及血管新生,如伤口愈合、糖尿病增殖性视网膜病变、动脉粥样硬化、肿瘤生长等。就肿瘤而言,研究表明其生长与转移均依赖于血管生成。肿瘤生长初期不需要血管新生,但生长至l~2mm3后,再继续增长就必须靠血管新生供给充足的营养才能维持。血管形成愈丰富,肿瘤生长愈旺盛。肿瘤不仅借助新生血管获得充分的营养和氧气供给,带走代谢废物;肿瘤的转移和扩散也是通过血管进行的。
当前应用于抗肿瘤的血管新生抑制剂有一类属于大分子蛋白的水解产物,比如已应用于临床的内皮抑素(endostatin)和血管抑素(angiostatin),它们分别是collagenxviii和纤溶酶原的水解产物。纤溶酶原是溶解纤维蛋白和溶解血栓过程中关键的酶原前体之一,结构上由7个紧密相连、相互协调的结构域组成,包括5个同源性很高的饼环状结构域kringle1~5,这5个kringle环的蛋白质一级结构有50%左右的同源性。血管抑素包含纤溶酶原的前四个kringle,具有特异性抑制内皮细胞增殖和新生血管形成的作用,在体内外的肿瘤模型试验均已证实了血管抑素通过抑制肿瘤血管生长能够有效的抑制肿瘤生长。后来,cao等人又发现纤溶酶原第5个饼环区(kringle5)具有较angiostatin更强的抑制内皮细胞增殖和迁移的能力,可更有效的抑制由生长因子诱导的新生血管增殖,并能诱导部分肿瘤细胞凋亡,对病理性血管新生疾病及肿瘤的生长转移有着明显的治疗效果。然而,当前对纤溶酶原及其饼环结构域的结构还了解甚少,尤其是结构与其功能的关系。chang等人构建了一个k5的lbs区点突变l71r,发现当k5第71位的亮氨酸突变为碱性氨基酸精氨酸后,对ω-氨基酸配体如赖氨酸类似物eaca的亲合力明显提高。但这种突变的k5(又称mk5)在癌症治疗应用领域研究较少。
技术实现要素:
本发明的第一个目的是提供一种靶向前列腺癌的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5。
本发明的第二个目的是提供一种所述的靶向前列腺癌的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5的构建方法。
本发明的第三个目的是提供一种所述的靶向前列腺癌的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5在制备治疗前列腺癌药物中的应用。
本发明的第四个目的是提供一种治疗前列腺癌的药物组合物。
基于以上目的,本发明的第一个方面,提供一种靶向前列腺癌的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5,所述重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5由dd3启动子驱动腺病毒e1a基因,腺病毒基因组敲除了e1b基因区域,同时,插入外源基因mk5。
进一步的,所述重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5与多西他赛具有协同增效抗癌作用。
本发明的第二方面,提供一种上述所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5的构建方法,包括以下步骤:
步骤一、穿梭质粒pshuttle-mk5-dd3-e1a-△e1b的构建
利用pcr的方法,将载体pshuttle-dd3-e1a-△e1b与mk5基因连接到一起,构建穿梭质粒pshuttle-mk5-dd3-e1a-△e1b;
步骤二、利用pmei酶切穿梭质粒,然后转化到含有padeasy-1质粒的bj5183感受态细胞中,使二者发生同源重组,以卡那霉素筛选鉴定以获得padeasy-mk5-dd3-e1a-△e1b;
步骤三、利用paci酶切质粒padeasy-mk5-dd3-e1a-△e1b,用effectene转染试剂将酶切后获得片段转染入人胚胎肾细胞hek-293中产生重组溶瘤腺病毒oad.mk5。
本发明的第三个方面,提供一种上述所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5在制备治疗前列腺癌药物中的应用。
本发明的第四个方面,提供一种上述所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5在制备协同增效治疗前列腺癌的药物中的应用。
本发明的第五个方面,提供一种治疗前列腺癌的药物组合物,所述药物组合物包括上述所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5。
本发明的第六个方面,提供一种具有协同增效的治疗前列腺癌的药物组合物,所述药物组合物包括上述所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5和多西他赛。
本发明的有益效果是:所述的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5的毒性低、抗前列腺癌效果好,且对治疗前列腺癌的药物多西他赛起到协同增效作用。
附图说明
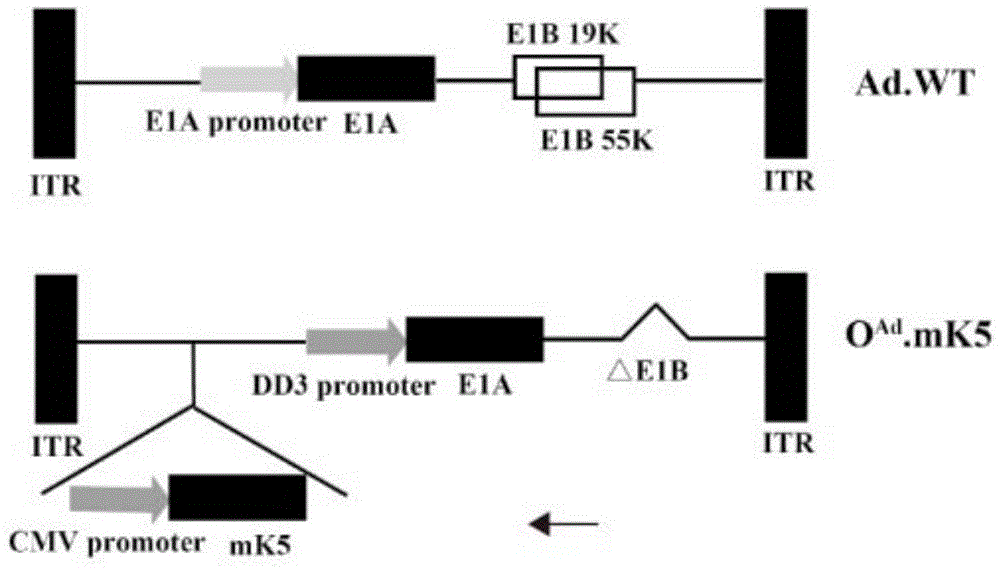
图1为重组溶瘤腺病毒oad.mk5的构建示意图。
图2为重组溶瘤腺病毒oad.mk5的野毒鉴定结果。其中,m:maker;泳道2为hek293细胞基因组,阳性对照;泳道3为wt病毒基因组,阳性对照;泳道4为h2o,阴性对照;泳道5为重组溶瘤腺病毒oad.mk5。
图3为重组溶瘤腺病毒e1b的敲除鉴定结果。其中,m:maker;泳道2为hek293细胞基因组,阳性对照;泳道3为wt病毒基因组,阳性对照;泳道4为h2o,阴性对照;泳道5为重组溶瘤腺病毒oad.mk5。
图4为外源基因mk5是否成功插入到正确位置的鉴定结果。其中,m:maker;泳道2为pshuttle-mk5;泳道3为重组溶瘤腺病毒oad.mk5。
图5为重组溶瘤腺病毒的e1a和mk5mrna及蛋白的表达水平。
图6为重组溶瘤腺病毒oad.mk5对前列腺癌细胞的杀伤性检测结果。
图7为重组溶瘤腺病毒oad.mk5对前列腺癌细胞的安全性检测结果。
图8为docetaxel与重组溶瘤腺病毒oad.mk5体外协同增效抗癌结果图。
图9为重组溶瘤腺病毒oad.mk5的体内抗癌结果图。
图10为免疫荧光染色结果图。
图11为tunel染色结果图。
图12为h&e染色结果图。
具体实施方式
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。除非另外说明,本发明所采用的技术,均是本领域常规技术,如分子克隆技术、微生物学技术、细胞生物学技术等。
其中,以下实施例的重组溶瘤腺病毒oncoad-dd3-e1a-△e1b-mk5简称oad.mk5。
以下实施例所用的试剂及细胞系:
1、主要细胞系包括:hela、a549、lncap22rv1、wpmy-1均购自上海生命科学研究院细胞库。hela用mem培养基培养,a549用f12k培养基培养,lncap和22rv1用rpm-i640培养,wpmy-1用dmem培养。
2、hek293购自atcc(rockville,md,usa),dmem培养基培养。
3、人原代前列腺成纤维细胞、人原代肝成纤维细胞购于赛百糠生物技术股份有限公司,dmem培养基培养。
4、培养基中都补充了10%的胎牛血清,培养基购自gibco公司,胎牛血清购自上海威正翔禹生物科技有限公司。
5、多西他赛(docetaxel,mce),用细胞级dmso溶解配制成10mm浓度,贮存在-20℃。
实施例1重组溶瘤腺病毒oad.mk5的构建
本发明采用ad-easy系统构建腺病毒,在大肠杆菌中进行同源重组,获得含有目标基因的质粒;在293细胞中包装,获得了含有目标基因的病毒。具体操作如下:
步骤一、穿梭质粒pshuttle-mk5-dd3-e1a-△e1b的构建
对pzxc2.dd3-e1a.(targetinggene-virotherapyforprostatecancerbydd3-drivenoncolyticvirus-harboringinterleukin-24gene[j].internationaljournalofcancer,2010,127(3):707-717.)进行xhoi和xbai双酶切,与同样用xhoi和xbai双酶切的pshuttle-psur-e1a-△e1b(按照中国专利cn108342366a公开的pshuttle-psur-e1a-△e1b的构建方法获得)相连,得到pshuttle-dd3-e1a-△e1b重组质粒。
以pca13-mk5(increasedsuppressionofoncolyticadenoviruscarryingmutantk5oncolorectaltumor[j].biochemical&biophysicalresearchcommunications,2008,374(2):198-203)为模板,设计一步克隆引物,得到mk5表达框片段;与xhoi单酶切胶回收的pshuttle-dd3-e1a-△e1b片段;将mk5表达框片段、线性化的pshuttle-dd3-e1a-△e1b片段与汉恒生物的一步克隆试剂反应,得到穿梭质粒pshuttle-mk5-dd3-e1a-△e1b。
(1)一步克隆引物序列如下:
f:tggtaccgcggccgcctcgagaattccctggcattatgccc(seqidno:1)
r:ttgacaagtcgacgatgcaatctcgagtcgatgctagacgatccagac(seqidno:2)
(2)pcr反应体系如下:
使用kod-plusneopcr酶,98℃,5min,95℃,30s,55℃,30s,68℃,1min,68℃,5min,32个循环。
步骤二、利用pmei(biolabs,newengland)酶切穿梭质粒,然后转化到含有padeasy-1质粒的bj5183感受态细胞(按照中国专利cn201810651915.2公开的构建方法获得)中,使二者发生同源重组,以卡那霉素筛选鉴定以获得padeasy-mk5-dd3-e1a-△e1b。
步骤三、利用paci酶切质粒padeasy-mk5-dd3-e1a-△e1b,用effectene转染试剂将酶切后获得片段转染入人胚胎肾细胞hek-293中产生重组溶瘤腺病毒oad.mk5(如图1所示)。
实施例2重组溶瘤腺病毒oad.mk5的鉴定
通过血液基因组试剂盒(beyotime,china)抽取病毒感染lncap细胞后的基因组,用pcr的方法鉴定我们所构建的病毒中是否掺有野毒,病毒e1b区是否敲除,外源基因mk5是否成功插入到正确位置,以及序列是否发生突变。本实施例以hek293细胞基因组和wt病毒基因组为阳性对照,水为阴性对照,oad.mk5病毒感染组为实验组。
具体的引物序列如下:
(1)野毒鉴定,其pcr产物长度为325bp,鉴定结果如图2所示。结果显示:无pcr阳性条带。证明重组溶瘤腺病毒无野毒存在。
(2)病毒e1b区是否敲除的鉴定,采用e1b的引物来鉴定e1b区域是否敲除,其pcr产物长度为250bp鉴定结果如图3所示。结果显示,构建的病毒oad.mk5没有扩增出阳性条带。证明e1b完全敲除。
(3)外源基因mk5是否成功插入到正确位置以及序列是否发生突变的鉴定,以mk5表达框插入位置上下游序列为引物,其pcr产物长度为1197左右,水为阴性对照,携带mk5基因质粒为阳性对照,如箭头所示位置有阳性条带,如图10所示。结果证明:插入位置正确,又通过引物测序,证明其无突变。
综上,重组溶瘤腺病毒oad.mk5构建成功。
实施例3rt-pcr鉴定重组溶瘤腺病毒在细胞中e1a和mk5mrna的表达水平
细胞以一定数量铺于六孔板中,12小时后,加入5moi病毒,48小时后,抽提rna,采用trizol(cwbio,china)裂解法;用反转录试剂盒(toyobo,japan)将mrna反转录为cdna;实时定量pcr试剂盒sybrgreenrealtimepcrmastermix(toyobo,japan)用于检测目的基因的表达,具体引物序列如下:
为了检测oad.mk5在前列腺癌细胞和非前列腺癌细胞中的复制能力,用5moi的病毒oad.mk5分别感染lncap、22rv1、a549和hela细胞。结果显示,相较于非前列腺癌细胞a549和hela,通过rt-pcr检测溶瘤腺病毒感染后e1a在lncap、22rv1等前列腺癌细胞中均有很高的表达水平,对前列腺癌细胞的特异性选择具有更好的优势(如图5a、5b所示)。最后,通过rt-pcr检测了mk5分别在lncap、22rv1、a549和hela中的表达(如图5d所示),与前面结果一致的,在前列腺癌细胞系lncap和22rv1中mk5高表达。
实施例4westernblot分析
病毒以5moi的浓度加到细胞中,48h后收蛋白,每孔加入100ul的裂解液ripa(beyotime,china)(ripa中按100:1加入蛋白酶体抑制剂pmsf(beyotime,china)),用细胞刮刀把细胞刮下来,收到一个rnaasefree的ep管中。在4℃冷库中用振荡器震荡10min以充分裂解,然后以4℃,13000rpm,离心10min,取上清80ul作为收集的蛋白样品,按照4:1的比例向蛋白样品中加入5×sds-page(beyotime,china)蛋白上样缓冲液,混匀后100℃煮10min,另取蛋白样品10ul用于蛋白定量,采用bca蛋白定量试剂盒(thermofisherscientific,massachusetts,usa)。按照目标蛋白分子量大小配置合适浓度的sds聚丙烯酰胺凝胶(beyotime,china)。将已经配平浓度的蛋白样品以及蛋白marker(thermofisherscientific,massachusetts,usa)依次加入泳道。电泳起始电压80v,待样品进入分离胶后将电压调为120v。之后以90v恒定电压转膜,转膜时间根据蛋白分子量决定(约65~80min)。电转完毕,用含5%脱脂奶粉的tbst封闭液,室温封闭60min。之后加入合适稀释比的一抗,4℃摇床孵育过夜或室温两小时。tbst洗膜3次,每次5min,然后加入合适稀释比的hrp标记的二抗,摇床室温孵育1h,tbst充分漂洗3次,每次10min。最后显色,将显色底物(thermofisherscientific,massachusetts,usa)中的a液与b液1:1混匀,取适量混匀后的显色液覆盖于pvdf(millipore,usa)膜上,在全自动化学发光成像系统中曝光成像。
结果:通过western-blot检测了5moioad.mk5感染lncap、22rv1、a549和hela细胞后,e1a的表达(如图5c所示),结果显示,在lncap细胞中表达最多,并且在hela细胞中也有少许表达。
实施例5mtt法检测重组溶瘤腺病毒oad.mk5体外对前列腺癌细胞的杀伤效果
将合适数量(约3000/孔)的细胞铺于96孔板中,于co2培养箱中培养12-24h后,向各孔中加入合适moi梯度稀释的重组溶瘤腺病毒oad.mk5100ul(或者pbs),以不加病毒的细胞作为对照,同时设置只加培液的调零孔,培养指定时间后取出,向每孔加入20μlmtt溶液(4mg/ml),co2培养箱中继续培养4h,吸弃各孔内上清液,每孔加入150μldmso,摇床振荡15min,使结晶物充分溶解,用酶标仪检570nm(检测波长)与650nm(参照波长)处的吸光值,然后代入如下公式计算细胞生存率:细胞生存率=(od病毒感染孔-od调零孔)/(od对照孔-od调零孔)×100%;以mois梯度或者培养天数为横轴,以细胞生存率为纵轴绘制细胞生存曲线。
本实施例分别以0.1、1、2、5、10、20moi的病毒oad.mk5感染lncap和22rv1细胞,四天后,mtt法检测细胞的生存率(如图6a和图6b所示)。结果显示,oad.mk5对lncap和22rv1有很好的杀伤作用,尤其是lncap,5moi病毒就可以将细胞全部杀光。
接着,发明人检测了时间梯度下(1-4天),10moioad.mk5病毒作用后,lncap和22rv1的细胞存活情况(如图6c和图6d所示)。结果显示,在病毒作用三天后,lncap几乎被全部杀灭。
结论:重组溶瘤腺病毒oad.mk5对前列腺癌细胞具有很强的杀伤力。
实施例6mtt法检测重组溶瘤腺病毒oad.mk5对前列腺癌细胞的安全性
(1)wpmy-1是正常前列腺间质细胞,通过mtt实验,分别从浓度梯度(0.1、1、2、5、10、20moi)和时间梯度(1、2、3、4day)的角度,检测oad.mk5对wpmy-1的杀伤作用(如图7a和图7b所示)。结果显示,oad.mk5对wpmy-1杀伤性很小。
(2)检测重组溶瘤腺病毒oad.mk5对人原代前列腺成纤维细胞和原代肝成纤维细胞的杀伤作用,检测了在一系列浓度梯度下(0.1、1、2、5、10、20、50、100moi)下,原代细胞的存活能力(如图7c和图7d所示)。结果显示,oad.mk5对原代细胞基本无杀伤作用。
结论:重组溶瘤腺病毒oad.mk5的安全性良好。
实施例7多西他赛docetaxel与溶瘤腺病毒oad.mk5的体外协同增效抗癌作用
选取对数生长期的lncap细胞,以每孔5000个细胞,铺于96孔板中,放置37度和5%二氧化碳的培养箱中,待细胞贴壁后,每孔分别加入一系列梯度的溶瘤腺病毒oad.mk5(0、0.1moi、1moi、2moi、5moi、10moi、20moi、50moi、100moi),以及一系列浓度的docetaxel(0、0.3nmol/l、1nmol/l、3nmol/l、10nmol/l、30nmol/l、100nmol/l、300nmol/l、1000nmol/l),每组3个重复孔,放置37度和5%二氧化碳的培养箱中培养,72小时后,用mtt法测出细胞的生存率,并计算出ic50。经检测,oad.mk5和docetaxel的ic50值分别为16.26moi和14.51nm。
根据ic50值选取病毒oad.mk5梯度(8moi、10moi、16moi、32moi)、docetaxel浓度(12nmol/l、15nmol/l、24nmol/l、48nmol/l)以及溶瘤腺病毒oad.mk5(8moi、10moi、16moi、32moi)和docetaxel(12nmol/l、15nmol/l、24nmol/l、48nmol/l)联合使用,并以不作任何处理为对照组和只加培养液为调零组,每组3个重复孔,放置37度和5%二氧化碳的培养箱中培养,48小时后,用mtt法测出细胞的生存率。
结果如图8所示,相比于任何单一处理组,溶瘤腺病毒oad.mk5联合docetaxel能够更有效杀伤lncap细胞,运用calcusyn软件处理杀伤效果对应联合指数(fa-ci)的定量数据,处理组的联合指数(ci)值用x表示,中间曲线表示联合处理组的模拟联合指数值,包含95%置信区间的两行代数估计,在实验比率下所有实验ci值在两个置信度之间,结果显示0<ci<1之间,表明联合处理是协同增效作用。
结论:低剂量的docetaxel与溶瘤腺病毒oad.mk5联合处理具有协同增效作用。
实施例9lncap移植瘤模型的构建及重组溶瘤腺病毒oad.mk5的体内抗癌效果
为了进一步证明oad.mk5对前列腺癌的抑制作用,我们选用了lncap细胞为移植瘤模型进行体内实验。lncap细胞来源于前列腺癌患者的淋巴结转移灶,既具有前列腺肿瘤的细胞生物学特征,又保留了雄性激素早期依赖的生物学特征,并且具有淋巴转移的特征。虽然其单独成瘤率很低,但是与基质胶混合成瘤率基本达到100%。lncap细胞的上述特征使其成为目前最常用的研究前列腺癌治疗、机理、诊断的前列腺癌细胞系。因此,本课题中选用lncap细胞作为体内实验的动物模型。
动物实验
订购3-4周龄的小鼠,适应培养一周后,以500万每只小鼠的lncap细胞量,腋下皮下成瘤,细胞以无血清培养基与matrigel基质胶(bd,usa)1:1混合成100μl后注射,每天观察测量瘤子大小,待小鼠肿瘤长到80-100mm3后,瘤内注射病毒,共四次隔天注射,注射病毒总量为2×109pfu,以pbs作为对照,每隔两天测量肿瘤大小。
本实验分两组,pbs组和oad.mk5组。在实验进行到第43天的时候,oad.mk5组有6只小鼠,其中3只肿瘤完全消退(如图9a所示)。
接着,持续测量了总计160天小鼠肿瘤的变化(如图9b所示),发现在后期小鼠肿瘤有一定的复发。
结论:oad.mk5病毒可以有效地抑制lncap小鼠移植瘤的生长,并且毒副作用很小,实验160天,小鼠无一死亡。证明了上述构建的重组溶瘤腺病毒oad.mk5有安全性保障。
实施例10免疫组化揭示oad.mk5的抑癌机制
为了进一步揭示oad.mk5的抑癌机制,本实施例使用cd31免疫荧光染色、tunel染色和h&e染色分析oad.mk5在lncap异种移植物中的抗血管生成和凋亡作用。
(1)免疫组化分析肿瘤组织的血管形成能力
小鼠在实验结束后处死,剥取瘤,在pbs中清洗干净,取适合大小的瘤子在otc中包埋,8μm冰冻切片机切片。染色前先用4%的pfa固定30-60min,pbs洗三次后,0.5%tritonx-100(5%bsa配置)透膜封闭30-60min,之后加cd31(bd,usa)荧光抗体(1:400稀释)室温避光孵育2h后,pbs洗3次,每次十分钟,之后染dapi室温避光孵育5min,pbs洗3次,每次十分钟,无尘纸擦干玻片后,用抗荧光淬灭的封片剂封片,4℃过夜凝固后,荧光显微镜下观察。
在用oad.mk5治疗的动物中观察到未治疗动物中内皮标志物cd31的阳性细胞数和少数阳性cd31细胞(如图10a和图10b所示)。
结论:oad.mk5可抑制肿瘤生长、肿瘤血管生成。
(2)组织水平的凋亡检测-tunel
将实验结束的小鼠处死,取出皮下肿瘤,切合适大小的肿瘤块置于包埋盒中,otc包埋后冻于-80℃。将冰冻切片机预冷后,开始切片,设置切片厚度为7μm,保存-80℃或者直接染色。染色前将切好的片子用4%的pfa固定30-60min,pbs洗两次,每次10min,之后用0.5%tritonx-100透膜,室温孵育5后,pbs洗两次,每次10min,按protocol配好试剂后,滴加在组织上,37℃避光孵育60min,之后pbs洗3次,滴加dapi染液,室温孵育5-10min后,pbs洗3次,最后用抗荧光淬灭的封片剂封片,待片子固定后,荧光显微镜下观察。
结果显示,在oad.mk5处理的肿瘤中观察到比在pbs组中更高百分比的tunel阳性细胞(如图11a和图11b所示)。
结论:oad.mk5也可能通过凋亡途径来抑制肿瘤。
(3)h&e染色
对实验小鼠实行安乐死后,取出肿瘤,用4%的pfa4℃冰箱固定过夜。将固定过夜后的肿瘤组织取出,采用乙醇梯度脱水的方法进行脱水,具体为:依次将组织浸入75%、85%乙醇中各一个小时,再浸入95%的乙醇一小时,最后浸入无水甲醇一小时,之后用二甲苯透明。将上述组织块直接装框,之后石蜡浸泡,石蜡切片机以5μm的厚度进行连续切片,然后将切片在37℃水中展片后转移到载玻片上,置于烘机上烘干。进行染色之前先复水,之后苏木精(sangonbiotech,china)染7min,流水冲3min后,在1%的盐酸乙醇中浸泡3s,流水冲30min,75%的乙醇蘸一下后伊红(sangonbiotech,china)染30s,流水冲3min,之后进入脱水步骤,最后中性树脂封片。
h&e染色的结果可以看出,oad.mk5组小鼠肿瘤组织坏死区域相对pbs组少了很多,并且,与未处理的动物或处理的动物相比,来自oad.mk5处理的微球组织的肿瘤含有较少的血管(如图12所示)。
序列表
<110>上海元宋生物技术有限公司
<120>靶向前列腺癌的重组溶瘤腺病毒及其构建方法和应用
<130>181064
<141>2018-09-07
<160>14
<170>siposequencelisting1.0
<210>1
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>1
tggtaccgcggccgcctcgagaattccctggcattatgccc41
<210>2
<211>48
<212>dna
<213>人工序列(artificialsequence)
<400>2
ttgacaagtcgacgatgcaatctcgagtcgatgctagacgatccagac48
<210>3
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcgtaatatttgtctaggg19
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgggtataaatacactacac20
<210>5
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>5
cgtgtagtgtatttatacc19
<210>6
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>6
gtggcagataatatgtct18
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggtaccgcggccgcctcgag20
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctcgagattgcatcgtcgac20
<210>9
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>9
gtgatagagtggtgggtttgg21
<210>10
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcaggctcaggttcagaca19
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
acccagaagactgtggatgg20
<210>12
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>12
tctagacggcaggtcaggtc20
<210>13
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>13
gttacgactactgtgatg18
<210>14
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>14
cgatccagacatgataag18
- 还没有人留言评论。精彩留言会获得点赞!