用于产生液珠的管状结构及液珠产生方法与流程
本公开涉及一种用于产生液珠的管状结构及液珠产生方法。
背景技术:
液珠式数字聚合酶连锁反应(dropletdigitalpolymerasechainreaction,ddpcr)是一种对核酸分子进行绝对定量的方法。在一般的液珠式数字聚合酶连锁反应中,可利用液珠产生器将样品划分成数百乃至数万个纳升甚至皮升级别的单个油包水液珠。在这些液珠中,有些液珠不含核酸分子,或仅含单一核酸分子。之后对液珠中的检体进行pcr扩增,最后再以荧光信号进行检测以及统计分析。相对于传统的定量聚合酶连锁反应,数字聚合酶连锁反应可展现高灵敏性、高准确性且多目标的定量能力。
目前,使用市售的ddpcr机台进行检测的方法包括以下步骤:利用液珠产生器产生液珠;将产生的液珠放置于96孔盘的封膜机,进行封膜:将封膜后的96孔盘置入pcr机器,执行核酸放大;以及将经核酸放大后的液珠抽取至液珠检测仪,以进行光学判读。因各操作流程在不同的容器以及不同机台内处理,因此,样品容易在转移的过程中损耗且程序自动化相当困难。同时,ddpcr过程中需要会消耗大量耗材,尤其用于产生液珠的液珠产生器,因有检体交叉污染疑虑,无法重复使用,而使检测的成本提高。
目前缺乏能够方便且精准用于液珠数字聚合酶连锁反应的产品。
技术实现要素:
本公开提供一种用于产生液珠的管状结构以及使用所述管状结构产生液珠的方法。本公开的管状结构中具有微孔或微管道以将水相试剂分离,此水相试剂经由管状结构内油相液体的剪切作用,而形成具有油包水结构的液珠。由于本公开的管状结构以单一管状结构即可生成液珠,相较于现有技术使用的多槽结构更不占空间。在本公开的一些实施例中,本公开的管状结构在液珠产生后还可持续用于进行液珠式数字聚合酶连锁反应或其他生物化学反应,并可于原位进行液珠检测或液珠分离,而无需将液珠移出至另一反应容器或机台。在这种情况下,液珠的产生、后续所进行生物化学反应(例如聚合酶连锁反应)以及最终的液珠检测检验或收集等,都可于本公开的单一管状结构中完成而无需更换不同容器耗材或反应槽。因此,可以在无交互污染疑虑下进行精准的生物化学反应及/或检测,不但可降低生物化学检测成本,且操作便捷而能够进一步实现程序自动化的目的。
本公开的管状结构包括外管、试剂容置区、第一微管道、注油管道、排气管道、储油区、液珠容置区以及第二微管道。所述试剂容置区设置于所述管状结构内部的上部中间处且沿着管身长度方向延伸。所述第一微管道设置于所述管状结构内部且位于所述试剂容置区下方。所述第一微管道的第一端连接至所述试剂容置区且通过连接的所述第一端与所述试剂容置区连通,且所述第一微管道沿着所述管身长度方向延伸。所述注油管道与所述排气管道设置于所述管状结构内部的上部处且分别位于所述试剂容置区的相对两侧,其中所述注油管道与所述排气管道沿着所述管身长度方向延伸。所述储油区设置于所述管状结构内部的下部处,其中所述注油管连接至所述储油区上方且与所述储油区相连通。所述液珠容置区设置于所述管状结构内部的下部处,其中所述排气管连接至所述液珠容置区上方且与所述液珠容置区相连通。所述第二微管道位于所述储油区与所述液珠容置区之间且连接至所述储油区与所述液珠容置区,其中所述第二微管道沿着垂直于所述管身长度方向的径向延伸。所述第一微管道以相对于所述第一端的第二端垂直连接至所述第二微管道,且所述第二微管道与所述储油区、所述液珠容置区以及所述第一微管道相连通。所述第一微管道的直径小于所述第二微管道的直径。
本公开的用于产生液珠的管状结构包括试剂容置内管以及油剂容置外管。所述试剂容置内管设置于所述管状结构内部的中间处且沿着管身长度方向延伸,其中所述试剂容置内管具有第一空腔以容置试剂液且所述试剂容置内管包括微孔阵列位于所述试剂容置内管的下部。所述油剂容置外管位于所述试剂容置内管外部且围绕所述试剂容置内管的侧部及所述下部,其中,所述油剂容置外管具有第二空腔以容置油体,所述微孔阵列位于所述试剂容置内管与所述油剂容置外管之间,所述试剂容置内管中的所述试剂液可通过所述微孔阵列而在所述油剂容置外管中的所述油体中分离形成所述液珠。
本公开的液珠产生方法包括:提供管状装置,所述管状结构包括设置于所述管状结构内部的试剂容置区、油剂容置区、液珠容置区以及第一与第二微管道,其中所述第一微管道连接于所述试剂容置区下方且与所述试剂容置区连通,所述第二微管道连接于所述油剂容置区与所述液珠容置区之间且与所述油剂容置区与所述液珠容置区相连通,所述第一微管道垂直连接至所述第二微管道,且所述第一与第二微管道彼此相连通;加入包含检体的试剂液至所述试剂容置区中;加入油剂至所述油剂容置区中;以及驱使所述试剂液通过所述第一微管道并驱使所述油剂流入所述第二微管道,使所述油剂包覆所述试剂液而形成所述液珠。
基于上述,本公开的管状结构利用其内所包含的第一微管道与第二微管道的立体垂直流路相交的立体结构,在非同一平面上建构液珠产生机制,以油包水(water-in-oil)的方式,在微管导道内产生液珠。从产生液珠、检测液珠、分离液珠,到最后液珠收集,都可在同一管状结构耗材内完成。不但可减少检测过程人为操作的失误,增加可靠度,提升检测功能性。并且因为减少耗材使用以及样品耗损,可以达成低成本且精准有效率的生化检测方式。
为让本公开的上述特征和优点能更明显易懂,下文特举实施例,并配合所附的附图作详细说明如下。
附图说明
图1a及图1b分别为本公开的第一实施例的管状结构的剖视图及俯视图;
图2a是本公开的第二实施例的管状结构的剖视图;
图2b是说明使用本公开的第二实施例的管状结构产生液珠的方法的示意图,图2b对应于图2a的虚线方框部分;
图3a是本公开的第三实施例的管状结构的剖视图;
图3b是说明使用本公开的第三实施例的管状结构产生液珠的方法的示意图,图3b对应于图3a的虚线方框部分;
图4a是本公开的第四实施例的管状结构的立体透视图;
图4b是本发明的第四实施例的管状结构的俯视图;
图4c是本公开的第四实施例的管状结构的剖视图;
图5a是本公开的第五实施例的管状结构的立体透视图;
图5b是本公开的第五实施例的管状结构的剖视图;
图5c是说明使用本公开的第五实施例的管状结构产生液珠的方法的示意图,图5c对应于图5b的虚线方框部分;
图6a是本公开的第六实施例的管状结构的立体透视图;
图6b是本公开的第六实施例的管状结构的俯视图;
图6c是本公开的第六实施例的管状结构的剖视图;
图7a及图7b分别为实例1的管状结构的上部的下表面及下部的上表面的电子显微镜照片图;
图8a至图8d分别为实例2的管状结构的上部的下表面、中部上表面、中部下表面及下部的上表面的电子显微镜照片图;
图9为本公开的液珠式数字聚合酶连锁反应装置的示意图;
图10a及图10b分别为实验实例a-1的液珠在油膜干燥前后的光学显微镜影像图;
图11a及图11b分别为实验实例a-2的液珠在油膜干燥前后的光学显微镜影像图;
图12为实验实例a-3的液珠在油膜干燥前的光学显微镜影像图;
图13为实验实例a-4的液珠在油膜干燥前的光学显微镜影像图;
图14为实验实例b-1的t型加热载台模块的立体示意图;
图15为实验实例b-2的单平面型薄壳板加热载台模块的立体示意图;
图16为实验实例b-3的单平面套管型加热载台模块的立体示意图;
图17为实验实例b-4的多管单侧平边型加热载台模块的立体示意图;
图18为实验实例c-1的温度变化曲线图;
图19为实验实例c-2的温度变化曲线图;
图20为实验实例c-3的温度变化曲线图;
图21为实验实例c-4的温度变化曲线图;
图22为实验实例c-5的温度变化曲线图;
图23为实验实例c-6的温度变化曲线图;
图24为使用abi7500与本公开的实验设备进行聚合酶连锁反应后以琼脂胶体电泳判读λdna放大的信号的照片图;
图25为实验实例d-2的pcr实验的琼脂胶体电泳实验结果的照片图;
图26为实验实例d-3的pcr实验的琼脂胶体电泳实验结果的照片图;
图27为实验实例d-4的pcr实验的琼脂胶体电泳实验结果的照片图。
符号说明
100、200、300、400、500、600:管状结构
101:试剂容置内管
102:油剂容置外管
103:外管支撑部
104:环状支撑肋
105:微孔
111:第一空腔
112:第二空腔
202:外管
204:中隔板
210:试剂容置区
212:注油孔
214:排气孔
215:第一微管道
220:注油管道
225:油区连接孔道
230:排气管道
235:液珠区连接孔道
240:储油区
245:第二微管道
250:液珠容置区
302:外管
304:中隔板
310:试剂容置区
312:注油孔
314:排气孔
315:第一微管道
320:注油管道
325:油区连接孔道
330:排气管道
335:液珠区连接孔道
340:储油区
345:第二微管道
350:液珠容置区
402:外管
410:试剂容置区
415:第一微管道
425:油区连接孔道
435:液珠区连接孔道
440:下层预封储油区
445:第二微管道
450:下层液珠容置区
460:上层预封储油区
470:上层液珠容置区
502:外管
510:上层试剂容置区
512:注油孔
514:排气孔
515:第一微管道
520:注油管道
525:油区连接孔道
530:排气管道
535:液珠区连接孔道
540:储油区
545:第二微管道
550:液珠容置区
580:下层试剂容置区
602:外管
610:上层试剂容置区
612:注油孔
614:排气孔
615:第一微管道
625:油区连接孔道
635:液珠区连接孔道
640:下层预封储油区
645:第二微管道
650:下层液珠容置区
660:上层预封储油区
670:上层液珠容置区
680:下层试剂容置区
1:液体驱动模块
2:卡匣模块
3:检测模块
1000、2000、3000、4000:载台
1100、3100:绝热板
1200、2200、3200、4200:致冷芯片
1300、2300、3300、4300:散热铜板
1400、2400、3400、4400:散热风扇
d:液珠
o:油剂
w:试剂液
具体实施方式
下文列举实施例并配合附图来进行详细地说明,但所提供的实施例并非用以限制本公开所涵盖的范围。此外,附图仅以说明为目的,并未依照原尺寸作图。为了方便理解,在下述说明中相同的元件将以相同的符号标示来说明。另外,关于文中所使用「包含」、「包括」、「具有」等等用语,均为开放性的用语,也就是指「包含但不限于」。再者,文中所提到的方向性用语,例如「上」、「下」等,仅是用以参考附图的方向,并非用来限制本公开。
在本文中,液珠(droplet)是指具有内外双层结构的微滴,其中内层为水相,外层为油相。液珠的体积可以是例如小于约1微升(或在约1微升与1纳升之间或在约1微升与1皮升之间)、小于约1纳升(或在约1纳升与约1皮升之间)、或小于约1皮升(或在约1皮升与1飞升之间)等。液珠可以具有小于约1000、100、10或1微米的直径(或平均直径),或约1000至10微米的直径(或平均直径)等。液珠可以是球形的或非球形的。液珠可各自包覆不小于液珠一半尺寸的待测样品,进行分别定量计数。
在本文中,「试剂液」是指用于形成液珠内层的水相试剂,其可通过例如混合检体、水及/或pcr试剂而形成。举例而言,检体可包括生物检体(例如血液、血浆、唾液、精液、卵子、尿液)、生物分子(biomolecules)、纳米颗粒、病毒、食物检体或环境检体等。举例而言,检体可以是从人体或动物血液、血浆、唾液、精液、卵子、尿液、分子生物、病毒等来源中提取的核酸片段(包括dna或rna等)或模板(template)、将食品或中药材消化稀释后的液状检体或是例如饮水、清洗用水、灌溉用水等环境检体。检体中可包括例如呈色剂、荧光标记或磁性标记以便于后续检测。pcr试剂可包括脱氧核糖核苷三磷酸(deoxy-ribonucleotidetriphosphated--ntp)、镁离子、氯化钾、硫酸钾、酵素(enzyme)、引子(primer)、探针(probe)、缓冲液(buffer)、细胞组织裂解缓冲液(lysisbuffer)、纳米颗粒等,但不限于此。举例而言,试剂液中也可包含荧光染剂以便于后续检测。
在本文中,「油剂」是指用于形成液珠外层的油相的疏水性物质。油剂可包括具有耐热性的油,例如可包括硅油、植物油、氟化油,如fc-40、fc-7500,或矿物油,如烷烃,或其组合,但不限于此。
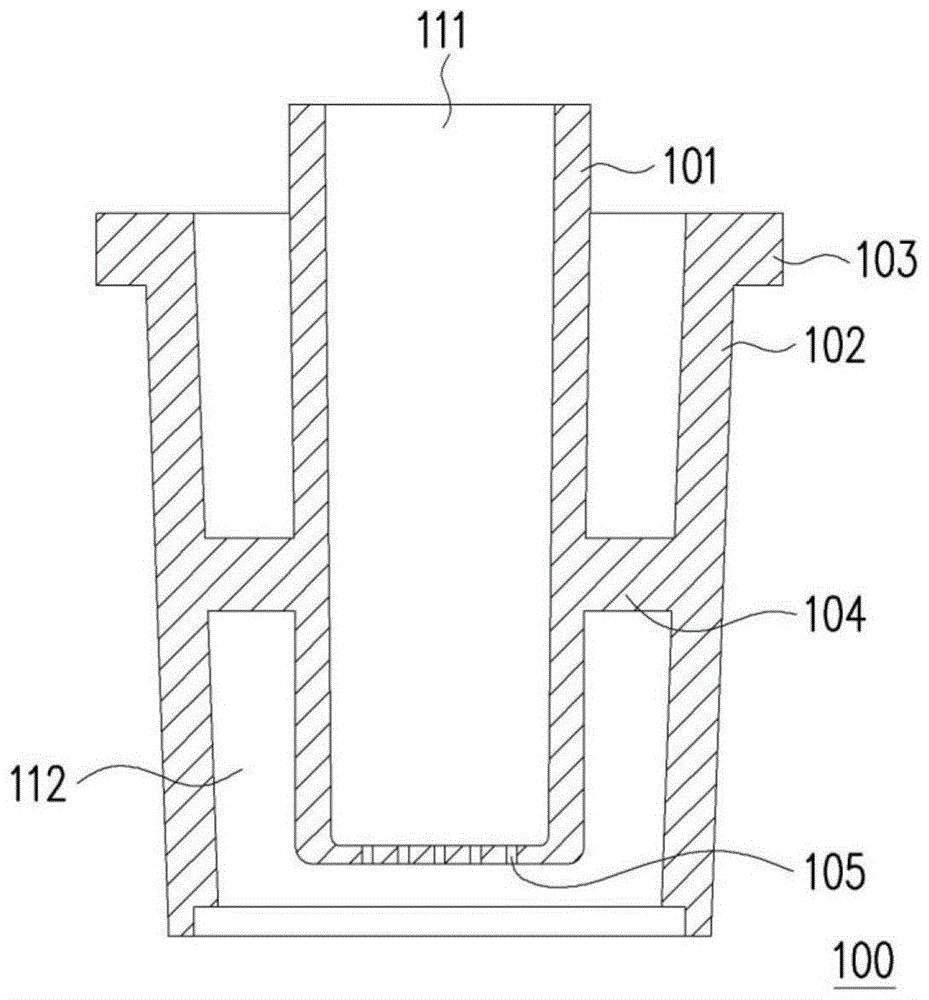
图1a及图1b分别为本公开的第一实施例的管状结构的剖视图及俯视图。
参照图1a及图1b,本公开的第一实施例的管状结构100包括试剂容置内管101、油剂容置外管102、外管支撑部103以及环状支撑肋104。试剂容置内管101底部具有阵列型的微孔105。微孔直径可为0.05mm~0.5mm,较佳为0.3mm。油剂容置外管102的底部为封闭型结构。环状支撑肋104连接试剂容置内管101与油剂容置外管102。外管支撑部103让管状结构100可放置于实验载台上以方便于实验取放。
使用管状结构100产生液珠的方法包括:于试剂容置内管101的第一空腔111中置放试剂液;于油剂容置外管102的第二空腔112置放油剂;利用例如空气压力的外部驱动力,使第一空腔111中的试剂液通过微阵列型的微孔105形成微小液滴并进入第二空腔112而与第二空腔112中的油剂结合形成油包水的液珠。
根据本公开的第一实施例的管状结构100可使用模制方法利用例如透明压克力制造。详言之,以精密加工分别制造试剂容置内管101、油剂容置外管102及环状支撑肋104,再将各组件进行组合而形成管状结构100,但不限于此。
图2a是本公开的第二实施例的管状结构200的剖视图。图2b是说明使用本公开的第二实施例的管状结构200产生液珠的方法的示意图,图2b对应于图2a的虚线方框部分。
参照图2a及图2b,本公开的第二实施例的管状结构200具有外管202且管内可分为上部及下部。上部包括试剂容置区210、注油管道220、排气管道230、注油孔212、排气孔214、第一微管道215、油区连接孔道225以及液珠区连接孔道235。下部包括储油区240、液珠容置区250、第二微管道245以及中隔板204。试剂容置区210设置于上部中间处且沿着管身长度方向延伸。第一微管道215设置于试剂容置区210下方。第一微管道215具有连接至试剂容置区210的第一端以及与第一端相对且连接至液珠容置区250的第二端且第一微管道215的第二端与第二微管道245的一端相切。注油管道220与排气管道230分别位于试剂容置区210的相对两侧且沿着管身长度方向延伸。注油管道220上方具有注油孔212。注油管道220通过油区连接孔道225与下方的储油区240相连通。排气管道230上方具有排气孔214。排气管道230通过液珠区连接孔道235与下方的液珠容置区250相连通。储油区240与液珠容置区250由中隔板204隔开。中隔板204上方具有第二微管道245。中隔板204可为透明的,且从第二微管道245下方沿着管身长度方向延伸至管状结构200的底部处。第二微管道245位于储油区240与液珠容置区250的顶面处,且沿着垂直于管身长度方向的径向延伸。也就是说,第二微管道245、储油区240与液珠容置区250的上表面可实质上共面。第二微管道245可具有连接至储油区240的第三端以及与第三端相对且连接至液珠容置区250的第四端,且第一微管道215的第二端垂直连接至第二微管道245的第四端。
在本公开的实施例中,第一微管道215的内径可例如为0.05至0.5mm,第二微管道245的内径可例如为0.1至1mm。此外,第一微管道215的内径可小于第二微管道245的内径,因此所形成的液珠可完整地被油膜包覆。
参照图2b,使用管状结构200产生液珠的方法包括:于注油孔212将油剂o注入注油管道220并使油剂o填充储油区240,将试剂液w填充于试剂容置区210,利用注射泵压缩空气,使得试剂液w与油剂o分别通过第一微管道215及第二微管道245,并通过油剂o的出口流体压力剪切使油剂o包覆试剂液w而形成液珠d。所形成的液珠d可存放在液珠容置区250。
图3a是本公开的第三实施例的管状结构300的剖视图。图3b是说明使用本公开的第三实施例的管状结构300产生液珠的方法的示意图,图3b对应于图3a的虚线方框部分。
参照图3a及图3b,本公开的第三实施例的管状结构300具有外管302且管内可分为上部及下部。上部包括试剂容置区310、注油管道320、排气管道330、注油孔312、排气孔314、第一微管道315、油区连接孔道325以及液珠区连接孔道335。下部包括储油区340、液珠容置区350、第二微管道345以及中隔板304。试剂容置区310设置于上部中间处,且沿着管身长度方向延伸。第一微管道315设置于试剂容置区310下方。第一微管道315可具有连接至试剂容置区310的第一端及与第一端相对且连接至第二微管道345上方的第二端,使试剂容置区310与第二微管道345彼此连通。注油管道320与排气管道330分别位于试剂容置区310的相对两侧且沿着管身长度方向延伸。注油管道320上方具有注油孔312。注油管道320通过油区连接孔道325与下方的储油区340相连通。排气管道330上方具有排气孔314。排气管道330通过液珠区连接孔道335与下方的液珠容置区350相连通。储油区340与液珠容置区350由中隔板304隔开。中隔板304上方具有第二微管道345。中隔板304可为透明的,且从第二微管道345下方沿着管身长度方向延伸至管状结构300的底部处。第二微管道345位于储油区340与液珠容置区350的顶面处,且沿着垂直于管身长度方向的径向延伸。也就是说,第二微管道345、储油区340与液珠容置区350的上表面可实质上共面。第二微管道345具有连接至储油区340的第三端以及与第三端相对且连接至液珠容置区350的第四端,且第一微管道315的第二端垂直连接至第二微管道345的介于所述第三端与所述第四端的中段处。
在本公开的实施例中,第一微管道315的内径可例如为0.05至0.5mm,第二微管道345的内径可例如为0.1至1mm。此外,第一微管道315的内径可小于第二微管道345的内径,因此所形成的液珠可完整地被油膜包覆。
参照图3b,使用管状结构300产生液珠的方法包括:于注油孔312将油剂o注入注油管道320并使油剂o填充储油区340,将试剂液w填充于试剂容置区310,利用注射泵压缩空气,使得试剂液w连续通过第一微管道315而到达第二微管道345并在第二微管道345中与连续通过第二微管道345的油剂o相遇,通过试剂液w与油剂o的表面张力的差异使油剂o包覆试剂液w而形成液珠d。所形成的液珠d可存放在液珠容置区350。
图4a是本公开的第四实施例的管状结构400的立体透视图。图4b是本公开的第四实施例的管状结构400的俯视图。图4c是本公开的第四实施例的管状结构400的剖视图。
参照图4a至图4c,本公开的第四实施例的管状结构400具有外管402且管内可分为上部及下部。上部包括试剂容置区410、上层预封储油区460、上层液珠容置区470、第一微管道415、油区连接孔道425以及液珠区连接孔道区435。下部包括下层预封储油区440、下层液珠容置区450、第二微管道445以及中隔板404。试剂容置区410设置于上部中间处且沿着管身长度方向延伸。第一微管道415设置于试剂容置区410下方。第一微管道415具有连接至试剂容置区410的第一端以及与第一端相对且连接至第二微管道445上方的第二端,而使试剂容置区410与第二微管道445彼此连通。上层预封储油区460与上层液珠容置区470分别位于试剂容置区410的相对两侧且沿着管身长度方向延伸。如图4b所示,从管状结构400的上方观察时,上层预封储油区460与上层液珠容置区470可具有圆弧形状或半月形状。因此相较于第二实施例的管状结构200或第三实施例的管状结构300的管状注油管道可填充更多的油剂。上层预封储油区460通过油区连接孔道425与下方的下层预封储油区440相连通。上层液珠容置区470通过液珠区连接孔道435与下方的下层液珠容置区450相连通。下层预封储油区440与下层液珠容置区450由中隔板404隔开。中隔板404上方具有第二微管道445。中隔板404可为透明的,且从第二微管道445下方沿着管身长度方向延伸至管状结构400的底部处。第二微管道445位于下层预封储油区440与下层液珠容置区450的顶面处,且沿着垂直于管身长度方向的径向延伸。也就是说,第二微管道445、下层预封储油区440与下层液珠容置区450的上表面可实质上共面。第二微管道445具有连接至下层预封储油区440的第三端以及与第三端相对且连接至下层液珠容置区450的第四端,且第一微管道415的第二端垂直连接至第二微管道445的介于所述第三端与所述第四端的中段处。
在本公开的实施例中,第一微管道415的内径可例如为0.05至0.5mm,第二微管道445的内径可例如为0.1至1mm。此外,第一微管道415的内径可小于第二微管道445的内径,因此所形成的液珠可完整地被油膜包覆。
管状结构400与管状结构300的结构类似,不同之处在于管状结构400还包括上层液珠容置区470以及上层预封储油区460。因此使用管状结构400产生液珠时,油剂已预先封填在预封储油结构中,可直接将试剂液填充于试剂容置区410,利用注射泵压缩空气,同时带动试剂容置区的试剂液与预封储油结构内的油剂,而无需由外部注入油剂。另外,所产生的液珠可分别储存在上层液珠容置区470与下层液珠容置区450中。
图5a是本公开的第五实施例的管状结构的立体透视图。图5b是本公开的第五实施例的管状结构500的剖视图。图5c是说明使用本公开的第五实施例的管状结构500产生液珠的方法的示意图,图5c对应于图5b的虚线方框部分。
参照图5a至图5c,本公开的第五实施例的管状结构500具有外管502且管内可分为上部及下部。上部包括上层试剂容置区510、注油管道520、排气管道530、注油孔512、排气孔514、油区连接孔道525以及液珠区连接孔道535。下部包括储油区540、液珠容置区550、下层试剂容置区580、第一微管道515以及第二微管道545。上层试剂容置区510与下层试剂容置区580分别设置于上部中间处与下部中间处且沿着管身长度方向延伸。上层试剂容置区510与下层试剂容置区580彼此连通。上层试剂容置区510的内径可大于下层试剂容置区580的内径。注油管道520与排气管道530分别位于上层试剂容置区510的相对两侧且沿着管身长度方向延伸。注油管道520上方具有注油孔512。注油管道520通过油区连接孔道525与下方的储油区540相连通。排气管道530上方具有排气孔514。排气管道530通过液珠区连接孔道535与下方的液珠容置区550相连通。储油区540与液珠容置区550设置于下层试剂容置区580的相对两侧。第一微管道515设置于下层试剂容置区580下方以及储油区540与液珠容置区550之间,且沿管身方向沿伸至管状结构内部的底部处而与第二微管道545连接。第一微管道515具有连接至下层试剂容置区580下方的第一端以及与第一端相对且连接至第二微管道545上方的第二端,而使下层试剂容置区580与第二微管道545彼此连通。第二微管道545位于管状结构的内部的底部处且沿着垂直于管身长度方向的径向延伸。第二微管道545可具有连接至储油区540的第三端以及连接至液珠容置区550的第四端,且第一微管道515的第二端垂直连接至第二微管道545的介于所述第三端与所述第四端的中段处。
管状结构500的底部可为光滑平坦表面使得管状结构500下方的检测模块可通过管状结构500的底部直接观察第二微管道545中的液珠。
在本公开的实施例中,第一微管道515的内径可例如为0.05至0.5mm,第二微管道545的内径可例如为0.1至1mm。此外,第一微管道515的内径可小于第二微管道545的内径,因此所形成的液珠可完整地被油膜包覆。
使用管状结构500产生液珠的方法与使用管状结构300产生液珠的方法类似,不同之处在于第一微管道515与第二微管道545设置于接近底部平面,方便液珠形成后的直接检测,便于即时调整流体驱动流速等参数。液珠产生后,流进液珠容置区550,在第二微管道545的下方可配置光学检测系统,可通过光学检测系统的即时检测来判断是否有液珠通过第二微管道545,以便即时进行压力驱动系统的调控。液珠产生完毕后,可接着对管状结构500进行温度控制循环,使在液珠内的检体进行聚合酶连锁反应,以扩增液珠内的检体。举例而言,可使用具有加热功能的载台对管状结构500进行温度控制循环,但本公开不限于此。聚合酶连锁反应结束后,可再通过压力驱动系统推动液珠使液珠从液珠容置区550通过第二微管道545而到达储油区540。因此,可再次通过光学检测系统对通过第二微管道545的液珠进行光学信号检测。
也就是说,ddpcr的液珠产生、聚合酶连锁反应到液珠检测等步骤都可于本公开的第五实施例的管状结构500中进行而无需更换耗材,因此可简化ddpcr的程序并降低成本。
图6a是本公开的第六实施例的管状结构的立体透视图。图6b是本公开的第六实施例的管状结构600的俯视图。图6c是本公开的第六实施例的管状结构600的剖视图。
参照图6a至图6c,本公开的第六实施例的管状结构600具有外管602且管内可分为上部及下部。上部包括上层试剂容置区610、上层预封储油区660、上层液珠容置区670、注油孔612、排气孔614、油区连接孔道625以及液珠区连接孔道区635。下部包括下层预封储油区640、下层液珠容置区650、下层试剂容置区680、第一微管道615、以及第二微管道645。上层试剂容置区610与下层试剂容置区680分别设置于上部中间处与下部中间处且沿着管身长度方向延伸。上层试剂容置区610与下层试剂容置区680彼此连通。上层试剂容置区610的内径可大于下层试剂容置区680的内径。上层预封储油区660与上层液珠容置区670分别位于上层试剂容置区610的相对两侧且沿着管身长度方向延伸。从管状结构600的上方观察时,上层预封储油区660与上层液珠容置区670可具有圆弧形状或半月形状。上层预封储油区660上方具有注油孔612。上层预封储油区660下方通过油区连接孔道625与下方的下层预封储油区640相连通。上层液珠容置区670具有排气孔614。上层液珠容置区670下方通过液珠区连接孔道635与下方的下层液珠容置区650相连通。下层预封储油区640与下层液珠容置区650设置于下层试剂容置区680的相对两侧。第一微管道615设置于下层试剂容置区680下方以及下层预封储油区640与下层液珠容置区650之间,且沿管身方向沿伸至管状结构内部的底部处而与第二微管道645连接。第一微管道615具有连接至下层试剂容置区680下方的第一端以及与第一端相对且连接至第二微管道645上方的第二端,而使下层试剂容置区680与第二微管道645彼此连通。第二微管道645位于管状结构的内部的底部处且沿着垂直于管身长度方向的径向延伸。第二微管道645具有连接至下层液珠容置区650的第三端以及与第三端相对且连接至下层预封储油区640的第四端,且第一微管道615的第二端垂直连接至第二微管道645的介于所述第三端与所述第四端的中段处。。
管状结构600的底部可为光滑平坦表面使得管状结构600下方的检测模块可通过管状结构600的底部直接观察第二微管道645中的液珠。
在本公开的实施例中,第一微管道615的内径可例如为0.05至0.5mm,第二微管道645的内径可例如为0.1至1mm。此外,第一微管道615的内径可小于第二微管道645的内径,因此所形成的液珠可完整地被油膜包覆。
使用管状结构600产生液珠的方法与使用管状结构400产生液珠的方法类似,不同之处在于第一微管道615与第二微管道645设置于接近底部平面,方便液珠形成后的直接检测,便于即时调整流体驱动流速等参数。液珠产生后,流进下层液珠容置区650,在第二微管道645的下方可配置光学检测系统,可通过光学检测系统的即时检测来判断是否有液珠通过第二微管道645,以便即时进行压力驱动系统的调控。液珠产生完毕后,可接着对管状结构600进行温度控制循环,使在液珠内的检体进行聚合酶连锁反应,以扩增液珠内的检体。举例而言,可使用具有加热功能的载台对管状结构600进行温度控制循环,但本公开不限于此。聚合酶连锁反应结束后,可再通过压力驱动系统推动液珠使液珠从下层液珠容置区650通过第二微管道645而到达下层预封储油区640。因此,可再次通过光学检测系统对通过第二微管道645的液珠进行光学信号检测。
也就是说,ddpcr的液珠产生、聚合酶连锁反应到液珠检测等步骤都可于本公开的第六实施例的管状结构600中进行而无需更换耗材,因此可简化ddpcr的程序并降低成本。
参照图4a、图5a及图6a,根据本公开的实施例的管状结构还可包括可对合于管状结构顶部的外盖,以避免交叉污染,防止溢漏,且便于储存运送。适用于本公开的外盖并无特别限制且可具有各种形式。附图中的外盖仅为举例说明,根据本公开的实施例的管状结构的外盖不以此为限。
根据本公开的实施例的管状结构可由高分子聚合材料形成。举例而言,高分子聚合材料可为丙烯腈-丁二烯-苯乙烯(acrylonitrile-butadiene-styrene,abs)共聚物、丙烯腈-苯乙烯树脂(acrylonitrile-styreneresin,as)、块状模料(bulkmoldingcompound,bmc)、醋酸纤维素(celluloseacetate,ca)、硝化纤维素(cellulosenitrate,cn)、环烯烃共聚物(cyclo-olefincopolymer,coc)、环烯烃聚合物(cyclo-olefinpolymer,cop)、乙基纤维素(ethylcellulose,ec)、环氧树脂(epoxyresin,ep)、乙烯/乙酸乙烯酯共聚物(ethylenevinylacetatecopolymer,eva)、全氟(乙烯-丙烯)塑胶(perfluoro(ethylene-propylene),fep)、纤维强化塑胶(fiberreinforcedplastics,frp)、三聚氰胺甲醛树脂(melamineformaldehyderesin,mf)、聚甲基丙烯酸甲酯(polymethylmethacrylate,pmma)、聚酰胺(polyamide,pa)、聚芳酯(polyarylate,par)、聚丁烯(polybutene,pb)、聚(对酞酸丁二酯)(poly(butyleneterephthalate),pbt)、聚碳酸酯(polycarbonate,pc)、聚二甲基硅氧烷(polydimethylsiloxane,pdms)、低密度聚乙烯(lowdensitypolyethylene,ldpe)、高密度聚乙烯(highdensitypolyethylene,hdpe)、聚乙烯(pe)、聚(醚/醚/酮)(poly(ether-ether-ketone),peek)、聚对苯二甲酸乙二酯(pet)、聚醚砜(poly(ethersulfone),pes)、酚醛树脂(phenol-formaldehyderesin,pf)、聚甲醛(polyoxymethylene,pom)、聚丙烯(polypropylene,pp)、聚氧二甲苯(polyphenyleneoxide,ppo)、聚对苯硫醚(poly(p-phenylenesulfide),pps)、耐冲击聚苯乙烯(highimpactpolystyrene,hips)、聚苯乙烯(polystyrene,ps)、聚砜(polysulphone,psf)、聚四氟乙烯(poly(tetrafluoroethylene),ptfe)、聚胺甲酸酯(polyurethane,pu)、聚乙烯醇(polyvinylalcohol,pva)、聚(乙酸乙烯酯)(poly(vinylacetate),pvac)、聚(乙烯醇缩丁醛)(poly(vinylbutyral),pvb)、聚氯乙烯(pvc)、聚氯乙烯醋酸乙烯酯(polyvinylchlorideacetate,pvca)、聚偏二氯乙烯(polyvinylidenechloride,pvdc)、聚乙烯甲醛(polyvinylformal,pvfm)、饱和聚酯(saturatedpolyester,sp)、尿素甲醛树脂(ureaformaldehyderesin,uf)、不饱和聚酯(unsaturatedpolyester,up)或其任意的组合,但本公开不以此为限。所形成的管状结构可为透明的。
根据本公开的实施例的管状结构可通过例如吹塑成形、挤出成形、压力成形及射出成形等通用模制方法来获得。根据本公开的实施例的管状结构可通过分别制造个别组件并将各组件接合而制造。举例来说,可分别制造管状结构的上部组件、下部组件及外盖后,再将其接合。各组件的接合方式并没有特别限制。举例而言,接合方式可为热熔接合、超音波接合、uv硬化法、化学键接合、胶粘接合法、榫接合等,但本公开不以此为限。
在本公开的实施例中,在管状结构上方可配置液体驱动模块作为动力源以通过空气推动管状结构内的试剂液与油剂通过微管道而在第二微管道或液珠容置区内使所述油剂包覆所述试剂液而形成油包覆试剂的液珠。举例而言,所述液体驱动模块可包括例如注射泵(syringepump)、蠕动泵(peristalticpump)等动力源以推动空气而推动管状结构内的试剂液与油剂而形成液珠。在另一实施例中,可对管状结构进行加热以通过管状结构内部的空气驱动试剂液与油剂。举例来说,本公开的液珠产生方法可包括使用热源驱动空气,同时加热试剂容置区与注油管道,内部空气同时驱动试剂液与所述油剂,而在第二微管道内使所述油剂包覆所述试剂液而形成油包覆试剂的液珠。
在本公开的实施例中,于管状结构下方可配置有检测模块以即时检测管状结构中的液珠。具体而言,检测模块可通过管状结构的平面透明底部直接观察于第二微管道中的液珠。举例来说,可使用电磁场方式或光学方式检测液珠。电磁场方式检测包括通过磁场、电场、电磁波,检测液珠的电磁场信号强度。光学方式检测包括通过冷光、吸收光、荧光等方式检测液珠的信号强度。具体而言,检测模块例如可为光学显微镜或光谱分析仪,但不限于此。检测模块可在液珠产生时即时检测液珠产生的状态,以调整液体驱动模块的参数。对于需要pcr放大的检体,也可于pcr反应后,通过液体驱动模块而使液珠从液珠区通过第二微管道而进行即时检测。或者,对于不需要进行pcr放大的稀释检体,做定量式的浓度判读。
举例而言,当要检测食物检体或环境检体中的微量农药分子时,可使用拉曼光谱检测液珠的拉曼散射,以定量液珠内微量的农药分子,以确定农药残留量。当要检测食物检体或环境检体中的微量金属时,可在检体中加入呈色剂而与检体中的金属反应生成有颜色的物质。接着利用本公开的管状结构产生液珠。以光度计测量液珠的吸收光强度以定量液珠内微量金属的浓度,以确定重金属的含量。
在本公开的实施例中,置放管状结构的载台可具有温度控制功能。所述载台可用于在液珠产生期间加热管状结构中的加热试剂容置区与注油管道以驱动试剂液与油剂或是当液珠于管状结构中产生后,可通过载台直接对管状结构进行温度控制以使管状结构内的液珠进行pcr反应而扩增。
在以下实例中将更详细地阐述本公开。然而,提供以下实例仅是为了说明本公开,且因此本公开并非仅限于以下实例。
实例1:中置型微管道预封油槽管状结构
以射出成型制作本公开的第四实施例的中置型微管道预封油槽管状结构。材料为聚丙烯,成品分为上、中、下三件,管状结构外径为6mm,中间以超音波焊接接合此三组件,使之成为一体。参照图4a,实例1的管状结构具有外盖。外盖为密封盖,具有可弯折结构,结构上方分别具有试剂孔密封套、注油孔与排气孔的密封套,可在封盖时将试剂容置区、注油管道与排气管道密封,防止检测过程的污染。上层管状结构内含试剂容置区、第一微管道、上层预封储油区与上层液珠容置区。下层管状结构包括下层预封储油区、第二微管道、中隔板及下层液珠容置区。
图7a及图7b分别为实例1的管状结构的上部的下表面及下部的上表面的电子显微镜照片。参照图7a,实例1的管状结构的上部有中间隔板分隔上层预封储油区与上层液珠容置区,在中间隔板上方有一直径为0.1mm的通孔(即第一微管道),连通试剂容置区,管壁断面上方具有超音波焊接结构,用以接合管状结构的下部,在管壁断面上有凸出的定位销,便于做超音波接合前的定位;参照图7b,管状结构的下部具有中隔板分隔下层预封储油区与下层液珠容置区,在中间隔板上有一宽度为0.2mm的横向微流道(即第二微管道),作为连接下层预封储油区与下层液珠容置区的通道,在管壁断面上有对应于管状结构上部位置,用以超音波接合的凹陷的定位孔。
实例2:下置型微管道预封油槽管状结构
实例2以射出成型制作本公开的第六实施例的下置型微管道预封油槽管状结构。材料为聚丙烯,成品分为多件拆接分别制作,再将各分件上、下层连接成整体,使之成为一体的管状结构。
图8a、图8b、图8c及图8d分别为实例2的管状结构的上部的下表面、中部上表面、中部下表面及下部的上表面的电子显微镜照片。参照图8a,管状结构的上部中间处具有上层试剂容置区分隔上层预封储油区与上层液珠容置区,在上层试剂容置区周围、管壁断面周围与中间隔板断面上方具有超音波焊接结构,用以接合管状结构的中部,在管壁断面上有凸出的定位销,便于做超音波结合前的定位;参照图8b,管状结构的中部中间处具有下层试剂容置区分隔下层预封储油区与下层液珠容置区,在管壁断面上有对应于管状结构上部下表面的位置,有用以超音波接合的凹陷定位孔;参照图8c,管状结构的中部下表面具有中间隔板分隔下层预封储油区与下层液珠容置区,隔板上方设计一直径为0.1mm的通孔,连通上层试剂容置区,在管壁断面周围与中间隔板断面上方具有超音波焊接结构,用以接合管状结构的下部,在管壁断面上有凸出的定位销,便于做超音波结合前的定位;参照图8d,管状结构的下部具有中间隔板分隔下层预封储油区与下层液珠容置区,在中间隔板上有一宽度为0.2mm的横向微流道,作为下层预封储油区与下层液珠容置区的通道,在管壁断面上有对应于管状结构中部下表面位置,用以超音波接合的凹陷的定位孔。
以下说明使用本公开的管状结构进行液珠式数字聚合酶连锁反应(ddpcr)的实验实例。
实例3:实验设备的设置
图9为本公开的液珠式数字聚合酶连锁反应装置的示意图。参照图9,本公开的液珠式数字聚合酶连锁反应装置包括液体驱动模块1、卡匣模块2与检测模块3。卡匣模块2包含本公开的管状结构与置放管状结构的载台。液体驱动模块1包括注射管、马达、可动组件、固定机构与位置感测元件。本公开的管状结构置放于载台内部,由加热板控制载台的温度上升、下降。本公开的管状结构下方具有透光视窗,可经由设置在载台下方的检测模块3进行检测。检测模块3可包括例如光学ccd,记录管内液珠产生的结果,或者也可包括光电倍增管(pmt),接收液珠的光学信号,并由控制器记录与分析。
实例4:试剂液的制备
本公开的实例中所使用的试剂液分别按照表1所示的试剂成分、浓度与体积进行制备。
表1
实验实例
实验实例a:液珠产生测试
根据表2的参数及试剂使用与实例1相同的方法制造具有不同微管道尺寸的管状结构,并使用不同的流速同时推动试剂液与油剂(dropletgenerationoilforprobes;购自bio-rad)。收集并以光学显微镜观察所产生的液珠。
表2
图10a及图10b分别为实验实例a-1的液珠在油膜干燥前后的光学显微镜影像。图11a及图11b分别为实验实例a-2的液珠在油膜干燥前后的光学显微镜影像。图12为实验实例a-3的液珠在油膜干燥前的光学显微镜影像。图13为实验实例a-4的液珠在油膜干燥前的光学显微镜影像。
在图10a中可观察到纯水在油液中漂浮。在图10b中可观察到微液珠产生合并的状态。比较实验实例a-1及a-2,可明显观察到在相同操作条件下,当微管道尺寸减小时,可得到较小的液珠。比较实验实例a-3及a-4,可明显观察到流速愈慢,得到较小的液珠;流速愈快,得到较大的液珠。此外,使用本公开的管状结构可产生尺寸均匀的液珠。
实验实例b:载台模块的设置
载台模块可用于置放本公开的管状结构并对管状结构中的液珠区进行温度控制以执行聚合酶连锁反应。以下将通过实例更详细地阐述适用于本公开的管状结构的载台模块。然而,适用于本公开的管状结构的载台模块不以此为限。
实验实例b-1:t型加热载台模块的设置
图14为实验实例b-1的t型加热载台模块的立体示意图。
参照图14,实验实例b-1的t型加热载台模块具有可同时置放多个管状卡匣的t型加热载台1000,材料为铝合金。其中,加热载台1000下方有绝热板1100,避免热源导入机台内,加热载台1000的侧边有致冷芯片1200,提供加热、冷却循环所需的温度控制器,致冷芯片1200放置于散热铜板1300上,散热铜板1300内部具有散热功能的鳍片设计,散热铜板1300的一侧连接散热风扇1400,散热风扇可将致冷芯片1300产生的热源导出。
实验实例b-2:单平面型薄壳板加热载台模块的设置
图15为实验实例b-2的单平面型薄壳板加热载台模块的立体示意图。
参照图15,实验实例b-2的单平面型薄壳板加热载台模块具有可同时置放多个管状卡匣的单平面型薄壳板加热载台2000,材料为铝合金,表面做阳极处理。其中,薄壳板加热载台2000的结构实体厚度减少,以降低温控循环过程金属的热损失,加热载台2000下方可具有绝热板(未绘示),避免热源导入机台内;加热载台2000的一侧平面与致冷芯片2200相接,致冷芯片2200提供加热、冷却循环所需的温度控制器,致冷芯片2200放置于散热铜板2300上,散热铜板2300内部具有散热功能的鳍片设计,散热铜板的一侧连接散热风扇2400,散热风扇2400可将致冷芯片2200产生的热源导出。
实验实例b-3:单平面套管型加热载台模块的设置
图16为实验实例b-3的单平面套管型加热载台模块的立体示意图。
参照图16,实验实例b-3的单平面套管型加热载台模块具有可同时置放多个管状卡匣的单平面套管型加热载台3000,材料为铝合金,表面做阳极处理。其中,管状卡匣紧紧置入套管型加热载台3000内部,各管间以空气隔绝,形成各自独立的结构,金属材料部分做极简化,可以降低温控循环过程金属的热损失。套管型加热载台3000下方承板3100为另一绝热材料,避免热源导入机台内;加热载台3000的一侧平面与致冷芯片3200相接,致冷芯片3200提供加热、冷却循环所需的温度控制器,致冷芯片3200放置于散热铜板3300上,并在与铜板3300接触的平面上涂布导热膏,增加导热效果,散热铜板3300内部具有散热功能的鳍片设计,散热铜板3300的一侧连接散热风扇3400,散热风扇3400可将致冷芯片3200产生的热源导出。
实验实例b-4:多管单侧平边型加热载台模块的设置
图17为实验实例b-4的多管单侧平边型加热载台模块的立体示意图。
参照图17,实验实例b-4的多管单侧平边型加热载台模块具有可同时置放多个管状卡匣的多管单侧平边型加热载台4000,材料为铝合金。其中,多管单侧平边型加热载台4000的侧边为一平面,与致冷芯片4200贴合,提供加热、冷却循环所需的温度控制器,加热载台4000各管中间有间隙,用以隔绝不同管间的热传效应,维持各管间一致的均温状态。致冷芯片4200放置于散热铜板4300上,散热铜板4300内部具有散热功能的鳍片设计,散热铜板4300的一侧连接散热风扇4400,散热风扇4400可将致冷芯片4200产生的热源导出。
实验实例c:温度循环测试
实验实例c分别以实验实例b-1、实验实例b-2、实验实例b-3以及实验实例b-4的加热载台模块进行温度循环测试以比较不同加热载台模块的温度控制效果。
实验实例c-1:测试实验实例b-1的t型加热载台模块的温度控制效果
在载台内部分别置入一般商用pcr管(购自axygen;型号:pcr-02-c)与实例1的管状结构。pcr管内装有200μl的油(casno.8042-47-5;购自tedia)。在实例1的管状结构中间与外侧分别装入30μl的油。pcr管于实例1的管状结构的管内各槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度,比较在同样温控条件下,各感测点温度随时间的变化曲线。
图18为实验实例c-1的温度变化曲线图。循环温度控制设定在98℃与58℃之间。其中,pcr管内温度反应最慢,因管内的液体体积最多,升温与降温的反应速率比较慢,提供的热源无法到达设定的温度范围;在实例1的管状结构内,由于油液体积较少,其管内油的升降温度变化速率明显高于pcr的管内温度的测量结果,其中,以靠近加热源的位置,有更佳的升降温反应速率。
t型加热载台设计具有可双面加热的优点,但金属体积较大而降低了加热与冷却的反应速率。以管状结构侧边槽内温度变化为例,从30℃升温到80℃的时间需要59秒,升温速率约为0.85℃/sec;从90℃降温到60℃的时间则需要28秒,降温速率约为1.1℃/sec。
实验实例c-2:测试实验实例b-2的单平面型薄壳板加热载台模块的温度控制效果
以实验实例b-2的单平面型薄壳板加热载台模块做温度循环测试。在载台内部置入3个实例1的管状结构,在实例1的管状结构内侧与外侧分别装入30μl的油(casno.8042-47-5;购自tedia),并在管内各槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度,比较在同样循环温控条件,各感测点温度随时间的变化曲线。
图19为实验实例c-2的温度变化曲线图。循环温度控制点分别设定为93℃、57℃与71.5℃,回馈控制的温度传感器置于加热载台外侧孔内,温度传感器分别测量管状结构内侧与外侧槽内油的温度,由于管状结构内侧紧邻加热源,其管内油的升降温度变化速率明显高于管状结构外侧温度的测量结果。
实验实例b-2的单平面型薄壳板加热载台,由于减少载台的金属体积,在使用相同温控设备情况下,大幅提升了加热与冷却的反应速率。以管状结构内侧边槽内温度变化为例,从30℃升温到80℃的时间仅需24秒,升温速率约为2.1℃/sec;从90℃降温到60℃的时间则仅需要21秒,降温速率约为1.4℃/sec。实验实例b-2的单平面型薄壳板加热载台可更有效率地对本公开的管状结构进行温度控制。
实验实例c-3:测试实验实例b-3的单平面套管型加热载台模块的温度控制效果
以实验实例b-3的单平面套管型加热载台做温度循环测试,在载台内部中间置入单一个实例1的管状结构,在实例1的管状结构内侧、中间与外侧分别装入30μl的油(casno.8042-47-5;购自tedia),并在管内各槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度。
循环温度控制点分别设定为93℃、57℃与71.5℃,回馈控制的温度传感器置于加热载台中间孔内,温度传感器分别测量管状结构内侧、中间与外侧槽内油的温度,比较在同样循环各感测点温度随时间的变化曲线。
图20为实验实例c-3的温度变化曲线图。其中,内侧槽内从30℃升温到80℃的时间需要26秒,升温速率约为1.92℃/sec;从90℃降温到60℃的时间则需要17秒,降温速率约为1.76℃/sec。实验实例b-3的单平面套管型加热载台对内侧槽内温度变化速率达到与实验实例b-2的单平面型薄壳板加热载台相同的水准。此外,对于外侧槽内温度也有显着的提升效果,且各槽的升降温速率较为一致,与温度设定值的差距减小,尤其适合作为温控循环的加热载台。
实验实例c-4:实验实例b-4的多管单侧平边型加热载台模块的温度循环测试
以实验实例b-4的多管单侧平边型加热载台做温度循环测试。在载台外部包覆绝热材料,在载台内部置入3个pcr管(购自axygen;型号:pcr-02-c),并在pcr管内装入20μl的矿物油(casno.8042-47-5;购自tedia)与10μl的试剂液b。在各管内槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度。
图21为实验实例c-4的温度变化曲线图。循环温度控制设定在95℃与62.5℃之间,温度测量结果显示,pcr各管内的循环温度变化曲线趋于一致,到达温度稳定平衡区域,各管间的温度误差量<0.5℃。比较循环温度控制的设定曲线与pcr管内温度的温度测量值,pcr管内温度反应较慢,因热量由加热板传递至加热载台,再由加热载台传递至管内,升温与降温的反应速率比较慢,到达稳定温度所需要时间较长。
实验实例c-5:比较商用pcr管与本公开的管状结构的循环温度控制效果
实验实例c-5比较商用pcr管与根据本公开的管状结构的循环温度控制效果。在2个实验实例b-4的多管单侧平边型加热载台内部分别置入3个商用pcr管(购自axygen;型号:pcr-02-c)与3个实例1的管状结构。商用pcr管与根据本公开的管状结构内各装有20μl的矿物油(casno.8042-47-5;购自tedia)与10μl的试剂液b。在中间管的内槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度,比较在同样温控条件,各感测点温度随时间的变化曲线。
图22为实验实例c-5的温度变化曲线图。实验循环温度结果显示,实例1的管状结构中的边槽的液体具有更快的升温与降温速率。由于实例1的管状结构中的边槽内的液体分布的空间为薄壁半环形状,相较于一般商用pcr管内液体在底部的球状分布,更有利于循环温度升降时的反应速率。
实验实例c-6:比较不同散热板材料对pcr循环温度的影响
实验实例c-6比较不同散热板材料对pcr循环温度的影响。散热板的功能是将致冷芯片所产生的热量导出分布于散热板上,再由风扇排放于空气中。也就是说,致冷芯片的一侧为加热载台,而另一侧为散热板。在固定其他实验条件状态下,分别以黄铜与铝合金制作散热板。以实验实例b-4的多管单侧平边型加热载台做温度循环测试。加热载台内部放置商用pcr管,并在商用pcr管内装入20μl的矿物油(casno.8042-47-5;购自tedia)与10μl的试剂液b。在各管内槽插入白金温度传感器,由记忆式四视窗温度计(tm-947sd)记录各感测位置的温度,比较在同样温控条件,各感测点温度随时间的变化曲线。
图23为实验实例c-6的温度变化曲线图。实验结果显示散热板材质对管内液体温度的升降温速率并无显着影响。因此虽然纯铜的热传导能力高于纯铝,但铜合金具有单位体积重量较大的缺点,而铝合金具有便宜、密度低、容易加工成型等优点,并广泛使用在cpu散热器产品上。在散热性能无显着差别的状态下,使用铝合金制作散热板具有更高的经济效益。
实验实例d:聚合酶连锁反应(pcr)
实验实例d-1:比对使用本公开的实验设备与商业pcr仪器进行聚合酶连锁反应的结果
实验实例d-1使用本公开实例1的管状结构与实验实例b-3的单平面套管型加热载台模块进行聚合酶连锁反应测试,并将测试结果与使用商业聚合酶连锁反应仪器进行聚合酶连锁反应测试的结果进行比对。本实验实例采用恒温环状扩增法(loopmediatedisothermalamplification(lamp))进行测试。商业pcr仪器为多重荧光基因定量光谱分析仪(appliedbiosystemsinc.,7500,realtimepcr)。聚合酶连锁反应结束后,利用琼脂胶体电泳(agarosegelelectrophoresis)检测聚合酶连锁反应的结果,以平行比对使用本公开的实验设备与商业pcr仪器的实验结果进行聚合酶连锁反应的结果。
首先,将20μl的试剂液c与20μl的油(casno.8042-47-5;购自tedia)分别加入实例1的管状结构的试剂容置区与油槽。使用实验实例b-3的单平面套管型加热载台模块对管状结构分别进行恒温66.5℃及65℃持温90分钟的恒温pcr实验测试。另外,使用多重荧光基因定量光谱分析仪以相同试剂在65℃的操作温度下进行pcr放大。接着,以琼脂胶体电泳判读λdna放大的信号。
图24为使用abi7500与本公开的实验设备进行聚合酶连锁反应后以琼脂胶体电泳判读λdna放大的信号的照片。如图24的左边部分所示,使用abi7500仪器平台所产生dna的放大结果,positive信号亮度高与negative信号有显着的差异。中间为dnaladder,有不同长度片段的dna,作为dna分子量分析的参考。图24右边则是使用本公开的单平面套管型加热载台进行恒温pcr后的结果。结果显示当恒温温度为66.5℃时,positive与negative都无信号放大结果。当恒温温度为65℃时,positive与negative都可产生正确的结果。从本实验实例结果可以观察到,使用本公开的管状结构与加热载台在适当的反应条件下,确实可有效地进行聚合酶连锁反应并得到正确的结果。
实验实例d-2:商用pcr管材的pcr测试
实验实例d-2在配备有温度控制装置的实验实例b-4的多管单侧平边型加热载台中置入3个商用pcr管(购自axygen;型号:pcr-02-c)进行pcr实验。pcr实验完成后,利用琼脂胶体电泳(agarosegelelectrophoresis)进行dna放大后的平行比对。
首先,将10μl的pcr试剂液b与20μl的油(casno.8042-47-5;购自tedia)加入商用pcr管中,并于封盖后进行循环温度测试。在实验实例b-4的多管单侧平边型加热载台模块内,先升温在95℃持温10分钟后,再进行双温层多次热循环实验,进行dna放大实验测试。实验固定参数高温温度为95℃与低温温度62.5℃,操作控制参数分别为高温持温时间、低温持温时间与热循环次数。进行dna放大的控制参数测试。结果显示于图25及表3中。
图25为实验实例d-2的pcr实验的琼脂胶体电泳实验结果的照片。图25的最左栏为dnaladder,有不同长度片段的dna,作为dna分子量分析的参考。图25的第2-4栏为同一热循环操作条件在不同管件产生的dna放大信号结果,各管的positive信号都为正确,结果显示,经过热循环的实验流程,dna在正确的位置被放大,且各管间的重复性良好。图25的第5-7栏缩短高温持温时间为10秒,固定其他实验条件,琼脂胶体电泳结果显示,dna放大信号强度增加,且各管间也维持高强度的放大信号。图25的第8-10栏则维持第一次的实验条件,增加热循环的次数,并置放negative样本作比对,琼脂胶体电泳结果显示,dna放大信号强度都比第一次的操作条件增加,positive与negative都可产生正确的结果。
实验结果显示使用配备有温度控制装置的实验实例b-4的多管单侧平边型加热载台,使用商用pcr管件做dna放大测试,在可控制的操作条件下,可以达成dna信号放大的结果。
表3
实验实例d-3:使用实例1的管状结构进行pcr测试
实验实例d-3在配备有温度控制装置的实验实例b-4的多管单侧平边型加热载台中置入3个实例1的管状结构进行pcr实验。同时,使用96孔pcr热循环仪(appliedbiosystemsinc.,veriti)进行试剂验证测试,再利用琼脂胶体电泳(agarosegelelectrophoresis)进行dna放大后的平行比对。
首先,将20μl的pcr试剂液b与20μl的油(casno.8042-47-5;购自tedia)加入实例1的管状结构内侧槽,并于封盖后进行循环温度测试。在实验实例b-4的多管单侧平边型加热载台模块内,进行高温95℃与低温62.5℃两个设定温度间的温度循环35次的测试。另外,使用商用的96孔pcr热循环仪(appliedbiosystemsinc.,veriti)进行验证测试,以相同试剂进行平行比对。结果显示于图26及表4中。
表4
本实验以琼脂胶体电泳判读dna放大的信号,图26为实验实例d-3的pcr实验的琼脂胶体电泳实验结果的照片。最左边为dnaladder,不同长度片段的dna,作为dna分子量分析的参考。从左边起算第2-5栏为使用abiveriti热循环仪平台所产生dna的放大结果,positive信号亮度高与negative信号有显着的差异。图25的第6-7栏则是使用实验实例b-4的多管单侧平边型加热载台配合根据本公开的实例1的管状结构进行pcr的结果。positive信号在相同位置产生高亮度信号,表示有dna放大的结果;negative则无dna放大信号,信号判别都正确。
实验实例d-4:不同条件下pcr测试结果的比较
实验实例d-4比较不同系统与不同管件在不同操作条件状态的pcr结果。实验实例d-4在配备有温度控制装置的实验实例b-4的多管单侧平边型加热载台中分别置入商用pcr管(购自axygen;型号:pcr-02-c)与实例1的管状结构进行pcr实验。同时,使用96孔pcr热循环仪(appliedbiosystemsinc.,veriti)进行试剂验证测试。
首先,在各管内装入20μl的矿物油(casno.8042-47-5;购自tedia)与10μl的试剂液b。接着根据表5的实验操作参数进行pcr实验。pcr实验完成后,再利用琼脂胶体电泳(agarosegelelectrophoresis)进行dna放大后的平行比对。实验实例d-4的操作条件与琼脂胶体电泳结果如图27与表5所示。
表5
图27为实验实例d-4的pcr实验的琼脂胶体电泳实验结
果的照片。图27最左栏为dnaladder,具有不同长度片段的dna,作为dna分子量分析的参考。从左边起算第2-3栏为使用abiveriti热循环仪平台所产生dna的放大结果,positive信号亮度高与negative信号有显着的差异。从左边起算第4-5栏为使用根据本公开的加热载台与管状结构所产生的dna放大结果。使用实例1的管状结构与实验实例b-4的多管单侧平边型加热载台所产生的positive信号清楚。接着,从左边起算第6-14栏为使用实验实例b-4的多管单侧平边型加热载台与商用pcr管(购自axygen;型号:pcr-02-c),在不同热循环操作条件下,所产生dna的放大结果。其中,第6-8栏为高温温度95℃、高温持温时间为10秒、低温温度62℃、低温持温时间40秒、热循环次数35次,各管都可产生正确的dna放大信号;第9-11栏变更低温温度为62.5℃并缩短低温持温时间为30秒,各管也可产生正确的dna放大信号;第12-14栏进一步缩短高温持温时间为0秒,并维持低温持温时间,dna放大的结果也可正确判读。
由此系列实验证明,以本公开的加热载台配合商用pcr管件与本公开的管状结构都可完成dna放大的结果。
综上所述,本公开提供一种可用于液珠式数字聚合酶连锁反应的管状结构以及使用所述管状结构产生液珠的方法。所述管状结构可用于产生液珠、聚合酶连锁反应及/或检测,可减少液珠式数字聚合酶连锁反应的耗材使用量、简化液珠式数字聚合酶连锁反应的流程,并降低液珠式数字聚合酶连锁反应的成本。
虽然结合以上实施例公开了本公开,然而其并非用以限定本公开,任何所属技术领域中具有通常知识者,在不脱离本公开的精神和范围内,可作些许的更动与润饰,故本公开的保护范围应当以附上的权利要求所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!