一种单细胞微流控检测芯片的制作方法
本实用新型属于分子生物学和微流控技术领域,具体涉及一种单细胞微流控检测芯片。
背景技术:
微流控技术又称芯片实验室,它可以将常规的生物化学反应集成到几平方厘米的芯片内。由于微流控芯片有着微米级的通道,与细胞的尺寸相当,所以在单细胞的研究中越来越受到关注。
最早用于单细胞研究的微流控芯片是“quake”芯片,该芯片集成有复杂的泵阀系统,可以对单细胞进行操控。之后随着液滴技术的发展,出现了drop-seq技术,该技术极大的提高了单细胞测序的通量。另外还有一些通过微结构进行单细胞捕获以分析的微流控芯片相继出现。
综上所述,在单细胞研究领域中,微流控芯片技术已经成为一种极具发展潜力的研究平台,通过微流控芯片的设计,可以实现对单细胞进行捕获、操控、分析等。但是,现有高通量单细胞测序中,大多基于微流控液滴技术,在产生大量液滴的过程中,有一定的几率在一个液滴中同时还有一个细胞和一个含有barcode捕获序列的微珠。由于在液滴形成过程中单细胞和单个微珠的包被都服从泊松分布,细胞的利用率极低(1%左右)。
技术实现要素:
本实用新型的目的在于提供一种对单细胞捕获、操控、分析方便,且效率高的单细胞微流控检测芯片。
本实用新型提供的单细胞微流控检测芯片,包含上层芯片和下层芯片,中间有一层可以溶解的壳聚糖薄膜,将上、下层芯片分隔;其中:
所述上、下层芯片中含有上下相互对应的流体通道结构;并且所述上、下层芯片中分别含有一个液体的入口,及一个液体出口,与所述的流体通道连通;
该微流控检测芯片的上、下层流体通道分别含有一个主通道,在所述主通道上具有许多个捕获腔室。
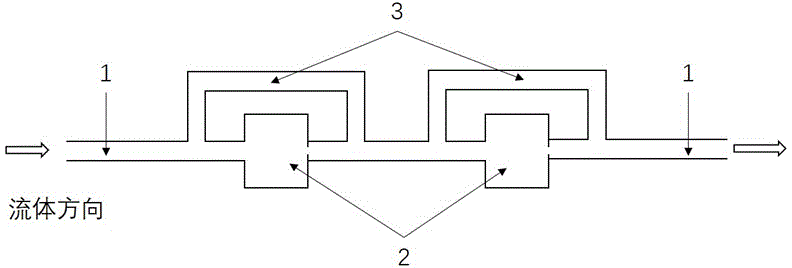
本实用新型中,该微流控检测芯片的上、下层的各个捕获腔室旁边还含有一个次通道,该次通道环绕捕获腔室,两端与所述主通道连通(参见图1)。
进一步地,所述微流控检测芯片上、下层主通道上含有200-1000个捕获腔室。
进一步地,所述微流控检测芯片上、下层主通道与次通道的高度为15-100微米,宽度为50-150微米;所述捕获腔室的入口宽度为50-150微米;所述捕获腔室的出口宽度为10-50微米。
本实用新型提供的上述微流控检测芯片的制备方法,包括上、下层芯片模板的制备,采用软光刻方法,具体步骤为:
(1)在硅片或玻璃基底表面旋涂15-50微米厚的su-8光刻胶,95℃前烘15-60分钟;
(2)将含有上层或下层通道结构的掩膜固定于含有光刻胶的基底表面,紫外曝光使su-8按照掩膜的结构聚合;
(3)95℃后烘10-30分钟,自然冷却后用乳酸乙酯除去未曝光的su-8胶,形成上层或下层通道结构模板;
(4)180℃坚膜1-2小时,冷却后形成芯片上层和下层结构模板;
(5)利用三甲基硅烷对芯片模板进行低粘附处理。
微流控检测芯片的制备的具体步骤为:
(1)分别利用上述制备的芯片上层和下层结构模板制备pdms芯片上、下层结构;
(2)将1-2wt%的壳聚糖旋涂在玻璃基底表面,置于热板上形成壳聚糖薄膜;
(3)将下层芯片结构蘸取约5-10微米厚的预聚合pdms,并置于壳聚糖薄膜上,再置于80℃烘箱中使pdms固化;
(4)将0.5-5%的naoh溶液注入到下层芯片通道内,并将含有壳聚糖薄膜的基底以及与壳聚糖薄膜结合在一起的下层芯片结构一起浸入0.5-5%naoh溶液中;
(5)48-72小时后,壳聚糖薄膜将与芯片下层的pdms从基底上分离,用去离子水洗去残留的naoh溶液,置于室温或烘箱中干燥;
(6)利用等离子处理后的上层芯片与下层芯片结构对准,封接在壳聚糖薄膜的另一侧,即形成所需的微流控检测芯片。
本实用新型提供的微流控检测芯片使用方法,具体步骤如下:
(1)分别将待测的细胞悬液与barcode微珠分别从芯片的上层和下层入口注入芯片内,根据芯片的设计,待每一个细胞或者微珠进入相应的捕获单元后会卡在该单元后面的狭小处,从而使该单元的流阻变大,后续的细胞或微珠会随着流体进入流阻较小的旁侧次通道,再进入下一个捕获单元,以此类推;
(2)待细胞和微珠都通过芯片后,再将油相从上、下层芯片的入口通入芯片中,以排除流体通道内的水相,同时存留在捕获单元的液体将形成独立的液滴;
(3)再将含有0.1-1wt%醋酸的油相从上、下层芯片的入口注入,使壳聚糖薄膜在醋酸的作用下溶解,使上、下层捕获单元内的液滴接触并发生融合,以形成细胞和微珠的一一对应;
(4)待所需反应完成后,用相应的缓冲液从芯片的出口反向通入,以洗出微珠;也可将芯片上下层揭开后收集微珠。
微珠收集后,按照所需的方法进行后续的反转录、pcr、建库、测序、分析等流程。
本实用新型的微流控检测芯片可以用于单细胞测序等研究。
本实用新型利用微流控芯片的微结构实现了单细胞与单微珠的捕获;芯片内含有可溶解的壳聚糖薄膜,在细胞和微珠的捕获过程中起到分离的作用,溶解后即完成mrna与微珠的结合;芯片的上下对齐的结构可以大大提高细胞与微珠的配对率,减少微珠的消耗,也大大提高单细胞测序的细胞利用效率;上下腔室的结构也可降低单细胞核酸之间的交叉污染;此外,在本芯片捕获结构内形成的液滴不含有表面活性剂,后续微珠收集的操作中可以减少破乳的步骤。
附图说明
图1为芯片通道结构图示。
图2为细胞或微珠捕获流程示意图。
图3为芯片内壳聚糖膜溶解使用示意图。
图中标号:1为主通道,2为捕获腔室,3为次通道。
具体实施方式
本实用新型利用微流控芯片技术,制备具有阵列结构的捕获腔室,同时利用可溶解的壳聚糖将上下芯片分隔。待利用芯片捕获单细胞和微珠后,通过溶解分隔层的壳聚糖,使上下层芯片的对应捕获腔室联通,并由微珠捕获所述细胞裂解后的核酸分子;最后回收微珠,再按照所需的方法进行转录、pcr、建库、测序、分析等流程。
实施例1
该微流控芯片模板制备采用软光刻方法,其上、下层芯片结构模板按照以下步骤进行制备:
(1)在硅片基底表面旋涂su-8光刻胶(细胞层光刻胶厚度为30微米,微珠层光刻胶厚度约50微米),95℃前烘30分钟;
(2)将含有上层或下层通道结构的掩膜固定于含有光刻胶的基底表面,如图2所示,紫外曝光使su-8按照掩膜的结构聚合;
(3)95℃后烘30分钟,自然冷却后用乳酸乙酯除去未曝光的su-8胶,形成上层或下层通道结构模板;
(4)180℃坚膜2小时,冷却后形成芯片上层和下层结构模板;
(5)利用三甲基硅烷对芯片模板进行低粘附处理。
该微流控芯片按照以下步骤进行制备:
(1)分别利用上、下层模板制备pdms芯片上下层结构;
(2)将2wt%的壳聚糖旋涂在玻璃基底表面,置于热板上形成壳聚糖薄膜;
(3)将下层芯片结构蘸取约10微米厚的预聚合pdms,并置于壳聚糖薄膜上,再置于80℃烘箱中使pdms固化;
(4)将2%的naoh溶液注入到下层芯片通道内,并将含有壳聚糖薄膜的玻璃基底以及与壳聚糖薄膜结合在一起的下层芯片结构一起浸入2%naoh溶液中;
(5)约48小时后,壳聚糖薄膜将与芯片下层的pdms从玻璃基底上分离,用去离子水洗去残留的naoh溶液后,置于室温或烘箱中干燥;
(6)利用等离子处理的后上层芯片与下层芯片结构对准后,封接在壳聚糖薄膜的另一侧,即形成所述芯片。
实施例2
单细胞检测芯片的使用方法:
(1)分别将待测的细胞悬液(100个/微升)与barcode微珠(直径约为40um、100个/微升)从芯片的上层(细胞层)和下层(微珠层)入口注入芯片内,根据芯片的设计,待每一个细胞或者微珠进入相应的捕获单元后会卡在该单元后面的狭小处,从而使该单元的流阻变大,后续的细胞或微珠会随着流体进入流阻较小的旁侧次通道,再进入下一个捕获单元,如图2所示,以此类推;
(2)待细胞和微珠都通过芯片后,再将油相从上、下层芯片的入口通入芯片中,以排除流体通道内的水相,同时存留在捕获单元的液体将形成独立的液滴;
(3)再将含有0.1-1wt%醋酸的油相注入芯片上、下层,壳聚糖薄膜会在醋酸的作用下溶解,使上、下层捕获单元内的液滴接触并发生融合,以形成细胞和微珠的一一对应,如图3所示;
(4)待所需反应完成后,可用相应的缓冲液从芯片的出口反向通入,以洗出微珠;也可将芯片上下层揭开后收集微珠;
(5)微珠收集后,可按照所需的方法进行反转录、pcr、建库、测序、分析等流程。
实验表明,使用本实用新型的微流控芯片的捕获结构,可以大大提高单细胞的捕获效率(实验统计结果:大于80%的捕获区域都能捕获单细胞),同时上下层的结构还可以提高单细胞和微珠的配对效率,从而提高单细胞测序的细胞利用效率(实验统计结果:细胞利用效率大于50%)。
- 还没有人留言评论。精彩留言会获得点赞!