生产物的制造方法与流程
本发明涉及一种由细胞生产的生产物的制造方法。
背景技术:
已知有为了制造生物医药品等而通过过滤而回收细胞培养液中所包含的培养产物的方法。
作为与培养产物的过滤相关的技术,例如,在日本特开2016-054686号公报中公开有培养产物的回收方法,该方法在产生培养产物的细胞的培养中,回收培养液中所包含的培养产物,所述方法包括:b.将培养液输送至过滤膜的工序;c.以沿与过滤膜表面平行的方向往返运动的方式改变培养液的流动并且进行过滤而获得渗透液的交替流过滤工序;d.使未渗透过滤膜而残留的培养残液返液的工序;及g.从渗透液回收培养产物的工序,作为b工序中所使用的过滤膜,使用培养液侧表面的平均孔径为20μm以上且100μm以下的多孔膜或培养液侧表面的直径成为小于20μm的孔的比例为培养液侧表面的所有孔的50%以下的多孔膜。
并且,在日本特开2009-045019号公报中公开有蛋白质的制造方法,该方法通过分离膜过滤在培养液中生产蛋白质的动物细胞的培养液,从滤液回收生产物即蛋白质,并且将未过滤液在培养液中保持或回流,且通过将新鲜培养基追加于培养液的连续过滤培养而制造蛋白质,所述方法中,作为分离膜使用具有平均细孔直径为0.01μm以上且小于1μm的细孔的多孔性膜,并且在0.1kpa至20kpa的范围的膜间差压的条件下进行过滤处理。
并且,作为在细胞培养中获得高活细胞密度的方法,在日本特开2016-039817号公报中公开有用于包含细胞培养培养基及细胞的细胞培养物的基于连续灌流培养培养细胞的方法,所述方法中,细胞培养基例如以0.01~0.3nl/细胞/天的比例添加于细胞培养物中,细胞培养物经过包含中空纤维的过滤模块上循环,其结果,产生具有比细胞培养物低的细胞密度的液体的流出,且过滤模块内的流动为交替切线流。
技术实现要素:
发明要解决的技术课题
在生物医药品等细胞生产物的制造中,为了提高生产物的生产效率,正在使用连续地过滤及排出培养液,另一方面,将包含营养成分的新鲜的培养基连续地供给至培养槽的灌流培养方法。
在灌流培养方法中,能够以高浓度培养细胞,但另一方面,若将细胞浓度设为高浓度,则随着继续进行培养而通过分离膜的生产物渗透率降低,从而存在生产物回收量减少的问题。日本特开2016-054686号公报、日本特开2009-045019号公报及日本特开2016-039817号公报中所记载的技术均无法应对这种问题。
本发明所涉及的实施方式要解决的课题在于提供一种在通过细胞培养生产生产物并使用分离膜从培养液分离生产物的生产物的制造方法中,尤其在以高浓度培养细胞的情况下,也能够将通过分离膜的生产物渗透率保持为较高的生产物的制造方法。
用于解决技术课题的手段
在用于解决上述课题的手段中包含以下方式。
<1>一种生产物的制造方法,其包括:培养容纳于培养容器中的细胞悬浮液中所包含的生产生产物的细胞的工序;
从培养容器提取细胞悬浮液,使用分离膜,并通过切向流过滤方式分离成具有比细胞悬浮液高的细胞浓度的返回液及具有比细胞悬浮液低的细胞浓度且包含生产物的渗透液的分离处理工序;
使返回液返回到培养容器中的工序;
向培养容器内供给新鲜培养基的工序;及
回收生产物的工序;
当将细胞悬浮液中的以cells/ml单位来表示的活细胞浓度设为nc,将分离膜的以m单位来表示的孔径设为dp,将分离膜的以m2单位来表示的过滤面积设为s,将以cm3单位来表示的分离膜一次侧流路体积设为vf时,细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的以个/ml单位来表示的个数密度nd满足以下式(1)。
nc≤nd≤s/(32×π×vf×dp2)式(1)。
<2>在<1>所述的制造方法中,满足式(1)的培养持续天数为10天以上。
<3>在<1>或<2>所述的制造方法中,满足式(1)的培养持续天数为10天以上且40天以下。
<4>在<1>至<3>中任一个所述的制造方法中,活细胞浓度nc满足以下式(2)。
2×107cells/ml≤nc≤20×107cells/ml式(2)
<5>在<1>至<4>中任一个所述的制造方法中还包括,从培养容器提取细胞悬浮液,并且将与所提取的量等量的新鲜培养基添加到培养容器内的泌水工序,泌水工序包括测定细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的个数密度nd的步骤及以使nd满足式(1)的方式调整泌水量的步骤。
<6>在<5>所述的制造方法中,细胞悬浮液的每天的泌水次数nb为1次以上,且当将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将nd的以个/ml单位来表示的目标值设为nd’,关于nb以下的任意的自然数n将第n次泌水之前的细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的以个/ml单位来表示的个数密度设为ndn时,以l单位来表示的第n次泌水量vbn满足以下式(3)及式(4)。
vbn=vc×(ndn-nd’)/ndn式(3)
nc≤nd’≤s/(32×π×vf×dp2)式(4)
<7>在<5>或<6>所述的制造方法中,细胞悬浮液的每天的泌水次数nb为1次以上,且当将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将nd的以个/ml单位来表示的目标值设为nd’,关于nb以下的任意的自然数n将第n次泌水之前的细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的以个/ml单位来表示的个数密度设为ndn时,以l单位来表示的第n次泌水量vbn满足以下式(3)及式(5)。
vbn=vc×(ndn-nd’)/ndn式(3)
2×107个/ml≤nd’≤2×109个/ml式(5)
<8>在<1>至<7>中任一个所述的制造方法中,培养生产生产物的细胞的工序包括通过搅拌叶片搅拌培养容器中的细胞培养液的步骤,
当将搅拌叶片的动力系数设为np,将搅拌叶片的以m单位来表示的叶片直径设为di,将搅拌叶片的以s-1单位来表示的转速设为ro,将细胞悬浮液的以kg/m3单位来表示的密度设为ρ,将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc时,由以下式(6)定义的搅拌叶片的以w/m3单位来表示的搅拌动力pv在10w/m3以上且150w/m3以下的范围内进行搅拌,且以培养容器的底面为基准将细胞悬浮液的以m单位来表示的液面高度设为hc时的泌水提取位置的以m单位来表示的高度hb为1/2×hc以下。
pv=np×ρ×ro3×di5/(vc×10-3)式(6)
<9>在<1>至<8>中任一个所述的制造方法中,培养生产生产物的细胞的工序包括通过分布器对细胞悬浮液进行气体通气的步骤,
当将细胞悬浮液的以n/m单位来表示的界面张力设为σ,将分布器的以μm单位来表示的孔径设为ds,将由分布器产生的单一气体的以ml单位来表示的体积设为vg,将分布器的以ml/分钟单位来表示的气体通气流量设为q,将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将细胞悬浮液的以kg/m3单位来表示的密度设为ρ,将以m/s2单位来表示的重力加速度设为g时,由以下式(7)及式(8)定义且以s-1·l-1为单位的每单位容量及单位时间的通气气体个数ng满足以下式(9)。
ng=q/(vg×vc×60)式(7)
vg=π×ds×σ/(ρ×g)式(8)
100s-1·l-1≤ng≤5000s-1·l-1式(9)
<10>在<9>所述的制造方法中,细胞悬浮液的界面张力σ及分布器的孔径ds分别满足以下式(10)及式(11)。
10mn/m≤σ≤100mn/m式(10)
0.1μm≤ds≤200μm式(11)
<11>在<1>至<10>中任一个所述的制造方法中,细胞为cho细胞。
<12>在<1>至<11>中任一个所述的制造方法中,分离膜的孔径dp为0.1μm以上且1μm以下,
在活细胞浓度达到最大或设定活细胞浓度之后的培养期间中,nd始终满足以下式(12)。
2×107≤nd≤2×109式(12)
<13>在<1>至<12>中任一个所述的制造方法中,以渗透液中所包含的生产物的浓度相对于细胞悬浮液中所包含的生产物的浓度之比来计算的通过分离膜的生产物的渗透率为55%以上。
发明效果
根据本发明所涉及的实施方式,提供一种在通过细胞培养生产生产物并使用分离膜从培养液分离生产物的生产物的制造方法中,尤其在以高浓度培养细胞的情况下,也能够将通过分离膜的生产物渗透率保持为较高的生产物的制造方法。
附图说明
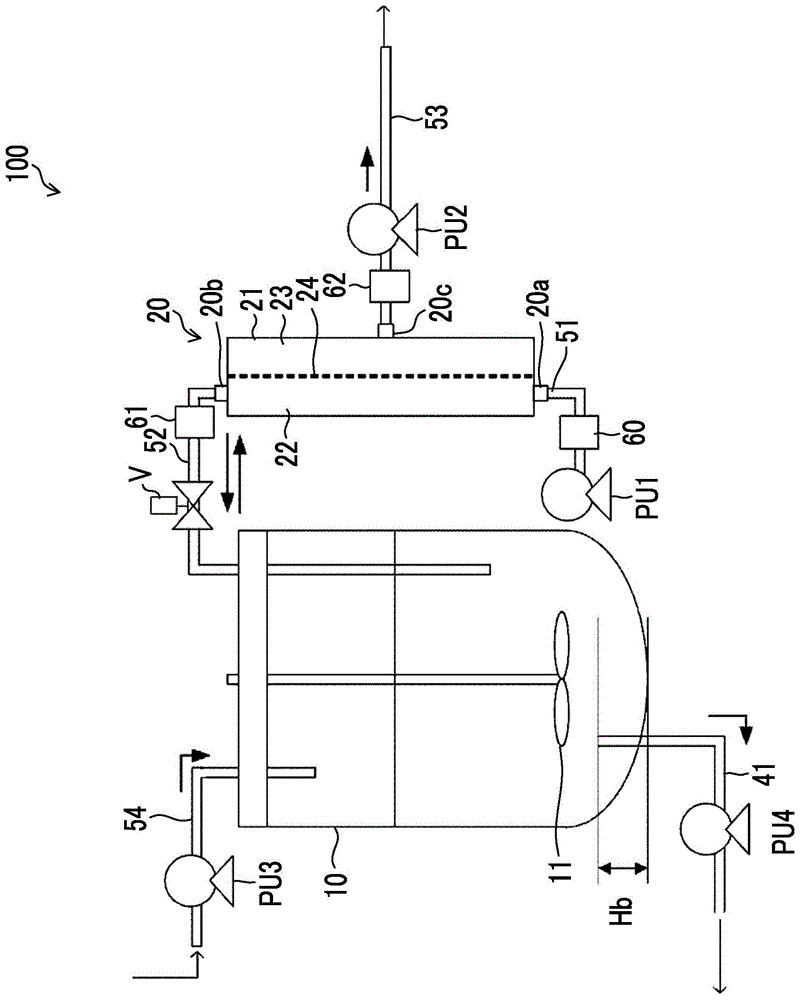
图1是表示能够适用于本发明所涉及的生产物的制造方法的实施中的细胞培养装置的结构的一例的图。
图2是用于说明中空纤维过滤器的过滤面积s及一次侧流路体积vf的图。
图3是用于说明平膜过滤器的过滤面积s的图。
图4是用于说明平膜过滤器的一次侧流路体积vf的图。
图5是示意地表示作为生产物的一例的抗体通过分离膜的情况的图。
图6是用于说明分布器的孔径ds及由分布器产生的单一气体的体积vg的图。
图7是表示实施例及比较例中的培养天数与粒子尺寸成为8dp以上且30dp以下的除活细胞以外的微粒子的个数密度nd之间的关系的曲线图。
图8是表示实施例及比较例中的培养天数与泌水量之间的关系的曲线图。
图9是表示实施例及比较例中的培养天数与通过分离膜的抗体渗透率之间的关系的曲线图。
图10是表示截留分子量与超滤膜的平均孔径之间的关系的曲线图。
具体实施方式
以下,对本发明所涉及的生产物的制造方法进行说明。但是,本发明所涉及的实施方式并不受以下实施方式的任何限定,能够适当附加变更来实施。
在本发明中,使用“~”来表示的数值范围是指将在“~”的前后记载的数值分别作为最小值及最大值而包含的范围。
在本发明中阶段性地记载的数值范围内,以某一数值范围来记载的上限值或下限值也可以与其他阶段性的记载的数值范围的上限值或下限值调换。并且,在本发明中所记载的数值范围内,以某个数值范围来记载的上限值或下限值也可以与实施例中示出的值调换。
在本发明中,两个以上的优选方式的组合为更优选的方式。
在本发明中,关于各成分的量,在存在多种与各成分相符的物质的情况下,若无特别说明,则表示多种物质的合计量。
在本发明中,“工序”这一词语不仅包括独立的工序,只要能够实现工序所期待的目的,则还包括不能与其他工序明确地区别的工序。
在各附图中,使用相同的符号来示出的构成要件表示是相同的构成要件。
本发明所涉及的生产物的制造方法包括:
培养容纳于培养容器中的细胞悬浮液中所包含的生产生产物的细胞的工序;
从培养容器提取细胞悬浮液,使用分离膜,并通过切向流过滤方式分离成具有比细胞悬浮液高的细胞浓度的返回液及具有比细胞悬浮液低的细胞浓度且包含生产物的渗透液的分离处理工序;
使返回液返回到培养容器中的工序;
向培养容器内供给新鲜培养基的工序;及
回收生产物的工序,
当将细胞悬浮液中的以cells/ml单位来表示的活细胞浓度设为nc,将分离膜的以m单位来表示的孔径设为dp,将分离膜的以m2单位来表示的过滤面积设为s,将以cm3单位来表示的分离膜一次侧流路体积设为vf时,细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的以个/ml单位来表示的个数密度nd满足以下式(1)。
nc≤nd≤s/(32×π×vf×dp2)式(1)。
关于用作生产生产物的细胞的细胞并无特别限定,但可举出动物细胞、植物细胞、酵母等真核细胞、枯草芽孢杆菌等原核细胞及大肠杆菌等。优选cho细胞、bhk-21细胞、c127细胞、ns0细胞及sp2/0-ag14细胞等动物细胞,在进行大量分析并且确立了基因工程学方法的方面上,更优选cho细胞。即使在细胞原本不生产所期望的生产物或产量少的情况下,例如,通过将对生产生产物中所需的蛋白质进行编码的质粒等表达载体导入于细胞,也能够有效地生产所期望的生产物。关于本发明中的由细胞生产的生产物,只要是上述细胞在培养液中生产的物质,则并无特别限定,例如可举出醇、酶、抗生素、重组蛋白及抗体等物质。其中,作为生产物,优选为重组蛋白或抗体,更优选为抗体。
当生产物例如为抗体时,也可以在cho细胞等动物细胞中生产抗体。作为动物细胞中所生产的抗体,并无特别限定,但例如可举出抗il-6受体抗体、抗il-6抗体、抗磷脂酰肌醇蛋白聚糖-3抗体、抗cd3抗体、抗cd20抗体、抗gpiib/iiia抗体、抗tnf抗体、抗cd25抗体、抗egfr抗体、抗her2/neu抗体、抗rsv抗体、抗cd33抗体、抗cd52抗体、抗ige抗体、抗cd11a抗体、抗vegf抗体及抗vla4抗体等。作为抗体,不仅包含来源于人、小鼠、大鼠、仓鼠、兔子及猴子等动物的单克隆抗体,还包含嵌合抗体、人源化抗体及双特异抗体(bispecific抗体)等人为改变的抗体。
通过培养生产生产物的细胞,能够生产设为目的的生产物。培养能够按照周知的方法进行。
作为生产生产物的细胞的培养中所使用的培养基,能够使用通常使用于细胞培养的液体培养基。例如能够使用opticho(lifetechnologies公司,12681011)培养基、达尔伯克改良伊格尔培养基(dmem)、伊格尔最低限度必需培养基(mem)、rpmi-1640培养基、rpmi-1641培养基、f-12k培养基、哈姆f12培养基、伊思柯夫改良培养液(imdm)、mccoy’s5a培养基、leibovitz'sl-15培养基,及ex-cell(商标)300系列(jrhbiosciences公司)、cho-s-sfmii(invitrogen公司)、cho-sf(sigma-aldrich公司)、cd-cho(invitrogen公司)、ischo-v(irvinescientific公司)、pf-acf-cho(sigma-aldrich公司)等培养基。
在培养基中也可以添加胎牛血清(fcs)等血清。或者,培养基也可以是无血清培养基,例如完全合成培养基。
在培养基中也可以补充氨基酸、盐、糖类、维生素、激素、生长因子、缓冲液、抗生素、脂质、微量元素及植物蛋白质的水解物等追加成分。
培养基的ph根据所培养的细胞而不同,但通常为ph6.0~8.0,优选为ph6.8~7.6,更优选为ph7.0~7.4。
培养温度通常为30℃~40℃,优选为32℃~37℃,更优选为36℃~37℃。在培养中也可以变更培养温度。
培养在co2浓度为0~40%优选为2~10%的气氛下进行。
在培养中,根据需要,能够增加培养基的交换、通气和/或搅拌。
生产生产物的细胞的培养能够在培养装置(也被称为生物反应器)或除此以外的适当的容器内进行。作为培养装置,可举出发酵槽型罐培养装置、气升型培养装置、培养瓶型培养装置、旋转瓶型培养装置、微载体型培养装置、流动层型培养装置、中空纤维型培养装置、滚瓶型培养装置及填充槽型培养装置等。
如后面所述,培养规模优选为0.1l以上且5000l以下,更优选为0.5l以上且3000l以下,进一步优选为1l以上且2000l以下。
本发明所涉及的生产物的制造方法中所包含的工序中包括:从培养容器提取细胞悬浮液,使用分离膜,并通过切向流过滤方式分离成具有比细胞悬浮液高的细胞浓度的返回液及具有比细胞悬浮液低的细胞浓度且包含生产物的渗透液的分离处理工序;使返回液返回到培养容器中的工序;及向培养容器内供给新鲜培养基的工序。
为了至少补充作为渗透液损失的培养液而供给新鲜培养基,因此可以说本发明所涉及的生产物的制造方法使用灌流培养。
灌流培养是添加新鲜的培养基的同时去除已使用的培养基的培养法。根据灌流培养,能够实现超过1×108细胞/ml的高细胞浓度。典型的灌流培养从持续1天或两天的批式培养启动开始,然后,在培养物中连续地、阶段地和/或断续地添加新鲜的供给培养基,同时去除已使用的培养基。在灌流培养中,能够使用沉淀、离心分离或过滤等方法,一边维持细胞浓度一边去除已使用的培养基。
灌流培养的优点在于,生产设为目的的生产物的培养比批式培养法或流加培养维持更长时间。并且,通过选择分离膜的膜孔径,能够一边向系统外回收生产物一边持续进行培养,因此能够缩短生产物在培养液中的滞留时间,并通过减少化学变化能够较高地保持生产物的质量。
也能够进行组合了流加培养或灌流培养的培养。作为组合的一例,可举出将伴随团注的流加培养为了维持生长期细胞的培养而使用,接着为了生产以灌流培养为目的的生产物而使用的例子。
灌流也可以是连续地、阶段地、断续地或它们的组合中的任何方式。由于分离膜的孔径小于生产生产物的细胞,因此生产生产物的细胞保持在作为培养液的细胞悬浮液中,渗透液实际上不包含细胞或以远比细胞悬浮液低的浓度包含细胞。由于通过细胞培养表达的设为目的的生产物小于膜孔径,因此能够使生产物转移到渗透液侧并进行回收。
在生产生产物的细胞的培养中,种植细胞浓度通常为0.2×106cells/ml以上且3×107cells/ml以下,优选为0.5×106cells/ml以上且1×107cells/ml以下。
在生产生产物的细胞的培养中,培养期间中的活细胞率在整个期间,优选为80%以上,更优选为85%以上,进一步优选为90%以上。若活细胞率在上述范围内,则生产物的生产效率高,并且能够减少细胞悬浮液中的废物。
在生产生产物的细胞的培养中,最大活细胞浓度(最高达到活细胞浓度)优选为2×108cells/ml以下,更优选为1.5×108cells/ml以下,进一步优选为1.2×108cells/ml以下。
若最大活细胞浓度在上述范围内,则能够更有效地抑制通过分离膜的生产物渗透率的降低。从提高生产物的生产效率的观点出发,最大活细胞浓度优选为2×107cells/ml以上,更优选为3×107cells/ml以上,进一步优选为4×107cells/ml以上。
在本发明中,关于根据自由组合上限值的记载及下限值的记载规定各参数的范围,也属于本发明中所公开的事项的范围内。
作为培养生产生产物的细胞中的灌流比,优选为0.3vvd以上且5.0vvd以下,更优选为0.3vvd以上且3.0vvd以下。其中,vvd如下表示。
vvd=(volumeoffreshmedium/workingvolumeofreactor/day,每天的供给培养液量/培养液量)
种植细胞浓度及培养中的最大细胞浓度能够通过用常规方法测量细胞数量并且对细胞数量除以培养液量来求出。最大活细胞浓度为培养期间中的活细胞浓度的最大值,根据培养条件而不同。
培养期间中的活细胞率(存活率)通过对活细胞数量除以(活细胞数量+死细胞数量)来求出。例如,活细胞数量及死细胞数量的测量能够使用采用基于台盼蓝染色法的生死判定的商品名称vi-cellxr(beckmancoulter公司)进行测量。
在本发明所涉及的生产物的制造方法中的分离处理工序中,从培养容器提取细胞悬浮液,使用分离膜,并通过切向流过滤方式分离成具有比细胞悬浮液高的细胞浓度的返回液及具有比细胞悬浮液低的细胞浓度且包含生产物的渗透液。
切向流过滤方式是指,通过使成为膜分离处理对象的液体沿分离膜的膜面流过,使尺寸小的成分与液体成分一同向分离膜的渗透侧移动,将尺寸大的成分及剩余液体成分保持在分离膜的未渗透侧的方式。
在本发明中,也将分离膜的未渗透侧,即供给侧称为一次侧,将分离膜的渗透侧称为二次侧。
在本发明中,基于切向流过滤方式的膜分离处理可以形成从培养容器提取的细胞悬浮液沿分离膜的膜面向平行的单方向的流动,也可以形成使从培养容器提取的细胞悬浮液的流动方向每隔规定时间反转而往复的流动。
在本发明所涉及的生产物的制造方法中,培养细胞的工序、分离处理工序、使返回液返回到培养容器中的工序、向培养容器内供给新鲜培养基的工序、回收生产物的工序及后述的泌水工序等中的“工序”这一词语不是表示若结束一个处理则开始下一处理的批处理来依次进行的处理,而是表示时间上并行进行的处理。因此,例如一边进行培养工序,一边从培养容器提取细胞悬浮液并进行分离处理工序。并且,返回液向培养容器的输送、新鲜培养基向培养容器内的供给及生产物的回收也在时间上与培养工序及分离处理工序并行进行。通过时间上并行进行各工序,能够有效地分离及回收生产出的生产物。另外,各工序也可以连续进行,例如也可以为了切换分离处理工序中的切向流过滤的流动方向等而存在暂时的停止时间。
通常,能够使用泵来进行从培养容器的细胞悬浮液的提取,但也可以使用可利用的其他送液机构。从培养容器提取的细胞悬浮液输送至过滤器部。从培养容器向过滤器部的细胞悬浮液的提取可以间歇进行,也可以连续进行,但从稳定地保持系统状态的观点出发,优选连续进行。
过滤器部例如具备容器及将容器内的空间隔开为供给侧及渗透侧而对从培养容器提取的细胞悬浮液实施膜分离处理的分离膜。在分离膜的供给侧,过滤器部具有分别与配管连接的流入口及流出口。在基于切向流过滤方式的膜分离处理中,当每隔规定时间使从培养容器提取的细胞悬浮液的流动方向反转时,流入口及流出口按照流动方向的反转而被调换。
作为分离膜,能够使用由将纤维状部件编织成网眼状而构成的筛网过滤器。通过使用筛网过滤器,与使用中空纤维膜的情况相比,能够促进包含细胞的尸体及细胞的破碎物的细胞培养中不需要的成分向渗透侧的排出。由此,能够从培养容器内有效地去除细胞培养中不需要的成分,从而能够提高培养容器内的细胞的生长性。
并且,作为分离膜,能够使用中空纤维膜。通过使用中空纤维膜,与使用筛网过滤器的情况相比,能够减少细胞向渗透侧渗透的风险。并且,能够减少因细胞进入分离膜而产生堵塞的风险。由此,能够减少细胞的损失。在该情况下,作为中空纤维膜,能够使用微孔滤膜(mf膜)或超滤膜(uf膜)。
分离膜不渗透细胞悬浮液中的活细胞,但渗透细胞悬浮液中的设为目的的生产物。活细胞与生产物之间渗透性产生差异的理由在于活细胞的尺寸与设为目的的生产物的尺寸之间存在差异。例如,当在动物细胞中生产抗体时,抗体的尺寸为1nm~5nm左右,相对于此,动物细胞的大小为10μm级别程度,因此例如通过使用作为分离膜的微孔滤膜或超滤膜,能够将活细胞留在一次侧,并且使抗体通过分离膜而转移到二次侧。并且,液体成分例如水分子的大小微小,因此液体成分的一部分量与抗体一同转移到二次侧。其结果,残留在一次侧的液体中的细胞浓度上升。如此,通过进行基于切向流过滤方式的分离,输送至过滤器部的细胞悬浮液不渗透分离膜而留在一次侧,从而分离成具有比细胞悬浮液高的细胞浓度的返回液及渗透分离膜而转移到二次侧的具有比细胞悬浮液低的细胞浓度的渗透液。渗透液中包含设为目的的生产物。
另外,这里所说的细胞悬浮液中的细胞浓度表示培养容器内的细胞悬浮液中的活细胞的浓度。
并且,若无特别说明,则在本发明中“细胞浓度”是指“活细胞浓度”。
留在一次侧的返回液从过滤器部流出而返回到培养容器中。
例如,当将切向流过滤中的过滤器部供给侧空间中的流动方向固定为单方向时,也可以将细胞悬浮液通过基于与从培养容器供给至过滤器部的泵相同泵的送液压力从流出口流出,并通过连接流出口与培养容器的配管使其返回到培养容器中。在该情况下,返回液通过与培养容器中的细胞悬浮液向过滤器部的流入口移动时通过的配管不同的配管而返回到培养容器中,从而形成循环的流动。
另一方面,当随着时间的经过使切向流过滤中的过滤器部供给侧空间中的流动方向反转,即,使流动往复时,例如也可以使用兼用吸入口及喷出口的隔膜泵等而根据隔膜的移动方向而使流动往复。在该情况下,返回液通过与培养容器中的细胞悬浮液向过滤器部的流入口移动时通过的配管相同的配管而返回到培养容器中,并且与流动方向的反转一同流入口及流出口反转。
当形成循环的流动时,例如能够适当地使用spectrumlaboratories,inc.的krosflo灌流培养流道装置(kml-100、kps-200、kps-600)或levitronix制的puralev系列。并且,当形成往复的流动时,能够适当地使用repligen公司的atfsystem。
渗透了分离膜的渗透液中包含设为目的的生产物。回收渗透液中的生产物而能够使用于医药品的制造及食品的制造等各种用途。
生产物的回收可以是简单的渗透液的回收例如将渗透液回收到罐中。当提高生产物的纯度或变更溶剂例如形成为粉末状等变更形态时,能够将渗透液提供至进一步处理。
例如,渗透了分离膜的渗透液中所包含的生产物能够通过纯化处理进行纯化。所获得的生产物能够纯化至高纯度。
当生产物为抗体或其残片等的多肽时,生产物的分离及纯化使用通常的多肽中所使用的分离及纯化方法即可。例如,只要适当选择组合亲和层析法等柱层析法、过滤器、超滤、盐析、透析、sds聚丙烯酰胺凝胶电泳及等电聚焦电泳等,则能够分离及纯化多肽,但并不限定于此。所获得的多肽的浓度测量能够通过吸光度的测量或酶联免疫吸附测量法(enzyme-linkedimmunosorbentassay;elisa)等来进行。
作为亲和层析法中所使用的色谱柱,可举出蛋白质a色谱柱,蛋白质g色谱柱。作为除亲和层析法以外的层析法,例如可举出离子交换层析法、疎水层析法,凝胶过滤、反相层析法及吸附层析法等。这些层析法能够使用hplc(highperformanceliquidchromatography;高效液相层析法)或fplc(fastproteinliquidchromatography;快速蛋白液相层析法)等液相层析法来进行。
从培养容器输送至过滤器部的细胞悬浮液分离成渗透液及返回液,因此返回液的量少于输送至过滤器部的细胞悬浮液的量。
为了至少补充输送至过滤器部的细胞悬浮液量与返回液量之差,将新鲜培养基供给至培养容器内。通过将新鲜培养基供给至培养容器内,能够抑制培养容器内的细胞浓度过度上升,并且能够将培养容器内的细胞的状态保持为健康的状态。即,可获得基于灌流培养的益处。
当因后述的泌水工序中的提取操作而存在与向过滤器部的送液另行从培养容器损失的细胞悬浮液时,新鲜培养基向培养容器内的供给以也补充因泌水工序中的提取操作而损失的细胞悬浮液量的方式,即,将培养容器内的细胞悬浮液量保持为大致恒定的方式进行。即,当进行泌水工序时,新鲜培养基向培养容器内的供给还包含泌水工序中的新鲜培养基添加操作。可以说泌水工序中的新鲜培养基向培养容器内的添加作为新鲜培养基向培养容器内的供给的一部分来进行。
用于补充作为渗透液损失的液量的新鲜培养基的添加及用于补充泌水工序中所提取的细胞悬浮液的液量的新鲜培养基的添加可以通过相同的配管进行,也可以通过单独的配管进行。
另外,新鲜培养基向培养容器内的供给可以间歇进行,也可以连续进行。并且,培养容器内的细胞悬浮液量无需始终完全恒定,可以是大致恒定例如产生±10%或±5%或±1%左右的变动。
培养容器内的细胞悬浮液量的测量无需一定要始终进行,也可以间歇进行。
即便细胞悬浮液量中存在若干变动,也能够获得基于灌流培养的益处。
在本发明所涉及的生产物的制造方法中,当将细胞悬浮液中的以cells/ml单位来表示的活细胞浓度设为nc,将分离膜的以m单位来表示的孔径设为dp,将分离膜的以m2单位来表示的过滤面积设为s,将以cm3单位来表示的分离膜一次侧流路体积设为vf时,细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的以个/ml单位来表示的个数密度nd满足以下满足式(1)。
nc≤nd≤s/(32×π×vf×dp2)式(1)
细胞悬浮液中的活细胞浓度nc能够使用beckmancoulter公司的cellviabilityanalyzervi-cellxr(商品名称)来求出。
当分离膜为微孔滤膜或超滤膜时,分离膜的孔径dp能够通过压汞法以平均孔径来测量。例如,能够使用shimadzucorporation制的autoporeiv9520并通过在分离膜中高压压入汞而测量孔径dp。
另外,超滤膜(有时也称为uf膜:ultrafiltrationmembrane)是指,平均孔径小于微孔滤膜(有时也称为mf膜:microfiltrationmembrane),平均孔径为0.001μm~0.01μm,其分离性能由截留分子量来定义的过滤膜。
在孔径小的超滤膜中,有时通过压汞法难以测量平均孔径。在该情况下,超滤膜的平均孔径能够根据截留分子量进行推算。具体而言,如http://chemeng.in.coocan.jp/memb/m_mb4.html所记载,使具有已知分子量的多种标准物质渗透成为对象的超滤膜,将阻止率成为90%时的标准物质的分子量设为该超滤膜的截留分子量。
阻止率是指,将过滤之前的溶液中的设为对象的物质的浓度设为cb,将滤液(渗透液)中的设为对象的物质的浓度设为cp时,由1-(cp/cb)给出的值。
能够由标准物质的分子量推算分子直径,因此超滤膜的平均孔径能够根据截留分子量进行推算。具体而言,如表1所记载,由截留分子量推算平均孔径。当截留分子量与标准物质的分子量不一致时,标绘截留分子量及平均孔径,通过线性插值等进行内插,由此能够推算平均孔径。作为一例,将标绘表1的截留分子量而进行了内插时的例子示于图10中。能够将如此获得的推算值用作超滤膜的平均孔径。
从抑制生产生产物的细胞的渗透并且有效地使生产物渗透的观点出发,分离膜的孔径dp优选为0.1μm以上且1μm以下,进一步优选为0.15μm以上且0.8μm以下,进一步更优选为0.17μm~0.23μm,最优选为0.2μm。
粒子尺寸为8dp以上且30dp以下的微粒子的个数密度能够使用beckmancoulter公司的商品名称multisizer4e来进行测量。即,本发明中的粒子尺寸为由基于beckmancoulter公司的商品名称multisizer4e的库尔特原理求出的粒子尺寸。粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子的个数密度nd能够由从粒子尺寸为8dp以上且30dp以下的微粒子的个数密度减去粒子尺寸为8dp以上且30dp以下的活细胞的浓度来求出。
[表1]
过滤面积s为分离膜的一次侧膜面积。
例如,当分离膜为如图2所示的形状的中空纤维膜时,每根的过滤面积以直径df及长度l为基础以π×df×l来求出。当中空纤维膜的总数为n根时,整体的过滤面积s以s=π×df×l×n来求出。
或者,当分离膜为如图3所示的形状的平膜,且上侧为一次侧而下侧为二次侧时,过滤面积s以图3中的由点描部表示的面积来求出。另外,在图3中,在一次侧设置有包含分离膜的向过滤器部的流入口30a及流出口30b。
分离膜一次侧流路体积vf为在过滤器部内的空间中与分离膜相接存在的空间的体积,也可以说是在过滤器部内的空间中相对于分离膜的膜面存在于铅垂方向一次侧的空间的体积。
例如,当分离膜为如图2所示的形状的中空纤维膜,中空纤维膜的内侧为一次侧,且中空纤维膜的总数为n根时,分离膜一次侧流路体积vf以直径df及长度l为基础以π×(df2/4)×l×n来求出。
相反,当中空纤维膜的外侧为一次侧,且中空纤维膜的总数为n根时,分离膜一次侧流路体积vf成为存放中空纤维膜的容器(未图示)与中空纤维膜之间的空间的体积,并且以从存放中空纤维膜的容器的内容积减去π×(df2/4)×l×n来求出。
或者,当分离膜为如图4所示的形状的平膜,且上侧为一次侧而下侧为二次侧时,分离膜一次侧流路体积vf以图4中的由点描部表示的体积来求出。
在本发明所涉及的生产物的制造方法中,将细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的微粒子且除活细胞以外的微粒子(以下,也称为“特定微粒子”)的个数密度nd控制在由式(1)表示的范围内。
根据本发明所涉及的生产物的制造方法,即使在以高浓度培养细胞的情况下,也能够将通过分离膜的生产物渗透率保持为较高的理由虽然尚不完全明确,但推测为如下叙述的理由。
因nd为细胞悬浮液中的活细胞浓度nc以上,能够有效地获得缓解细胞与分离膜的膜壁碰撞或钻入其中而受到的损伤的效果。即,特定微粒子为了缓解对细胞的损伤而存在某种程度的量反而更有效。因此,本发明所涉及的生产物的制造方法与以将细胞悬浮液内的微粒子作为代谢物来捕捉而简单地排出为目的的技术大为不同。
并且,因nd为s/(32×π×vf×dp2)以下,能够有效地获得抑制生产物渗透分离膜时的渗透率(以下,也称为生产物渗透率)降低的效果。
基于切向流过滤方式的膜分离处理是用于减少对细胞的损伤并且抑制生产物渗透率降低的有效地手段。通过采用基于切向流过滤方式的膜分离处理,与进行基于死端过滤方式的膜分离处理的情况相比,能够减少由细胞被强烈地推向膜引起的损伤,并且能够减少因微粒子而阻碍生产物的渗透。但是,即便采用基于切向流过滤方式的膜分离处理,若不采取一些对策,则培养时间变长并且产生生产物渗透率的降低。迄今为止,与通过分离膜的生产物渗透率的降低相关的详细机理尚未得到阐明。
在本发明所涉及的生产物的制造方法中,细胞悬浮液中的粒子尺寸为8dp以上且30dp以下的微粒子且除活细胞以外的微粒子(特定微粒子)的个数密度nd在式(1)的范围内。在生产物渗透率的降低中,粒子尺寸为8dp以上且30dp以下的除活细胞以外的微粒子发挥大的作用。粒子尺寸小于8dp的粒子的粒子尺寸小于分离膜的孔径,对生产物渗透率的降低贡献小。由于生产物能够穿过粒子之间的间隙,因此粒子尺寸超过30dp的粒子也对生产物渗透率的降低贡献小。因此,认为特定微粒子在生产物渗透率的降低中发挥主要作用。这种特定微粒子例如作为死细胞或受到伤害的细胞碎片等而产生。
s/vf的值越小,相对于分离膜的膜面的单位面积的分离膜一次侧流路体积越变大。只要特定微粒子的个数密度相同则相对于分离膜的膜面的单位面积的分离膜一次侧流路体积变大表示相对于分离膜的膜面的单位面积存在阻碍生产物渗透的可能性的特定微粒子的数量增加。
并且,认为只要dp变大,则特定微粒子的尺寸也增大,因此特定微粒子每一个的截面积大致与dp2成比例。认为只要特定微粒子的截面积相对于分离膜的膜面的面积的比例增大,则与其相当的量通过分离膜的生产物的渗透容易被阻碍。
例如当培养容器中的细胞悬浮液体积为1l时,s优选为0.005m2以上且1m2以下,更优选为0.007m2以上且0.5m2以下,进一步优选为0.01m2以上且0.3m2以下。在此,s的优选范围通常与细胞悬浮液体积成比例。即,这些优选范围能够解释为细胞悬浮液体积每1l的s的优选范围。
并且,例如当细胞悬浮液体积为1l时,vf优选为10cm3以上且50cm3以下,更优选为20cm3以上且40cm3以下,进一步优选为25cm3以上且35cm3以下。在此,vf的优选范围通常与细胞悬浮液体积成比例。即,这些优选范围能够解释为细胞悬浮液体积每1l的vf的优选范围。
因此,在式(1)中,以特定微粒子的个数密度nd成为根据活细胞浓度nc、过滤面积s、分离膜一次侧流路体积vf及分离膜的孔径dp求出的特定范围内的方式进行控制。在式(1)中,nd被规定为nc以上且s/(32×π×vf×dp2)以下,但nd优选为1.1×nc以上且s/(48×π×vf×dp2)以下,更优选为1.2×nc以上且s/(64×π×vf×dp2)以下,进一步优选为1.3×nc以上且s/(96×π×vf×dp2)个/ml以下。
在培养容器内,通过将阻碍通过分离膜的生产物渗透的除活细胞以外的特定微粒子的个数密度控制在式(1)的范围内,能够实现高生产物渗透率。作为用于进行这种控制的方法,可举出将特定微粒子的个数密度能够控制在上述范围内的适当的条件下进行培养的方法。
但是,通常,随着培养时间变长,存在特定微粒子的个数密度增大的倾向。因此,用于维持满足式(1)的状态的控制可以通过从培养容器内去除特定微粒子的处理来进行。
例如,也可以进行通过离心分离法去除细胞悬浮液中所包含的特定微粒子的处理。例如,也可以进行从培养容器将细胞悬浮液的一部分输送至离心分离器,沉淀去除特定微粒子,使上清液返回到培养容器中的处理。
或者,用于维持满足式(1)的状态的控制也可以通过从培养容器提取细胞悬浮液并将与所提取的量等量的新鲜培养基添加到培养容器内的泌水工序(以下,也简称为“泌水”)来进行。
在泌水工序中所提取的细胞悬浮液中所包含的特定微粒子从培养容器被去除,因此通过泌水工序能够减少特定微粒子的数量。
在泌水工序中,“将与所提取的量等量的新鲜培养基添加到培养容器内”是指,如上所述将培养容器内的细胞悬浮液量保持为大致恒定。
尤其在用于基于切向流过滤方式的分离操作的细胞悬浮液的提取连续进行的情况下,供给至培养容器内的新鲜培养基的量也补充作为渗透液损失的液体量,因此进行泌水工序中的提取时所添加的新鲜培养基的量必定与泌水工序中所提取的细胞悬浮液的量(以下,也称为泌水量)不同。
泌水工序中的“将与所提取的量等量的新鲜培养基添加到培养容器内”的处理可以与从培养容器提取细胞培养液同时进行,也可以从培养容器提取细胞培养液之后在规定时间内进行。
作为规定时间,例如可以是10小时以内或1小时以内或10分钟以内或1分钟以内。
在泌水工序中提取细胞培养液之后,即便培养容器内的细胞悬浮液的量暂时减少,只要在规定时间内恢复到与培养容器内的提取细胞悬浮液量之前的细胞悬浮液量相比大致恒定的量,则视为进行了“将与所提取量等量的新鲜培养基添加到培养容器内”的处理。
泌水工序中的提取可以从培养容器中的设置于比细胞悬浮液的液面更靠下部的位置的配管(以后,也称为排出管)仅打开设置于排出管途中的阀来进行,也可以将设置于细胞悬浮液的液面更靠下部的位置的排出管与泵连接而使泵工作来进行。
培养期间中的泌水量可以是恒定,也可以在培养期间的途中改变。
在改变的情况下,可以在每次进行泌水时重新设定泌水量,也可以每隔一定期间例如1天1次重新设定泌水量。并且,泌水工序可以间歇进行,也可以连续进行。
在连续进行的情况下,例如即便将每单位时间的泌水量设为恒定,也可以在培养期间的途中改变,也可以在每次进行泌水时量重新设定每单位时间的泌水量,还可以每隔一定期间例如1天1次重新设定每单位时间的泌水量。
即使在间歇进行泌水工序的情况下,优选每天进行1次以上泌水工序。通过将泌水工序之间的间隔设为1天以内,能够以更高精度控制特定微粒子的个数密度,从而能够更有效地控制生产物渗透率的降低。
在改变泌水量或每单位时间的泌水量的情况下,为了长时间维持满足式(1)的状态,优选测量特定微粒子的个数密度,根据其结果确定泌水量或每单位时间的泌水量,即进行反馈控制,但特定微粒子的个数密度的测量并不是必须的。通过适当地设定培养条件,即便不进行反馈控制,也能够维持培养期间中的至少某种程度的期间及满足式(1)的状态。
即,在本发明中,用于维持满足式(1)的状态的控制在培养期间中并不一定要根据特定微粒子数量改变泌水等条件。
但是,不能说仅根据泌水量或每单位时间的泌水量的初始设定,能够始终以长时间维持满足式(1)的状态的方式设定适当的泌水量或每单位时间的泌水量。例如,有可能会存在随着培养期间变长而特定微粒子数量增加或减少从而导致脱离式(1)的范围。因此,在培养期间中,优选根据特定微粒子的个数密度的测量值进行反馈控制。
如此,从维持满足式(1)的状态的观点出发,离心分离或泌水等从培养容器内去除特定微粒子的处理优选一边监测特定微粒子的个数密度一边在适当的条件下进行。监测无需始终进行,例如可以在每次的特定微粒子的去除处理之前进行。
并且,特定微粒子的去除处理可以连续进行,在该情况下,以规定的定时进行监测即可。
通常,在进行培养时,经常进行对细胞浓度的测量,但特定微粒子的增加量并不与细胞的生长成比例,因此仅测量细胞浓度,则无法知道特定微粒子的个数密度。因此,通过进行监测特定微粒子的个数密度并根据其结果从培养容器去除特定微粒子的处理,即进行反馈处理,能够可靠地将特定微粒子的个数密度维持在式(1)的范围内。
在本发明所涉及的生产物的制造方法中,无需维持从最初的种植经过整个培养期间满足式(1)的状态。即,本发明所涉及的生产物的制造方法还包含在培养期间的一部分维持满足式(1)的状态的实施方式。当存在不满足式(1)的期间时,进行培养生产生产物的细胞的工序、分离处理工序、使返回液返回到培养容器中的工序、向培养容器内供给新鲜培养基的工序及回收生产物的工序,且关于满足式(1)的期间,进行本发明所涉及的生产物的制造方法。
但是,在培养期间中,在至少生产物的主要生产期间优选维持满足式(1)的状态。
因此,至少在细胞悬浮液中的细胞浓度达到最大活细胞浓度或设定活细胞浓度之后的培养期间中,优选维持满足式(1)的状态。最大活细胞浓度为培养期间中的活细胞浓度的最大值,根据培养条件而不同。设定活细胞浓度是指,用于设定起始点的任意设定的活细胞浓度,该起始点为开始基于泌水等从培养容器内去除用于维持满足式(1)的状态的特定微粒子的处理的特定微粒子数量控制操作的起始点。
基于本发明所涉及的生产物的制造方法的生产物渗透率降低的抑制效果在以高密度培养细胞的情况下更加显著,因此设定活细胞浓度例如可以是2×107cells/ml以上且20×107cells/ml以下的范围内的值。设定活细胞浓度更优选为3×107cells/ml以上且15×107cells/ml以下,进一步优选为4×107cells/ml以上且12×107cells/ml以下。在活细胞浓度增加至2×107cells/ml以上之后的时期,特定微粒子的生成速度也变快。因此,当设定活细胞浓度为2×107cells/ml以上且20×107cells/ml以下时,在达到了设定活细胞浓度之后的培养中,基于以使特定微粒子数量满足式(1)的方式进行控制的生产物渗透率降低抑制效果更加显著。
在细胞悬浮液中的细胞浓度达到了最大活细胞浓度或设定活细胞浓度之后的培养期间中,进一步优选结束培养为止始终维持满足式(1)的状态。并且,在种植细胞之后,在培养期间中,进一步更优选始终满足式(1)的状态得到维持。
用于维持满足式(1)的状态的控制例如与用于使细胞悬浮液中的活细胞的浓度或活细胞的比例恒定的控制大为不同。例如,特定微粒子有可能是从死细胞释放出的细胞内容物等,因此,即便是活细胞浓度逐渐减少的时期或活细胞的比例逐渐降低的时期,特定微粒子的个数密度也可能会增加。如此,用于维持满足式(1)的状态的控制为与用于使活细胞的浓度或活细胞的比例恒定的控制不同的技术思想,在用于维持满足式(1)的状态的控制中,活细胞的浓度通常发生变动。
如此,特定微粒子的个数密度并不与活细胞的浓度成比例,因此用于维持满足式(1)的状态的控制也与在灌流培养中用于将供给至每个活细胞的新鲜培养基量设为恒定的控制明显不同。在灌流培养中,若进行用于将供给至每个活细胞的新鲜培养基量设为恒定的控制,则能够使活细胞的状态稳定,但无法将特定微粒子的个数密度维持在式(1)的范围内。
如上所述,进行培养生产生产物的细胞的工序、分离处理工序、使返回液返回到培养容器中的工序、向培养容器内供给新鲜培养基的工序及回收生产物的工序,且关于满足式(1)的期间,进行本发明所涉及的生产物的制造方法。
在进行上述各工序的期间,优选尽量长时间维持满足式(1)的状态。通过长时间维持满足式(1)的状态,能够更长时间抑制通过分离膜的生产物渗透率的降低。
因此,满足式(1)的培养持续天数优选为3天以上,更优选为10天以上。通过持续3天以上,抑制生产物渗透率降低的效果更加显著。满足式(1)的培养持续天数越长,越能够更长期有效地制造生产物。满足式(1)的培养持续天数的上限并无特别限定,但若培养期间变得非常长,则有时会产生细胞的生产物生产活性的降低等。因此,满足式(1)的培养持续天数更优选为3天以上且90天以下,进一步优选为10天以上且60天以下,更进一步优选为10天以上且40天以下,进一步更优选为15天以上且30天以下。
另外,在本发明中,关于对各参数所记载的多个范围,关于根据只要一个范围的上限值与另一个范围的下限值不产生矛盾则通过自由组合规定的新的范围,也在本发明中所公开的事项的范围内。另外,在种植之后,可以存在除进行本发明所涉及的生产物的制造方法以外的期间,例如,在种植之后的一段期间(例如1天间~5天间)可以存在不进行分离处理工序、使返回液返回到培养容器中的工序及向培养容器内供给新鲜培养基的工序的期间。
是否处于满足式(1)的状态能够通过从培养容器采样细胞培养液而测量特定微粒子的个数密度来确认。
满足式(1)的培养持续天数例如可以通过在对培养基种植细胞之后,从分离处理工序的开始时测量特定微粒子的个数密度而确认是否处于满足式(1)的状态来进行。
当本发明所涉及的生产物的制造方法还包括泌水工序时,也可以通过从初次泌水工序开始时测量特定微粒子的个数密度而确认是否处于满足式(1)的状态来进行。当导致特定微粒子的个数密度脱离式(1)的范围时,例如即便不结束培养操作本身,在脱离了式(1)的范围的时间点,也成为满足式(1)的培养的持续期间已结束。
满足式(1)的状态可以从分离处理工序的开始起持续3天以上,例如持续10天以上。满足式(1)的状态可以从分离处理工序的开始起例如持续3天以上且90天以下或10天以上且60天以下或10天以上且40天以下或15天以上且30天以下。当在分离处理的开始之后开始泌水工序(间歇或连续地)时,满足式(1)的状态可以从初次泌水工序的开始起持续3天以上,例如持续10天以上。满足式(1)的状态可以从初次泌水工序的开始起例如持续3天以上且90天以下或10天以上且60天以下或10天以上且40天以下或15天以上且30天以下。
如上所述,基于本发明所涉及的生产物的制造方法的生产物渗透率降低的抑制效果在以高密度培养细胞时更加显著。因此,细胞悬浮液中的活细胞浓度nc优选满足以下式(2)。
2×107cells/ml≤nc≤20×107cells/ml式(2)
细胞悬浮液中的活细胞浓度nc更优选为3×107cells/ml以上且15×107cells/ml以下,进一步优选为4×107cells/ml以上且12×107cells/ml以下。当活细胞浓度nc为2×107cells/ml以上且20×107cells/ml以下时,若不是以满足式(1)的方式控制特定微粒子数量,则生产物渗透率容易下降,但根据以满足式(1)的方式控制特定微粒子数量的本发明所涉及的生产物的制造方法,能够充分获得对生产物渗透率降低的抑制效果。
本发明所涉及的生产物的制造方法优选为还包括从培养容器提取细胞悬浮液并将与所提取的量等量的新鲜培养基添加到培养容器内的泌水工序,且泌水工序包括测量细胞悬浮液中的特定微粒子的个数密度nd的步骤及以nd满足式(1)的方式调整泌水量的步骤的制造方法。这里的细胞悬浮液的提取为培养容器中的细胞悬浮液的一部分的提取。特定微粒子的个数密度nd的测量例如能够通过从培养容器采样细胞悬浮液并测量细胞悬浮液中的特定微粒子的个数密度来进行。根据特定微粒子的个数密度nd的测量值,以nd满足式(1)的方式调整泌水量,即进行所谓的反馈控制,由此能够以可靠地满足式(1)的方式持续进行培养。
例如,细胞悬浮液的每天的泌水次数nb为1次以上,且当将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将nd的以个/ml单位来表示的目标值设为nd’,关于nb以下的任意的自然数n将第n次泌水之前的细胞悬浮液中的特定微粒子的以个/ml单位来表示的个数密度设为ndn时,优选使以l单位来表示的第n次泌水量vbn满足以下式(3)及式(4)。
vbn=vc×(ndn-nd’)/ndn式(3)
nc≤nd’≤s/(32×π×vf×dp2)式(4)
nd的目标值nd’为欲通过进行泌水来实现的特定微粒子的个数密度,在满足式(4)的范围内能够任意设定。通过将第n次泌水量设定为由式(3)确定的泌水量vbn,能够将第n次泌水之后的nd的值调整为nd’。nd’可以是每天相同的值,也可以按每一天重新设定。另外,在式(3)中,并未记载nd’与变量n之间的关系,但特定微粒子的个数密度的目标值nd’可以按各n设定,在该情况下,nd’也能够记载为nd’n。例如,当上次泌水之后的nd的值为nc以上且(32×π×vf×dp2)以下的值时,可以将上次泌水之后的nd值用作nd’n。并且,nb为1次以上即可,例如也可以是1次以上且10次以内或2次以上且5次以内。泌水频度高的一方具有能够更精密地控制特定微粒子的个数密度的倾向。
当连续进行泌水时,将从改变了泌水速度的时间点到下次改变泌水速度的时间点为止设为1次泌水而适用式(3)及式(4)即可。换言之,当连续进行泌水时,从改变泌水速度的时间点到下次改变泌水速度的时间点为止的泌水构成1次泌水。
当泌水通过开闭设置于排出管的阀来进行时,泌水量能够通过阀的开度及阀的开放时间中的至少一个来调节,并且,当泌水通过设置于排出管的泵来进行时,泌水量能够通过泵的输出及泵的运行时间中的至少一个来调节。
在式(4)中,nd’被规定为nc以上且s/(32×π×vf×dp2)以下,但nd’优选为nc×1.1以上且s/(48×π×vf×dp2)以下,更优选为nc×1.2以上且s/(64×π×vf×dp2)以下,进一步优选为nc×1.3以上且s/(96×π×vf×dp2)以下。通过将nd’设为nc个/ml以上,能够有效地获得缓解因细胞与分离膜的膜壁碰撞或钻入其中而受到的损伤的效果,通过设为s/(32×π×vf×dp2)个/ml以下,能够有效地获得抑制通过分离膜的生产物渗透率的降低的效果。
本发明所涉及的生产物的制造方法优选为如下制造方法,即,细胞悬浮液的每天的泌水次数nb为1次以上,且当将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将nd的以个/ml单位来表示的目标值设为nd’,关于nb以下的任意的自然数n将第n次泌水之前的细胞悬浮液中的特定微粒子的以个/ml单位来表示的个数密度设为ndn时,以l单位来表示的第n次泌水量vbn满足以下式(3)及式(5)。
vbn=vc×(ndn-nd’)/ndn式(3)
2×107个/ml≤nd’≤2×109个/ml式(5)
当连续进行泌水时,将从改变了泌水速度的时间点到下次改变了泌水速度的时间点为止设为1次泌水而适用式(3)及式(5)即可。换言之,当连续进行泌水时,从改变泌水速度的时间点到下次改变泌水速度的时间点为止的泌水构成1次泌水。vc优选为0.1l以上且5000l以下,更优选为0.5l以上且3000l以下,进一步优选为1l以上且2000l以下。
nd’优选设定为尤其由式(5)规定的范围内。通过将nd’设定为由式(5)规定的范围内,能够更有效地获得对细胞的损伤缓解效果及生产物渗透率降低的抑制效果。nd’优选为2.2×107个/ml≤nd’≤1.5×109个/ml,更优选为2.4×107个/ml≤nd’≤1×109个/ml。
本发明所涉及的生产物的制造方法中的培养生产生产物的细胞的工序可以包括通过搅拌叶片搅拌培养容器内的细胞培养液的步骤。培养生产生产物的细胞的工序优选为如下工序:
包括通过搅拌叶片搅拌培养容器中的细胞培养液的步骤,
当将搅拌叶片的动力系数设为np,将搅拌叶片的以m单位来表示的叶片直径设为di,将搅拌叶片的以s-1单位来表示的转速设为ro,将细胞悬浮液的以kg/m3单位来表示的密度设为ρ,将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc时,在由以下式(6)定义的搅拌叶片的以w/m3单位来表示的搅拌动力pv为10w/m3以上且150w/m3以下的范围内进行搅拌,且以培养容器的底面为基准将细胞悬浮液的以m单位来表示的液面高度设为hc时的泌水提取位置的以m单位来表示的高度hb为1/2×hc以下。np优选为0.1以上且2以下,更优选为0.3以上且1.5以下,进一步优选为0.5以上且1.2以下。ro优选为1.3s-1以上且6.7s-1以下,更优选为2s-1以上且5s-1以下,进一步优选为3s-1以上且4s-1以下。
pv=np×ρ×ro3×di5/(vc×10-3)式(6)
叶片直径di为从搅拌叶片的旋转中心到离旋转中心最远的搅拌叶片上的点为止的距离2倍的值。液面高度hc表示从培养容器中的细胞悬浮液的最下点到最上点为止的距离,是由培养容器的形状、细胞悬浮液的液量及死体积确定的值。并且,泌水提取位置的高度hb为从培养容器提取细胞悬浮液的高度,且以从细胞悬浮液的最下点到用于进行泌水的配管吸入口为止的垂直距离来求出。当配管吸入口的开口面不是水平时,hb的测量以配管吸入口的开口面的中心为止的距离来进行。
通过旋转搅拌叶片,搅拌容纳于培养容器内部的细胞悬浮液,细胞悬浮液的均匀性得到提高。在此,搅拌动力pv为表示细胞悬浮液的混合程度的指标,通过将搅拌动力pv设为10w/m3以上,具有有效地获得细胞与培养基之间的物质移动的促进效果的倾向,通过将搅拌动力pv设为150w/m3以下,能够更有效地进行基于泌水的特定微粒子的去除。
搅拌动力pv优选为10w/m3以上且150w/m3以下,更优选为15w/m3以上且150w/m3以下,进一步优选为20w/m3以上且100w/m3以下。
泌水提取位置的高度hb优选为1/2×hc以下,更优选为1/3×hc以下,进一步优选为1/4×hc以下。
通过将搅拌动力控制在上述范围内并且将hb设为1/2×hc以下,能够更有效地进行基于泌水的特定微粒子的去除。这是因为,只要是上述范围内的搅拌动力,则即便进行搅拌,由于特定微粒子适度沉淀于培养容器内,因此通过以使hb成为上述范围内的方式设置的用于进行泌水的配管能够有效地提取特定微粒子。
在本发明所涉及的生产物的制造方法中,培养生产生产物的细胞的工序可以包括通过分布器对细胞悬浮液进行气体通气的步骤。
培养生产生产物的细胞的工序优选为如下工序:
包括通过分布器对细胞悬浮液进行气体通气的步骤,
当将细胞悬浮液的以n/m单位来表示的界面张力设为σ,将分布器的以μm单位来表示的孔径设为ds,将由分布器产生的单一气体的以ml单位来表示的体积设为vg,将分布器的以ml/分钟单位来表示的气体通气流量设为q,将培养容器中的细胞悬浮液的以l单位来表示的体积设为vc,将细胞悬浮液的以kg/m3单位来表示的密度设为ρ,将以m/s2单位来表示的重力加速度设为g时,由以下式(7)及式(8)定义且以s-1·l-1为单位的每单位容量及单位时间的通气气体个数ng满足以下式(9)。
ng=q/(vg×vc×60)式(7)
vg=π×ds×σ/(ρ×g)式(8)
100s-1·l-1≤ng≤5000s-1·l-1式(9)
细胞悬浮液的界面张力σ能够使用自动表面张力仪cbvp-z(kyowainterfacescienceco.,ltd制)并通过平板法来测量。如图6所示,由分布器产生的单一气体的体积vg为从分布器的孔释放到细胞悬浮液的每个气泡的体积。vg为能够按照式(8)并通过计算求出的理论值。
因此,式中的各记号为表示实际细胞悬浮液中的特性的记号,例如,界面张力σ表示细胞悬浮液的液温下的界面张力,密度ρ也表示细胞悬浮液的液温下的密度。通气气体个数ng为表示在一秒钟对每细胞悬浮液1l供给几个具有通过上述计算求出的体积vg的气泡的值。若通气气体个数ng为100s-1·l-1以上,则通过来自分布器的通气气体能够有效地获得细胞与培养基之间的物质移动的促进效果,若通气气体个数ng为3000s-1·l-1以下,则由气体的破泡引起的对细胞的损伤小,能够有效地获得抑制特定微粒子的个数密度的效果。关于由分布器产生的气体,每单位体积及单位时间产生的个数即通气气体个数ng越多,越卷入周围的细胞,通过进行破泡促进特定微粒子的增加。因此,通过将通气气体个数ng控制在上述范围内,能够抑制特定微粒子的产生。
通气气体个数ng优选为100s-1·l-1以上且5000s-1·l-1以下,更优选为200s-1·l-1以上且3500s-1·l-1以下,最优选为300s-1·l-1以上且2000s-1·l-1以下。
细胞悬浮液的界面张力σ及分布器的孔径ds分别优选为以下范围内。
σ优选为10mn/m以上且100mn/m以下,更优选为20mn/m以上且80mn/m以下,进一步优选为30mn/m以上且60mn/m以下。
ds优选为0.1μm以上且200μm以下,更优选为0.2μm以上且100μm以下,进一步优选为0.5μm以上且50μm以下。
若σ为10mn/m以上,并且ds为0.1μm以上,则能够有效地产生细胞与培养基之间的物质移动的促进效果。若σ为10.0×10-2n/m以下,并且ds为200μm以下,能够抑制由通气气体引起的对细胞的损伤,并且能够产生足够的个数的通气气体气泡。
本发明所涉及的生产物的制造方法优选为如下制造方法,
分离膜的孔径dp为0.1μm以上且1μm以下,
在活细胞浓度达到最大或设定活细胞浓度之后的培养期间中,优选nd始终满足以下式(12)。
2×107≤nd≤2×109式(12)
nd更优选满足2.2×107≤nd≤1.5×109,进一步优选满足2.4×107≤nd≤1×109。
若分离膜的孔径dp为0.1μm以上,则能够有效地渗透生产物,若分离膜的孔径dp为1μm以下,则能够有效地防止细胞的渗透。
并且,在进行生产物的生产的主要期间即活细胞浓度达到最大或设定活细胞浓度之后的培养期间中,nd优选设定为尤其由式(12)规定的范围内。通过将nd设为式(12)的范围内,能够更有效地获得对细胞的损伤缓解效果、生产物渗透率的降低的抑制效果。dp优选为0.1μm以上且1μm以下,更优选为0.15μm以上且0.8μm以下,进一步优选为0.17μm~0.23μm,最优选为0.2μm。
在本发明所涉及的生产物的制造方法中,作为渗透液中所包含的生产物的浓度相对于细胞悬浮液中所包含的生产物的浓度之比来计算的通过分离膜的生产物的渗透率优选为55%以上。根据本发明所涉及的生产物的制造方法,能够有效地抑制通过分离膜的生产物渗透率的降低,因此能够将生产物渗透率维持在55%以上。尤其在进行生产物的生产的主要期间即活细胞浓度达到最大或设定活细胞浓度之后的培养期间中,始终通过分离膜的生产物渗透率更优选为55%以上。通过分离膜的生产物渗透率更优选60%以上,进一步优选为70%以上,进一步更优选为80%以上。
以下,参考附图进一步对本发明所涉及的生产物的制造方法进行详细说明。在图4中示出具备平膜型分离膜的过滤器部的一例,在图5中示意地示出使用了如图4所示的平膜型分离膜时的基于切向流过滤方式的膜分离处理的一例的情况。在该例子中,由生产生产物的细胞生产的目的生产物为抗体。
当从具有图4所示的平膜型分离膜的过滤器部的流入口30a流入细胞悬浮液并且从流出口30b流出细胞悬浮液时,细胞悬浮液从流入口30a朝向流出口30b与分离膜的膜面平行地流动。如图5所示,在过滤器部的一次侧存在细胞悬浮液中所包含的细胞(图中的白色圆圈)、抗体(图中的y字)及特定微粒子(图中的用点涂抹的圆圈)等。在图5中,分离膜24的上侧为一次侧,下侧为二次侧。
细胞具有大于分离膜的孔径dp的尺寸,因此无法渗透分离膜,从而留在分离膜的一次侧。抗体具有小于分离膜的孔径dp的尺寸,因此通过分离膜的孔而向二次侧转移。特定微粒子其一部分位于细胞与分离膜之间,由此缓解细胞因与分离膜的膜壁碰撞或钻入其中而受到的损伤。
另一方面,特定微粒子还妨碍抗体接近分离膜的孔,因此妨碍抗体渗透分离膜,从而降低抗体渗透率。抗体渗透率的降低在相对于分离膜的膜面面积即过滤面积s特定微粒子的数量多时尤其显著,但另一方面,为了保护细胞优选存在一定数量的特定微粒子。
由此可以理解,通过以满足式(1)的方式控制特定微粒子的个数密度,能够抑制对细胞的损伤并且抑制抗体渗透性的降低。
另外,在基于切向流过滤方式的膜分离处理中,在随着时间的经过使切向流过滤中的过滤器部供给侧空间中的流动方向反转,即,使流动往复的情况下,图4中的流出口30b及流入口30a在每次反转流动方向时进行反转。
图1是表示能够适用于本发明所涉及的生产物的制造方法的实施中的细胞培养装置100的结构的一例的图。
细胞培养装置100具有:培养容器10,将生产作为生产物的一例的抗体的细胞与培养基一同容纳并进行培养;流路52,提取容纳于培养容器10的细胞悬浮液并输送至过滤器部20;过滤器部20,具有对从培养容器10提取的细胞悬浮液实施基于切向流过滤方式的膜分离处理的分离膜24;流路51,从过滤器部20排出被分离膜24阻止的成分;及流路53,用于回收渗透了分离膜24的成分(渗透液)。
在培养容器10的内部设置有具有搅拌叶片11的搅拌装置。通过旋转搅拌叶片11,搅拌容纳于培养容器10内部的培养基,培养基的均匀性得到保持。
流路51的一端与过滤器部20的流出/流入口20a连接,另一端与泵pu1连接。通过泵pu1,产生通过流路51的液体的流动,通过流路52的培养容器10中的细胞悬浮液的提取,或形成其反方向的流动。流路51中的送液压力能够由设置于泵pu1与过滤器部20之间的压力计60测量,流路52中的送液压力能够由在设置于流路52上的夹管阀v与过滤器部20之间设置的压力计61测量。泵pu1的送液压力p能够通过夹管阀v的开度来调整。
过滤器部20具备容器21、将容器21内的空间隔开为供给侧22及渗透侧23并且对从培养容器10提取的细胞悬浮液实施膜分离处理的分离膜24。并且,过滤器部20在供给侧22具有细胞悬浮液流出或流入的流出/流入口20a及细胞悬浮液流入或流出的流入/流出口20b。从培养容器10提取的细胞悬浮液在从流入/流出口20b流入容器21的内部并从流出/流入口20a向容器21外部流出的期间通过分离膜24上。过滤器部20一边使成为膜分离处理对象的液体沿分离膜24的膜面(与膜面平行的方向)流过,一边进行将尺寸小的成分输送至渗透侧23的基于切向流过滤方式的膜分离处理。基于切向流过滤方式的膜分离处理可以是形成从培养容器10提取的细胞悬浮液沿分离膜24的膜面平行地向单方向循环的流动的处理,也可以是形成细胞悬浮液沿分离膜24的膜面往复的流动的处理,但在此主要对形成往复的流动的情况进行说明。
细胞悬浮液中所包含的细胞不渗透分离膜24而从流出/流入口20a向容器21的外部流出,包含细胞的液体经由流路51暂时输送至泵pu1。泵pu1为隔膜泵,该液体临时储存于通过隔膜的移动而产生的空间。泵pu1兼用吸入口及喷出口,因此是能够形成通过隔膜的移动而往复的流动的泵。另一方面,细胞悬浮液中所包含的抗体渗透分离膜24而从设置于渗透侧23的排出口20c排出至容器21的外部。在渗透侧23连接有设置有泵pu2的流路53,包含渗透到渗透侧23的抗体的渗透液经由流路53被回收(回收工序)。流路53中的送液压力能够由设置于过滤器部20与泵pu2之间的压力计62测量。细胞不渗透分离膜24但抗体渗透分离膜24,因此渗透液具有比细胞悬浮液低的细胞浓度且包含抗体。
渗透分离膜24而被回收的渗透液中所包含的抗体经由流路53输送至进行抗体纯化的纯化处理部(未图示)。
在基于切向流过滤方式的膜分离处理中,当形成从培养容器10提取的细胞悬浮液沿分离膜24的膜面往复的流动时,随着时间的经过使泵pu1的送液方向反转。当使泵pu1的送液方向反转时,细胞悬浮液经由流路51从泵pu1被提取而输送至过滤器部20,被分离膜24阻止的成分作为返回液从过滤器部20经由流路52返回到培养容器10的内部。细胞不渗透分离膜24,因此返回液具有比细胞悬浮液高的细胞浓度。另外,在此对利用泵pu1的内部空间形成往复的流动的实施方式进行了说明,但本发明所涉及的实施方式并不限定于此。例如,也可以通过进一步设置连接泵pu1与培养容器10的流路(未图示),使从流出/流入口20a流出的液体作为返回液返回到培养容器10中。在该情况下,能够将流动方向设为单方向,但根据需要,也能够随着时间的经过使泵pu1的送液方向反转。
细胞培养装置100具有用于将新鲜的培养基供给至培养容器10的流路54及设置于流路54途中的泵pu3。通过使泵pu3工作,通过流路54向培养容器10内添加新鲜培养基,以便除了作为渗透液损伤的液体量以外,还补充因进行泌水而损失的液体量。
为了将培养容器10内的特定微粒子的比例控制在式(1)的范围内,从一端在培养容器内的下部开口的流路41提取培养容器内的细胞悬浮液,进行从流路54供给用于补充细胞悬浮液的减少量的新鲜的培养基的泌水。泌水可以间歇进行,也可以连续进行。在流路41的途中设置有泵pu4,经由在离细胞悬浮液的最下点的高度为hb的位置上开口的流路41从培养容器10提取细胞悬浮液。所提取的渗出液可以废弃,也可以进行膜处理等而回收生产物。并且,培养容器10也可以具备用于采集用于测量特定微粒子的个数密度的样品的未图示的采样口。
如以上进行的说明,根据本发明,即使在以高浓度培养细胞的情况下,也能够提供可将通过分离膜的生产物渗透率保持为较高的生产物的制造方法。制造出的生产物例如能够使用于生物医药品及再生医疗等。
实施例
以下,通过实施例进一步对本发明的实施方式进行具体说明,但本发明的实施方式并不限定于以下实施例。
使用图1所示的细胞培养装置进行了制造生产物的实验。
首先,在培养容器中加入0.8l培养基(商品名称cdopticho,thermofisherscientifick.k.制)并且在37℃温度下保持,从培养容器上面以38ml/分钟通入空气,以2ml/分钟通入co2,并放置1天。接着,以培养容器内的细胞浓度成为2.0×105cells/ml且培养容器内的液量成为1.0l的方式种植了生产作为生产物的抗体的细胞。从种植起3天后,以1.2l/天的比例进行了基于泵的细胞悬浮液的连续提取及基于切向流过滤方式的过滤(分离处理工序)以及新鲜培养基(商品名称cdopticho,thermofisherscientifick.k.制,及商品名称cellboost7a及7b,gehealthcare制的混合物)的供给(供给新鲜培养基的工序)。在基于切向流过滤方式的过滤中,将细胞悬浮液分离成具有比细胞悬浮液高的细胞浓度的返回液及具有比细胞悬浮液低的细胞浓度且包含作为生产物的抗体的渗透液,使返回液返回到培养容器(将返回液返回到培养液的工序)中。并且,通过回收渗透液,回收了作为生产物的抗体。
在该状态下,继续进行培养,直至成为规定的设定活细胞浓度。关于实施例1及4~12以及比较例1~6,将设定活细胞浓度设为8×107cells/ml,关于实施例2,将设定活细胞浓度设为12×107cells/ml,关于实施例3,将设定活细胞浓度设为14×107cells/ml。成为规定的设定活细胞浓度的天设为第1天,从第1天起按照表2及表3中所记载的协议1天1次进行泌水操作(泌水工序)的同时继续进行了培养(培养工序)。
从第1天起,在泌水前后分别从培养容器内及分离膜二次侧采样液体,分别对培养容器内的特定微粒子的个数密度及培养容器内和分离膜二次侧的抗体浓度进行了定量。每天的特定微粒子的个数密度及抗体渗透率设为泌水前后的值的算术平均值。其中,仅将培养最后一天设为前天的泌水之后及当天的泌水之前的值的算术平均值。并且,将每天的抗体渗透率(生产物的渗透率)计算为分离膜二次侧中的抗体浓度/培养容器内的抗体浓度×100。
按照以下协议进行了各天的泌水。
<泌水协议>
关于表2及表3中记载为“基于特定微粒子个数密度”的实施例及比较例,将当天的泌水之前的特定微粒子的个数密度设为nd,将前天的泌水之后的特定微粒子的个数密度设为目标个数密度nd’,将泌水量设定为(nd-nd’)/nd×1l。其中,nd’的上限值设为9.5×108个/ml。
关于表2及表3中记载为“恒定量”的实施例及比较例,将各天的泌水量设为恒定的0.20l。
关于表2及表3中记载为“基于细胞浓度”的比较例,将泌水之前的细胞浓度设为nc,将设定活细胞浓度设为nc’,而将泌水量设为(nc-nc’)/nc×1l。
在上述实验中,作为细胞悬浮液提取过滤泵,使用了隔膜式往复atf泵(商品名称atf2,repligen制)。
使用beckmancoulter公司的商品名称multisizer4e及商品名称vi-cellxr并通过从粒子尺寸8dp以上且30dp以下的所有粒子数量减去粒子尺寸8dp以上且30dp以下的活细胞数量,由此进行了特定微粒子的个数密度的定量。
在抗体浓度的定量中使用了高效液相色谱(商品名称prominence,shimadzucorporation制)。直接装载了分离膜二次侧的渗透液。作为色谱柱,使用了appliedbiosystems(应用生物系统)poros50a内径4.6mm×50mm(thermofisherscientific株式会社制)。并且,作为洗脱液,使用20mm的磷酸缓冲液+300mm的nacl(ph7)及20mm的磷酸缓冲液+300mm的nacl(ph2.8),并通过梯度洗脱法进行了测量。
培养液的液温下的界面张力使用自动表面张力仪(商品名称cbvp-z,kyowainterfacescienceco.,ltd制)并通过平板法进行了测量。
并且,上述实验中所使用的细胞为生产抗体的cho细胞,培养容器中的细胞悬浮液的液量vc为1.0l,培养容器中的培养液(细胞悬浮液)的液面高度hc为0.088m。并且,作为分离膜,使用了中空纤维型mf膜即repligen公司的孔径(dp)0.2μm的pes(聚醚砜)过滤器f2rf02pes。该分离膜的过滤面积为0.13m2,中空纤维直径df为1.0×10-3m,一次侧流路体积vf为33cm3。搅拌叶片的叶片直径di为85×10-3m,动力系数np为1.0。培养容器中的培养液即细胞悬浮液的密度ρ为1000kg/m3,界面张力σ为5.1×10-2n/m。上述实验中的s/(32×π×vf×dp2)的值成为9.8×108个/ml。
使用培养持续天数期间的抗体渗透率的测量值中的最小值,并根据以下评价基准进行了评价。
a:最小的抗体渗透率为85%以上;
b:最小的抗体渗透率为75%以上且小于85%;
c:最小的抗体渗透率为65%以上且小于75%;
d:最小的抗体渗透率为55%以上且小于65%;
e:最小的抗体渗透率小于55%。
将通过以上的实施例及比较例获得的结果示于以下表2及表3中。将培养持续天数期间的特定微粒子的个数密度的测量值中的最小值设为最小个数密度,将最大值设为最大个数密度来示于表2及表3中。
并且,将培养持续天数期间的活细胞浓度的测量值中的最大值设为最大细胞浓度来示于表2及表3中。
在任一实施例及比较例中,特定微粒子的最小个数密度均为大于最大细胞浓度的值,因此满足式(1)中的左侧不等式,即nc≤nd。
关于在持续进行了培养及基于切向流过滤方式的过滤的18天的期间是否始终满足式(1)中的右侧不等式,即nd≤s/(32×π×vf×dp2),能够通过比较特定微粒子的最大个数密度与s/(32×π×vf×dp2)的值来进行判定。
将培养持续天数期间的泌水量中的最小值设为最小泌水量而将最大值设为最大泌水量来示于表2及表3中。当泌水的协议为“恒定量”时,每次泌水量相同,因此最小泌水量与最大泌水量的值相同。
在表2及表3中,培养持续天数以天为单位来表示,最大细胞浓度以107cells/ml单位来表示,特定微粒子的最小个数密度及最大个数密度以108个/ml单位来表示,最小泌水量及最大泌水量以l单位来表示,提取高度以m单位来表示,搅拌叶片的转速以s-1单位来表示,搅拌动力以w/m3单位来表示,分布器的孔径以μm单位来表示,通气气体体积以10-4ml单位来表示,气体通气量以ml/min单位来表示,通气气体个数以s-1·l-1单位来表示,抗体渗透率以%单位来表示。
如表2及表3所示,在满足式(1)的实施例1~实施例12中,经过18天的培养期间抗体渗透率良好为65%以上。另一方面,在培养期间的途中成为式(1)的范围外的比较例1~比较例6中,抗体渗透率的最小值较低为小于55%。
由此可知,通过维持满足式(1)的状态,能够将生产物的渗透率维持为较高。
并且,从实施例1的结果与实施例4的结果之间的比较可知,当泌水工序包括测量特定微粒子的个数密度nd的步骤及以nd满足式(1)的方式调整泌水量的步骤时,能够更有效地抑制生产物渗透率的降低。
另一方面可知,当以将细胞浓度设为恒定的方式进行泌水时,如比较例4~比较例6所示,无法抑制生产物渗透率的降低。
从实施例4~实施例6之间的比较及实施例1与实施例7之间的比较可知,当hb/hc比在上述记载的优选范围内时,更有效地抑制生产物渗透率的降低。
从实施例8及实施例9之间的比较及实施例1与实施例10之间的比较可知,当搅拌叶片的搅拌动力pv在10w/m3以上且150w/m3以下的范围内时,更有效地抑制生产物渗透率的降低。
从实施例1、实施例11及实施例12之间的比较可知,当通气气体个数ng在上述记载的优选范围内时,更有效地抑制生产物渗透率的降低。
在图7中示出了实施例1、实施例6及实施例12以及比较例4及比较例6中的培养天数与粒子尺寸成为8dp以上且30dp以下的除活细胞以外的微粒子个数密度nd之间的关系。
从图7可知,在实施例1、实施例6及实施例12中,特定微粒子的个数密度维持为较低,但在比较例4及比较例6中,在培养期间中特定微粒子个数密度成为高的值。
在图8中示出了实施例1、实施例6及实施例12以及比较例4及比较例6中的培养天数与泌水量之间的关系。
在比较例4及比较例6中,进行了与细胞浓度相应的泌水量的调整,但每天的泌水量与实施例1、实施例6及实施例12中的每天的泌水量大为不同。
如此,与细胞浓度相应的泌水量的调整与用于维持本发明所涉及的式(1)的泌水量的控制大为不同。
在图9中示出了实施例1、实施例6及实施例12以及比较例4及比较例6中的培养天数与通过分离膜的抗体渗透率之间的关系。
从图9可知,在实施例1、实施例6及实施例12中,有效地抑制了抗体渗透率的降低,但在比较例4及比较例6中,抗体渗透率在培养期间中大幅降低。
符号说明
10培养容器
11搅拌叶片
20过滤器部
20a流出/流入口
20b流出/流入口
20c排出口
21容器
22供给侧
23渗透侧
24分离膜
30a流入口
30b流出口
41流路
51~54流路
60~62压力计
100细胞培养装置
pu1~pu4泵
v夹管阀
hb提取位置的高度
df中空纤维直径
l中空纤维的长度
s过滤面积
vf分离膜一次侧流路体积
dp分离膜孔径
ds分布器的孔径
vg单一气体的体积
于2018年3月19日申请的日本国专利申请2018-051261的公开其全部内容根据参考编入于本说明书中。
本说明书中所记载的所有的文献、专利申请及技术标准,根据参考而援用于此的每个文献、专利申请及技术标准与具体且个别记载时相同程度地根据参考编入于本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!