心肌损伤治疗药的制作方法
本发明涉及心肌损伤治疗药,更具体地,涉及能够抑制dp116mrna表达的寡核苷酸和包含其的药物。
背景技术:
迪谢内型(duchenne型)肌营养不良(dmd)是由于dmd基因异常引起的肌营养不良蛋白缺陷而发病的。对于dmd,大多数病例合并有心功能障碍,很多病例由于心力衰竭而死亡(非专利文献1和2)。作为该dmd的心功能障碍的治疗是使用通常的心脏保护剂等,还没有针对dmd特异的心功能障碍的治疗(非专利文献3)。
肌营养不良蛋白是称为dp427的同工型,在dmd中,根据基因的异常部位,每个患者所缺陷的肌营养不良蛋白的同工型是不同的。作为肌营养不良蛋白的同工型,已知有dp427、dp260、dp140、dp116和dp71。
松尾等人报导了他们发现dmd的心功能障碍的发病因素是心脏中表达的肌营养不良蛋白dp116(下文中也称为dp116)(非专利文献4)。对dp116表达与心功能障碍之间关系的分析表明,表达dp116的dmd患者比不表达的患者更早且更强地出现心功能障碍。这启示了抑制dp116的表达是心功能障碍治疗的分子靶标。
现有技术文献
非专利文献
非专利文献1:kamdarf,garrydj.dystrophin-deficientcardiomyopathy.jamcollcardiol.2016;67:2533-2546.
非专利文献2:nigrog,comili,politanol,bainrj.theincidenceandevolutiveofcardiomyopathyinduchennemusculardystrophy.intjcardiol.1990;26:271-277.
非专利文献3:markhamlw,spicerrl,khourypr,wongbl,mathewskd,cripelh.steroidtherapyandcardiacfunctioninduchennemusculardystrophy.pediatrcardiol.2005;26:768-771.
非专利文献4:yamamotot,awanoh,zhanz,enomoto-sakumam,kitaakis,matsumotom,nagaim,satoi,imanishit,hayashin,matsuom,iijimak,saegusaj,cardiacdysfunctioninduchennemusculardystrophyislessfrequentinpatientswithmutationsinthedystrophindp116codingregionthaninotherregions.2018;cirsgenomprecism编著,2018;11:e001782.
技术实现要素:
发明要解决的问题
本发明的目的在于确立心功能障碍的治疗法。
用于解决问题的方法
本发明人们进行了对dp116mrna表达进行抑制的修饰核酸的探索。合成了多种针对dp116的外显子s1的剪接促进序列的修饰核酸,将它们导入u251细胞,通过rt-pcr法分析了dp116mrna的量。其结果是发现了抑制dp116表达的核酸药物。
本核酸药物是能够用于dmd的心功能障碍的治疗的药物。另外,认为也能够用于成人中的心功能障碍的治疗。
本发明的要点如以下所述。
(1)一种寡核苷酸、其药理上允许的盐或溶剂合物,所述寡核苷酸是含有与肌营养不良蛋白基因的内含子55区域的一部分互补的核苷酸序列的、碱基数为15~30的寡核苷酸,其包含5’-tgtcttcct-3’或5’-cagcttgaaccgggc-3’(seqidno:64)的序列(其中,序列中的t可以为u)。
(2)根据(1)所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,寡核苷酸包含5’-tgtcttcct-3’的序列(其中,序列中的t可以为u)。
(3)根据(1)或(2)所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,寡核苷酸包含seqidno:15~59中的任一序列(其中,序列中的t可以为u、u可以为t)。
(4)根据(1)或(2)所述的寡核苷酸、其药理上允许的盐或溶剂合物,其包含seqidno:20、25~33和35~37中的任一序列。
(5)根据(1)~(4)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其能够抑制肌营养不良蛋白dp116的表达。
(6)根据(1)~(5)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的糖和/或磷酸二酯键中的至少一个被修饰。
(7)根据(1)~(6)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的糖是d-呋喃核糖,糖的修饰是d-呋喃核糖的2′位的羟基的修饰。
(8)根据(1)~(7)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的糖是d-呋喃核糖,糖的修饰是d-呋喃核糖的2’-o-烷基化和/或2′,4′-交联化。
(9)根据(1)~(8)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的糖是d-呋喃核糖,糖的修饰是d-呋喃核糖的2’-o-烷基化和/或2′-o,4′-c-亚烷基化。
(10)根据(1)~(8)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的糖是d-呋喃核糖,糖的修饰是d-呋喃核糖的2’-o-甲基化和/或2′-o,4′-c-亚乙基化。
(11)根据(1)~(10)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其中,构成寡核苷酸的磷酸二酯键的修饰是硫代磷酸酯。
(12)心功能障碍的预防和/或治疗药,其包含根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物。
(13)根据(12)所述的预防和/或治疗药,其以表达肌营养不良蛋白dp116的患者为对象。
(14)根据(13)所述的预防和/或治疗药,其中,表达肌营养不良蛋白dp116的患者是迪谢内型肌营养不良患者。
(15)dp116表达抑制剂,其包含根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物。
(16)心功能障碍的预防和/或治疗方法,其包括向受试者以医药上有效的量施用根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物。
(17)抑制dp116表达的方法,其包括用根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物处理表达dp116的细胞、组织或器官。
(18)根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,用于在心功能障碍的预防和/或治疗方法中使用。
(19)根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物的用途,用于抑制dp116的表达。
(20)一种用于口服或非口服地给药的制剂,其包含根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物。
(21)根据(1)~(11)中任一项所述的寡核苷酸、其药理上允许的盐或溶剂合物,其用作药物。
本发明以dmd患者表达的dp116作为靶标,非常期待成为特异性极高的治疗法。
发明效果
通过本发明能够实现抑制dp116的表达,治疗心功能障碍。
本说明书包含作为本申请的优先权基础的日本专利申请特愿2018-112863的说明书和/或附图中所记载的内容。
附图简述
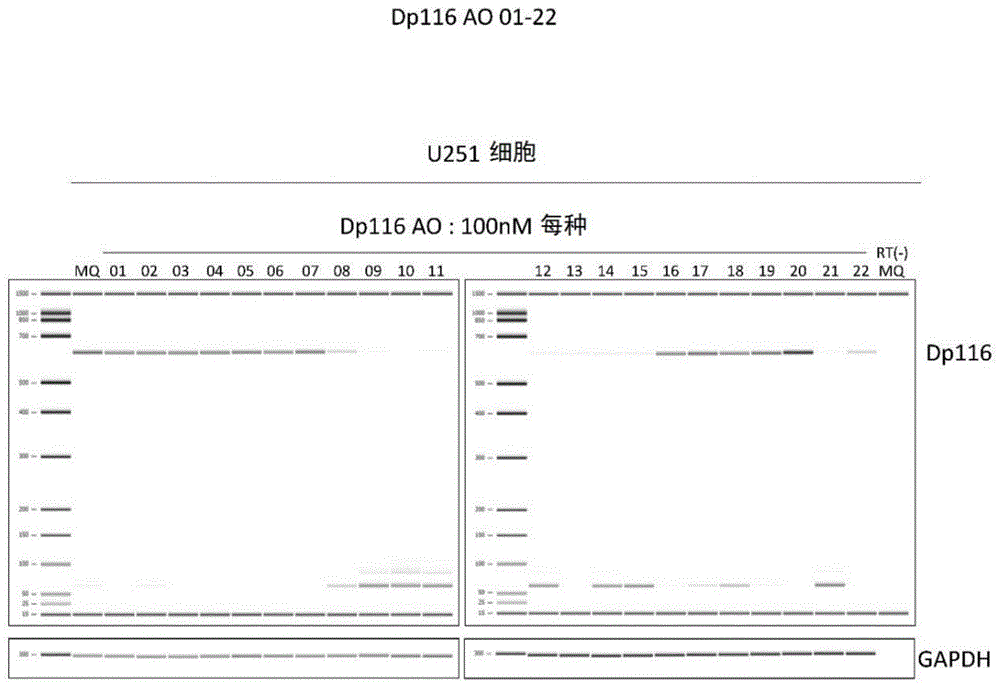
图1:将合成的反义寡核苷酸导入u251细胞中,对24小时后自细胞提取的mrna进行rt-pcr而扩增,使用bioanalyzer进行分析的图。显示了dp116和gapdh的rt-pcr产物的泳动条带。
图2:半定量分析图1中扩增的产物的结果。求出dp116和gapdh的rt-pcr产物量的比,以ao无添加(mq)时为1,而以比的方式表示了各ao添加时的值。
图3:示出了本发明的寡核苷酸的作用机制。本发明的寡核苷酸对dp116的外显子1(s1)和外显子56连接的剪接反应进行阻断,能够特异地阻碍dp116表达。
图4:显示了由实施例化合物对miracell心肌细胞中的dp116蛋白质表达进行抑制的图。纵轴显示了dp116的条带强度除以β-肌动蛋白的条带强度的值。
图5:示出了由实施例化合物对u251细胞中的dp116mrna表达进行抑制的图。纵轴显示了dp116的pcr反应物的条带强度除以gapdh的pcr反应物的条带强度的值。
图6:示出了由实施例化合物对u251细胞中的dp116mrna表达进行抑制的图。纵轴显示了dp116的pcr反应物的条带强度除以gapdh的pcr反应物的条带强度的值。
具体实施方式
以下,对本发明的实施形态进一步详细说明。
本发明提供了寡核苷酸、其药理上允许的盐或溶剂合物,上述寡核苷酸是含有与肌营养不良蛋白基因的内含子55区域的一部分互补的核苷酸序列的、碱基数为15~30的寡核苷酸,其包含5’-tgtcttcct-3’或5’-cagcttgaaccgggc-3’(seqidno:64)的序列(其中,序列中的t可以为u)。
本发明的寡核苷酸、其药理上允许的盐和溶剂合物优选地包含5’-tgtcttcct-3’的序列(其中,序列中的t可以为u)。
作为本发明的寡核苷酸、其药理上允许的盐和溶剂合物,可以例示包含seqidno:15~59中的任一序列(其中,序列中的t可以为u、u可以为t)的那些。
本发明的寡核苷酸的碱基数为15~30是合适的,优选为15~21、更优选为15~18。
本发明的寡核苷酸、其药理上允许的盐和溶剂合物能够抑制肌营养不良蛋白dp116的表达。通过抑制dp116的表达,可以期待心功能障碍的预防和/或治疗效果。
dmd基因是负责迪谢内型肌营养不良(dmd)的基因,其的异常会导致肌营养不良蛋白(dp427)发生缺陷。dmd基因为人最大的基因,有4200kb,编码包含79个外显子的14kb的mrna。基因内有5个启动子,由它们分别产生dp427、dp260、dp140、dp116和dp71这些组织特异性的肌营养不良蛋白同工型。
肌营养不良蛋白dp116是由在内含子55内的启动子产生的第2小的同工型,在施旺细胞中表达。该启动子被命名为s启动子,然后外显子1被命名为s1。其mrna与其他同工型共享dp116特异性的外显子1,以及dmd基因的外显子56至79的外显子。
本发明的寡核苷酸是反义寡核苷酸,其由与肌营养不良蛋白基因的内含子55区域的一部分互补的核苷酸序列组成。本发明的寡核苷酸能够对dp116的外显子1(s1)与外显子56连接的剪接反应进行阻断,特异性阻碍dp116的表达(图3)。认为本发明的寡核苷酸对内含子55的功能没有影响,或者即使有影响的话也很小,例如,认为并不对dp427的前mrna进行降解。
构成本发明的寡核苷酸(反义寡核苷酸)的核苷酸可以为天然型dna、天然rna、dna/rna嵌合体及它们的修饰形式中的任一种,优选其中至少1个为修饰核苷酸。
作为本发明中的修饰核苷酸,可以例示糖被修饰的那些(例如,d-呋喃核糖的2’位的羟基被修饰的那些(d-呋喃核糖被2′-o-烷基化的那些、d-呋喃核糖被2′,4′-交联化的那些(d-呋喃核糖被2′-o,4′-c-亚烷基化的那些等)等)、磷酸二酯键被修饰的那些(例如,硫代酯化(チオエ一ト化)、碱基被修饰的那些、组合这些修饰的那些等。就构成反义寡核苷酸的至少一个d-呋喃核糖被′-o-烷基化的那些或被2′-o,4′-c-亚烷基化的那些而言,由于对rna的结合力高、对核酸酶的耐性高,因此可期待高于天然型的核苷酸(即,寡dna、寡rna)的治疗效果。另外,对构成寡核苷酸的至少一个磷酸二酯键被硫代酯化的那些而言,由于对核酸酶的耐性高,因此也可以期待高于天然型的核苷酸(即,寡dna、寡rna)的治疗效果。包含如上所述的被修饰的糖和被修饰的磷酸这两者的寡核苷酸由于对核酸酶的耐性更高,因此可以期待更加高的治疗效果。
关于本发明的寡核苷酸(反义寡核苷酸),作为糖的修饰的例子,可以例举:d-呋喃核糖的2′-o-烷基化(例如,2′-o-甲基化、2′-o-氨基乙基化、2′-o-丙基化、2′-o-烯丙基化、2′-o-甲氧基乙基化、2′-o-丁基化、2′-o-戊基化、2′-o-炔丙基化等);d-呋喃核糖的2′-o,4′-c-亚烷基化(例如,2′-o,4′-c-亚乙基化、2′-o,4′-c-亚甲基化、2′-o,4′-c-亚丙基化、2′-o,4′-c-四亚甲基化、2′-o,4′-c-五亚甲基化等)、s-cet(2′,4′-约束的乙基(constrainedethyl))、amna(酰胺交联的核酸(amide-bridgednucleicacid))等的2′,4′-交联化;d-呋喃核糖的2′-脱氧-2′-c,4’-c-亚甲氧基亚甲基化、3′-脱氧-3′-氨基-2′-脱氧-d-呋喃核糖、3′-脱氧-3′-氨基-2′-脱氧-2′-氟-d-呋喃核糖等的2′脱氧化与其他修饰的组合等。
关于本发明的寡核苷酸(反义寡核苷酸),作为磷酸二酯键的修饰的例子,可以例举:硫代磷酸酯键、甲基膦酸酯键、甲基硫代膦酸酯键、二硫代磷酸酯键、磷酰胺酯(phosphoroamidate)键等。
关于本发明的寡核苷酸(反义寡核苷酸),作为碱基的修饰的例子,可以例举:胞嘧啶的5-甲基化、5-氟化、5-溴化、5-碘化、n4-甲基化、胸腺嘧啶的5-去甲基化(尿嘧啶)、5-氟化、5-溴化、5-碘化、腺嘌呤的n6-甲基化、8-溴化、鸟嘌呤的n2-甲基化、8-溴化等。
作为构成本发明的寡核苷酸的核苷酸残基,可以例举下述所示结构的at、gt、5mect、ct、tt、ut、ap、gp、5mecp、cp、tp、up、as、gs、5mecs、cs、ts、us、am1t、gm1t、cm1t、5mecm1t、um1t、am1p、gm1p、cm1p、5mecm1p、um1p、am1s、gm1s、cm1s、5mecm1s、um1s、a2t、g2t、c2t、t2t、ae2p、ge2p、ce2p、te2p、ae2s、ge2s、ce2s、te2s、a1t、g1t、c1t、t1t、ae1p、ge1p、ce1p、te1p、ae1s、ge1s、ce1s、te1s、am2t、gm2t、5mecm2t、tm2t、am2p、gm2p、5mecm2p、tm2p、am2s、gm2s、5mecm2s、tm2s。
本发明的寡核苷酸(反义寡核苷酸)可以使用市售的合成仪(例如,perkinelmer公司的利用亚磷酰胺(phosphoramidite)法的模型392)等,可以按照文献(nucleicacidsresearch,12,4539(1984))所记载的方法合成。关于此时可使用的亚磷酰胺试剂,关于天然型的核苷及2′-o-甲基核苷(即,2’-o-甲基鸟苷、2’-o-甲基腺苷、2’-o-甲基胞苷、2’-o-甲基尿苷),可以使用市售的试剂。关于烷基的碳数为2~6个的2’-o-烷基鸟苷、腺苷、胞苷及尿苷,如以下所述。
2′-o-氨基乙基鸟苷、腺苷、胞苷、尿苷可以按照文献(blommers等人,biochemistry(1998),37,17714-17725.)所述合成。
2′-o-丙基鸟苷、腺苷、胞苷、尿苷可以按照文献(lesnik,e.a.等人,biochemistry(1993),32,7832-7838.)所述合成。
2′-o-烯丙基鸟苷、腺苷、胞苷、尿苷可以使用市售的试剂。
2′-o-甲氧基乙基鸟苷、腺苷、胞苷、尿苷可以按照专利(us6261840)或文献(martin,p.helv.chim.acta.(1995)78,486-504.所述合成。
2′-o-丁基鸟苷、腺苷、胞苷、尿苷可以按照文献(lesnik,e.a.等人,biochemistry(1993),32,7832-7838.)所述合成。
2′-o-戊基鸟苷、腺苷、胞苷、尿苷可以按照文献(lesnik,e.a.等人,biochemistry(1993),32,7832-7838.)所述合成。
2′-o-炔丙基鸟苷、腺苷、胞苷、尿苷可以使用市售的试剂。
2′-o,4′-c-亚甲基鸟苷、腺苷、胞苷、5-甲基胞苷和胸苷可以按照wo99/14226所述的方法制备,关于亚烷基的碳数为2~5个的2′-o,4′-c-亚烷基鸟苷、腺苷、胞苷、5-甲基胞苷和胸苷可以按照wo00/47599所述的方法制备。
d-呋喃核糖的被2′-脱氧-2′-c,4′-c-亚甲基氧基亚甲基化的核苷可以按照文献(wang,g.等人,tetrahedron(1999),55,7707-7724所述合成。
s-cet(约束的乙基,constrainedethyl)可以按照文献(seth,p.p.等人,j.org.chem(2010),75,1569-1581)所述合成。
amna可以按照文献(yahara,a.等人,chembiochem(2012),13,2513-2516)或wo2014/109384所述合成。
在本发明中,核酸碱基序列可以分别将腺嘌呤记载为(a)或(a),将鸟嘌呤记载为(g)或(g),将胞嘧啶记载为(c)或(c),将胸腺嘧啶记载为(t)或(t),和将尿嘧啶记载为(u)或(u)。可以使用5-甲基胞嘧啶代替胞嘧啶。核酸碱基中尿嘧啶(u)或(u)与胸腺嘧啶(t)或(t)具有互换性。尿嘧啶(u)或(u)与胸腺嘧啶(t)或(t)的任一者均可用于形成与互补链的腺嘌呤(a)或(a)的碱基对。
通过在将亚磷酰胺试剂耦合后,使硫、二硫化四乙基秋兰姆(tetd,appliedbiosystems公司)、beaucage试剂(glenresearch公司)、或氢化黄原素(xanthanehydride)等试剂进行反应,由此可以合成具有硫代磷酸酯键的反义寡核苷酸(tetrahedronletters,32,3005(1991),j.am.chem.soc.112,1253(1990),pct/wo98/54198)。
作为合成仪所使用的可控孔度玻璃(cpg),对键合了2′-o-甲基核苷的可控孔度玻璃而言,可以利用市售品。另外,可以按照文献(oligonucleotidesynthesis,editedbym.j.gait,oxforduniversitypress,1984)所述,将按照wo99/14226所述的方法制备的2′-o,4′-c-亚甲基鸟苷、腺苷、5-甲基胞苷和胸苷、按照wo00/47599所述的方法制备的亚烷基的碳数为2~5个的2′-o,4′-c-亚烷基鸟苷、腺苷、5-甲基胞苷和胸苷这样的核苷键接至cpg。通过使用经修饰的cpg(日本特开平7-87982的实施例12b所记载),可以合成3′末端键接了2-羟基乙基磷酸基的寡核苷酸。另外,如果使用3′-氨基-修饰基c3cpg、3′-氨基-修饰基c7cpg、甘油基cpg(glenresearch)、3′-间隔基c3synbasecpg1000、3′-间隔基c9synbasecpg1000(linktechnologies),则可以合成3′末端键接了羟基烷基磷酸基或氨基烷基磷酸基的寡核苷酸。
本发明的寡核苷酸(反义寡核苷酸)作为药物,具体地可以用于心功能障碍的预防和/或治疗,特别地用于心肌损伤例如心肌病,优选为扩张型心肌病的预防和/或治疗。
本发明的寡核苷酸(反义寡核苷酸)也可以以药理上允许的盐的形式使用。所谓“药理上允许的盐”是指寡核苷酸(反义寡核苷酸)的盐,作为这样的盐,可以例举:如钠盐、钾盐、锂盐这样的碱金属盐;如钙盐、镁盐这样的碱土金属盐;铝盐、铁盐、锌盐、铜盐、镍盐、钴盐等金属盐;如铵盐这样的无机盐;如叔辛基胺盐、二苄基胺盐、吗啉盐、葡萄糖胺(glucosamine)盐、苯基甘氨酸烷基酯盐、乙二胺盐、n-甲基还原葡糖胺(glucamine)盐、胍盐、二乙胺盐、三乙胺盐、二环己基胺盐、n,n’-二苄基乙二胺盐、氯普鲁卡因盐、普鲁卡因盐、二乙醇胺盐、n-苄基-苯乙基胺盐、哌嗪盐、四甲基铵盐、三(羟甲基)氨基甲烷盐的有机盐等胺盐;如氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐这样的氢卤酸盐;硝酸盐、高氯酸盐、硫酸盐、磷酸盐等无机酸盐;如甲磺酸盐、三氟甲磺酸盐、乙磺酸盐这样的低级烷基磺酸盐;如苯磺酸盐、对甲苯磺酸盐这样的芳基磺酸盐;乙酸盐、苹果酸盐、反丁烯二酸盐、丁二酸盐、柠檬酸盐、酒石酸盐、草酸盐、顺丁烯二酸盐等有机酸盐;如甘氨酸盐、赖氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐这样的氨基酸盐等。这些盐可以通过公知的方法制备。
另外,寡核苷酸(反义寡核苷酸)和其药理上允许的盐有时也以溶剂合物(例如,水合物)的形式存在,也可为这样的溶剂合物。
因此,本发明提供了包含上述寡核苷酸、其药理上允许的盐或溶剂合物的心功能障碍的预防和/或治疗药。
本发明的预防和/或治疗药可以以表达肌营养不良蛋白dp116的患者为对象。表达肌营养不良蛋白dp116的患者可以为迪谢内型肌营养不良患者,但不限于这样的患者。
在将本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物用于心功能障碍的预防和/或治疗的情形,可将其本身或与适宜的药理上允许的赋形剂、稀释剂等混合,通过片剂、胶囊剂、颗粒剂、散剂或糖浆剂等口服地,或者通过注射剂、栓剂、贴附剂或外用剂等非口服地给药。
这些制剂是使用赋形剂(例如,如以下的有机类赋形剂:如乳糖、白糖、葡萄糖、甘露糖醇、山梨糖醇这样的糖衍生物;如玉米淀粉、马铃薯淀粉、α淀粉、糊精这样的淀粉衍生物;如结晶纤维素的纤维素衍生物;阿拉伯胶;葡聚糖;支链淀粉;如以下的无机类赋形剂:如轻质无水硅酸、合成硅酸铝、硅酸钙、偏硅铝酸镁这样的硅酸盐衍生物;如磷酸氢钙这样的磷酸盐;如碳酸钙这样的碳酸盐;如硫酸钙这样的硫酸盐等;等)、润滑剂(例如,硬脂酸;如硬脂酸钙、硬脂酸镁的这样硬脂酸金属盐;滑石;胶体二氧化硅;如蜂蜡、鲸蜡这样的蜡类;硼酸;己二酸;如硫酸钠这样的硫酸盐;二醇;反丁烯二酸;苯甲酸钠;dl亮氨酸;如月桂基硫酸钠、月桂基硫酸镁的这样月桂基硫酸盐:如无水硅酸、硅酸水合物的硅酸类;上述淀粉衍生物等)、粘合剂(例如,羟丙基纤维素、羟丙基甲基纤维素、聚乙烯基吡咯烷酮、聚乙二醇、与上述赋形剂同样的化合物等)、崩解剂(例如,如低取代度羟丙基纤维素、羧甲基纤维素、羧甲基纤维素钙、内部交联羧甲基纤维素钠这样的纤维素衍生物;如羧甲基淀粉、羧甲基淀粉钠、交联聚乙烯基吡咯烷酮这样的经化学修饰的淀粉/纤维素类等)、乳化剂(例如,如膨润土、胶体硅铝酸镁(veegum)这样的胶体性黏土;如氢氧化镁、氢氧化铝这样的金属氢氧化物;如月桂基硫酸钠、硬脂酸钙这样的阴离子表面活性剂;如苯扎氯铵这样的阳离子表面活性剂;如聚氧乙烯烷基醚、聚氧乙烯山梨糖醇酐脂肪酸酯、蔗糖脂肪酸酯这样的非离子表面活性剂等)、稳定剂(如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯这样的对氧基苯甲酸酯类;如氯丁醇、苄醇、苯乙醇这样的醇类;苯扎氯铵;如苯酚、甲酚这样的酚类;硫柳汞;脱氢乙酸;山梨酸等)、矫味除臭剂(例如,通常使用的甜味剂、酸味剂、香料等)、稀释剂等添加剂,通过公知的方法而制备。
本发明的预防和/或治疗药可以含有0.1~250μ摩尔/ml的寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物,优选地,可以含有1~50μ摩尔/ml的寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物、0.02~10%w/v的碳水化物或多元醇和0.01~0.4%w/v的药理上允许的表面活性剂。
作为上述碳水化合物,特别优选单糖类或二糖类。作为这些碳水化合物和多元醇的例子,可以例举:葡萄糖、半乳糖、甘露糖、乳糖、麦芽糖、甘露糖醇和山梨糖醇。这些可单独使用,也可并用。
另外,作为本发明中的表面活性剂的优选的例子,可以例举:聚氧乙烯山梨糖醇酐单酯~三酯、烷基苯基聚氧乙烯、牛胆酸钠、胆酸钠(sodiumcholate)及多元醇酯。其中,特别优选聚氧乙烯山梨糖醇酐单酯~三酯,其中,作为酯,特别优选油酸酯、月桂酸酯、硬脂酸酯和棕榈酸酯。这些可单独使用,也可并用。
另外,本发明的治疗药更优选为可含有0.03~0.09m的药理上允许的中性盐、例如氯化钠、氯化钾和/或氯化钙。
另外,本发明的治疗药更优选为可含有0.002~0.05m的药理上允许的缓冲剂。作为优选的缓冲剂的例子,可以例举:柠檬酸钠、甘氨酸钠、磷酸钠、三(羟甲基)氨基甲烷。这些缓冲剂可单独使用,也可并用。
进一步地,上述的治疗药可通过溶液状态供给。但是,由于存在必须保存一定时间的情形等,故而为了使寡核苷酸(反义寡核苷酸)稳定而防止治疗效果的降低,通常优选预先冷冻干燥,在这种情况下,在使用时以溶解液(注射用蒸馏水等)重建(reconstruction),即,制成施用的液体状态使用即可。因此,本发明的治疗药也括冷冻干燥的状态的治疗药,所述治疗药用于以各成分成为特定的浓度范围的方式利用溶解液进行重建而使用。为了促进冷冻干燥物的溶解性,可使其进一步含有白蛋白、甘氨酸等氨基酸。
在施用本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物给人的情形,例如,以成人每天约0.01~100mg/kg(体重)、优选地0.1~20mg/kg(体重)的施用量,1次或分成多次进行皮下注射、点滴静脉注射或静脉注射即可,其施用量或施用次数可根据疾病的种类、症状、年龄、施用方法等适当变更。
将本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物向人、例如表达肌营养不良蛋白dp116的患者的施用可以例如如下所述进行。即,通过技术人员公知的方法制备寡核苷酸(反义寡核苷酸)、其药理上允许的盐或溶剂合物,通过常规方法对其进行杀菌处理,例如制备125mg/ml的注射用溶液。将该溶液例如以输液的形式点滴注射施用至患者静脉内,使得寡核苷酸(反义寡核苷酸)的施用量相对于体重每1kg例如成为10mg。施用例如是以1周的间隔进行,其后也通过通过超声心动图在确认治疗效果的同时适当地重复该治疗。
另外,本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐和溶剂合物可以用于抑制dp116的表达。因此,本发明提供了dp116表达抑制剂,其包含上述寡核苷酸、其药理上允许的盐或溶剂合物。作为dp116表达抑制剂,可以使用在表达dp116的细胞中,与对照相比,可以将dp116mrna量减少至约30%以下、优选为20%以下、更优选为10%以下的寡核苷酸、其药理上允许的盐或溶剂合物,但是只要具有dp116的表达抑制功能即可,并不限于上述范围。本发明的dp116表达抑制剂可以作为药物或实验用试剂使用。
作为实验用试剂使用的情形,可以通过用本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐和溶剂合物处理表达dp116的细胞、组织或器官而抑制dp116的表达。本发明的寡核苷酸(反义寡核苷酸)、其药理上允许的盐和溶剂合物可以按对抑制dp116表达而言有效的量使用。作为表达dp116的细胞,可以例示胶质母细胞瘤(glioblastoma)来源的细胞、心肌细胞(cardiomyocyte)、施旺细胞等天然来源的细胞。另外,也可以例示除了天然来源的细胞之外的、导入了dp116基因的重组细胞。作为表达dp116的组织和器官,可以例示胶质母细胞瘤(glioblastoma)、心脏、外周神经系统等。可以通过用rt-pcr分析样品中的dp116mrna、用蛋白质印迹法检测样品中的dp116蛋白质、用质量分析法检测对dp116特异的肽片段,由此分析dp116的表达。
实施例
在下文中,通过实施例具体描述本发明。另外,这些实施例是用于描述本发明,而不是限制本发明的范围。
(参考例1~14)
ho-am1s-te2s-am1s-gm1s-te2s-am1s-gm1s-ae2s-am1s-gm1s-ae2s-am1s-um1s-ce2s-um1s-gm1s-ae2s-cm1t-h(dp116-01)(seqidno:1)
使用核酸自动合成仪(bioautomation制造的mermade192x),利用亚磷酰胺法(nucleicacidsresearch,12,4539(1984))进行合成。作为试剂,使用活化剂溶液-3(0.25mol/l5-苄硫基-1h--四唑/乙腈溶液,和光纯药工业制造,产品编号013-20011)、capaforakta(1-甲基咪唑/乙腈溶液,sigma-aldrich制造,产品编号l040050)、capb1forakta(乙酸酐/乙腈溶液,sigma-aldrich制造,产品编号l050050)、capb2forakta(吡啶/乙腈溶液,sigma-aldrich制造,产品编号l050150)、dcadeblock(二氯乙酸/甲苯溶液,sigma-aldrich制造,产品编号l023050)。作为用来形成硫代磷酸酯键的硫化试剂,使用乙腈(脱水,关东化学制造,产品编号01837-05)、吡啶(脱水,关东化学制造,产品编号11339-05)1∶1(v/v)溶液进行溶解,使得苯基乙酰基二硫化物(carbosynth制造,产品编号fp07495)为0.2m而使用。作为亚酰胺(amidite)试剂,2’-o-me核苷的亚磷酰胺(腺苷体产品编号anp-5751,胞苷体产品编号anp-5752,鸟苷体产品编号anp-5753,尿苷体产品编号anp-5754)而言,使用了chemgenes制造的那些。对非天然型的亚磷酰胺而言,使用了日本专利特开2000-297097的实施例14(5’-o-二甲氧基三苯甲基-2’-o,4’-c-亚乙基-6-n-苯甲酰基腺苷-3’-o-(2-氰基乙基n,n-二异丙基)亚磷酰胺)、实施例27(5’-o-二甲氧基三苯甲基-2’-o,4’-c-亚乙基-2-n-异丁酰基鸟苷-3’-o-(2-氰基乙基n,n-二异丙基)亚磷酰胺)、实施例22(5’-o-二甲氧基三苯甲基-2’-o,4’-c-亚乙基-4-n-苯甲酰基-5-甲基胞苷-3’-o-(2-氰基乙基n,n-二异丙基)亚磷酰胺)、实施例9(5’-o-二甲氧基三苯甲基-2’-o,4’-c-亚乙基-5-甲基尿苷-3’-o-(2-氰基乙基n,n-二异丙基)亚磷酰胺)的化合物。作为固相载体,使用glenunysupportfc96孔形式0.2μmol(glenresearch制造),合成了表述的参考例1的化合物。其中,亚酰胺体的缩合所需的时间设为约9分钟。
利用600μl的浓氨水处理具有目的序列的被保护的寡核苷酸类似物,由此自支持体切下低聚物,并且脱去磷原子上的保护基氰基乙基和核酸碱基上的保护基。将低聚物的混合溶液与clarityqspdna上样缓冲液(phenomenex制造)300μl混合并装到clarityspe96孔板(phenomenex制造)上。依序添加clarityqspdna上样缓冲液∶水=1∶1溶液1ml、水3ml、3%二氯乙酸(dca)水溶液3ml、水6ml后,收集通过20mmtris水溶液∶乙腈=9∶1溶液提取的成分。将溶剂蒸馏去除后,获得目的化合物。该化合物用反相hplc(柱(phenomenex,clarity2.6μmoligo-ms100a(2.1×50mm));a溶液:100mm六氟异丙醇(hfip)、8mm三乙胺水溶液;b溶液:甲醇;b%:10%→25%(4分钟,线性梯度);60℃;0.5ml/分钟;260nm)分析后,在2.887分钟被洗脱。通过负离子esi质量分析而鉴定化合物。
本化合物的碱基序列是与智人肌营养不良蛋白(dmd)(ncbi-genbank登录号ng_012232.1)的核苷酸编号1836403~1836420进行互补的序列。
与参考例1的化合物同样地,也合成了参考例2至14的化合物。表1中记载了参考例1的化合物的数据和参考例2至14的化合物。
表1
表中的“序列”中的大写字母表示d-呋喃核糖的2′-o,4′-c-亚乙基化,小写字母表示d-呋喃核糖的2′-o-甲基化。核苷之间的键均为硫代磷酸酯键。即,大写字母是ae2s、ge2s、ce2s、te2s中的任一者,3’末端以外的小写字母是am1s、gm1s、cm1s、um1s,3’末端的小写字母是am1t、gm1t、cm1t、um1t中的任一者。表中的“开始”和“结束”表示在x染色体上智人肌营养不良蛋白(dmd)refseqgene(lrg_199)(ncbi-genbank登录号ng_012232.1)的核苷酸编号,表中的“序列”示出与从“开始”到“结束”的核苷酸序列互补的序列。表中的“分子量”表示了通过负离子esi质量分析的实测值。
(实施例1~10)
与参考例1同样地,也合成了实施例1至10的化合物。表2中记载了实施例1至10的化合物。
表2
表中的“序列”中的大写字母表示d-呋喃核糖的2′-o,4′-c-亚乙基化,小写字母表示d-呋喃核糖的2′-o-甲基化。核苷之间的键均为硫代磷酸酯键。即,大写字母是ae2s、ge2s、ce2s、te2s中的任一者,3’末端以外的小写字母是am1s、gm1s、cm1s、um1s,3’末端的小写字母是am1t、gm1t、cm1t、um1t中的任一者。表中的“开始”和“结束”表示在x染色体上智人肌营养不良蛋白(dmd)refseqgene(lrg_199)(ncbi-genbank登录号ng_012232.1)的核苷酸编号,表中的“序列”示出与从“开始”到“结束”的核苷酸序列互补的序列。表中的“分子量”表示了通过负离子esi质量分析的实测值。
(实施例11~18)
与参考例1同样地,也合成了实施例11至18的化合物。表3中记载了实施例11至18。
表3
表中的“序列”中的大写字母表示d-呋喃核糖的2′-o,4′-c-亚乙基化,小写字母表示d-呋喃核糖的2′-o-甲基化。核苷之间的键均为硫代磷酸酯键。即,大写字母是ae2s、ge2s、ce2s、te2s中的任一者,小写字母是am1s、gm1s、cm1s、um1s、am1t、gm1t、cm1t、um1t中的任一者。表中的“开始”和“结束”表示在x染色体上智人肌营养不良蛋白(dmd)refseqgene(lrg_199)(ncbi-genbank登录号ng_012232.1)的核苷酸编号,表中的“序列”示出与从“开始”到“结束”的核苷酸序列互补的序列。表中的“分子量”表示了通过负离子esi质量分析的实测值。
(实施例19~45)
与参考例1同样地也合成了实施例19至45的化合物。表4中记载了实施例19至45。
表4
表中的“序列”中的大写字母表示d-呋喃核糖的2′-o,4′-c-亚乙基化,小写字母表示d-呋喃核糖的2′-o-甲基化。核苷之间的键均为硫代磷酸酯键。即,大写字母是ae2s、ge2s、ce2s、te2s中的任一者,小写字母是am1s、gm1s、cm1s、um1s、am1t、gm1t、cm1t、um1t中的任一者。表中的“开始”和“结束”表示在x染色体上智人肌营养不良蛋白(dmd)refseqgene(lrg_199)(ncbi-genbank登录号ng_012232.1)的核苷酸编号,表中的“序列”示出与从“开始”到“结束”的核苷酸序列互补的序列。表中的“分子量”表示了通过负离子esi质量分析的实测值。
(试验例1)实施例和参考例化合物引起的u251细胞的dp116表达抑制
来自胶质母细胞瘤的u251细胞自atcc购入。将细胞在37℃,在5%co2气氛中培养。
寡核苷酸向u251细胞的转染
如下所述,将实施例和参考例制备的化合物(反义寡核苷酸)转染u251细胞。
1.在opti-mem(gibco-brl)100μl中溶解了实施例制备的化合物(用miliq10μg/20μl)200pmol。
2.向1的溶液中加入6μlplusreagent(gibco-brl),室温放置15分钟。
3.在另外的管中于opti-mem100μl中溶解了8μllipofectamine(gibco-brl)。
4.在2的处理后,向处理液添加3,再室温放置15分钟。
5.分化诱导后第4天的成肌细胞用pbs洗1次后,添加opti-mem800μl。
6.在4的处理后,将处理液添加至5中。
7.将6的细胞在37℃5%co2气氛中培养3小时后,向各孔中添加dmem(含有6%hs)500μl。
8.再继续培养。
rna提取
如下所述进行rna的提取。
1.培养转染了反义寡核苷酸的细胞1天后,用pbs洗1次,将isogen(nippongene)500μl添加至细胞。
2.室温放置5分钟后,将孔内的isogen回收到管中。
3.按照isogen(nippongene)的方案提取rna。
4.最后在depw20μl中溶解rna。
逆转录反应
如下所述进行逆转录反应。
1.向rna2μg添加depw(经焦碳酸二乙酯处理的无菌水)至6μl。
2.向1的溶液中添加随机六聚体(invitrogen,3μg/μl进行20倍稀释后)2μl。
3.于65℃加热10分钟。
4.在冰上冷却2分钟。
5.向上述反应液中添加mmlv逆转录酶(invitrogen200u/μl)1μl、人胎盘核糖核酸酶抑制剂(takara40u/μl)1μl、dtt(附随mmlv逆转录酶提供)1μl、缓冲液(附随mmlv逆转录酶提供)4μl、dntps(附随takaraextaq提供)5μl。
6.于37℃保温1小时,然后于95℃加热5分钟。
7.反应后保存在-80℃。
pcr反应
如下所述进行pcr反应。
1.混和下述成分后,94℃加热4分钟。
逆转录反应产物3μl
正向引物(10pmol/μl)1μl
反向引物(10pmol/μl)1μl
dntp(附随takaraextaq提供)2μl
缓冲液(附随takaraextaq提供)2μl
extaq(takara)0.1μl
无菌水11μl
2.94℃处理4分钟后,将94℃1分钟·60℃1分钟·72℃3分钟的处理进行35个循环。
3.72℃加热7分钟。
需要说明的是,用于检测dp116的表达抑制的pcr反应中使用的正向引物和反向引物的碱基序列如下。
正向引物dp116ex1f-2:5′-gggttttctcaggattgctatgc-3′(seqidno:60)
反向引物4f:5′-cccactcagtattgacctcctc-3′(seqidno:61)
另外,使用gapdh基因作为内部标准。pcr反应中使用的正向引物和反向引物的碱基序列如下。
正向引物gapdh-f:5’-cccttcattgacctcaac-3’(seqidno:62)
反向引物gapdh-r:5’-ttcacacccatgacgaac-3’(seqidno:63)
4.使用agilent生物分析仪进行了pcr反应物的分析。泳动分离后定量了各条带的量。
5.pcr反应的反应产物的序列
通过2%琼脂糖凝胶电泳分析了扩增产物。
从泳动后的凝胶切出扩增产物的条带,将pcr产物亚克隆入pt7blue-t载体(novagen),使用thermosequenqsetmiidyeterminatorcyclesequencing试剂盒(amershampharmaciabiotec),通过abiprism310geneticanalyzer(appliedbiosystems)进行测序反应,确认了碱基序列。反应程序按照所附的手册进行。
[结果]
将实施例和参考例的dp116-01至-022的反义寡核苷酸导入u251细胞,24小时后rt-pcr分析了mrna。自替代反义寡核苷酸而仅导入了mq(miliq水)的细胞获得扩增产物。同样地,自导入了各种反义寡核苷酸的细胞提取的rna作为材料,rt-pcr扩增了dp116。获得了扩增产物的条带的浓度不同。(图1:图中泳道的编号01至22分别表示dp116-01至dp116-022。泳道显示mq是表示使用了mq的情况)因此,进行了该扩增产物的半定量分析。其结果是,dp116-08至dp116-015、dp116-021和dp116-022而言,使dp116mrna量降低至与对照相比约20%左右或以下。特别地,dp116-13最强地降低了dp116量。判明其使dp116mrna量降低到为使用了mq的细胞的约10%(图2)。
根据以上确定,dp116-13为最强力的抑制dp116表达的反义寡核苷酸。(试验例2)由实施例化合物对miracell心肌细胞中的dp116蛋白质表达的抑制
将0.1μg/ml纤连蛋白溶液(f1141-1mg,sigma)或0.1%明胶溶液(190-15805,富士film和光纯药)以100μl每孔添加至96孔板中,于37℃孵育2小时,由此包被了板。除去孔中的溶液,同时通过如所附说明书所示的操作进行解冻,将悬浮在thawingmedium(y50015,takarabio)中的miracell心肌细胞(y50015,takarabio)以1x105个细胞/孔、100μl的容量播种在板中,37℃,5%co2培养箱培养2天后,将培养基交换为culturemedium(y50013,takarabio)。再培养1天后,将悬浮在optimem(31985062,gibco)中的1μm实施例化合物(dp116-13、dp116-13a和dp116-13e)与悬浮在optimem中的5%lipofectamine2000(52887,invitrogen)以1∶1混合,并孵育了20分钟,将经孵育的溶液以每孔添加10μl方式进行转染。另外,以添加不含实施例化合物的仅lipofectamine2000的溶液的那些作为阴性对照、以添加了dp116表达质粒的那些作为阳性对照。培养3天后(第6天),将细胞用pbs(10010023,gibco)洗2次,将125mmtris-hcl(ph6.8),4%sds,4m脲中添加有蛋白酶抑制剂(p8340,sigma)的裂解缓冲液(lysisbuffer)每孔添加50μl,由此,溶解细胞而产生裂解物(lysate)。
将laemmli样品缓冲液(1610737,bio-rad)中添加了100mmdtt的样品缓冲液与裂解物以1∶1的体积混合,95℃加热处理5分钟。将该样品以每孔10μl加样至4-20%criteriontgx预制凝胶(5671095,bio-rad),于150v电泳60分钟。泳动后,使用iblot2干式转印系统(thermoscientific)将凝胶上的蛋白质转移到pvdf膜。使用startingblock(tbs)封闭缓冲液(37579,thermoscientific)封闭后,与用cangetsignalimmunoreactionenhancersolution1(nkb-101,toyobo)1000倍稀释的抗肌营养不良蛋白抗体(ab15277,abcam)4℃反应一晚。pvdf膜用tbs-t(9997s,cst)洗涤后,与用cangetsignalsolution2进行20000倍稀释的抗兔igg,hrp-linkedwholeabdonkey(na-934-1ml,gehealthcare)室温反应1小时。pvdf膜用tbs-t洗涤后,与luminatafortewesternhr底物(wbluf0500,merck-millipore)反应1分钟,用imagequantlas4000(gehealthcare)检测化学发光的条带。对上样对照的β-肌动蛋白而言,如下检测:将检测dp116后的pvdf膜浸在restorepluswesternblotstrippingbuffer(46430,thermoscientific)室温15分钟进行剥脱后,将pvdf膜与用cangetsignalimmunoreactionenhancersolution1进行1000倍稀释的抗β-肌动蛋白抗体(4970s,cst)和用cangetsignalsolution2进行20000倍稀释的抗兔igg,hrp-linkedwholeabdonkey于室温各反应1小时,使用luminatafortewesternhr底物,用imagequantlas4000检测化学发光的条带。
对于dp116和β-肌动蛋白的条带,使用imagequanttl软件计算了从各条带的条带平均发光强度减去背景的发光强度后的值。为了校正上样量,用dp116的条带强度除以β-肌动蛋白的条带的值绘制了图(图4)。
dp116蛋白质的条带强度在为阳性对照的转染了dp116质粒的细胞中是增加的。另一方面,在转染了实施例化合物(dp116-13、dp116-13a、和dp116-13e)的细胞中,条带强度与对照相比是降低的,dp116蛋白质的表达量减少了。特别地,与对照相比,dp116-13将dp116蛋白质表达量减少至约30%左右。
(试验例3)由实施例化合物对u251细胞中的dp116表达的抑制
用与试验例1同样的方法评价了实施例化合物dp116-13、dp116-13a至dp116-13h。其结果是,与对照相比,dp116-13、dp116-13a至dp116-13h将dp116mrna量降低至约20%以下(图5)。特别地,与对照相比,dp116-13a,-13b,-13c,-13g和-13h将dp116mrna量降低至约10%左右或以下。
(试验例4)由实施例化合物对u251细胞中的dp116表达的抑制
用与试验例1同样的方法评价了实施例化合物dp116-13a.1至dp116-13a.8。其结果是,与对照相比,dp116-13a.1至dp116-13a.8将dp116mrna量降低(图6)。特别地,与对照相比,dp116-13a.1、dp116-13a.3至dp116-13a.5将dp116mrna量降低至约20%左右或以下。
将本说明书所引用的全部刊物、专利及专利申请直接作为参考而并入本说明书中。
产业上的可利用性
本发明能够用于心功能障碍的预防和/或治疗。
序列表独立文本
<seqidno:1~59>示出反义寡核苷酸的序列。构成反义寡核苷酸的核苷酸可以为天然型dna、天然型rna、dna/rna的嵌合体、它们的修饰体中任一种,也可以为至少1个为修饰核苷酸。
<seqidno:60~63>示出引物的序列。
<seqidno:64>示出反义寡核苷酸的序列。构成反义寡核苷酸的核苷酸可以为天然型dna、天然型rna、dna/rna的嵌合体、它们的修饰体中任一种,也可以为其中至少1个为修饰核苷酸。
- 还没有人留言评论。精彩留言会获得点赞!