微生物和精细化学品生产的制作方法
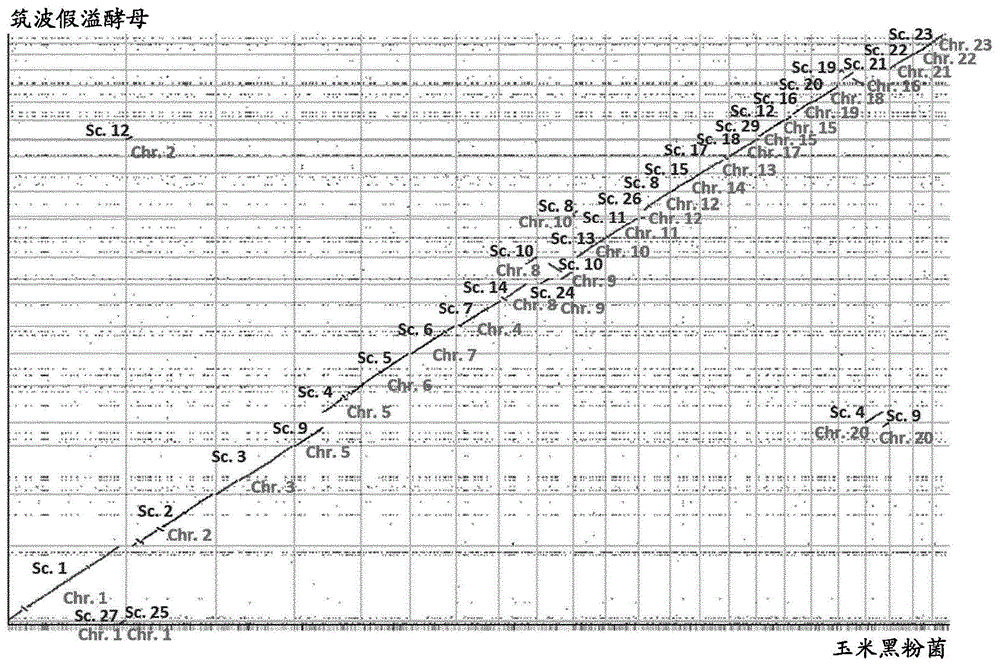
本发明涉及发酵生产精细化学品、尤其衣康酸酯或衣康酸。本发明提供生产微生物、发酵组合物和培养基、可用于生所述产物的蛋白质与表达这类蛋白质的核酸,和用于生产精细化学品的方法。发明背景衣康酸,也称作亚甲基酸琥珀酸,亚甲基丁二酸、丙烯二羧酸或2-丙烯-1,2-二羧酸,是多种产品(例如丙烯酸纤维和橡胶)的重要前体,或例如用作非织造纤维、纸和混凝土涂料中的粘合剂和施胶剂。衣康酸酯可以用作其他商品和专用化学品的中间体。工业上迄今用来生产衣康酸的主要生产微生物是丝状真菌土曲霉(aspergillusterreus,土曲霉(a.terreus))。尽管已经在土曲霉中实现高滴度的衣康酸,该生物遭遇最佳用于衣康酸生产的培养基中生长不良并且不利地受剪切应力影响,从而排除在常规的搅拌罐生物反应器中进行发酵。以遗传方式优化土曲霉的尝试至多已经产生不确定的结果(参见例如wo2016069849)。已经测试用于衣康酸生产的多种备选微生物,包括解脂耶罗维亚酵母(yarrowialipolytica)(wo2016069849)、大肠杆菌(escherichiacoli)(us2010285546)、酿酒酵母(saccharomycescerevisiae)(wo2015181312)。geiser等人(fungalbiologyandbiotechnology2014,1:2)已经测试用于衣康酸生产的多种黑粉菌(ustilaginomycetes)并且发现大部分受测微生物还以甚至更大的量产生副产物,如苹果酸酯,因而削弱预期的衣康酸生产率。苹果酸酯作为副产物形成是特别不利的,因为衣康酸生产过程据信依赖于krebs循环,从而苹果酸酯损耗将降低衣康酸生产效率。其他受测黑粉菌是要求特定生物安全规定的明确的植物病原体如狗牙根黑粉菌(ustilagocynodontis),因而降低工业适用性。另外,全部生产均依赖于包含酵母提取物(一种昂贵的工业规模发酵用组分)的复杂培养基。wo2009106627a2描述了使用假溢酵母(pseudozyma)、假丝酵母属(candida)和球拟酵母属(torulopsis)酵母生产衣康酸的生产方法。但是,该文件报道了低得不可接受的生产率(0.25g/(lh))和产率(37.5%w/w衣康酸:葡萄糖)。同样,文件wo2016103140描述了通过分类学黑粉菌纲(ustilaginomycetes)的多种成员尤其生产衣康酸酯。该文件报道(图13),在近乎7天培养后获得的衣康酸酯浓度总是低于10g/l,并且对于大部分受测菌株,不能获得衣康酸酯生产或获得明显的副产物如苹果酸酯。因此,仍需要产业规模生产衣康酸的改进方法和这类改进方法中需要的材料,例如生产微生物、由所述生产微生物表达的蛋白质和表达这类蛋白质的核酸和发酵组合物,包括为衣康酸生产而优化的培养基,及相应的衣康酸生产宿主。发明概述本发明因此提供一种衣康酸生产宿主微生物,其中微生物包含至少一个在ip基因座外部整合入微生物的基因组中的异源表达盒,其中表达盒包含a)在有功能启动子的有效控制下的异源ria1基因,和/或b)在异源有功能启动子的有效控制下的ria1基因。在描述本发明的又一方式,提供一种衣康酸生产宿主微生物,其中宿主是包含表达盒的重组微生物,所述表达盒用于-表达ria1基因和/或-表达至少两个选自adi1、mtt1和tad1的基因,其中所述表达盒在整合位点处整合入微生物的基因组中,其中整合位点a)位于左边界基因和右边界基因之间,其中在相应野生型微生物中,左边界基因和右边界基因的相应翻译起始密码子的相应第一核苷酸由最多51600个核苷酸分隔,其中左边界基因编码具有乙酰-coa合成酶活性的蛋白质,并且其中右边界基因编码蛋白质,其由与seqidno.25具有至少21%同一性的氨基酸序列组成;和/或b)距可读框的最近边界至多51600个核苷酸存在,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列,和/或c)位于可读框内部或替换可读框,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列。在描述本发明衣康酸生产宿主微生物的又一方式,生产宿主是重组微生物,其a)包含产生衣康酸的活跃衣康酸代谢途径,和b)其中失活至少一个基因,其i)编码与以下者具有30%序列同一性的蛋白质和/或ii)其互补链在至少低严格性条件下与编码以下者的核酸序列杂交蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者。在又一个实施方案中,本发明提供整合载体,所述整合载体包含用于ip基因座外部整合的与强组成型活性启动子有效连接的ria1基因。根据本发明,相应地提供生产宿主微生物,其中用本发明的整合载体转化微生物。本发明还提供一种改变衣康酸生产宿主微生物的方法,所述方法包括将-表达ria1基因和/或-表达至少两个选自adi1、mtt1和tad1的基因,的至少一个表达盒整合入微生物的基因组中除ip基因座之外的整合位点处。根据本发明,还提供一种获得重组衣康酸生产宿主微生物的方法,所述方法包括a)培养亲本微生物,b)以任何顺序和/或同时进行,-若如此需要:一次或多次转化,以向微生物提供任何异源adi1、mtt1和tad1基因,以在微生物中获得活跃衣康酸途径,-至少一次整合处于组成型活性启动子控制下的ria1基因,其中不在ip-基因座中整合,-失活至少一个基因,其i)编码与以下者具有30%序列同一性的蛋白质和/或ii)其互补链在至少低严格性条件下与编码以下者的核酸序列杂交蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者;和c)分离因步骤b)产生的重组衣康酸生产宿主微生物。本发明也提供生产衣康酸的生产方法,所述方法包括步骤a)将生产宿主微生物发酵以产生衣康酸,和b)回收步骤(a)中产生的衣康酸,其中微生物是本发明的微生物或根据本发明可获得。优选地,生产方法是分批发酵、补料分批发酵或连续发酵。还优选地,补料分批发酵8天后发酵培养基中衣康酸对苹果酸的浓度比率是至少15:1。附图简述图1.r2cat产生的同线性图。筑波假溢酵母h488的框架映射到玉米黑粉菌(u.maydis)521的基因组序列上图2.puc-ip-ura3质粒构建。借助相应限制性位点的互补作用扩增ptura3的左侧翼区和右侧翼区。将xbai与bglii消化的片段和bglii与ecori消化的片段连接入xbai与ecori切割的pucbm21质粒。图3.ptura3缺失质粒puc-dk-ura3构建。使用bglii,使puc-ip-ura3线性化。潮霉素选择标记(由潮霉素抗性基因hygb、hsp70启动子和hsp70终止子组成)经bamhi消化并连接入线性化的puc-ip-ura3质粒。这是可能的,因为bamhi和bglii产生相容性粘末端。图4.构建lacz-报道基因过量表达质粒的克隆策略。相应的启动子序列(*相应基因的上游区域的大约1,050bp长的序列)和lacz报道基因(β半乳糖苷酶)的orf在重叠-pcr过程中融合为一体。5'末端与kpni限制性位点互补并且3’末端与psti限制性位点互补。将融合产物连接入kpni与nsii消化的pptt-质粒,原因在于nsii所生成末端和psti所生成末端的相容性,因此产生以下lacz过量表达质粒:ppttpactinlacz;ppptpgapdhlacz;ppptphsp70lacz;ppptptef1lacz。图5.筑波假溢酵母h488lacz-转化体的β-半乳糖苷酶活性[umg-1总蛋白]。lacz报道基因分别在启动子pactin、pgapdh、phsp70、ptef1或pumhsp70(对照)控制下过量表达。将细胞在3mlypd(完全)培养基中培育2天。图6.筑波假溢酵母h488lacz-转化体的β-半乳糖苷酶活性[umg-1总蛋白]。lacz报道基因分别在启动子pactin、pgapdh、phsp70、ptef1或pumhsp70(对照)控制下过量表达。将细胞在含2gl-1氮源和0.2gl-1磷酸盐源的3mlmg-it极限培养基中培养4天。图7.筑波假溢酵母m15lacz-转化体的β-半乳糖苷酶活性[umg-1总蛋白]。lacz报道基因分别在启动子pactin、pgapdh、phsp70、ptef1或pumhsp70(对照)控制下过量表达。将细胞在3mlypd(完全)培养基中培育2天。图8.筑波假溢酵母m15lacz-转化体的β-半乳糖苷酶活性[umg-1总蛋白]。lacz报道基因分别在启动子pactin、pgapdh、phsp70、ptef1或pumhsp70(对照)控制下过量表达。将细胞在含2gl-1氮源和0.2gl-1磷酸盐源的3mlmg-it极限培养基中培养4天。图9.筑波假溢酵母h488中产生衣康酸的基因簇。该簇位于框架19上并且仅由衣康酸合成所需要的五个基因组成:ria1(衣康酸的调节蛋白)、mtt1(线粒体tca转运蛋白)、adi1(乌头酸-δ-异构酶)、itp1(衣康酸酯转运蛋白)、tad1(反-乌头酸脱羧酶)。图10.筑波假溢酵母中因与玉米黑粉菌的序列相似性而提出的衣康酸生产途径。顺-乌头酸从线粒体由mtt1运入细胞溶胶中,在那里,它由乌头酸-δ-异构酶(adi1)转化成反-乌头酸并且由反-乌头酸脱羧酶(tad1)进一步脱羧成终产物ita。ita随后由itp1分泌入细胞周围环境。基因adi1、itp1、mtt1和tad1受ria1活性上调。全部基因均在位于框架19上的簇中组织。在产生ita的真菌土曲霉(灰色箭头标记)中,顺-乌头酸直接由顺-乌头酸脱羧酶(atcad1)转化成衣康酸酯。图11是琥珀酸脱氢酶铁-硫蛋白亚单位的蛋白质序列的多重比对。仅完整拼写最上端氨基酸序列;对于全部其他氨基酸序列,仅如此给出在每个相应的位置与上部序列的相应氨基酸不同的氨基酸,从而点表示在相应的位置,存在上部序列的相应氨基酸。比对的蛋白质是:底部序列“seq048”是根据筑波假溢酵母seq.id.no.48的序列。图12.与野生型菌株h488(顶部)中的受影响区域相比,筑波假溢酵母菌株hr12(底部)中整合ria1-过量表达质粒pptt-pactin-ria1的基因组座位。绿色标度标出在其间必须已经发生异源重组事件的orf。图13.为过量表达负责筑波假溢酵母中ita产生的天然基因所产生的质粒。图14.筑波假溢酵母参考菌株h488、m15和m15-cad图15.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488adi1-过量表达转化体的衣康酸与苹果酸产量。图16.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15adi1-过量表达转化体的衣康酸与苹果酸产量。图17.筑波假溢酵母参考菌株h488、m15和m15-cad。图18.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488itp1-过量表达转化体的衣康酸与苹果酸产量。图19.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15itp1-过量表达转化体的衣康酸与苹果酸产量。图20.筑波假溢酵母参考菌株h488、m15和m15-cad。图21.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488mtt1-过量表达转化体的衣康酸与苹果酸产量。图22.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15mtt1-过量表达转化体的衣康酸与苹果酸产量。图23.筑波假溢酵母参考菌株h488、m15和m15-cad。图24.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488tad1-过量表达转化体的衣康酸与苹果酸产量。图25.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15mtt1-过量表达转化体的衣康酸与苹果酸产量。图26.筑波假溢酵母参考菌株h488、m15和m15-cad。图27.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488ria1-过量表达转化体的衣康酸与苹果酸产量。图28.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15ria1-过量表达转化体的衣康酸与苹果酸产量。图29.在50mlmg-ia极限培养基(n:2gl-1、p:0.1gl-1,c:15%w/v,无ph-对照)中8天摇瓶培养期间六个选择的ria1过量表达转化体的ita与ma产量(gl-1)和生长(od600)进展图30.在含10%(w/v)葡萄糖(参比)、蔗糖、d-木糖或10%v/v甘油作为唯一碳源的mg-ia极限培养基(n:4gl-1,p:1.0gl-1)中筑波假溢酵母hr12的生长(od600)模式。将细胞在带挡板的烧瓶中于30℃和220转/分钟培育7天。使用3.3gl-1caco3,缓冲培养基。图31.在含10%(w/v)葡萄糖(参比)、蔗糖、d-木糖或10%v/v甘油作为唯一碳源的mg-ia极限培养基(n:4gl-1,p:1.0gl-1)中筑波假溢酵母hr12的衣康酸生产。将细胞在带挡板的烧瓶中于30℃和220转/分钟培育7天。使用3.3gl-1caco3,缓冲培养基。图32.与h488相比,筑波假溢酵母hr12中衣康酸簇基因相对转录的定量实时pcr结果。在mg-ia极限培养中培育基细胞,直至od600=2-3达到为止。使用延伸因子1(ef1)和遍在蛋白缀合的酶(ubc6)作为参比基因。hr12表达水平对h488表达水平归一化。n=2,误差线显示标准差。图33.用于过量表达天然肌动蛋白强启动子控制下土曲霉cad1基因的质粒。图34.筑波假溢酵母参考菌株h488、m15和m15-cad。图35.在3mlmg-ia培养基中培养10天后,筑波假溢酵母h488atcad1-过量表达转化体的衣康酸与苹果酸产量。图36.在3mlmg-ia培养基中培养10天后,筑波假溢酵母m15atcad1-过量表达转化体的衣康酸与苹果酸产量。图37.用于筑波假溢酵母中过量表达顺乌头酸天然编码基因aco1(pseudog3035,无天然存在的内含子)和aco2(pseudog2814)的质粒pptt.cbx.oaco1-ex和pptt.cbx.oaco2。图38.筛选过量表达aco1和aco2的筑波假溢酵母hr12转化体。将细胞在良好培养中用3mlmg-ia生产培养基于30℃和220转/分钟培养六天。用大约20mgcaco3/孔,缓冲培养基。误差线显示两份独立培养物的标准差。图39.在ypd培养基中预培养并转移入50ml新鲜ypd培养基中的筑波假溢酵母h488的细胞生长(od600)。在培养首日(箭头标记)向培养物供应20gl-1葡萄糖。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育图40.在mg培养基中预培养并转移入50mlmg培养基中的筑波假溢酵母h488的细胞生长(od600)。将酵母细胞第二次转移入50mlypd培养基(右图)。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育图41.在ypd培养基中预培养并转移入50mlmg培养基中的筑波假溢酵母的细胞生长(od600)。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育图42.在mg培养基中预培养并转移入50mlmg培养基中的筑波假溢酵母h488的细胞生长(od600)。通过添加10%(v/v)新鲜ypd培养基或1x维生素溶液诱导细胞生长。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育图43.在含多种量的(nh4)2so4和kh2po4/k2hpo4x3h2o的mg-t培养基中筑波假溢酵母h488的生长和有机酸产量特征。将细胞在ypd预培养基中培养一天并且转移入50mlmg-t培养基。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育,使用3.3gl-1caco3缓冲培养基。图44.在含多种量的nano3和kh2po4/k2hpo4x3h2o的mg-ia培养基中筑波假溢酵母h488的生长(od600)和有机酸产量(gl-1)特征。将细胞在ypd预培养基中培养一天并且转移入50mlmg-ia培养基。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育,使用3.3gl-1caco3缓冲培养基。图45.在n/p比为2/0.1或5/0.1(n=nano3,p=kh2po4/k2hpo4x3h2o)的mg-ia培养基中筑波假溢酵母m15的生长(od600)和有机酸产量(gl-1)特征。将细胞在ypd培养基中预培养一天并且转移入50mlmg-ia培养基。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育,使用3.3gl-1caco3缓冲培养基。图46.在具有各种n/p比(n=nano3,p=kh2po4/k2hpo4x3h2o)的mg-ia培养基中,3ml孔培养物内筑波假溢酵母m15的衣康酸与苹果酸产量(gl-1)。将细胞在ypd培养基中预培养一天并且转移入3mlmg-ia培养基。将细胞在30℃,220转/分钟孵育,使用caco3缓冲培养基。图47.在n/p比为2/0.1或1/0.1(n=nano3,p=kh2po4/k2hpo4x3h2o)的mg-ia培养基中筑波假溢酵母m15-cad的生长(od600)和有机酸产量(gl-1)特征。将细胞在ypd培养基中预培养一天并且转移入50mlmg-ia培养基。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育,使用3.3gl-1caco3缓冲培养基。图48.在n/p比为5/0.1或5/1(n=nano3,p=kh2po4/k2hpo4x3h2o)的mg-ia培养基中筑波假溢酵母m15-cad的生长(od600)和有机酸产量(gl-1)特征。将细胞在ypd培养基中预培养一天并且转移入50mlmg-ia培养基。将细胞按初始od600=1在500ml带挡板的烧瓶中于30℃,220转/分钟培育,使用3.3gl-1caco3缓冲培养基。图49.在具有各种n/p比(n=nano3,p=kh2po4/k2hpo4x3h2o)的mg-ia培养基中,3ml孔培养物内筑波假溢酵母hr12的衣康酸与苹果酸产量(gl-1)。将细胞在ypd培养基中预培养一天并且转移入3mlmg-ia培养基。将细胞在30℃,220转/分钟孵育,使用caco3缓冲培养基。图50.在含nano3(参考)、nh4cl或nh4no3作为n源的mg-ia极限培养基(n:4gl-1,p:1.0gl-1)中筑波假溢酵母hr12的生长(od600)模式。将细胞在带挡板的烧瓶中于30℃和220转/分钟培育7天。使用3.3gl-1caco3,缓冲培养基。图51.在含nano3(参考)、nh4cl或nh4no3作为n源的mg-ia极限培养基(n:4gl-1,p:1.0gl-1)中筑波假溢酵母hr12的衣康酸产量(gl-1)。将细胞在带挡板的烧瓶中于30℃和220转/分钟培育7天。使用3.3gl-1caco3,缓冲培养基。图52.ita生产培养基mg-ia-n/p:2/0.1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养八天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图53.ita生产培养基mg-ia-n/p:5/0.1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养八天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图54.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养六天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图55.ita生产培养基mg-ia-n/p:2/0.1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph=7.0,po2=55%和初始葡萄糖浓度150gl-1培养六天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图56.ita生产培养基mg-ia-n/p:2/0.1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=90%和初始葡萄糖浓度150gl-1培养六天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图57.ita生产培养基mg-ia-n/p:2/0.1gl-1(nano3)中筑波假溢酵母m15-cad的600ml生物反应器培养。将细胞在30℃,ph大约5.5–用4gl-1caco3调整,po2=55%和初始葡萄糖浓度150gl-1培养六天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图58.ita生产培养基mg-ia-n/p:2/0.1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养五天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图59.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养五天。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图60.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度150gl-1培养十天。在第5天,输入100gl-1葡萄糖。每24小时监测葡萄糖消耗量。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图61.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度75gl-1培养十天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图62.ita生产培养基mg-ia-n/p:5.5/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度75gl-1培养八天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图63.ita生产培养基mg-ia-n/p:8/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度75gl-1培养七天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图64.ita生产培养基mg-ia-n/p:8/1gl-1(nano3)及1.75x无机盐;微量元素;硫胺素,fecl3中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度75gl-1培养七天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图65.ita生产培养基mg-ia-n/p:4/1gl-1(nh4cl)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5,po2=55%和初始葡萄糖浓度75gl-1培养八天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图66.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5->在第1天4.0(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养八天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图67.ita生产培养基mg-ia-n/p:4/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5->在第1天4.0(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养八天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。在第7天输入1gl-1n源(虚线箭头标记)。图68.ita生产培养基mg-ia-n/p:5/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5->在第1天4.0->在第2天3.5(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养七天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图69.ita生产培养基mg-ia-n/p:5/1gl-1(nano3)中筑波假溢酵母hr12的600ml生物反应器培养。将细胞在30℃,ph=5.5->在第1天4.0->在第2天3.5->在第3天3.0(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养七天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。图70.600ml生物反应器内ita生产培养基mg-ia-n/p:6/1gl-1(nano3)中筑波假溢酵母hr12的半连续培养。将细胞在30℃,ph=5.5->在第1天4.0(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养十四天。每24小时监测葡萄糖消耗量并复调至大约75g|1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。在第7天,将50%的培养液交换为新鲜培养基(虚线箭头标记)。图71.筑波假溢酵母hr12在600ml生物反应器的ita生产培养基mg-ia-n/p:6/1gl-1(nano3)中的半连续培养。–对损耗修正-将细胞在30℃,ph=5.5->在第1天4.0(用黑色箭头标记),po2=55%和初始葡萄糖浓度75gl-1培养14天。每24小时监测葡萄糖消耗量并复调至大约75gl-1。在同一期间,测定产生的有机酸(ita与ma)量以及细胞干重(dcw)。在第7天,将50%的培养液交换为新鲜培养基(虚线箭头标记)。图72.ria1氨基酸序列的多重比对。仅完整拼写最上端氨基酸序列;对于全部其他氨基酸序列,仅如此给出在每个相应的位置与上部序列的相应氨基酸不同的氨基酸,从而点表示在相应的位置,存在上部序列的相应氨基酸。对齐的蛋白质是:“wo2015140314”:wo2015140314a1的seqidno.16;uniprot条目a0a0u2wfx7/ria1_ustmd;uniprot条目a0a0d1cu52/a0a0d1cu52_ustma;uniprot条目r9p2w9/r9p2w9_psehs;“seq36”:seqidno.36;“seq35”:seqidno.35;“seq37”:seqidno.37;“seq48”:seqidno.48。发明详述下文更详细地描述本发明。本说明书向微生物学
技术领域:
普通技术人员演说。本说明书应以愿意理解的心态解读。应当理解,本说明书,如同对任何技术性事实或教导内容的任何其他有限说明,无论如何是不能详尽的。特别地,本发明的任何具体教导内容或实例的特征应理解为意指本发明任何其他教导内容的任选部分。除非另外限定,否则本文中所用的全部术语(包括技术术语和科学术语)具有如本领域普通技术人员通常理解的相同含义,所述普通技术人是具有发酵领域普通经验的生物技术人员。全部术语应当解读为具有与本说明书及相关技术的语境下其含义一致的含义,并且除非本文中明确地如此限定,否则不应当以理想化或过于正式的意义解读。出于简明和/或清晰,本文中不详细描述熟知的物质、方法、功能或结构。如本文所用,当提到可度量值如质量数量、浓度、时间、温度等使用时,术语“约”意在包括所指量的0.1%、0.25%、0.5%、0.75%、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%变异。除非另外说明,否则本说明书中的全部数值均应理解为受术语“约”修饰。如本文所用,术语“和/或”意在包括一个或多个相关的所列项的任何及全部可能组合,以及当按替代性(“或”)解读时,意在包括组合的缺少。还将理解,在本说明书中使用时,如本文所用,术语“包括”和“包含”及其语法变体规定所述特征、步骤、操作、要素和/或组分的存在,但不排除存在或增加一个或多个其他特征、步骤、操作、要素、组分和/或其组合。就组合物或方法中参数范围的定义而言,这类术语指相应的组合物或方法不包含多于参数值的最大值和小于参数值的最小值。例如,如果培养基可用于发酵,发酵培养基包含0.01-0.1%(v/v)的复杂培养基组分,其中复杂培养基组分的总浓度不低于0.01%(v/v)且不高于0.1%(v/v)。如本文所用,术语“包含”也包括术语“由……组成”。如本文所用,术语“基本上由组成”(及其语法变体),如用于本发明的组合物和方法,意指组合物/方法可以含有额外组分,只要额外组分不实质地更改组合物/方法。如用于组合物/方法,术语“实质更改”指组合物/方法的有效性升高或降低至少约20%或更大。例如,如果整合入生产宿主微生物的基因组中或在所述基因组中失活的表达盒增加或降低微生物的衣康酸酯生产率达至少50%,该表达盒“实质地更改”微生物。本发明微生物的“基因组”是有复制性、可遗传性遗传物质的总体——一般和优选地是dna——例外是以下这类独立分子,所述独立分子尽管自主复制,但像是游离病毒和游离质粒,并非属于微生物物种的定义。如本文所用的术语“表达”或“基因表达”指合成基因产物、优选地蛋白质或功能性rna的过程,并且通常利用以下步骤:dna转录、任选地rna加工及在蛋白质表达情况下rna翻译。术语“表达盒”(及其语法变体或语义变体)指一段核酸,优选地dna,其包含为表达这个区段做好准备的核酸区段(也称作“序列”)。表达盒还可以包含允许在宿主细胞中增强所述核酸区段表达的元件。这些元件可以包括增强子反应元件、终止子序列、多聚腺苷化序列等。根据本发明,“启动子”是能够在宿主细胞中启动转录的连续核酸节段。如果启动子足以在可重复条件下引起相应的基因在相应的微生物中转录,则该启动子是“有功能的”。合适的启动子可以是诱导型的或阻遏型的或组成型活性的,其中对于诱导型和阻遏型启动子,转录水平根据环境阻遏或化学条件变动,并且组成型启动子在发酵期间大部分条件下有活性。另外,可以通过用适当选择的不同核糖体结合位点替换天然核糖体结合位点,改变启动子。优选的启动子:最优选地,本发明的强组成型活性启动子是pactin启动子并且与seqidno.74的序列具有至少96%的序列同一性。这种启动子有利地允许在假溢酵母中特别宽泛地表达多种蛋白质并且在实施例中进一步加以描述。术语“杂交”表示多核苷酸在低、中等、高或极高严格性条件下与标记的核酸探针或其全长互补链或前者的子序列复性(“杂交”)。为使杂交发生,通常将核酸分子热变性或化学变性以使双链解链成为两条单链和/或去除来自单链核酸的发夹或其它二级结构。杂交体的这种形成或解链取决于多种参数,例如温度。温度升高有利于解链,而温度下降有利于杂交。但是,这种杂交体形成过程不以线性方式随施加的温度变化而变:杂交过程是动态的,并且已经形成的核苷酸对也支持相邻核苷酸配对。因而,在良好逼近情况下,杂交是一个是或非过程,并且存在一个基本上规定杂交和非杂交之间界限的温度。这个温度是解链温度(tm)。tm是以摄氏度计的温度,在所述温度,具有给定出核苷酸序列的全部分子50%杂交成双链,并且50%作为单链存在。解链温度(tm)取决于所分析核酸序列的物理特性并且因此可以指示两个不同序列之间的关系。但是,解链温度(tm)还受完全与序列不相关的各种其他参数影响,并且必须考虑施加的杂交实验条件。例如,增加盐(例如一价阳离子)导致tm较高。可以通过进行物理杂交实验确定给定杂交条件的tm,但是也可以计算机模拟估计给定dna序列对的tm。在这个实施方案中,meinkoth和wahl的等式(anal.biochem.,138:267–284,1984)用于具有50个或更多个碱基长度的片段:tm=81.5℃+16.6(logm)+0.41(%gc)-0.61(甲酰胺%)-500/l。m是一价阳离子的体积摩尔浓度,%gc是dna片段中鸟苷和胞嘧啶的百分数,甲酰胺%是杂交溶液中甲酰胺的百分数,并且l是以碱基对计的杂交体的长度。该等式用于0.01至0.4m的盐范围和30%至75%的gc%。尽管上述tm是完美匹配探针的温度,对每1%错配,tm降低约1℃(bonner等人,j.mol.biol.81:123-135,1973):tm=[81.5℃+16.6(logm)+0.41(%gc)-0.61(%甲酰胺)-500/l]-非同一性%。这个等式可用于具有35或更多个核苷酸的探针并且在科学方法文献(例如,引用于:“recombinantdnaprinciplesandmethodologies”,jamesgreene,章节“biochemistryofnucleicacids”,pauls.miller,第55页;1998,crcpress)、许多专利申请(例如,引用于:us7026149)及还在商业企业的数据文件(例如来自www.genomics.agilent.com的“equationsforcalculatingtm”)中广泛应用。对于至少100个核苷酸长度的探针,术语“低严格性条件”意指遵循标准dna印迹程序,在42℃于5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和25%甲酰胺预杂交和杂交12至24小时。使用0.2xssc,0.2%sds在50℃,最终洗涤载体材料三次,各自15分钟。对于至少100个核苷酸长度的探针,术语“中等严格性条件”意指遵循标准dna印迹程序,在42℃于5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和35%甲酰胺预杂交和杂交12至24小时。使用0.2xssc,0.2%sds在55℃,最终洗涤载体材料三次,各自15分钟。对于至少100个核苷酸长度的探针,术语“中等-高严格性条件”意指遵循标准dna印迹程序,在42℃于5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和35%甲酰胺预杂交和杂交12至24小时。使用0.2xssc,0.2%sds在60℃,最终洗涤载体材料三次,各自15分钟。对于至少100个核苷酸长度的探针,术语“高严格性条件”意指遵循标准dna印迹程序,在42℃于5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和50%甲酰胺预杂交和杂交12至24小时。使用0.2xssc,0.2%sds在65℃,最终洗涤载体材料三次,各自15分钟。对于至少100个核苷酸长度的探针,术语“极高严格性条件”意指遵循标准dna印迹程序,在42℃于5xsspe、0.3%sds、200微克/ml剪切和变性的鲑精dna和50%甲酰胺预杂交和杂交12至24小时。使用0.2xssc,0.2%sds在70℃,最终洗涤载体材料三次,各自15分钟。术语“序列同一性”分别指两个氨基酸序列或两个核酸序列之间最大可忍受偏差的数值指标,其中已知一个序列(也称作“基准序列”)并且另一个序列应与基准序列比较。通过以下方式测定偏差:首先对齐两个待比较的序列并且随后分别计数相同氨基酸或核苷酸的数目,除以根据比对结果包含这个序列中全部空位的基准序列的总长度。使用needleman-wunsch-算法(needleman,saulb.和wunsch,christiand.(1970):"ageneralmethodapplicabletothesearchforsimilaritiesintheaminoacidsequenceoftwoproteins(适用于两种蛋白质的氨基酸序列中检索相似性一般方法)";journalofmolecularbiology.48(3):443–453),按以下参数进行比对:-对于氨基酸比对:空位开口罚分10、空位延伸罚分0.5、eblosum62(blosum62的emboss版本)替换矩阵-对于核酸比对:空位开口罚分10、空位延伸罚分0.5,ednafull(ncbinuc4.4的emboss版本)替换矩阵例如,供试序列aagatactg(9个核苷酸)与基准序列gatctga(7个核苷酸)对齐将导致:因此,存在6个相同位置(“gat”和“ctg”),并且基准序列长度因比对而增加1个位置,从而序列同一性是6/(7+1)*100=75%。在本发明的序列中可以改变氨基酸的情况下,这类变化优选地是保守性突变。使用氨基酸的标准单字母代码,氨基酸a由氨基酸s保守性替换;氨基酸d由e、n保守性可替换;氨基酸e由d、k、q保守性可替换;氨基酸f由w、y保守性可替换;氨基酸h由n、y保守性可替换;氨基酸i由l、m、v保守性可替换;氨基酸k由e、q、r保守性可替换;氨基酸l由i、m、v保守性可替换;氨基酸m由i、l、v保守性可替换;氨基酸n由d、h、s保守性可替换;氨基酸q由e、k、r保守性可替换;氨基酸r由k、q保守性可替换;氨基酸s由a、n、t保守性可替换;氨基酸t由s保守性可替换;氨基酸v由i、l、m保守性可替换;氨基酸w由f、y保守性可替换;氨基酸y由氨基酸f、h、w保守性替换。使用氨基酸的标准三字母代码,特别优选的替换是ala<->glu、ala<->gly、ala<->pro、ala<->ser、ala<->thr、ala<->val、arg<->lys、asn<->ser、asp<->asn、asp<->glu、asp<->gly、gly<->ser、leu<->lle、leu<->val、phe<->tyr、ser<->thr和val<->lle。术语“野生型”微生物在本文用于微生物的比较并且指其中缺少对具体比较所讨论的特征的微生物。一般,这类微生物是所讨论的微生物已经或可以从其中衍生的祖先菌株。例如,在诸如“在相应野生型微生物中n个核苷酸分隔的基因a和b之间包含插入物的生产宿主微生物”的表述中应如下解读:“野生型微生物”是与生产宿主微生物相同的微生物,例外是野生型微生物的相关核酸——一般称作“染色体”,不考虑其染色属性——中连接基因a和b的序列,从而在所述野生型微生物中,鉴于基因a位于基因b的5'位置,基因a的3'边界——即终止密码子——和基因b的5'边界——即起始密码子——由n个核苷酸分隔。对uniprot条目的提及指截至2018年3月1日欧洲中部时间的相应序列。尽管下文将参考本发明的实施方案描述本发明的某些方面,但可以理解,可以在形式和细节方面做出各种变化,而不脱离如权利要求定义的本公开的精神和范围。本发明涉及产生衣康酸和/或其盐。本说明书中每当提及衣康酸,这种提及也适用于衣康酸酯(并且反之亦然),如果技术上有意义的话。本发明提供衣康酸生产宿主微生物。出于本发明目的,生产宿主微生物优选地属于担子菌门(basidiomycota)。如上所述,该门的微生物尚未在工业上用来生产衣康酸,尽管过去有过多次尝试。本发明基于以下研究结果:与上文提及的现有技术中的观点相反,过量表达涉及产生衣康酸的全部基因并非足够和/或并非必要。相反,本发明提供修饰的微生物,其特征在于表达ria1基因的表达盒稳定整合入其基因组中,和/或提示,应当使担子菌门中通常存在的基因失活以产生衣康酸。优选地,通过整合表达ria1基因的表达盒进行这类失活。本发明因而获得可用于发酵的微生物,在无需同时获得不利副产物、尤其苹果酸酯的高生产率情况下实现衣康酸高生产率。根据本发明,衣康酸生产宿主微生物备选地称作“生产宿主”、“宿主微生物”、“生产微生物”等。术语“生产宿主微生物”及其相应的命名变体涵盖亲本细胞的例如因复制期间出现的突变或例如因额外转化而并非与亲本细胞完全相同的任何后代。本发明的生产宿主微生物包含产生衣康酸的活跃代谢途径。本发明的宿主微生物可以天然地包含这类活跃衣康酸途径,即,甚至在至少一个包含有功能启动子控制下的ria1基因的表达盒整合入微生物的基因组之前亦是如此。然而,如下文描述,本发明还提供基于并不天然包含活跃衣康酸途径的这类微生物,获得衣康酸生产宿主微生物的方法。根据本发明的一个方面,生产宿主微生物包含表达盒。该表达盒包含在有功能启动子的有效控制下的ria1基因。优选地,在表达盒中,ria1基因就与ria1基因有效连接的启动子而言是异源的。用于本发明目的异源序列是以下任一者:(a)非宿主序列,(b)如适用,通过(ba)插入、(bb)替换和/或(bc)缺失一个或多个碱基或氨基酸而改变的序列,(c)来自不同宿主细胞菌株的序列,或(d)来自宿主细胞的不同基因组位置的同源序列;例如,本文中核酸序列的人工复制物视为异源。“同源”序列是存在于相同遗传源或物种中的序列,即它天然存在于有关物种的宿主细胞中,并履行相同或相似的功能。因此,本发明表达盒中的ria1基因优选地与启动子有效连接,所述启动子异于有效连接于野生型生产宿主微生物中ria1基因的任何启动子,如若所述野生型生产宿主微生物天然包含表达的ria1基因。以这种方式,本发明允许根据衣康酸发酵过程的需求,选择性影响ria1基因的表达。以下说明书提供这类特别优选的表达盒的实例和解释。ria1基因优选地就生产宿主微生物而言是异源的。优选地,ria1基因序列衍生自独立的遗传源或物种。表达盒整合在ip基因座外部。尽管文件wo2015/140314a1公开了,过量表达ria1导致衣康酸产量增加,生产率仍低于本发明。在loubradou等人,“ahomologueofthetranscriptionalrepressorssn6pantagonizescampsignallinginustilagomaydis”,molecularmicrobiology2001,719–30中,进一步描述了根据wo2015/140314a1作为整合位点使用的ip基因座。根据本发明,通过避开这个整合位点,获得了技术上可行的衣康酸生产率。为避免疑问,认为整合未在ip基因座外部发生,而已在ip基因座或其内部发生,至少在以下那些情况时如此,其中(a)当发生是,整合的核酸两侧皆旁置有ip基因座的(可能截短的或多多少少突变的)复制物,例如,通过同源重组方式旁置,或其中(b)微生物在相应野生型菌株内包含或重叠ip基因座的位置处含有整合的核酸;例如,这通过替换整合方式发生。一种鉴定担子菌中ip基因座的方法和使构建体位点特异性整合入因此鉴定的ip基因座的引物、载体和方法由zambanini等人,metabolicengineeringcommunications2017,12–21,第14-16页描述。根据本发明,ip基因座是负责表达基因的区域,所述基因编码琥珀酸脱氢酶铁-硫蛋白亚单位。broomfieldandhargreaves,currentgenetics1992,117-121描述了并且特别在该出版物的图2中描述了玉米黑粉菌的这种基因序列。该出版物及尤其所述的图2通过引用的方式并入本文,以进一步描述ip基因座。重要的是指出,本发明不涉及ip基因座和相应的琥珀酸脱氢酶铁-硫蛋白亚单位本身的功能;发明人已经发现,通过在相应微生物的ip基因座外部整合如本文所述的至少一个表达盒,改善衣康酸生产。优选地,微生物的ip基因座不含有如本文所述的表达盒,并且甚至更优选地,ip基因座不含有异源基因序列。ip基因座优选地是该微生物的编码琥珀酸脱氢酶铁-硫蛋白亚单位的可遗传性遗传物质的基因座。可以测试推定性多肽是否传输琥珀酸脱氢酶铁-硫蛋白亚单位的功能,例如通过重构来测试,即,一种包括以下步骤的方法:1.失活供试微生物中编码琥珀酸脱氢酶铁-硫蛋白亚单位的全部基因,旨在将供试生物的表型从萎锈灵(carboxin)抵抗改变成萎锈灵敏感;broomfield和hargreaves的上述公开中存在对这个过程的说明;2.在供试微生物中表达推定性多肽;3.测定步骤2中获得的供试生物中的萎锈灵抗性在;如果萎锈灵抗性恢复,则不存在其他合理解释的情况下,推定性多肽很可能传输琥珀酸脱氢酶铁-硫蛋白亚单位的功能。因此,本发明的ip基因座按缩窄含义是对其修饰导致萎锈灵敏感的基因座,其中琥珀酸脱氢酶铁-硫蛋白亚单位的表达导致萎锈灵抗性重构。优选地,ip基因座是编码多肽的基因,所述多肽与根据选自p32420(sdhb_ustma)、r9nz36(r9nz36_psehs)、m9mbs9(m9mbs9_psea3)、i2g708(i2g708_usth4)和v5f1l5(v5f1l5_kalbg)的uniprot条目的氨基酸序列具有至少约10%序列同一性、与根据选自p32420(sdhb_ustma)、r9nz36(r9nz36_psehs)、m9mbs9(m9mbs9_psea3)、i2g708(i2g708_usth4)和v5f1l5(v5f1l5_kalbg)的uniprot条目的氨基酸序列甚至更优选地具有至少20%、或甚至更优选地具有至少30%、或甚至更优选地具有至少40%、或甚至更优选地具有至少50%、或甚至更优选地具有至少60%、或甚至更优选地具有至少70%、或甚至更优选地具有至少80%、或甚至更优选地具有至少90%、或甚至更优选地具有至少94%、或甚至更优选地具有至少98%序列同一性。如果微生物属于黑粉菌属(ustilago),则优选地通过与uniprot条目p32420(sdhb_ustma)比较,确定氨基酸序列同一性;如果微生物属于kalmanozyma属,则优选地通过与uniprot条目v5f1l5(v5f1l5_kalbg)比较,确定氨基酸序列同一性;如果微生物属于假溢酵母属,则优选地通过与seqidno.48比较,确定氨基酸序列同一性。甚至更优选地,ip基因座是编码多肽的基因,所述多肽与根据seq.id.no.48的氨基酸序列具有至少10%序列同一性、与根据seq.id.no.48的氨基酸序列甚至更优选地具有至少20%、或甚至更优选地具有至少30%、或甚至更优选地具有至少40%、或甚至更优选地具有至少50%、或甚至更优选地具有至少60%、或甚至更优选地具有至少70%、或甚至更优选地具有至少80%、或甚至更优选地具有至少90%、或甚至更优选地具有至少94%、或甚至更优选地具有至少98%序列同一性。在更优选、更广泛意义下,本发明的ip基因座是包含编码琥珀酸脱氢酶铁-硫蛋白亚单位的基因的ip基因座并且由与seqidno.50具有至少75%、甚至更优选地至少50%序列同一性的核酸序列组成,所述核酸序列是编码琥珀酸脱氢酶铁-硫亚单位的玉米黑粉菌embl条目z11738.1的编码区。特别地在微生物属于假溢酵母属(pseudozyma)情况下,ip基因座优选地由与seqidno.51具有至少75%、甚至更优选地至少50%序列同一性的核酸序列组成,所述核酸序列是根据seqidno.50的序列的筑波假溢酵母等同物。甚至更优选地,根据本发明,至少一个并且最优选地全部表达盒均整合于ip基因座外部,所述ip基因座包含编码琥珀酸脱氢酶铁-硫蛋白亚单位的基因并且由与seqidno.52具有至少75%、甚至更优选地至少50%序列同一性的核酸序列组成,所述核酸序列是embl条目z11738.1的序列。特别地在微生物属于假溢酵母属情况下,根据本发明,至少一个并且最优选地全部表达盒均整合于ip基因座外部,所述ip基因座包含编码琥珀酸脱氢酶铁-硫蛋白亚单位的基因并且由与seqidno.53具有至少75%、甚至更优选地至少50%序列同一性的核酸序列组成。特别优选如下情况:至少一个和优选地全部本发明表达盒整合于借助第一边界区域和第二边界区域限定的序列区域外部,其中第一边界区域由与seqidno.54具有至少50%序列同一性的核酸组成并且第二边界区域由与seqidno.55具有至少50%序列同一性的核酸组成。在野生型微生物中,第一和第二边界区域优选地相距至少约800至5000个核苷酸、更优选地880至约2000个核苷酸和最优选地至少1100至2000个核苷酸。序列seqidno.54和55是与根据筑波假溢酵母seqidno.53的序列毗邻的左边界序列和右边界序列。最优选地,本发明的全部表达盒均整合于与根据seqidno.56的序列具有50%序列同一性的核酸序列外部。根据本发明,提供包含表达盒的重组衣康酸生产宿主微生物,所述表达盒用于(a)表达ria1基因和/或(b)表达至少两个选自adi1、mtt1和tad1的基因。具有活跃衣康酸代谢途径的微生物,如本发明的宿主微生物,将(至少衣康酸生产条件下)通常表达mtt1线粒体三羧化物转运蛋白基因、adi1乌头酸δ-异构酶基因、tad1反-乌头酸脱羧酶基因和itp1衣康酸酯转运蛋白基因。优选地,本发明的微生物将(至少在衣康酸产生条件下)还表达ria1转录调节蛋白基因。如本文所述,本发明的ria1基因产物增加adi1基因,mtt1基因,tad1基因和/或itp1基因的表达,因而导致衣康酸高生产率,同时苹果酸酯生产有利地低。任选地,如例如从土曲霉已知,该微生物可以表达(至少在衣康酸产生条件下)cad1顺-乌头酸脱羧酶基因,其中这种cad1表达可以相对于表达adi1和/或tad1同时出现或可以取而代之。如果本发明微生物的物种已经包含活跃衣康酸途径,则有可能但并不必然优选的是:使一个或多个表达ria1基因的表达盒整合入微生物基因组中如本文所述的位置处。然而,微生物可以包含用于ria1基因和用于adi1、itp1、mtt1和tad1基因中一者或多者的异源表达盒。尤其,在其中野生型担子菌包含其表达不受异源ria1基因表达盒的表达诱导的adi1、itp1、mtt1和/或tad1基因的那些情况下,优选是引入、优选地通过稳定整合入微生物的基因组中如本文所述的位点处从其中ria1基因可诱导这类基因的微生物基因组衍生的相应adi1、itp1、mtt1和/或tad1基因的表达盒。通过这种方式,有利地实现异源ria1表达盒(优选地包含有功能启动子控制下的异源ria1基因)的有效性,这转而促进享受有利的衣康酸生产率和/或可忽略的副产物苹果酸酯。表达盒优选地整合入微生物的基因组中整合位点处,所述整合位点a)位于左边界基因和右边界基因之间,其中在相应野生型微生物中,左边界基因和右边界基因的相应翻译起始密码子的相应第一核苷酸由最多51600个核苷酸分隔,其中左边界基因编码具有乙酰-coa合成酶活性的蛋白质,并且其中右边界基因编码蛋白质,其由与seqidno.25具有至少21%同一性的氨基酸序列组成;和/或b)距可读框的最近边界至多6500个核苷酸存在,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列,和/或c)位于可读框内部或替换可读框,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25或其外显子中任一者具有至少30%序列同一性的氨基酸序列。如实施例中所示,本发明已经鉴定一个在ip基因座外部的整合位点,所述整合位点允许表达盒稳定整合并且使得在不必接受大量形成苹果酸酯作为副产物的情况下,衣康酸生产率高成为可能。根据描述本发明的一个方式,整合位点位于左边界基因和右边界基因之间,所述左边界基因编码具有乙酰-coa合成酶活性的蛋白质,所述右边界基因是编码由与seqidno.25具有至少21%同一性的氨基酸序列组成的蛋白质的可读框。在环形基因组的情况下,术语“在……之间”应理解成标示连接野生型基因组中左边界基因和右边界基因的较短核酸区段,即,无一个或多个表达盒整合。在野生型担子菌中,左边界基因和右边界基因一般相隔最多51600个核苷酸、优选地至少25800个和最多51600个核苷酸,甚至更优选地至少28000个和最多42200个核苷酸,以及甚至更优选地至少35000个和最多42100个核苷酸。根据描述本发明的另一个方式,整合位点距可读框的最近边界至多6500个核苷酸存在,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25或这些序列之任意者的外显子中任一者具有至少30%序列同一性的氨基酸序列。如实施例中所示,这些可读框可以存在于适合插入本发明表达盒的位置中。可以理解,仅为描述本发明插入位点的位置而给出前述序列,而不考虑任何生物学功能。应当指出,例如在筑波假溢酵母(pseudozymatsukubaensis)的基因组中,前述序列按照如上文给出的顺序出现。这允许在其他担子菌中鉴定相应序列。优选地,整合位点距任何核酸序列的最近边界至多6500个核苷酸存在,所述任何核酸序列与seqidno.4、seqidno.6、seqidno.8、seqidno.10、seqidno.12、seqidno.14、seqidno.16、seqidno.18、seqidno.20、seqidno.22、seqidno.24、seqidno.26中任一者具有至少30%序列同一性。已经在特别优选的野生型生产宿主微生物筑波假溢酵母中特别优选的整合位点处发现这些核酸序列;它们对应于相应的氨基酸序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25。因此,整合位点优选地距任何核酸靶序列的最近边界至多6500个核苷酸、优选地至多5500个核苷酸、甚至更优选地至多2800个核苷酸存在,所述任何核酸靶序列与seqidno.4、seqidno.6、seqidno.8、seqidno.10、seqidno.12、seqidno.14、seqidno.16、seqidno.18、seqidno.20、seqidno.22、seqidno.24、seqidno.26中任一者具有至少30%序列同一性,其中相应的靶序列至少假定地翻译成分别与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25具有30%同一性的氨基酸。甚至更优选地,整合位点距可读框的最近边界至多6500个核苷酸、优选地至多5500个核苷酸、甚至更优选地至多2800个核苷酸存在,所述可读框翻译成与seqidno.seqidno.19,seqidno.15和/或seqidno.29中任一者具有至少30%序列同一性的氨基酸序列。根据本发明,预期这些氨基酸序列产生涉及影响krebs循环的代谢功能。通过整合一个或多个本发明表达盒,如此失活或下调相应的靶多肽,从而消除它们对krebs循环的干扰。根据描述本发明的再一个方式,表达盒整合于可读框内部或替换可读框,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列。如上文所述,上文所示的氨基酸序列衍生自根据备选b)的核苷酸序列。再次,可以理解,仅为描述本发明插入位点的位置而给出前述序列,不考虑任何生物学功能;相应野生型微生物甚至没有必要产生具有前述任一者序列的多肽。优选地,相应的野生型微生物中的相应可读框具有至少6500个核苷酸长度。再次优选地,至少一个表达盒整合于靶核酸序列内部或替换靶核酸序列,所述靶核酸序列与seqidno.4、seqidno.6、seqidno.8、seqidno.10、seqidno.12、seqidno.14、seqidno.16、seqidno.18、seqidno.20、seqidno.22、seqidno.24、seqidno.26中任一者具有至少30%序列同一性,其中靶核酸序列至少假定地翻译成分别与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25具有30%序列同一性的氨基酸序列。和甚至更优选地,至少一个表达盒整合于靶核酸序列内部或替换靶核酸序列,所述靶核酸序列与seqidno.20、seqidno.16和/或seqidno.30中任一者具有至少30%序列同一性,其中靶核酸序列至少假定地翻译成分别与seqidno.19、seqidno.15和/或seqidno.29具有30%序列同一性的氨基酸序列。应当理解,本发明的微生物可以包含插入相同或不同基因座的两个或更多个表达盒。在实施例中,一个包含两个用于表达ria1的表达盒的示例性整合整合入相同的基因座。根据本发明,优选表达盒均不整合入ip基因座。进一步优选地,分别用于表达ria1、adi1、mtt1和tad1基因的本发明全部表达盒均整合于作为如上文所述的备选项a)至c)中任一者给出的位点处。根据本发明的一个方面,重组衣康酸生产宿主微生物a)包含产生衣康酸的活跃衣康酸代谢途径,和优选地b)失活至少一个基因,其i)编码与以下者具有30%序列同一性的蛋白质和/或ii)其互补链在至少低严格性条件下与编码以下者的核酸序列杂交蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者。如实施例中所示,与相应的野生型毒株相比,担子菌中仅存在用于ria1表达的质粒并不可靠地导致衣康酸生产率升高。越发令人惊讶是,如下文实施例显示,甚至ria1表达中等增加(如通过qpcr所测定)可以导致衣康酸生产率显著改善,同时作为副产物的苹果酸酯无明显生成。本发明与其中异源ria1基因在ip基因座整合入黑粉菌纲基因组(参见例如zambanini等人,biotechnolbiofuels,2017,10:131,其使用整合入香根草黑粉菌(u.vetiveriae)菌株tz1的ip基因座中的构建体;geiser等人,microbialbiotechnology2016,116–126描述了整合特异性,参见页122)的现有技术相比,甚至在优化的条件下,现有技术观察到与本发明实施例相比明显更低的衣康酸生产率,并且不想要的苹果酸酯按苹果酸酯(g/l):衣康酸酯(g/l)大致1:1-3:1的比率产生。因此,本发明的教导是:失活至少一个、更优选地两个或更多个编码下述蛋白质的基因可用于获得前述优点,所述蛋白质分别与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25具有30%序列同一性。描述本教导内容的另一个方式是,在下述情况时,失活至少一个、更优选地两个或更多个基因是有利的:一个或多个基因分别包含在至少低严格性条件下与编码前述任一序列的核酸序列杂交的核酸序列或由其组成。如本文所述,优选地通过整合表达盒或整合在其内进行失活,所述表达盒用于表达ria1基因和/或表达至少两个选自adi1、mtt1和tad1的基因。根据本发明,失活的至少一个基因优选地包含下述序列或由其组成,所述序列的互补链在至少中等严格性条件下、甚至更优选地在至少高严格性条件下和甚至更优选地在极高严格性条件下杂交于编码蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者的核酸序列。另外根据本发明,失活的至少一个基因优选地包含下述序列或由其组成,所述序列编码与蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者具有至少约45%序列同一性、甚至更优选地至少60%序列同一性、甚至更优选地至少75%序列同一性、甚至更优选地至少85%序列同一性、甚至更优选地至少90%序列同一性、甚至更优选地至少91%序列同一性、甚至更优选地至少95%序列同一性、甚至更优选地至少98%序列同一性的蛋白质。另外根据本发明,优选的微生物包含至少一个表达ria1基因和/或表达至少两个基因选自adi1、mtt1和tad1的表达盒,其中表达盒至少一者在整合位点处整合入微生物的基因组中,其中整合位点距可读框的最近边界至多6500个核苷酸、优选地至多5500个核苷酸,甚至更优选地至多2800个核苷酸存在,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少45%、甚至更优选地至少60%、甚至更优选地至少75%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少91%、甚至更优选地至少95%、甚至更优选地至少98%序列同一性的氨基酸序列,和/或位于可读框内部或代替可读框,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少45%、甚至更优选地至少60%、甚至更优选地至少75%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少91%、甚至更优选地至少95%、甚至更优选地至少98%序列同一性的氨基酸序列。在每种情况下,如上文所述在seqidno.19,seqidno.15和/或seqidno.29的一个或多个序列及在整个长度范围与其具有至少45%、甚至更优选地至少60%、甚至更优选地至少75%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少91%、甚至更优选地至少95%、甚至更优选地至少98%序列同一性的相应序列处或其中,优选失活性整合。与相同条件下培养的相应野生型菌株相比,本发明的优选的生产宿主微生物显示特征性基因表达水平。a)ria1基因的表达水平增加至少50倍,和/或b)至少两个选自adi1、mtt1和tad1的基因的表达水平增加至少1000倍,和/或c)itp1基因的表达水平增加最多500倍。根据本发明,如实施例中进一步解释,使用标准qpcr方案,对相应的mrna测量表达水平。如实施例佐证,与野生型菌株相比,ria1基因表达甚至适度地增加50-1000、甚至更优选地100-900,引起实现本发明的优点,尤其衣康酸生产率高及产生很少或甚至不产生作为发酵副产物的苹果酸酯。另外,这种ria1基因表达增加可以导致adi1、mtt1和/或tad1表达水平升高至少1000倍。优选地,至少两个选自adi1、mtt1和tad1的基因的表达水平增加至少1050-6000倍,并且甚至更优选地,adi1和tad1的表达水平增加1000-4100倍及mtt1的表达水平增加2000-5500倍。另外优选地,itp1基因的表达水平增加最多500倍、更优选地0-300倍和甚至更优选地最多200倍。应当理解,这仅适用于这样的微生物,其中野生型菌株已经显示出活跃衣康酸代谢途径,从而在发酵期间衣康酸释放入发酵培养基。这个参数特别有利于选择衣康酸生产宿主微生物,因为那些已经显示出高水平itp1基因表达的微生物不需要任何进一步遗传干预,以增加衣康酸向发酵培养基释放,因而降低因引入用于过量表达重组itp1基因的表达盒所致的不利副作用的风险。根据本发明,生产宿主微生物优选地属于分类学类别黑粉菌纲、甚至更优选地属于黑粉菌目(ustilaginales),甚至更优选地属于黑粉菌科(ustilaginaceae),甚至更优选地属于以下任意者:anomalomyces、anthracocystis、bromeliago、核黑粉菌属(cintractia)、皮堆黑粉菌属(dermatosorus)、dirkmeia、eriocortex、丝黑粉菌属(farysia)、皮特黑粉菌属(franzpetrakia)、gymnocintractia、heterotolyposporium、kalmanozyma、langdonia、leucocintractia、macalpinomyces、瘤黑粉菌属(melanopsichium)、莫氏黑粉菌属(moesziomyces)、moreaua、mycosyrinx、parvulago、pericladium、portalia、假溢酵母属(pseudozyma)、restiosporium、裂孢黑粉菌属(schizonella)、shivasia、孢堆黑粉菌属(sporisorium)、stegocintractia、亚团黑粉菌属(tolyposporium)、茎黑粉菌属(tranzscheliella)、trichocintractia、triodiomyces、tubisorus、黑粉菌属(ustilago)、websdanea,并且最优选地属于假溢酵母属。鉴于现有技术调查的结果(zambanini等人,2017,任选地援引),即表明可以使用黑粉菌属(ustilago)微生物实现量更高的衣康酸(参见zambanini等人,2017表3),假溢酵母微生物和尤其筑波假溢酵母的效能是令人惊讶的。根据本发明进一步优选地,生产宿主微生物不表达土曲霉顺-乌头酸脱羧酶(cad1)基因的功能性直向同源物,也不表达玉米黑粉菌簇基因cyp3和rdo1中任一者。认为这些基因涉及衣康酸代谢;强烈表达这些基因可能导致衣康酸产生减少。根据本发明进一步优选地,生产宿主微生物不表达用于非同源末端连接的ku70蛋白和ku80蛋白的功能性直向同源物。按这种方式,生产宿主微生物对不想要的自发重组特别地稳定,尤其在生产宿主微生物包含多于一个本发明表达盒的情况下是这样。出于本发明目的,将ria1基因理解成编码ria1多肽的核酸序列。相应地,将itp1、adi1、mtt1或tad1基因分别理解成分别编码itp1、adi1、mtt1或tad1蛋白的核酸。根据本发明,与不表达ria1蛋白的相应菌株相比,根据功能性定义,ria1蛋白是能够增加基因itp1、adi1、mtt1和tad1中任一者表达至少10倍的蛋白质,如通过相应itp1、adi1、mtt1或tad1mrna的定量pcr所测量。根据结构性定义,ria1多肽与完整序列seqidno.35具有至少46%氨基酸序列同一性,优选地使用matgat程序并应用以下参数:blosum62矩阵、空位开口罚分12、空位延伸罚分2测定所述同一性。甚至更优选地,ria1多肽如上文刚才所述那样与seqidno.35具有至少55%氨基酸序列同一性、甚至更优选地至少57%氨基酸序列同一性。这类ria1蛋白在结构上密切对应于如本文实施例中所述的筑波假溢酵母ria1多肽,所述实施例进一步提示这类蛋白质的优点。还优选地,ria1蛋白的序列相似性相对于氨基酸序列seqidno.35是至少62%、甚至更优选地至少64%和甚至更优选地至少70%。特别优选在假溢酵母属中、最优选地在筑波假溢酵母中找到与这些多肽相对应的ria1多肽。特别地,优选的ria1多肽相对于seqidno.36的完整序列具有至少41%、甚至更优选地至少57%、甚至更优选地至少70%、甚至更优选地至少73$%、甚至更优选地至少80%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%的序列同一性。这类ria1多肽对应于实施例中进一步描述的有利ria1多肽。还优选地,ria1多肽的序列相似性相对于seqidno.36的氨基酸序列是至少46%、甚至更优选地至少59%、甚至更优选地至少70%、甚至更优选地至少73%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%。特别优选如下情况:根据上述功能性定义和/或结构性定义中任一者的ria1多肽包含至少1个、甚至更优选地至少2个、甚至更优选地至少3个、甚至更优选地至少4个、甚至更优选地至少5个、甚至更优选地至少6个、甚至更优选地至少7个、甚至更优选地至少8和最优选地全部9个分别与seqidno.38、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45和seqidno.46相对应基序。优选地,ria1多肽含有具有最多2个、甚至更优选地最多1个氨基酸交换的每个相应序列基序;除此之外,还优选与seqidno.38至seqidno.47的序列相比,这些基序不包含缺失或插入。甚至更优选地,序列基序的唯一差异在于,ria1多肽包含正确的序列seqidno.47,而非seqidno.38。最优选地,本发明的ria1多肽序列包含seqidno.47、seqidno.39、seqidno.40、seqidno.41、seqidno.42、seqidno.43、seqidno.44、seqidno.45和seqidno.46的全部基序,其中ria1多肽中基序与前述序列基序之间的总差异是最多1个氨基酸交换和最优选地0个氨基酸交换。根据结构性定义,itp1多肽与完整序列seqidno.33具有至少52%氨基酸序列同一性,优选地使用matgat程序并应用以下参数:blosum62矩阵、空位开口罚分12、空位延伸罚分2测定所述同一性。这类itp1蛋白在结构上密切对应于如本文实施例中所述的筑波假溢酵母itp1多肽,所述实施例进一步提示这类蛋白质的优点。还优选地,itp1蛋白的序列相似性相对于氨基酸序列seqidno.33是至少60%、甚至更优选地至少83%和甚至更优选地至少87%。特别优选在假溢酵母属中、最优选地在筑波假溢酵母中找到与这些多肽相对应的itp1多肽。特别地,优选的itp1多肽相对于seqidno.33的完整序列具有至少52%、甚至更优选地至少70%、甚至更优选地至少76%、甚至更优选地至少79%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%的序列同一性。这类itp1多肽对应于实施例中进一步描述的有利itp1多肽。根据结构性定义,adi1多肽与完整序列seqidno.32具有至少63%氨基酸序列同一性,优选地使用matgat程序并应用以下参数:blosum62矩阵、空位开口罚分12、空位延伸罚分2测定所述同一性。这类adi1蛋白在结构上密切对应于如本文实施例中所述的筑波假溢酵母adi1多肽,所述实施例进一步提示这类蛋白质的优点。还优选地,adi1蛋白的序列相似性相对于氨基酸序列seqidno.32是至少74%、甚至更优选地至少85%和甚至更优选地至少98%。特别优选在假溢酵母属中、最优选地在筑波假溢酵母中找到与这些多肽相对应的adi1多肽。特别地,优选的adi1多肽相对于seqidno.32的完整序列具有至少63%、甚至更优选地至少70%、甚至更优选地至少78%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%的序列同一性。这类adi1多肽对应于实施例中进一步描述的有利adi1多肽。根据结构性定义,mtt1多肽与完整序列seqidno.34具有至少53%氨基酸序列同一性,优选地使用matgat程序并应用以下参数:blosum62矩阵、空位开口罚分12、空位延伸罚分2测定所述同一性。这类mtt1蛋白在结构上密切对应于如本文实施例中所述的筑波假溢酵母mtt1多肽,所述实施例进一步提示这类蛋白质的优点。还优选地,mtt1蛋白的序列相似性相对于seqidno.34的氨基酸序列是至少59%。特别优选在假溢酵母属中、最优选地在筑波假溢酵母中找到与这些多肽相对应的mtt1多肽。特别地,优选的mtt1多肽相对于seqidno.34的完整序列具有至少53%、甚至更优选地至少57%、甚至更优选地至少70%、甚至更优选地至少78%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%的序列同一性。这类mtt1多肽对应于实施例中进一步描述的有利mtt1多肽。根据结构性定义,tad1多肽与完整序列seqidno.31具有至少84%氨基酸序列同一性,优选地使用matgat程序并应用以下参数:blosum62矩阵、空位开口罚分12、空位延伸罚分2测定所述同一性。这类tad1蛋白在结构上密切对应于如本文实施例中所述的筑波假溢酵母tad1多肽,所述实施例进一步提示这类蛋白质的优点。还优选地,tad1蛋白的序列相似性相对于seqidno.31的氨基酸序列是至少82%、甚至更优选地至少92%和甚至更优选地至少94%。特别优选在假溢酵母属中、最优选地在筑波假溢酵母中找到与这些多肽相对应的tad1多肽。特别地,优选的tad1多肽相对于seqidno.31的完整序列具有至少84%、甚至更优选地至少85%、甚至更优选地至少90%、甚至更优选地至少92%、甚至更优选地至少95%、甚至更优选地至少98%的序列同一性。这类tad1多肽对应于实施例中进一步描述的有利tad1多肽。本发明特别有利的生产宿主微生可用于将葡萄糖转化成衣康酸a)生产率为至少9.5g衣康酸/(ld)和/或b)产率为至少25%(w/w葡萄糖)。优选地,如此测定生产率:将发酵、优选地补料分批发酵8天后从发酵液回收的衣康酸的总质量除以发酵液最终体积和发酵期限。本发明也提供一种整合载体,所述整合载体包含用于ip基因座外部整合的与强组成型活性启动子有效连接的ria1基因。当转化担子菌、优选地转化前述纲、科、属或物种的担子菌,以将ria1表达盒(包含与强组成型活性启动子有效连接的ria1基因)特异性和可靠地整合入选定的特定整合位点时,这种整合载体允许实现本发明的前述优点。优选的本发明启动子是肌动蛋白启动子、hsp70启动子、tef启动子、gpd启动子和glc启动子,最优选如本文所述的肌动蛋白启动子。相应地,本发明提供一种改变衣康酸生产宿主微生物的方法,所述方法包括将-表达ria1基因和/或-表达至少两个选自adi1、mtt1和tad1的基因,的至少一个表达盒整合入微生物的基因组中除ip基因座之外的整合位点处。通过特异性整合时整合至少一个表达盒,这种方法使得本领域普通技术人员有可能将野生型担子菌转变成本发明的衣康酸生产宿主微生物,实现本文所述的优点。在该方法中,整合位点优选地a)位于左边界基因和右边界基因之间,其中在相应野生型微生物中,左边界基因和右边界基因的翻译起始密码子的腺嘌呤由最多51600个核苷酸分隔,其中左边界基因编码具有乙酰-coa合成酶活性的蛋白质,并且其中右边界基因编码蛋白质,其由与seqidno.25具有至少21%同一性的氨基酸序列组成;和/或b)距可读框的最近边界至多6500个核苷酸存在,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列,和/或c)位于可读框内部或替换可读框,所述可读框翻译成与seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23、seqidno.25中任一者具有至少30%序列同一性的氨基酸序列。上文已经描述且下文中进一步详述优选的整合位点和相应的优点。优选地,如此进行该方法,从而失活至少一个基因,所述基因i)编码与以下者具有30%序列同一性的蛋白质和/或ii)其互补链在至少低严格性条件下与编码以下者的核酸序列杂交蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者。再次,上文已经描述并且本文进一步描述这种失活的优点和优选失活的优点。该方法因此导致这样的微生物,其中相对于不包含至少一个整合于ip基因座外部的表达盒的对照微生物,所述微生物具有增加的衣康酸生产率。本发明也提供一种获得重组衣康酸生产宿主微生物的方法,所述方法包括a)培养亲本微生物,b)以任何顺序和/或同时进行,-若如此需要:一次或多次转化,以向微生物提供任何异源adi1、mtt1和tad1基因,以在微生物中获得活跃衣康酸途径,-至少一次整合处于组成型活性启动子控制下的ria1基因,其中不在ip-基因座中整合,-失活至少一个基因i)编码与以下者具有30%序列同一性的蛋白质和/或ii)其互补链在至少低严格性条件下与编码以下者的核酸序列杂交蛋白质序列seqidno.3、seqidno.5、seqidno.7、seqidno.9、seqidno.11、seqidno.13、seqidno.15、seqidno.17、seqidno.19、seqidno.21、seqidno.23或seqidno.25中任一者;和c)分离因步骤b)产生的重组衣康酸生产宿主微生物。一个特殊益处是,本发明提供一种衣康酸产生方法,所述方法包括a)将生产宿主微生物发酵以产生衣康酸,和b)回收步骤(a)中产生的衣康酸,其中微生物是本发明的微生物并且优选地根据改变衣康酸生产宿主微生物的前述任一方法获得或可获得和/或通过使用本发明的整合载体转化可获得或获得。发酵方法优选地是深层发酵,并且还优选地是分批发酵、补料分批发酵或连续发酵。补料分批发酵是特别优选的、特别有用的发酵方法,并且以下实施例中描述其中所用的材料。优选地在包含最多0.1%(v/v)的复杂培养基组分并具有最多5.5的ph的极限培养基中启动发酵。如实施例中所示,这类极限培养基特别地支持减少不利苹果酸酯副产物的量并且允许升高生产宿主微生物中衣康酸的生产率和产量。根据本发明,复杂培养基组分是玉米浸液(cornsteep)粉末、玉米浸液、玉米淀粉、玉米加工副产物、大豆加工副产物、糖蜜、酵母提取物、酵母自解产物和耗尽的发酵液。优选地,极限培养基不包含多于0.1%(v/v)的成分非确定培养基组分。最优选地,用于启动发酵和/或用于补料分批发酵期间添加的极限培养基不包含多于0.1%(v/v)的以下每者:玉米浸液粉末、玉米浸液、玉米淀粉、玉米加工副产物、大豆加工副产物、糖蜜、酵母提取物、酵母自解产物或耗尽的发酵液,甚至更优选地不包含多于总计0.1%(v/v)的玉米浸液粉末、玉米浸液、玉米淀粉、玉米加工副产物、大豆加工副产物、糖蜜、酵母提取物、酵母自解产物和耗尽的发酵液、并且最优选地不包含玉米浸液粉末、玉米浸液、玉米淀粉、玉米加工副产物、大豆加工副产物、糖蜜、酵母提取物、酵母自解产物和耗尽的发酵液。为避免疑问,宿主微生物和释放入发酵液中的物质不是发酵培养基的复杂培养基组分。本发明的发酵法如果优选地如此进行,则发期间酵,培养基(其优选地是如上文所述的极限培养基)的ph是最多5、甚至更优选地最多4.5和甚至更优选地3-4。降低ph到低于4导致细胞干重(dcw)停滞或至少导致明显生长迟缓,同时并未有损衣康酸生产率和产量情况,并且令人惊讶地,未导致苹果酸酯副产物形成的不利增加。培养基优选地包含多元醇碳源,并且发酵期间碳源的浓度不下降低于10g/l超过3小时。如通过实施例所示,这类发酵条件产生有利高的衣康酸生产率和产量,同时可忽略作为发酵副产物的苹果酸酯的形成。优选的多元醇碳源是葡萄糖、果糖、木糖、阿拉伯糖、乳糖、蔗糖、纤维二糖、麦芽糖、甘油和乙二醇。特别优选地,发酵培养基中衣康酸对苹果酸的浓度比率在发酵(分批发酵或补料分批发酵)结束时是至少15:1、优选地至少20:1和甚至更优选地至少100:1。根据本发明,不想要苹果酸形成。迄今,在黑粉菌中发酵产生衣康酸的全部先前尝试均不能重复地避免副产物苹果酸,在几种情况下,形成的苹果酸的量甚至高于衣康酸的量。减少微生物产生的苹果酸和优选地还减少微生物向培养基中分泌的苹果酸是有益的,因为苹果酸是krebs循环的组分;苹果酸损耗因此降低微生物以高产量发酵产生衣康酸的能力。步骤a)中的发酵方法优选地处于需氧或微需氧条件下。特别令人惊讶的是,即便早先尝试使用暂时微需氧条件发酵产生衣康酸(wo2009-1006627),但需氧条件将是有益的。实施例在本节中,缩写“ita”指衣康酸和/或衣康酸酯,“ma”指苹果酸/苹果酸酯并且“akg”指α-酮戊二酸/α-酮戊二酸酯。菌株、培养基和生长条件使用筑波假溢酵母菌株h488(cbs422.96,野生型,kawamura,d.,saito,o.,matsui,h.和morita,k.(1983).producingofitaconicacidbyyeasts:iiicultureidentificationofitaconicacidproducingstrains,shizuoka-kenkogyoshikenjohokoku27,77–88)、m15(h488的uv突变体)和新构建的ria1过量表达转化体hr12(h488-pptt.pactin.ria1,本工作)以及克隆用大肠杆菌(escherichiacoli)菌株dh10b。为了培养,使用12孔平板(3-ml微孔)、250-ml摇瓶、500-ml带挡板的烧瓶或600-ml生物反应器(multifors,inforsht,de)。将酵母细胞从-80℃深冷保存物(emers)划线到含有完全培养基ypd或选择用培养基(ym-hyg、ym-cbx)的琼脂平板上并且在30℃培育2-3天。在30℃和220转/分钟实施液态培养基中培养。在50ml完全培养基ypd中或用于产生衣康酸的极限培养基mg-ia中培育菌株。对于预培养物,将50ml液体ypd培养基(在500-ml带挡板的烧瓶中)用酵母细胞接种并且培育1-2天,直至od600达到25-30(ultrospec2000光度计,pharmaciabiotech)。将细胞通过离心收获(在3,500g,室温(rt)离心5分钟)并重悬于(高压灭菌的)2mldh2o中。将后续的液体培养物用为了获得初始od600=1所需量的细胞悬液接种。在筛选转化体的情况下,在3-ml(mg-ia)微孔培养物中培育细胞。用来自琼脂平板的细胞材料直接接种各孔并且用粘性膜密封平板的孔。对于摇瓶和孔板中培养,使用3.3gl-1caco3使培养基的ph保持恒定在5.0-5.5。关于生物反应器中的生长条件,参见表1。每24小时实施培养物采样。将大肠杆菌在液态lb-培养基中于37℃和220转/分钟培养。将细胞在含有氨苄青霉素(母液:10mgml-1,终浓度:100μgml-1)的固态lb-培养基上于37℃培育,以选择携带质粒的转化体。培养基和溶液mg-ian源:1gl-1nano3或nh4cl(尤其实验浓度选自1-8gl-1)p源:0.1gl-1kh2po4/k2hpo4x3h2o(尤其实验浓度选自0.1-3.0gl-1)无机盐类:0.7gl-1mgso4x7h2o,0.5gl-1nacl,0.5gl-1k2so4,0.4gl-1cacl2x2h2o微量元素:0.5mgl-1h3bo3,0.04mgl-1cuso4x5h2o,0.1mgl-1ki,0.4mgl-1mnso4x4h2o,0.2mgl-1na2moo4x2h2o,0.4mgl-1znso4x7h2o铁:6mgl-1fecl3x6h2o(乙醇中的母液)硫胺素:0.4mgl-1硫胺素-hcl碳源:150mgl-1葡萄糖,发酵期间每天调整ypd酵母提取物10gl-1蛋白胨(酪蛋白)20gl-1葡萄糖20gl-1ym酵母提取物3gl-1蛋白胨(酪蛋白)2.5gl-1麦芽提取物3gl-1葡萄糖5gl-1潮霉素b(100μgml-1)和萎锈灵(25μgml-1)用于选择含有质粒的筑波假溢酵母转化体lb(sambrook等人,1989)bacto-蛋白胨10gl-1酵母提取物5gl-1nacl10gl-1yepslight酵母提取物10gl-1蛋白胨(酪蛋白)4gl-1蔗糖4gl-1reg-培养基蛋白胨20gl-1蔗糖20gl-1山梨醇1m琼脂20gl-1scs山梨醇1m柠檬酸钠20mmph5.8stc山梨醇1mtris/hcl10mmph7.5cacl20.1m1x无机盐溶液3gl-1(nh4)2so41gl-1kh2po40.16gl-1k2hpo4x3h2o0.7gl-1mgso4x7h2o0.5gl-1nacl0.4gl-1ca(no3)2x4h2opbs8.0gl-1nacl0.2gl-1kcl1.78gl-1na2hpo4x2h2o0.27gl-1kh2po4一般技术:采样在孔板和摇瓶中培养实验情况下,每24小时通过直接取出200–1,000μl培养物培养液,实施采样培养物。通过经2个三通阀取出20ml培养物培养液(以维持无菌性),每24小时对生物反应器培养物采样。弃去前5ml培养液(以避免采样管中潜在积累的死细胞)。将剩余15ml培养物培养液收集入事先称重的15-mlfalcon管。光密度(od600)测量波长λ=600nm的光密度以追踪细胞生长情况。通过按3.500xg,rt离心5分钟,使细胞沉淀。用1x无机盐溶液洗涤沉淀物。在洗涤步骤后,将细胞重悬并用1x无机盐溶液稀释。在1.5ml一次性比色皿(层厚度:10mm)中用ultrospec2000光度计(pharmaciabiotech)实施测量。细胞干重(dcw)仅对生物反应器中培育的细胞培养物测定细胞干重。在事先称重的15-mlfalcon管中沉淀10ml培养液(在3,500g,rt离心10分钟)。将沉淀物用10mldh2o洗涤并且再次沉淀(在3,500g,rt离心10分钟)。移除上清液。随后将沉淀物在100℃干燥12小时并称重以最终测定dcw。葡萄糖酶测定法通过用酶分析试剂盒葡萄糖uv试验(r-biopharmag)进行酶测定法,测定培养介质中的葡萄糖浓度。根据生产商的操作方案进行。显微术将细胞离心并重悬于100μl固定液(pbs中4.5%v/v甲醛,pbs参见(sambrook等人,1989))中。借助光学和相差显微术按400x放大率进行可视化。dna酶处理根据标准方案使用以下反应混合物进行dna酶处理:样品hr12_1和h488_1的dna酶再处理dna酶i–无rna酶-eurx(roboklon,e1345)反应混合物32/38μlrna(hr12/h488)5μl10xdna酶i缓冲液1μlribolock核糖核酸酶抑制剂11.5/5.5μlh2o0.5μldna酶i在37℃15分钟用rnaclean-upxs-macherey-nagel纯化rna用15+10μlh2o洗脱(2步骤)用11.5μl的最大可能量进行cdna合成11.5μlrna1μl随机六聚体4μl5x缓冲液2μldntp′s0.5μlribolock40u/μl1μlrt对于rt对照,无rt并且总体积仅为10μl配制物2:10μl-反应混合物2.5/5.5μlrna(hr12_2/h488_2)3.0/0μlh2o0.5μl随机的六聚体2μl5x缓冲剂1μldntp′s0.5μlribolock20u/μl0.5μlrtrt-pcr用各自cdna进行pcr,作为双重确定;用rna和h2o对照进行pcr,作为单一确定10μl-反应混合物:5μlpcr-sybrgreen主混合物1.2μl混合引物(各自2.5pmol/μl)1μlcdna/rna/h2o2.8μlh2o96孔板中读取盖温度:105℃研究方案1:95.0℃,8:002:95.0℃,0:153:58.0℃,0:30平板读数4:72.0℃,0:10平板读数5:转至2,另外39次6:72.0℃,2:007:解链曲线60.0℃至95.0℃:增量0.5℃0:04平板读数8:20.0℃,0:01定量步骤3分析模式:荧光团cq测定:回归基线方法:sybr:自动计算实施例1:启动子表征对于四个基因tef3、hsp70、肌动蛋白和甘油醛3-磷酸脱氢酶基因的每一者,从立即上游区域扩增大约1,050bp长的序列。5'末端与kpni限制性位点互补并且3’末端与lacz-orf的前20bp互补。与此同时,从大肠埃希氏菌(escherichia(e.)coli)扩增编码β-半乳糖苷酶的lacz基因的orf,同时使5'末端与启动子序列之一的最后20bp互补并使得3’末端与psti限制性位点互补。在第二聚合酶链反应(pcr)期间,两个片段融合在一起。这可能归因于第一pcr中产生的两个片段的同源重叠末端。将重叠-pcr产物用kpni与psti消化并连接入线性化pptt质粒(质粒经kpni和nsii消化。nsii产生的末端与psti产生的末端相容)。将产生的lacz报道基因过量表达质粒,pptt-pactin-lacz;pppt-pgapdh-lacz;pppt-phsp70-lacz与pppt-ptef1-lacz各自转化入筑波假溢酵母h488和m15中。来自玉米黑粉菌的hsp70启动子(pumhsp70)充当阴性(数据未显示)。将获得的转化体在ypd完全培养基中培养2天或在mg-it(极限培养基)中培养4天。将细胞收获、机械裂解,提取并根据miller(1972)测试β-半乳糖苷酶活性。以onpg(邻-硝基苯基-β-d吡喃半乳糖苷)作为底物,在420nm对无细胞提取物的吸光度测量30分钟。为确定总蛋白含量,实施bradford蛋白质测定法(bradford,1976)。大部分转化体在完全培养基中显示β-半乳糖苷酶活性升高,而且在极限培养基中也如此。每个受检启动子的活性范围相当高。尽管与来自玉米黑粉菌的hsp70启动子相比,phsp70和ptef1转化体表现欠佳,但pactin是每种场景下显示酶活性升高的唯一受检启动子(参见图5-图8)。这类启动子活性差异的原因仍不清楚。归因于pactin控制下活性总体上相对高,这种启动子用于后续过量表达分析。实施例2:产生过量表达菌株通过异源引入完整的环状质粒pptt-pactin-ria1,产生了过量产生衣康酸的筑波假溢酵母hr12菌株。组成型肌动蛋白1强启动子用于全部的过量表达转化体。使用序列表中所列的引物,通过聚合酶链反应(pcr),从筑波假溢酵母h488的基因组dna衍生天然启动子序列和可读框(orf)序列(待过量表达的基因)。随后通过重叠-pcr,使启动子序列与相应的orf融合。通过分别扩增两个外显子并在一个pcr期间使启动子和两个外显子片段同时融合,克隆aco1的orf。随后切割重叠产物并连接入对应的质粒,所述质粒经切割并事先去磷酸化(关于限制性酶使用,参见图4)。实施例3:转化筑波假溢酵母转化方案改编自gillissen,b.,bergemann,j.,sandmann,c.,schroeer,b.,m.和kahmann,r.(1992).atwo-componentregulatorysystemforself/non-selfrecognitioninustilagomaydis,cell68,647–657,以及schulz,b.,banuett,f.,dahl,m.,schlesinger,r.,w.,martin,t.,herskowitz,i.和kahmann,r.(1990).theballelesofu.maydis,whosecombinationsprogrampathogenicdevelopment,codeforpolypeptidescontainingahomeodomain-relatedmotif,cell60,295–306。为转化筑波假溢酵母,仅使用新鲜制备的原生质体。为获得原生质体,将筑波假溢酵母细胞在30℃和220转/分钟在3mlym培养基中培育过夜。次日,将1ml培养物转移至50mlyeps浅培养基(lightmedium)并且在30℃和220转/分钟培育至少3小时,直至od600达到0.5。通过离心细胞收获(3.500xg,rt离心5分钟)。将细胞沉淀物用20mlscs洗涤,再次沉淀并重悬于2ml(在scs中6%w/v,无菌过滤)中。为了酶促裂解细胞壁,将细胞在室温于50ml-falcon管中温育并柔和振摇30-45分钟,直至50%的细胞是以原生质体形式存在。通过离心收获原生质体(10分钟,2,500转/分钟,4℃)。沉淀物在20mlscs,10mlscs和20mlstc(冰冷的scs与stc)中连续洗涤。在最后洗涤步骤后,将细胞重悬于0.5mlstc(冰冷)中并最终等分入1.5ml-反应管,体积为每管80μl。将原生质体温和地与至多15μg环状质粒dna(最大体积:10μl)混合并且在冰上温育10分钟。作为对照,使用10μldh2o替代dna。将细胞覆以500μlpeg4000(stc中40%w/v聚乙二醇4000,无菌过滤)并且在冰上温育15分钟。同时,配制选择性琼脂平板:使reg-培养基液化并冷却至大约50℃并且与两倍浓度的潮霉素b(200μgml-1)或萎锈灵(50μgml-1)混合。使用10mlreg-hyg/reg-cbx作为基底琼脂并覆以相同量的reg-培养基(无标志物)作为顶层琼脂。将原生质体温和地铺种并在30℃温育3-15天。将转化后获得的菌落划线到选择性平板上以纯化。随后,就衣康酸产生情况表型筛选单菌落。基因组dna分离自合适的候选物。使用基因组dna作为pcr模板,以检查相应的过量表达质粒的整合情况。通过对其基因组dna测序确认过量产生衣康酸的筑波假溢酵母菌株hr12。测序显示,处于组成型强启动子pactin控制下的针对衣康酸的调节基因ria1按照串联方向连同载体骨架的部分一起整合两次(参见图12)。第一拷贝由82.2%的过量表达质粒(1,627–9,167bp)组成并且第二拷贝由85.1%的过量表达质粒(1–7,804bp)组成。两个载体片段的整合出现在pseudog4086的orf中,同时删除由九个其他orf(pseudog4087–4095)组成的大约34kbp长的序列。负责筑波假溢酵母中产生ita的全部已知的天然基因均用来产生相应的过量表达质粒。由于先前试验中肌动蛋白1启动子展示总体最高的观测lacz-活性,故这种启动子序列用于ita簇基因(衣康酸代谢基因簇)的过量表达分析。类似于启动子活性试验,使这些基因与pactin序列融合,而在启动子-基因融合产物的5’-末端和3’末端上同时添加限制性酶位点。将产生的pcr产物消化并连接入相应线性化的pptt-质粒(参见图4)。关于产生的质粒,参见图13。根据bodinus,2011,将所得的质粒各自转化入筑波假溢酵母h488与m15,铺种在含有潮霉素b的reg-平板上并且在30℃培养3-10天。随后将转化体划线到含有潮霉素b的reg或ypd固体培养基上,以获得纯的单菌落。随后,在3ml孔培养物中就ita产生情况表型筛选单菌落。在12孔平板的每个孔中,添加刮铲头大小的caco3(大约20mg)并且随后用3ml液体mg-ia极限培养基(n:1gl-1;p:0.1gl-1;c:15%(w/v))填充。使用1μl-接种环,用单菌落接种每个孔。将平板各孔用半透膜密封并且在30℃和220转/分钟培养10天。在第3、第5、第7和第9天,每孔添加1mldh2o以代偿蒸发。在第10天通过离心收获细胞(4℃,18,000g离心15分钟)。对稀释的上清液(1:200–1:2.000)进行离子色谱,以定量产生的苹果酸(ma)和衣康酸。与参考菌株h488、m15和m15-cad相比,adi1过量表达仅产生总计四种轻微增加ita产生的转化体(ha1、ha8、ha10和ma7)。在10天培养后,这些四种转化体产生0.2–1.0gl-1ita。苹果酸仍是这些突变体中产生的主要有机酸(参见图14-图16)。在筑波假溢酵母野生型菌株h488中,过量表达衣康酸转运蛋白(itp1)无效果。不存在ita产生,仅检测到与h488相比相似量的ma(参见图18)。菌株m15中相同的过量表达导致不同结果。12个受检转化体中,10个显示升高水平的ita产生。这些转化体中三者mi8、mi9和mi11甚至分泌ita作为主要产物(参见图19)。这三个转化体产生9.9–12.5gl-1ita和6.7–9.0gl-1ma。在过量表达相同转运蛋白itp1的同时,在两个菌株之间观察到的差异可能潜在地意味着,ita的输出是菌株m15中的瓶颈。通过在h488中过量表达线粒体顺-乌头酸转运蛋白mtt1,仅一个转化体显示升高水平的ita(0.8gl-1ita,5.3gl-1ma)。其他突变体仅生ma(参见图21)。但是,菌株m15中相同的过量表达导致几个显示ita生产率升高的转化体,同时突变体mm8产生ita作为主要有机酸(11.5gl-1ita,8.0gl-1ma)(参见图22)。类似于乌头酸-δ-异构酶(adi1),通过过量表达tad1,仅可以在菌株h488中以及菌株m15中诱导少许ita产量(0.03–0.16gl-1)(参见图24与图25)。可以通过过量表达两种酶adi1和tad1,实现ita产生的仅少量(若有的话)增加。即便如此,引入上调的转运蛋白itp1和mtt1导致产量更高的转化体。通过过量表达两种转运蛋白之一产生更多ita的效果在菌株m15中最明显。这可能意味着,如果其他因素已经发挥作用,则顺-乌头酸从线粒体输出增加或ita输出本身并不导致更高的ita产生,但对于ita合成增加至关重要。通过用组成型上调的ria1基因拷贝转化筑波假溢酵母h488和m15,实现ita合成的显著改变。全部受筛选转化体均显示升高水平的ita。23个转化体中有20个产生ita作为主要产物(参见图27与图28)。尽管高度诱导ita产生,转化体之间的已形成ita的范围是巨大的:h488转化体为2.0–31.4gl-1并且m15转化体为1.3–33.4gl-1。相比ita,仅转化体hr7、mr4和mr11分泌更多的ma。摇瓶中培养生成的转化体及产生的衣康酸量定量:将最高产的六个转化体hr8;hr10;hr12;mr1;mr2;mr8稍后在含mg-ia极限培养基的摇瓶中培养,以进一步表征其ita产生能力。在带挡板的摇瓶中,将细胞在50mlmg-ia培养基(n:2gl-1,p:0.1gl-1,c:15%w/v)中培育八天。有意义地,与预筛选相比,仅转化体hr12显示相似的ita生产率(参见表5与图29)。hr12因此是用于进一步研究的主要转化体。转化体hr12表征为了酵母细胞能够仅依赖乙酸盐或乙醇作为碳源生长,辅酶a(coa)须乙酰化成乙酰-coa。pseudog4086编码催化这种反应的潜在乙酰-coa合成酶(形成amp)。通过质粒插入,局部缺失pseudog4086。为了核实乙醇/乙酸盐代谢是否受这种缺失影响,因此在含乙酸盐或乙醇作为唯一碳源的极限培养基上培育细胞(参见表6)。在野生型和hr12之间不存在可检测的生长行为差异。尽管局部缺失pseudog4086,酵母仍能够利用乙酸盐和乙醇。这个观察结果可以依据pseudog3222的基因产物的补偿效应解释。这个基因潜在地编码乙酸-coa连接酶(形成adp),该酶还催化coa的乙酰化。还不清楚筑波假溢酵母hr12是否仍能够依赖葡萄糖以外的其他碳源生长并产生ita。因此在含蔗糖、甘油或d-木糖作为如碳源的液体极限培养基中培育酵母hr12(参见图30和图31)。数据明确地显示,全部受测底物都为酵母用于生长及用来产生ita。以甘油(od600=45.6)和葡萄糖作为参考(od600=44.8),达到最高细胞密度。尽管导致细胞密度最低,但以蔗糖作为碳源时在培养七天后,筑波假溢酵母hr12产生量最高的ita,终点浓度为28.2gl-1ita。葡萄糖同等快速地转化成衣康酸,但实现较低的终浓度24.2gl-1.可能的原因是更多的碳用于细胞生长或脂质体或甘露糖基赤藓糖醇脂质(mel)形式储备。相对于蔗糖,采用甘油的ita产生在开始时慢得多,但达到可比量的ita(终点浓度:26.2gl-1)。依赖d-木糖的生长有点延迟,类似甘油的情况,但ita产量总体最低,第4天为16.6gl-1并且培养结束时仅为17.5gl-1。定量实时pcr提供证据:实际上,与野生型h488相比,hr12中全部五个ita簇基因均高度上调(图32和表6a)。与h488相比,hr12中过量表达的ria1基因显示470倍更高的转录速率。编码两种代谢酶adi1和tad1和线粒体转运蛋白mtt1的基因的表达甚至更高,增加2,500–3,500倍。衣康酸酯转运蛋白(itp1)的表达似乎仅略微地增加。这归因于以下事实:与hr12相比,h488中转录已经相对高(数据未显示)。鉴于数据,似乎无需进一步过量表达mtt1或任何其他ita簇基因,因为每个已分析基因的表达水平均高度地上调。过量表达受天然强启动子控制的例如来自土曲霉的顺-乌头酸脱羧酶基因(cad)图10显示筑波假溢酵母和土曲霉中的衣康酸产生途径。两个物种之间的差异是顺-乌头酸如何转化成衣康酸。在筑波假溢酵母中,顺-乌头酸在一个两步骤过程中代谢成ita,反-顺乌头酸为中间体。这个过程在土曲霉中是单步骤反应并受顺乌头酸脱羧酶(cad1)催化。构建了筑波假溢酵母转化体,其具有玉米黑粉菌hsp70启动子控制下的atcad1基因的额外拷贝。通过构建,产生了ita过量生产菌株m15-cad。为了确保atcad1基因在筑波假溢酵母中高度转录。因此,在pcr期间,使atcad1与天然的组成型pactin启动子融合,而同时添加kpni限制性位点(5'末端)和nsii限制性位点(3’末端)。2,589bp长的扩增子经kpni消化和nsii消化并连接入相应线性化的pptt-质粒,产生pppt-pactin-atcad1质粒(参见图33)。将环状质粒转化入筑波假溢酵母h488和m15。总计,已经产生并筛选13个转化体中(菌株h488中4个转化体,m15中9个)的ita产生能力(参见图35和图36)。全部转化体仍都产生苹果酸作为主要有机酸。菌株h488中未观察到通过过量表达atcad1产生ita。九个m15转化体中七个产生了量更高的ita,范围在0.7–5.4gl-1之间。m15-cad转化体类似地表现,相同条件下产生的ita量为0.7gl-1。受天然强启动子控制的乌头酸酶天然编码基因的过量表达问题在于,是否可以通过额外过量表达乌头酸酶以获得随后将供给失调的ita代谢途径的更多顺-乌头酸,进一步增加转化体hr12中ita的产生。首先,通过对ncbi数据库实施blastp检索,鉴定相应的酶。已经找到两个候选基因:pseudog3035,这个基因命名为ptaco1,和pseudog2814,命名为ptaco2。尽管aco1orf含有内含子,但扩增了无内含子的基因。方案类似于融合上述基因的pactin启动子:首先扩增两个外显子。第一外显子在5'末端与pactin启动子的3’-序列(21bp)互补,并在3’末端与第二外显子的5’-序列(20bp)互补。第二外显子的5'末端因此与第一外显子的3’-序列(20bp)互补。全部三个片段,pactin(与潮霉素b抗性盒互补,它携带萎锈灵抗性盒。天然aco2基因不含有内含子。借助重叠pcr,该基因与pactin启动子融合,同时还添加pfl23ii(5’-端)和nsii(3’末端)限制性位点。将消化的pcr产物连接入pfl23ii与nsii消化的pptt.cbx-质粒。将所得的aco1过量表达质粒和aco2过量表达质粒(参见图37)转化入筑波假溢酵母菌株hr12。总计已经获得11个转化体:5个aco1过量表达转化和6个aco2过量表达转化体。筛选全部转化体的ita酸产量。无一个转化体显示ita产量增加。与菌株hr12相比,hr12aco1-k5和hr12aco2-k1产生相等量。全部其他转化体均产生更少的ita。鉴定用于筑波假溢酵母的极限培养基kawamura等人(1981年,1982年,见上文)描述了用于培养筑波假溢酵母的培养基。这种培养基经修改用于配合筑波假溢酵母野生型h488产生ita并且最初含有玉米浸液(csl)作为诱导ita产生的基本组分。由于csl是组成不定的复杂成分,因此严格的标准化工艺不想要它。因此有必要找到替代极限培养基中csl的组分。在丰富ypd培养基中培养的筑波假溢酵母细胞以单个细胞形式显示快速生长。在带挡板的烧瓶中含ypd预培养物的50mlypd培养物里,它们可以在培养两天后实现至多od600=68的细胞密度。如果在用于子囊菌类嗜脂酵母的mg极限培养基中预培养酵母细胞(参见表7,修改根据mauersberger等人,2001:mauersberger,s.,wang,h.-j.,gaillardin,c.,barth,g.和nicaud,j.-m.(2001)insertionalmutagenesisinthen-alkane-assimilatingyeastyarrowialipolytica:generationoftaggedmutationsingenesinvolvedinhydrophobicsubstrateutilization,j.bacteriol.183,5102–5109)并转移入相同的极限培养基,则观察不到生长。如果将酵母在无生长一天后转移入ypd培养基,则细胞再次显示快速生长,表明细胞仍有活力。将细胞在丰富培养基(ypd)上预培养并转移入mg培养基时,在不转移入任一ypd培养基的情况下,可以观察到细胞生长。生长仍略微迟滞。这表明,某些化合物在痕量就可能足以使细胞在极限培养基中生长。为了观察是否可以诱导mg培养基中的生长,将筑波假溢酵母h488细胞在mg培养基中预培养并转移入新鲜的mg培养基中。在一天未观察到细胞生长后,向培养基供应10%(v/v)ypd培养基或1x复合维生素溶液(参见图42和表8)。两种情况下均观察到细胞生长。在后续培养中,测试在复合溶液中使用的单一维生素。八种维生素中的两种即肌醇和硫胺素使得筑波假溢酵母h488在mg培养基中生长成为可能(参见表9)。使用仅含有肌醇或硫胺素作为维生素的mg极限培养基,稳定培育筑波假溢酵母h488五代。酵母细胞甚至以巨大的胞内脂质体形式积累脂质(数据未显示)。然而,不能在含有筑波假溢酵母h488的mg-i培养基或mg-t培养基中检测到有机酸产生。使用mg-t作为过渡性极限培养基。优化用来产生衣康酸的培养基已经在这个项目中发现用于培育筑波假溢酵母h488的极限培养基的基本组成,但就其氮(n)含量和磷酸盐(p)含量而言,至关重要的是进一步开发它,以确保ita产生。测试n/p比率不同的mg-t培养基,显而易见的是不仅生长而且有机酸产生均明显地受不同的n/p比率影响(参见图43)。然而,苹果酸仍是筑波假溢酵母h488分泌的主要酸。按碳源的量调整mg-t组成,并且p源和n源的浓度设定为变量以测试不同比率。另外,把(nh4)2so4交换成nano3,因为硫酸根阴离子在ita定量的数据分析中起扰动作用。这种培养基命名为mg-ia(参见表10)。稍后在50mlmg-ia培养物中培养筑波假溢酵母h488。尽管仅有少量ita,但这是首次在含筑波假溢酵母野生型h488的极限培养基中产生ita。以2/0.1gl-1的n/p比率实现最高ita浓度0.3gl-1。同时,分泌12.4gl-1ma(参见图44)。在具有视为最佳的两个n/p比率(n/p:2/0.1–5/0.1)的相同培养基中培养筑波假溢酵母菌株m15。在mg-ia(n:2gl-1,p:0.1gl-1)中培养五天后,菌株m15已经分泌显著量的ita(6.9gl-1),但苹果酸以更大的量合成(9.5gl-1)。通过延长培养至八天,ita/ma比率达到临界点,ita是产生的主要酸:ita:14.8gl-1,ma:6.0gl-1(参见图45)。因此在具有不同量的n源(0.5-4.0gl-1)和p源(0.1-2.0gl-1)的3ml孔培养物中筛选筑波假溢酵母m15供产生ita。在氮量高和磷酸盐浓度低时,主要合成ma,但在低至中等氮浓度时,大大减少苹果酸酯产生。在较低的n浓度,ita反而是主要有机酸(参见图46)。这些结果,表明菌株m15中限制氮和磷酸盐触发ita产生。含n:2gl-1,p:0.1gl-1的摇瓶培养物中,当氮耗尽且细胞进入稳定生长阶段时,ita合成也大大增强(参见图45)。随后在mg-ia培养基中按n/p比率2/0.1和1/0.1培养过量产生ita的筑波假溢酵母菌株m15-cad。在八天培养后,与菌株m15相比,实现ita增加三倍-42.6gl-1(3.2gl-1ma)。在培养结束时,初始150gl-1葡萄糖剩下20.9gl-1葡萄糖,导致33%产率(g衣康酸酯/g葡萄糖)。随着氮量降低(1gl-1),实现较低细胞密度,这导致25.1gl-1的较低ita产生和仅24%的产率(参见图47)。增加氮量至5gl-1导致高得多的细胞密度,而同时ita产生大幅度减少:已经随0.1gl-1磷酸盐源产生15.5gl-1ita(ma:2.9gl-1;ita产率:15%)和随1.0gl-1p源产生24.1gl-1ita(ma:0.5gl-1;ita产率:16%)(参见图48)。全部所述菌株均显示培养基中的氮源和磷酸盐源比率与衣康酸分泌量之间的明确联系。如果考虑筛选不同的过量表达转化体,则已显而易见就ita生产率而言,转化体hr12行为不同。在3ml孔培养物中如同筑波假溢酵母m15那样筛选hr12,以检查这个转化体是否也依赖于某个量的n源和p源(参见图49)。在六天温育后,转化体产生大量的ita:16.3-24.4gl-1并仅产生适中浓度的ma:0.5-1.7gl-1。似乎在转化体hr12中存在因引入上调的ria1拷贝所致的解偶联作用。对于这种转化体,不限制为诱导ita产生所需要的n源或p源。尽管如此,采用更高的氮量和较低的p浓度,已经实现略高的ita浓度。这些样品中ma浓度已也较高。尽管成功地使ita合成与氮或磷酸盐限制条件解偶联,但仍不清楚不同n源是否影响借助菌株hr12产生ita。在含nano3(参考)、nh4cl或nh4no3作为n源的mg-ia培养基中培养筑波假溢酵母hr12,以检查潜在的关系。不想要(nh4)2so4,因为所得的[so4]2为阴离子。可以随nh4cl和nh4no3观察到略微较快的生长。细胞密度随nh4cl消退并且在七天培养后观察到最低。然而采用这种n源时,菌株hr12产生量最高的ita(在第7天27.5gl-1,ma和akg:0.18gl-1)。采用nano3培育的细胞达到最高细胞密度,但产生较少的ita:在第7天24.2gl-1,ma和akg:0.44gl-1.以nh4no3作为n源不损害生长行为,不过转化体hr12产生明显较少的ita:在第7天13.2gl-1,ma和akg:0.26gl-1。采用nh4no3时ita合成大幅下降的这种行为是令人惊讶的。它不能依据细胞团块的量描述。产生的细胞的数量正好在nano3和nh4cl时细胞的数量之间。也未确定培养基中存在的氮的相对量:nnano3:16.5%,nnh4cl:26.2%,nnh4no3:35.0%。在nh4cl情况下,细胞密度和ita产生之间似乎存在负相关。这是有益效果,因为以这种方式,更多资源可能潜在地转化成ita而非细胞团块。因此在稍后培养中,通过改变mg-ia的组成,将nano3替换为nh4cl(因此已经标记出有关培养)。发酵器中培养最有前景的转化体及产生的衣康酸量定量摇瓶中培养酵母在科学上是不可替代的,因为操作简单和它提供的结果及时。这种培养方法的主要缺点是对某些影响性变量例如通气缺少控制。为了能够可靠地大量培养酵母(中试装置和生产),逐级放大过程是必要的,因为微生物可能在较大体积中按非预期方式行事。在600ml-生物反应器中不同条件下培养筑波假溢酵母菌株m15-cad和hr12,以取得第一印象,ita产生是否可以可靠地从摇瓶层级放大,并且如果可以做到,则某些因素怎样影响ita生产率。为了发酵器培养,将细胞从甘油贮藏物(25%v/v)划线到ypd平板上。用这些细胞(最大四周龄)接种50mlypd培养基并且在30℃和220转/分钟培育一天至两天,直至实现细胞密度od600=25-35。通过在3,500g离心5分钟并将其重悬于3ml无菌h2o中,收获为了发酵器中获得初始od600=1.0所需的细胞量。发酵起点是接种时刻。若不另外陈述,则将细胞按以下条件培养:温度:30℃ph:5.5-通过添加1mhcl和2.5-5.0mnaoh持续调节通气:55%po2-1lmin-1供气并且在泡沫堆积情况下,通过动态搅拌≥400转/分钟来调节;自动地添加消泡ks911(evonikindustriesag)n源:nano3(或在相应标记的发酵中nh4cl)通过取出20ml培养物培养液,每24小时实施采样。通过测量光密度(od600)和细胞干重,确定细胞生长情况。使用uv-检验试剂盒(r-biopharmag,de)酶促估计葡萄糖浓度。通过离子色谱法实施有机酸浓度测量。另外,显微镜下对细胞观察形态变化和污染物的潜在存在。稍后考虑因取出培养物产生的损耗,以计算产量、生产率等。600ml生物反应器中用筑波假溢酵母m15-cad产生衣康酸在n/p比率为2/0.1或5/0.1gl-1的600mlmg-ia培养基中培养菌株m15-cad。与摇瓶培养物相比,ita生产率明显受n/p比率影响。采用仅2gl-1n源时,细胞团块的量相对低,但是已经产生更高的至多30gl-1的ita量。采用5gl-1n源时,与较低n源相比生物质产量加倍,但ita浓度仅为1/3。在两种培养基之间不仅存在巨大差异,发酵器中的ita产量显著低于摇瓶中。采用2gl-1n源,八天培养后在发酵器中产生30.5gl-1ita(1.0gl-1ma),相比之下,摇瓶中为42.6gl-1(3.2gl-1ma)。这构成仅72%在摇瓶中产生的酸。随着n浓度增加,这种效果甚至更明显。在八天后,仅可以实现58%的摇瓶培养浓度:8.9gl-1ita(0.3gl-1ma)。似乎可用的氮越多,则产生越多的生物质,因此更少碳源转化成ita。将n/p比率变动至4gl-1n源和1gl-1p源导致快速细胞生长,四天后dcw最大值为25.6gl-1。此后,细胞往往迅速死亡。ita产量与n/p比率5/0.1可比:六天后ita为10.9gl-1(1.1gl-1ma)。仅通过增加培养期间培养基(n/p比率:2/0.1)的ph至ph=7.0,就可以观察到有机酸产量大幅度变化。尽管相对于ph=5.5的先前发酵,酵母细胞显示相似的生长行为,但六天后仅3.4gl-1ita产生。甚至有机酸比率翻转,因为ma是产生的主要酸,培养结束时为6.9gl-1。在这种情况下,产生的生物质的量似乎不是问题。相对于ph=5.5,葡萄糖消耗及生物质积累速率十分相似。ita的溶解度随更高的ph值增加。这应当促进ita产生。为了通过升高tca循环中的顺-乌头酸合成潜在地增加ita,在发酵过程期间升高溶解氧至po2=90%(通气:2lmin-1)。这背后的构思是供应足够的氧,以确保电子传递链中的nad+和fad-再生。nad+和fad均为维持tca循环所需的必需电子载体。因为如此操作,总体ita产量极大地降低。六天后仅已经产生7.0gl-1ita和0.8gl-1ma。tca循环可能的确随供氧升高而更活跃,但生成的顺-乌头酸完全在tca循环用尽,而非转化成ita。在菌株m15-cad的生物反应器最后培养期间,关闭ph控制。反而使用4gl-1caco3维持ph。caco3是强碱(ca(oh)2)和弱酸(h2co3)的盐。它不溶于水中。当培养基中存在酸(强于h2co3)时,其阴离子替代碳酸根阴离子,同时形成相应的ca-酸式盐和h2co3(最终形成h2o和co2)。在发酵过程期间,仅使用这个量的caco3直至维持ph为5.5-6.0。因为如此操作,ita产量再次大大降低。六天后仅已经形成15.5gl-1ita和2.4gl-1ma。这的确是令人惊讶的影响,考虑与第一发酵相比,它是非常相似的发酵(参见图52)。唯一可察觉差异是维持约5.5ph的方法。再次可比量的细胞团块形成,但是消耗更少葡萄糖:在第一种情况下96gl-1和以caco3作为缓冲剂时85gl-1。这种葡萄糖消耗量差异类似于产生的ita的差异:26.6gl-1(在第6天)–15.5gl-1。于仍未知的原因,利用caco3似乎有损产物形成。总之,为了用筑波假溢酵母菌株m15-cad产生ita,重要的是限制可用的氮和磷酸盐供应。在摇瓶和较大的生物反应器中这的确如此,不过最佳n/p比率似乎在不同的培养物体积之间不同。磷酸盐限制是在这个菌株中诱导ita产生的必需部分。可用氮的量也是关键因素;如果存在n过量,则将用尽大部分葡萄糖以产生生物质,而非产生ita。另外,重要的是:还找出最大限度减少抑制性影响或竞争性代谢途径的最佳氧饱和度和ph。600ml生物反应器中用筑波假溢酵母hr12产生衣康酸还在600ml生物反应器中培养过量产生衣康酸的筑波假溢酵母菌株hr12。首先,采用认定对m15-cad最佳的条件。在分批发酵中以最初150gl-1葡萄糖,ph=5.5,po2=55%和温度30℃培养酵母。初始的n浓度和p浓度分别是2gl-1/0.1gl-1和4gl-1/1gl-1。显而易见,hr12行为不同于m15-cad。如孔培养物中已经显示,hr12不依赖于某个n/p-比率产生衣康酸。ita自发酵开始至结束以始终如一的速率形成。在氮和磷酸盐的量较少情况下(n/p:2/0.1gl-1),五天后产生41.6gl-1ita且无苹果酸产生,同时仅消耗90gl-1葡萄糖(参见图58)。这对应于8.3gl-1d-1的ita平均生产率。细胞快速生长。在第3天达到其最大值,但迅速下降,尽管ita的产生继续。图59显示初始n浓度和p浓度(4/1)升高非常有益于产生ita。与菌株m15-cad观察到的高n浓度和高p浓度的大幅度抑制作用不同,ita生产率升高66%。平均生产率为13.8gl-1d-1时,五天期间已经合成总计68.8gl-1ita,同时未检出ma的量。它在第2天-第3天达到其最大值并且此后缓慢下降。考虑消耗的葡萄糖和所得的68.8gl-1ita,实现产率46%(g衣康酸酯/g葡萄糖),甚至更多的资源可用时,细胞生长得较不密集并且生长更稳定。在后续培养中,上文描述的发酵(n/p:4/1gl-1)作为补料分批发酵重复总计十天,并且在第5天输入100gl-1(参见图60)。与先前培养相反,产生了显著更多的生物质。dcw在第3天达到最大值,维持这个量直至第5天。在输入葡萄糖后,细胞数量减少,但缓慢恢复直至发酵结束。在第5天,葡萄糖几乎完全耗尽,并且形成大约60gl-1ita。这与先前的培养一致。ita生产速率保持,整个培养时间几乎恒定为11.6gl-1d-1。在前五天期间,产生了可忽略量的ma和α-酮戊二酸(akg)(累积性1.6gl-1)。十天后,该量升至3.0gl-1。几乎30gl-1葡萄糖仍留在培养物培养液中。产生总计115.6gl-1ita,产率为28%w/w。从图61,显而易见,降低初始葡萄糖浓度至75gl-1并每日引入每日输入间隔期,导致细胞生物质快速增加。令人惊讶地,dcw在第5天后大幅度下降并此后保持恒定。通过更频繁地施加葡萄糖,总ita生产率略微降低至9.9gl-1d-1,有希望的产率为39%。升高氮浓度至5.5和8.0gl-1显示相似的最终结果。大量的细胞团块(dcw≥30gl-1)累积(参见图62和图63)。衣康酸产量也略微增加。在培养七天后,两种培养中产生大约90gl-1。通过将n-浓度从4gl-1变动至5.5gl-1,可以将生产率从9.9gl-1d-1增强至11.5gl-1d-1,同时还维持产率:36%w/w(先前为38%w/w)。采用8gl-1n源时,生产率甚至更高:12.8gl-1d-1,但是ita产率降至32%w/w。对于图64中所述的发酵,除葡萄糖外的全部资源起初均以较高的量存在:n/p比率:8/1及1.75x无机盐、微量元素和硫胺素量。以这种方式,ita生产率增加至13.4gl-1d-1(产率:33%w/w)。在七天后,合成93.5gl-1ita和1.4gl-1ma与akg。由于在摇瓶中测试的nh4cl有益,还在生物反应器中分析其用途(参见图65)。在八天后,产生90.3gl-1ita和2.3gl-1ma与akg。对于衣康酸,这对应于11.3gl-1d-1的生产率和41%w/w的产率。单纯通过切换n源,增加了生产率和产率。为了下游加工有机酸,非常有益的是已经在尽可能低的ph培养。因此分析较低ph值对生产率的影响。为了保持通过降低的ph调节所得的应激,在ph5.5启动发酵过程并且在第一天降低至4.0(并且在相应培养的第二天和第三天逐渐地进一步降至3.5和3.0)。图66显示与中性ph相比,细胞生长在ph4.0受约束高得多,但在发酵过程期间非常稳定。考虑细胞形态,细胞似乎尺寸更小,更频繁地形成假菌丝并且显示较低的脂质贮藏活性。如果形成任何脂质体,则与ph5.5时培育的细胞相比,其尺度微小。通过以下观察结果确认抑制脂质贮藏,即,这些酵母细胞在稍晚的培养日不漂浮,原因在于单个细胞密度因脂质积累所致的变化。稍后在几乎相同的发酵中确认这些结果,差异在于第7天供应1gl-1nano3以潜在地维持细胞活力(参见图67)。细胞生长首先非常迅速,但在降低ph后下降。在调节ph后,可以观察到与先前培养中相似的稳定生长行为。九天后的终浓度是98.1gl-1ita(生产率:10.9gl-1d-1,产率:40%w/w)及累积0.06gl-1ma与akg。通过进一步降低ph至3.5或甚至3.0,细胞生长和ita产生均以明显方式受到不利影响(参见图68和图69)。七天后分别产生48.9gl-1和62.9gl-1ita(在两种情况下累积0.5gl-1ma与akg)。尽管平均生产率仅在7.0和9.0gl-1d-1之间,但产率在31-38%w/w之间。应当认定在前几日期间,ita生产率显得像ph较高下培养过程的生产率。在两种发酵中,第4天后ita合成几乎停顿。这也在葡萄糖消耗量方面见到。这表示,酵母细胞按照与先前发酵可比、但当降低ph时减缓的速率,将葡萄糖转化成ita。在ph3.5和3.0,细胞不能较长时间维持ita产生或甚至细胞基本代谢。迄今显示,筑波假溢酵母hr12是时间较短的分批发酵中稳健的衣康酸生产者。然而对于较大规模的生产,以连续或半连续方式培养往往更有成本效益且更可行。通过半连续发酵,在某些时间后取出大部分的培养液,用新鲜培养基再次填充至初始体积,并且进一步培养。这带来效率更高的优点,原因在于培养时间较长。还可能完全转化底物。另外,必须不太频繁地实施构建并且因此最大限度降低相关风险(例如失效的接种物)。为了研究菌株hr12是否将为合适的候选物,实施半连续发酵。因此将酵母以n/p比率6/1(n源:nh4cl)在ph=4.0培养七天。在第7天,移除1/2的培养液并以新鲜培养基补充。如图70中所示,hr12在整个14天培养期间持续产生ita。甚至在更新后,生产率似乎稳定。在结束是,产生112.0gl-1ita(0.4gl-1ma与akg)。如果考虑因培养物替换所致的产物巨大损耗,理论上以11.5gl-1d-1的速率产生160.4gl-1ita,产率为35%w/w(参见图71)。表1.不同的非传统酵母基因组和酿酒酵母基因组在其染色体数目、基因组大小、gc含量、编码的基因数目和所得的蛋白质数目方面的比较。表2:与玉米黑粉菌染色体相比的筑波假溢酵母框架的同源框架或部分表3.报道的可用于筑波假溢酵母的强异源启动子序列和天然启动子序列表4.针对筑波假溢酵母hr12中已缺失基因的蛋白质blast的结果。*仅部分地缺失pseudog4086。表5.在50mlmg-ia极限培养基(n:2gl-1、p:0.1gl-1,c:15%w/v,无ph-对照)中8天摇瓶培养后,6个选择的ria1过量表达转化体的ita与ma浓度和ita生产率。受体菌株转化体ita浓度(8天)ma浓度(8天)ita生产率h488hr84.4gl-16.6gl-10.6gl-1d-1hr103.4gl-16.8gl-10.4gl-1d-1hr1236.4gl-10.0gl-14.6gl-1d-1m15mr19.9gl-14.9gl-11.2gl-1d-1mr217.8gl-13.9gl-12.2gl-1d-1mr83.5gl-12.9gl-10.4gl-1d-1附图部分中复现表6表6a:诱导ita代谢基因表7.用于子囊菌类嗜脂/亲脂酵母生长的mg极限培养基的组成。这种培养基是开发用于筑波假溢酵母产生ita的极限培养基的基础。表8.100x维生素母液的组成。100x维生素母液200mgl-1对氨基苯甲酸(paba)2mgl-1叶酸400mgl-1吡多醇-hcl2mgl-1生物素2gl-1肌醇200mgl-1核黄素400mgl-1泛酸钙400mgl-1烟酸400mgl-1硫胺素-hcl表9.含不同维生素的mg培养基中筑波假溢酵母h488的生长。培养基生长培养基生长mg-mg-n-mg-a-mg-p-mg-b-mg-r-mg-c-mg-t+mg-f-mg-vit.+mg-i+ypd+其中:表10.含不同浓度氮源和磷酸盐源的mg-ia极限培养基的组成。表11.序列表汇编当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1