用于生产具有抗肿瘤活性的细胞颗粒的方法与流程
[0001]
本发明涉及一种用于在细胞疗法中生产具有抗肿瘤活性的细胞颗粒的方法,该方法可以离体实施。
背景技术:
[0002]
众所周知,成体祖细胞,包括具有归因于人脂肪组织来源周细胞(以下简称ad-pc)的表型的细胞群,可以用作携带生物活性分子的载体。
[0003]
特别地,ad-pc可以携带所谓的“死亡配体”,即,属于肿瘤坏死因子超家族的分子家族。
[0004]
其中,肿瘤坏死因子相关凋亡诱导配体(以下简称trail)分子可以诱导病变组织中的细胞死亡,因此对于trail分子在某些生物医学领域的可能用途特别令人感兴趣。
[0005]
从欧洲专利ep2424979中已知一种生产用于治疗肿瘤的药物的方法,该方法包括制备编码trail分子的可溶性变体并稳定转染脂肪周细胞(ad-pc)的逆转录病毒载体。
[0006]
携带trail的ad-pc已经在体外和体内显示出对某些肿瘤的细胞毒活性,因此在癌症治疗方面特别令人感兴趣。
[0007]
此外,术语“细胞颗粒”表示细胞活性的产物,由自发释放到细胞外的粒子组成。
[0008]
这些粒子由全部或部分由磷脂组成的封闭圆形膜界定。此外,这些粒子的特征在于直径尺寸介于40nm和5000nm之间。
[0009]
细胞颗粒可以来源自质膜的突起,该突起随后从质膜脱离。
[0010]
或者,细胞颗粒可以来源于细胞内细胞器(称为内体),随后通过内体膜与质膜融合而释放到细胞外。
[0011]
或者,在细胞凋亡过程中,细胞颗粒可以来源自质膜的突起。
[0012]
已知在由组成细胞颗粒的粒子的内腔或膜中,细胞颗粒可以包括源自产生细胞颗粒的细胞的分子。
[0013]
然后,这些分子与细胞颗粒一起被输送到细胞外。
[0014]
但是,这种现有技术受到一些问题的影响。
[0015]
第一个问题是,出于治疗目的提供的在生物体内接种携带生物活性分子的活细胞的治疗的安全性仍在争论中,因为被接种细胞的命运无法预先控制,即,接种后细胞的行为是未知的。主要的不确定因素涉及被接种细胞不受控制的扩增的潜力,这可能导致健康器官受损和生理功能改变。
[0016]
第二个问题是,出于治疗目的在生物体内接种携带生物活性分子的活细胞会触发接受生物体的排斥反应,从而使治疗本身无效。
[0017]
第三个问题是,携带必须注入的生物活性分子的活细胞的使用需要产生大量细胞,因此成本很高。
技术实现要素:
[0018]
本发明的一个目的是改善现有技术。
[0019]
本发明的另一个目的是出于抗肿瘤目的,提供一种用于生产源自产生trail的ad-pc(ad-pc-trail)的细胞颗粒的方法。
[0020]
本发明的另一个目的是提供一种用于生产源自ad-pc-trail的细胞颗粒而不影响trail的抗肿瘤作用的方法。
[0021]
本发明的另一个目的是提供一种用于生产源自ad-pc-trail的细胞颗粒的方法,该方法减少了ad-pc-trail的同时施用,从而限制了归因于ad-pc自身的对生物体的每种不良副作用。
[0022]
本发明的另一个目的是提供一种用于生产源自ad-pc-trail的细胞颗粒的方法,该方法减少了ad-pc-trail的同时施用,从而使trail的施用是大体上经济的。
[0023]
根据一个方面,本发明根据权利要求1的特征提供一种用于生产具有抗肿瘤活性的细胞颗粒的方法。
[0024]
根据本发明的另一方面,根据权利要求5的特征提供一种细胞颗粒。
附图说明
[0025]
通过以下对用于生产具有抗肿瘤活性的细胞颗粒的方法的实施例的描述,本发明的其他特征和优点将更加明显,作为非限制性示例根据附图给出,其中:
[0026]
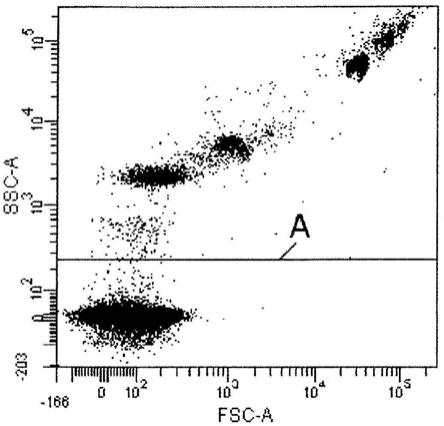
图1为示出了用流式细胞仪分析的已知直径介于500nm和3000nm之间的一类校准微珠的点图。水平线“a”将仪器的背景噪声(线以下)与代表获得的数据的点(线以上)分开。
[0027]
图2为示出了用流式细胞仪分析的分离的细胞颗粒的点图。水平线“a”将仪器的背景噪声(线以下)与代表获得的数据的点(线以上)分开。
[0028]
图3为示出了从ad-pc分离并用羧基荧光素二乙酸盐琥珀酰亚胺酯(cfda-se)分子染色的细胞颗粒的荧光的直方图。
[0029]
详细地,线“b”将与未用cfda-se染色的细胞颗粒的荧光强度相当的较低荧光强度的左视野与较高荧光强度的右视野分开。
[0030]
图4为示出了在用空载体修饰因此不表达trail的ad-pc(ad-pc-empty)来源的细胞颗粒中或在ad-pc-trail中(以pg/百万个细胞来表达)检测到的trail浓度的表。
[0031]
图5为在用源自ad-pc-empty或ad-pc-trail的细胞颗粒孵育的bxpc3肿瘤细胞之中细胞毒性试验的图。
[0032]
图6为在用源自ad-pc-empty或ad-pc-trail的细胞颗粒孵育的a673肿瘤细胞之中细胞毒性试验的图。
[0033]
图7为与对照a673细胞相比,对用ad-pc-trail来源的细胞颗粒孵育的a673细胞的半胱氨酸蛋白酶8(caspase 8)活化试验的图。
具体实施方式
[0034]
本发明涉及一种用于生产细胞颗粒(特别是源自ad-pc-trail、已发现具有抗肿瘤活性的细胞颗粒)的方法。
[0035]
根据图1,其示出了已知尺寸介于500nm和3000nm之间的校准微珠的样品的基于前
向散射(fsc)和侧向散射(ssc)形态学参数的流式细胞仪分析。
[0036]
根据图2,其示出了根据fsc和ssc形态学参数对从ad-pc分离的细胞颗粒的流式细胞仪分析。
[0037]
根据图3,其示出了用cfda-se染色后从ad-pc分离的细胞颗粒发出荧光。
[0038]
特别是,95.9%的细胞颗粒的荧光测试呈阳性。
[0039]
根据图4中的表,其示出了通过酶联免疫吸附试验(elisa)在源自ad-pc-empty或ad-pc-trail的细胞颗粒中检测到的trail浓度。
[0040]
特别是,值得注意的是没有检测到从ad-pc-empty来源的细胞颗粒释放的trail的存在,而测量到从源自100万个ad-pc-trail的细胞颗粒获得的446pg trail。
[0041]
根据图5,细胞毒性试验表明ad-pc-trail来源的细胞颗粒能够对bxpc3肿瘤细胞系产生细胞毒性作用。
[0042]
特别是,当用ad-pc-trail来源的细胞颗粒孵育细胞时,测得的bxpc3细胞的死亡率为34.6
±
3.6%,而当用ad-pc-empty来源的细胞颗粒孵育细胞时,死亡率为16.5
±
6.2%。使用t检验统计检验,两组之间具有统计学显著性差异,p<0.05(在图中用*表示)。
[0043]
数据表示为平均值
±
sem(平均值的标准误差),在以下其他附图中使用相同的表示。
[0044]
根据图6,细胞毒性试验表明ad-pc-trail来源的细胞颗粒能够对肿瘤细胞系a673产生细胞毒性作用。
[0045]
特别是,当用ad-pc-trail来源的细胞颗粒孵育细胞时,检测到的死亡率为93.1%,而当用ad-pc-empty来源的细胞颗粒孵育细胞时,死亡率为16.1
±
16.2%。
[0046]
使用t检验统计检验,两组之间具有统计学显著性差异,p<0.01(在图中用*表示)。
[0047]
数据表示为平均值
±
sem。
[0048]
根据图7,其示出了相对于参考对照,在用ad-pc-trail来源的细胞颗粒孵育后,a673细胞上的半胱氨酸蛋白酶8的活化百分比。该治疗已确定半胱氨酸蛋白酶的活化比对照中的高296
±
5%。
[0049]
使用t检验统计检验,相对于对照,具有统计学显著性差异,p<0.001。数据表示为平均值
±
sem。
[0050]
实施例1
[0051]
分离由ad-pc产生的细胞颗粒。
[0052]
用于分离由ad-pc产生的细胞颗粒的方法如下。
[0053]
将培养的已经达到约80%融合度的ad-pc用pbs(由biochrom gmbh生产)洗涤,并将培养基更换为含有1%l-谷氨酰胺(由lonza生产)和1%青霉素/链霉素(在0.9%nacl中的10000u/ml青霉素、10mg/ml链霉素,由paa laboratories生产)的αmem培养基(由thermo fisher scientific inc.生产)。
[0054]
然后在进行上清液收集之前,将ad-pc在培养箱中培养48小时。
[0055]
对从ad-pc-trail和ad-pc-empty的细胞培养物中收集的上清液进行差速离心处理:在+4℃下以2,000g的速度进行20分钟的初始离心,随后用0.8μm过滤器对上清液进行重力过滤,并在+4℃下以20,000g的速度进一步离心40分钟。
[0056]
在这些阶段结束时,将含有细胞颗粒的沉淀物重悬于最合适的培养基中,以用于
dmem培养基,将按照前述实施例1中的分离方案获得的完整细胞颗粒重悬于该培养基中。
[0078]
24小时后,每mts将20μl溶液添加到每个孔,在使用glomax discover仪器(由promega生产)进行495nm处吸光度的测量之前,将板在37℃下孵育1小时,495nm处吸光度与活力和代谢活性成正比。
[0079]
所有实验都包括基础死亡率的对照,该对照由与相同培养基接触但没有与细胞颗粒接触的肿瘤细胞组成。
[0080]
为了证实trail在诱导对a673细胞的细胞毒性中的作用,使用caspase-glo8测定试剂盒(由promega生产)研究了半胱氨酸蛋白酶8的活性。
[0081]
特别是,将肿瘤细胞以每孔5,000个细胞的浓度接种在白色多孔板中。
[0082]
第二天,将培养基更换为含有如前所述分离的、完整的ad-pc-trail来源的细胞颗粒的新鲜培养基。
[0083]
18小时后,根据制造商提供的方案,使用glomax discover仪器评估半胱氨酸蛋白酶8的活性。
[0084]
实施例3的结果
[0085]
在用源自ad-pc-empty和ad-pc-trail细胞的细胞颗粒孵育24小时后,通过用mts的细胞毒性试验,对诱导的bxpc3和a673肿瘤细胞系的死亡率进行了检测。
[0086]
用ad-pc-trail来源的细胞颗粒处理bxpc3细胞,死亡率为34.6
±
3.6%,显著高于用ad-pc-empty来源的细胞颗粒所获得的死亡率,而后者没有显示出相关的细胞毒性作用(见图5)。
[0087]
由ad-pc-trail来源的细胞颗粒诱导的a673细胞的死亡率为93.1
±
9.6%,显著高于用ad-pc-empty来源的细胞颗粒所获得的死亡率,而后者没有显示出显著的细胞毒性作用(见图6)。
[0088]
在用ad-pc-trail来源的细胞颗粒孵育a673肿瘤细胞18小时后,与未处理的对照相比,通过定量测定半胱氨酸蛋白酶8的活化百分比,可以验证trail在诱导肿瘤细胞死亡中的作用。
[0089]
该处理测得半胱氨酸蛋白酶的活化比对照的高296
±
5%,这支持由trail介导的细胞毒性作用(见图7)。
[0090]
在实践中,已经发现本发明达到了预期的目的。
[0091]
所构思的本发明易于进行修改和变型,所有这些修改和变型都在本发明构思的范围内。
[0092]
此外,所有细节都可以用其他技术上等效的细节进行替换。
[0093]
在实践中,在不脱离所附权利要求的保护范围的前提下,可以根据需要使用任何材料、设备和数量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1