NIR-II发射性发光体的制作方法
本发明主题主要涉及一系列能够在900nm至1700nm的光谱范围内产生聚集诱导发射的化合物以及它们在体内成像中的应用。
背景技术:
具有nir发射的有机染料在诸如有机发光二极管(oled)、荧光成像和防伪技术之类的许多领域是有利的。近红外(nir)荧光成像是一种生物相容性成像技术,该技术可以实现非侵入性、高分辨率且实时的可视化以及在细胞水平上对活生物体的动态跟踪。因此,nir荧光成像在疾病的早期检测和准确诊断中显示出巨大的潜力。
与诸如计算机断层摄影(ct)、磁共振成像(mri)和正电子发射断层摄影(pet)之类的其他成像技术相比,荧光成像具有成本低、分辨率高和实时监控性的优点。由于在1000nm至1700nm(近红外二区,“nir-ii”)的光谱范围内的光子散射最小且组织自发荧光可忽略不计,因此与使用nir-1荧光(650nm至900nm的光谱范围内的近红外一区)的传统荧光成像相比,nir-ii荧光成像具有改进的成像性能、更高的图像对比度、更大的穿透深度。
已经研究了包括天然聚合物、有机小分子染料、无机量子点和有机荧光纳米颗粒的多种荧光材料以用于荧光成像和传感。在这些荧光材料中,基于有机染料的荧光纳米颗粒由于其尺寸可调、细胞毒性低、光稳定性好且具有表面功能化可行性而成为研究焦点。
有机发射体种类丰富。然而,传统的平面有机染料在聚集时具有减弱的或甚至猝灭的发射,即为众所周知的聚集引起的猝灭(acq)。因此,传统平面有机染料的应用受到很大的限制。对于具有红光或近红外(nir)发射的染料来说,acq现象特别明显,因为这些染料的偏长的π-共轭或强的给体-受体(d-a)相互作用有利于强的π-π相互作用,从而抑制发射。与acq系统相反,tang等人发现的一类新型分子转子表现出聚集诱导发射(aie),这意味着它们在稀溶液中几乎不表现出发射或不表现出发射,但是通过分子内运动受限(rim)而增强了聚集体中的荧光。aie发光体(aiegen)的独特发射性质为制备高发射性有机荧光纳米颗粒铺平了道路。
与其他传统的可见光发射性染料相比,具有nir吸收和发射的有机染料因其较低的细胞或组织自发荧光干扰以及抗光漂白能力而在生物应用中更有利。然而,许多nir荧光团是有毒的。此外,许多现有的nir-ii荧光团在分离状态和聚集状态下都具有发射性。这些nir-ii荧光团的“始终开启”特征对于体内微环境的变动具有有限的响应能力。
现有nir荧光团的合成通常是复杂的。对于具有nir吸收的nir-ii发射性aiegen的合理设计和合成方法以前是难以实现的。首先,因为大多数aiegen具有高度扭曲的结构,所以由于分子主链的不良π-共轭,仅仅通过扩大π-系统的电子离域很难有效地进行红移发射。其次,通过稠环或双键而形成过大的π-共轭可能导致溶解性差、aiegen的不稳定性提高和/或acq问题。构建d-a(给体-受体)结构是一种提供红光发射体的非常有效的策略。然而,一些荧光团的扭曲结构导致d-a型aiegen的发射受到扭曲分子内电荷转移(tict)的影响,已经提出了扭曲分子内电荷转移(tict)为d-a型荧光团的主要非辐射性衰减途径之一。此外,由于强的分子间π-π相互作用,d-a结构的扩大的π-共轭可能导致acq问题。
因此,非常需要具有d-a结构却依然能够克服这些挑战的有机发光团。
技术实现要素:
本发明主题涉及具有聚集诱导发射(aie)特征的小分子化合物。本申请的化合物包括基于1,3-双(二氰基亚甲基)茚满(bdci)的给体-受体(d-a)结构的nir荧光团,bdci为空间缺电子的强受体。电子给体通过扭曲的准双键(tqdb)与受体连接。据信,本申请的化合物的aie特征至少部分源于存在扭曲的准双键。
本申请的化合物可以提供近红外二区(secondnear-infraredwindow,nir-ii)中的发射,从而用作nir-ii激活的荧光探针。本化合物是无毒的,因而可以用作nir-ii荧光染料以用于体内成像。本化合物可以与诸如肽、糖、适体和抗体之类的生物活性分子结合,以提供特异性和活性的nir-ii荧光探针。本化合物可以在许多应用中用作活性nir-ii荧光探针,例如癌细胞靶向成像、疾病的精确诊断和图像引导的光疗。由于本化合物可用于nir-ii区成像,因此这些化合物可以用于体内深部组织、高分辨率的光学成像。
在一个实施方案中,本化合物可以具有以下主链结构式:
其中r1和r2各自独立地选自由下列组成的组:
其中r3、r4、r5和r6各自独立地选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;
其中r7选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;并且
其中n为选自1、2、3、4和5中的整数。
在一个实施方案中,各r1和r2可以为
在一个实施方案中,各r3、r4、r5和r6可以为氢。
在一个实施方案中,n为1。
在另一个实施方案中,化合物为
附图说明
现在将参照附图对各种实施方案进行详细描述。
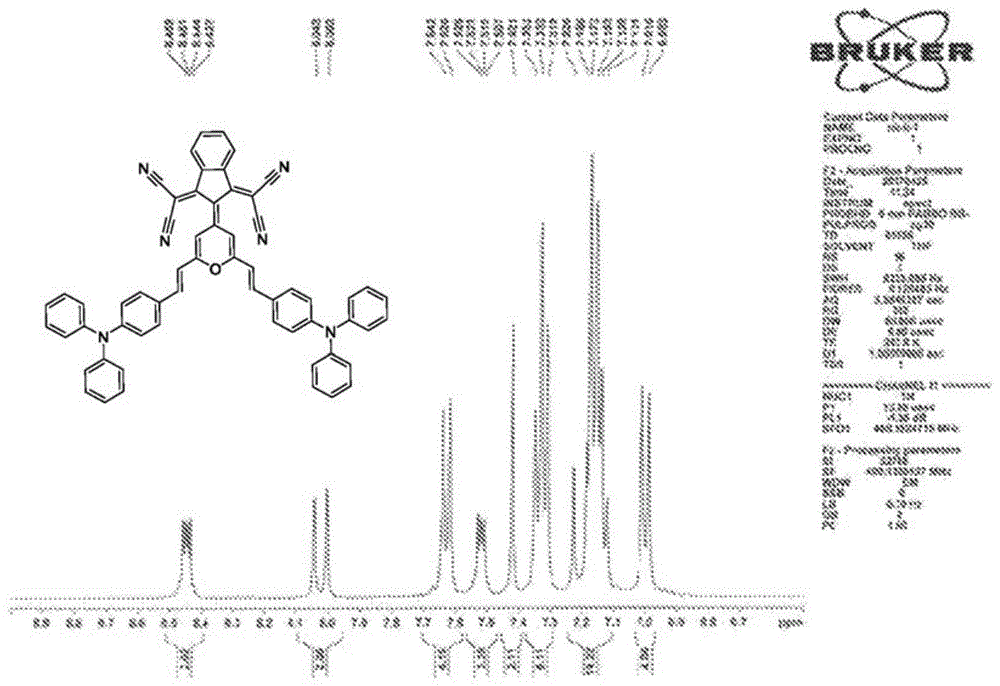
图1示出了tspci的1hnmr谱。
图2示出了tspci的13cnmr谱。
图3示出了tspci的高分辨质谱(maldi-tof)。
图4示出了(a)在日光下的tspci粉末的图像;(b)tspci的紫外-可见吸收光谱;(c)tspci在thf以及具有不同水分数(fw)的thf/水混合物中的光致发光(pl)谱;以及(d)950nm处的相对pl强度相对于fw的图(浓度:10μm;激发波长:808nm)。图4d的插图示出了在808nm波长的激光照射下,在1.5ml离心管中,tspci在thf(fw=0体积%)(左)和水/thf混合物(fw=90体积%)(右)中的荧光照片,使用ingaas照相机(1000nm至1600nm)采集荧光照片。
图5示出了对tspci绘制面板(nir-ii荧光)的半峰全宽(fwhm)曲线分析,其中(a)没有纸层覆盖;(b)一个纸层(64μm);(c)两个纸层(128μm);(d)三个纸层(192μm);(e)四个纸层(256μm);(f)五个纸层(320μm);(g)六个纸层(384μm);(h)七个纸层(448μm);(i)八个纸层(512μm);和(j)九个纸层(576μm)。每幅图中的插图示出了使用基于ingaas的nir-ii照相机拍摄的平面的灰度荧光图像。
图6示出了依次为图5a至图5j中提供的每个nir-ii荧光图像的空间分辨率分析。
图7示出了裸鼠在下列情况的时间过程nir-ii荧光图像:(a)静脉注射tspci溶液前;(b)注射tspci溶液后一秒;(c)注射tspci溶液后两秒;(d)注射tspci溶液后三秒;(e)注射tspci溶液后四秒;和(f)注射tspci溶液后五秒。
具体实施方式
定义
提供以下定义是为了理解本发明主题和构建所附专利权利要求。
应注意的是,如本说明书和所附权利要求书中所使用的,除非上下文另有明确规定,否则单数形式“一”、“一个”和“该”包括复数指示物。
如本文所使用的术语“λex”是指激发波长。
如本文所使用的短语“聚集引起猝灭”或“acq”是指π-共轭荧光团的聚集显著降低荧光团的荧光强度的现象。聚集体形成被称为使荧光团的光发射“猝灭”。
如本文所使用的短语“聚集诱导发射”或“aie”是指以无定形或结晶(固体)状态聚集时表现出显著增强的光发射而在稀溶液中表现出弱发射或几乎无发射的化合物所表现的现象。
如本文所使用的“发射强度”是指通常由荧光光谱仪或荧光显微镜测量获得的荧光/磷光的大小;如本文所使用的“荧光团”或“荧光分子”是指表现出荧光的分子;如本文所使用的“发光分子”或“发光团”是指表现出发光的分子;并且如本文所使用的“aiegen”是指表现出aie特征的分子。
如本文所使用的,“卤代”或“卤素”是指氟、氯、溴及碘。
如本文所使用的,“烷基”是指直链或支链的饱和烃基。烷基的实例包括甲基(me)、乙基(et)、丙基(例如正丙基及异丙基)、丁基(例如正丁基、异丁基、仲丁基、叔丁基)、戊基(例如正戊基、异戊基、戊基)、己基等。在各种实施方案中,烷基可具有1至40个碳原子(即c1-40烷基),例如1至30个碳原子(即c1-30烷基)。在一些实施方案中,烷基可具有1至6个碳原子,并且可被称为“低级烷基”。低级烷基的实例包括甲基、乙基、丙基(例如正丙基及异丙基)及丁基(例如正丁基、异丁基、仲丁基、叔丁基)。在一些实施方案中,烷基可以如本文所述地被取代。烷基通常不被另一烷基、烯基或炔基取代。
如本文所使用的,“烯基”是指具有一个或多个碳-碳双键的直链或支链烷基。烯基的实例包括乙烯基、丙烯基、丁烯基、戊烯基、己烯基、丁二烯基、戊二烯基、己二烯基等。一个或多个碳-碳双键可以是内部的(例如在2-丁烯中)或末端的(例如在1-丁烯中)。在各种实施方案中,烯基可具有2至40个碳原子(即c2-40烯基),例如2至20个碳原子(即c2-20烯基)。在一些实施方案中,烯基可以如本文所述地被取代。烯基通常不被另一个烯基、烷基或炔基取代。
如本文所使用的,“杂原子”是指除碳或氢以外的任意元素的原子,并且包括(例如)氮、氧、硅、硫、磷及硒。
如本文所使用的,“芳基”是指芳香族单环烃环体系或多环体系,其中,两个或更多个芳香族烃环稠合在一起(例如具有一个共用键)或至少一个芳香族单环烃环与一个或多个环烷基环和/或环杂烷基环稠合。芳基在其环体系中可具有6至24个碳原子(例如c6-24芳基),其可包含多个稠合环。在一些实施方案中,多环芳基可具有8至24个碳原子。芳基的任一适合的环位置可共价连接于定义的化学结构。只具有一个或多个芳香族碳环的芳基的例子包括苯基、1-萘基(双环)、2-萘基(双环)、蒽基(三环)、菲基(三环)、并五苯基(五环)等。至少一个芳香族烃环与一个或多个环烷基环和/或环杂烷基环稠合的多环体系的例子包括环戊烷的苯衍生物(即茚基,其为5,6-双环烷基/芳香族环体系)、环己烷的苯衍生物(即四氢萘基,其为6,6-双环烷基/芳香族环体系)、咪唑啉的苯衍生物(即苯并咪唑啉基,其为5,6-双环环杂烷基/芳香族环体系)及吡喃的苯衍生物(即苯并吡喃基,其为6,6-双环环杂烷基/芳香族环体系)。芳基的其他例子包括苯并二恶烷基、苯并二氧基(benzodioxolyl)、苯并二氢吡喃基、吲哚啉基等。在一些实施方案中,芳基可以如本文所述地被取代。在一些实施方案中,芳基可具有一个或多个的卤素取代基,并可被称为“卤芳”基。卤芳基的定义中包括全卤芳基(perhaloaryl),即芳基中所有的氢原子皆被卤原子取代(例如–c6f5)。在某些实施方案中,芳基由另一芳基取代,并且可被称为双芳基。双芳基的各芳基可以如本文所述地被取代。
如本文所使用的,“杂芳基”是指含有至少一个选自氧(o)、氮(n)、硫(s)、硅(si)及硒(se)中的环杂原子的芳香族单环体系或环体系中存在的至少一个环为芳香族的并含有至少一个环杂原子的多环体系。多环杂芳基包括具有两个或更多个稠合在一起的杂芳环的多环杂芳基,以及具有至少一个稠合到一个或多个芳香族碳环、非芳香族碳环和/或非芳香族环杂烷基环的单环杂芳环的多环杂芳基。杂芳基作为整体可具有(例如)5至24个环原子,并含有1至5个环杂原子(即5至20元的杂芳基)。杂芳基可在任一杂原子或碳原子处连接至定义的化学结构,只要能得到稳定的结构即可。通常,杂芳基环不含有o-o、s-s或s-o键。然而,杂芳基中的一个或多个n或s原子可被氧化(例如吡啶n-氧化物、噻吩s-氧化物、噻吩s,s-二氧化物)。杂芳基的例子包括(例如)以下示出的5元或6元的单环及5至6双环体系:其中t为o、s、nh、n-烷基、n-芳基、n-(芳烷基)(例如n-苯甲基)、sih2、sih(烷基)、si(烷基)2、sih(芳烷基)、si(芳烷基)2或si(烷基)(芳烷基)。这样的杂芳基环的例子包括吡咯基、呋喃基、噻吩基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三唑基、四唑基、吡唑基、咪唑基、异噻唑基、噻唑基、噻二唑基、异恶唑基、恶唑基、恶二唑基、吲哚基、异吲哚基、苯并呋喃基、苯并噻吩基、喹啉基、2-甲基喹啉基、异喹啉基、喹喔啉基、喹唑啉基、苯并三唑基、苯并咪唑基、苯并噻唑基、苯并异噻唑基、苯并异恶唑基、苯并二唑基、苯并恶唑基、噌啉基、1h-吲唑基、2h-吲唑基、吲哚嗪基、异苯并呋喃基、萘啶基、酞嗪基、蝶啶基、嘌呤基、恶唑并吡啶基、噻唑并吡啶基、咪唑并吡啶基、呋喃并吡啶基、噻吩并吡啶基、吡啶并嘧啶基、吡啶并吡嗪基、吡啶并哒嗪基、噻吩并噻唑基、噻吩并恶唑基、噻吩并咪唑基等。另外,杂芳基的例子包括4,5,6,7-四氢吲哚基、四氢喹啉基、苯并噻吩并吡啶基、苯并呋喃并吡啶基等。在一些实施方案中,杂芳基可以如本文所述地被取代。
如本文所使用的,“给体”材料是指具有空穴作为主要电流或电荷载流子的有机材料,例如有机纳米颗粒材料。
如本文所使用的,“受体”材料是指具有电子作为主要电流或电荷载流子的有机材料,例如有机纳米颗粒材料。
除非另外定义,否则本文所使用的所有技术和科学术语具有与本发明所述主题所属领域的普通技术人员通常理解的相同含义。
在提供数值范围的情况中,例如浓度范围、百分比范围或比率范围,应当理解,除非上下文另有明确规定,否则在该范围的上限与下限之间的、到下限单位的十分之一的各中间值以及在所述范围内的任何其他所述值或中间值包含在所述主题内。这些较小范围的上限和下限可独立地包括在较小范围中,并且此类实施方案也包括在所述主题内,受限于所述范围中的任何特定排除的极限值。在所述范围包括一个或两个极限值的情况中,排除那些所包括的极限值中的任一个或两个的范围也包括在所述主题中。
在整个申请中,各种实施方案的描述使用“包含”语言。然而,本领域技术人员将理解,在一些特定情况中,实施方案可以替代地使用语言“基本上由……组成”或“由……组成”进行描述。
为了更好地理解本教导并且决不限制本教导的范围,除非另外指出,否则在说明书和权利要求中使用的表示数量、百分比或比例的所有数字以及其他数值在所有情况下都应理解为由术语“约”进行修饰。因此,除非相反地指出,否则在以下说明书和所附权利要求书中阐述的数值参数为近似值,其可以根据寻求获得的所需性质而变化。至少,每个数值参数应该至少根据所报告的有效数字的数值并通过应用普通的舍入技术来进行解释。
化合物
本申请的化合物可以包括给体-受体(d-a)结构,其中扭曲的准双键(tqdb)将缺电子受体基团连接至电子给体基团。
示例性缺电子受体可以包括具有以下结构式的基于1,3-双(二氰基亚甲基)茚满的化合物:
示例性电子给体可以包括选自下列的至少一种化合物:
其中r1和r2各自独立地选自由下列组成的组:
其中r3、r4、r5和r6各自独立地选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;
其中r7选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;并且
n为选自1、2、3、4和5中的整数。
在一个实施方案中,示例性电子给体可以具有以下主链结构式:
其中r1和r2各自独立地选自由下列组成的组:
其中r3、r4、r5和r6各自独立地选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;
其中r7选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;并且
n为选自1、2、3、4和5中的整数。
根据一个实施方案,本申请的主题涉及具有以下主链结构式的化合物:
其中r1和r2各自独立地选自:
其中r3、r4、r5和r6各自独立地选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;
其中r7选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;并且
n为选自1、2、3、4和5中的整数。
在一个实施方案中,各r1和r2可以为
在一个实施方案中,各r3、r4、r5和r6可以为氢。
在一个实施方案中,n可以为1。
在另一个实施方案中,化合物为“tspci”,其具有以下结构式:
化合物性质
本申请的化合物在固态时具有荧光性质。例如,本申请的化合物从溶液状态到聚集体状态可以提供~35倍高的信号增强,并且本申请的化合物具有宽的吸收(500nm至850nm)。
本申请的化合物可以用作成像方法中的探针。成像方法可以包括(例如)在900nm至1700nm的近红外光谱范围内的荧光成像。例如,化合物可以在1000nm至1700nm的nir-ii光谱范围内或在其中某些更有限的范围内,如1000nm至1300nm,表现出明亮的发射。凭借化合物在nir-ii光谱中的发射,本申请的化合物具有高信噪比。荧光成像方法可以包括使靶细胞与一种或多种本申请的化合物相接触,以及在近红外光谱区对接触的靶细胞进行荧光成像。
本申请的化合物可以表现出优异的aie性质,并且可以容易地由市售可得的原料合成。本申请的化合物可以用于细胞成像方法中,以检测靶细胞中是否存在目的靶标。靶细胞可以与一种或多种本发明化合物相接触。可以使用成像方法检测是否存在目的靶标。目的靶标可以包括肽、糖、适体和抗体中的至少一种。例如,靶细胞可以为癌细胞。
在一个实施方案中,杀死靶癌细胞的方法可以包括:使靶癌细胞与一种或多种本申请的化合物相接触;在化合物接触靶癌细胞的同时对靶癌细胞进行成像;在化合物接触靶癌细胞的同时用光照射靶癌细胞以杀死靶癌细胞。
因此,本申请的化合物可以具有各种应用,包括癌细胞靶向成像、疾病诊断和图像引导光疗。根据一个实施方案,本申请的化合物可以用于与军事、能源和环境相关的技术中。例如,本申请的化合物可以应用于夜视、太阳能和脱盐技术。
aie活性
本发明主题涉及具有聚集诱导发射(aie)特征的有机化合物。化合物在固态或聚集态下可以具有荧光性质。在溶液状态下,化合物的发射性较低。
根据本教导的示例性化合物为tspci。如本文详细描述的,在溶液状态下,tspci发射性较低。然而,在聚集状态下,该化合物的发射通过分子内运动受限(rim)而被诱导或恢复。
合成方法
可以使用两步法合成本申请的化合物:1)使1,3-双(二氰基亚甲基)茚满(bdci)与2,6-二甲基-4-吡喃酮(1)在乙酸酐中反应,以产生中间体(spci);以及2)使中间体(spci)缩合,以提供本申请的化合物。示例性反应方案提供如下:
根据一个实施方案,本申请的主题涉及合成具有桥接缺电子受体和电子给体的扭曲准双键的荧光化合物的方法,该方法包括:
使1,3-双(二氰基亚甲基)茚满与2,6-二甲基-4-吡喃酮反应,以提供具有以下结构式的中间体化合物(spci):
使中间体化合物与
其中r1和r2各自独立地选自由下列组成的组:
其中r3、r4、r5和r6各自独立地选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;
其中r7选自由下列组成的组:h、f、cl、br、i、烷基、不饱和烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、羧基、氨基、磺酸基、烷硫基和烷氧基;并且
n为选自1、2、3、4和5中的整数。
通过以下实施例对本教导进行说明。
实施例
实施例1
spci和合成与表征
在50ml的双颈烧瓶中,将1(2,6-二甲基-γ-吡喃酮,300mg,2.41mmol)、bdci(1,3-双(二氰基亚甲基)茚满)(648mg,2.63mmol)和乙酸酐(10ml,97.8mmol)的混合物回流过夜。然后,将溶液冷却至室温并过滤,以获得粗产物,将粗产物通过硅胶柱色谱法进行纯化(洗脱溶剂,二氯甲烷:己烷=1:1,v/v),以获得为紫色粉末的化合物spci(626mg),产率74%。1hnmr(400mhz,dmso-d6)δ:8.34(br,2h),7.87(s,2h),7.68(br,2h),2.81(s,6h).13cnmr(100mhz,cdcl3)δ:169.03,158.11,154.08,137.53,131.73,123.57,120.11,115.56,115.53,110.58,61.14,20.49.hrms(maldi-tof),m/z:[m]+计算值:348.1011,实测值:348.1037。
实施例2
tspci的合成与表征
制备tspci的示例性反应方案如下:
使1,3-双(二氰基亚甲基)茚满(bdci)与2,6-二甲基-4-吡喃酮(1)在乙酸酐中、在120℃反应,以产生中间体spci。在50ml的双颈烧瓶中,将spci(168mg,0.48mmol)和4(4-(n,n-二苯基氨基)苯甲醛(329mg,1.21mmol)溶解在无水甲苯(15ml)中,以形成混合物。然后,将哌啶(1.0ml)和乙酸(0.5ml)添加到上述混合物中。将溶液搅拌并在120℃加热8小时,同时溶液颜色从紫色变为深蓝色。然后,将溶液冷却至室温并过滤,以获得粗产物,将粗产物通过硅胶柱色谱进行纯化(洗脱溶剂,二氯甲烷:甲醇=100:1,v/v),以获得为黑色粉末的tspci(46.5mg)(图4a),产率4%。1hnmr(400mhz,thf-d8)δ:8.44(dd,j=3.2hz,j=6.0hz,2h),8.02(d,j=16.0hz,2h),7.63(d,j=8.8hz,8h),7.51(dd,j=3.2hz,j=5.6hz,2h),7.35–7.31(m,8h),7.22–7.12(m,14h),6.99(d,j=8.4hz,2h).13cnmr(100mhz,cdcl3)δ:163.72,156.25,153.49,150.87,145.48,142.14,137.50,130.93,129.88,129.10,126.04,125.50,124.47,123.14,119.79,116.78,116.21,113.83,110.69,57.29.hrms(maldi-tof),m/z:[m]+计算值:858.3107,实测值:858.3108。
实施例3
tspci的光物理性质
在thf溶液(10μm)中测定的紫外-可见光谱示出了682nm处的最大吸收波长,具有相对高的摩尔消光系数(高达6.67×104m-1cm-1)(图4b)。通过改变四氢呋喃(thf)/水混合物中的水分数(fw)来研究tspci的aie性质(图4c)。当fw提高时,清楚地观察到显著的荧光增强,而在纯thf溶液中未观察到发射。在含水量为90体积%时,~950nm处的最强发射强度达到其最大值,由于分子内旋转受限,该发射强度比在纯thf中高~35倍(图5d)。聚集状态的tspci在1000nm至1700nm的宽nir-ii光谱范围内显示出明亮的发射。
实施例4
体内和体外成像研究
nir-i荧光成像使用maestro体内成像系统(cri,inc.)。为了获得nir-iaiegen(ttd)的荧光,分别选择605nm(±25nm)带通滤光片和645nm长通滤光片作为激发滤光片和发射滤光片。nir-ii成像使用自建的nir-ii体内成像系统进行。激发光由808nm二极管激光器提供。通过1000nm长通滤光片过滤从tspci发射的光,该滤光片与用于nir-ii荧光信号采集的二维ingaas阵列照相机(光谱响应范围为900nm至1700nm,photonicscience)联合使用。在成像平面处的激发功率密度为6.4mw/cm2,远低于由国际非电离辐射防护委员会确定的在808nm处为330mw/cm2的安全暴露极限。所有图像的曝光时间均为100ms。
tspci用于在两个面板上绘制字母以用于成像。然后使用基于ingaas的nir-ii照相机对未覆盖的面板和用不同层的纸覆盖的面板进行nir-ii荧光成像。图5a示出了没有纸层覆盖的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5b示出了具有一个纸层(64μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5c示出了具有两个纸层(128μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5d示出了具有三个纸层(192μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5e示出了具有四个纸层(256μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5f示出了具有五个纸层(320μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5g描述具有六个纸层(384μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5h示出了具有七个纸层(448μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5i示出了具有八个纸层(512μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图5j示出了具有九个纸层(576μm)的tspci绘制面板的半峰全宽(fwhm)曲线分析和相应的nir-ii荧光图像(插图)。图6示出了依次为图5a至图5j中提供的每个nir-ii荧光图像的空间分辨率分析。
在超声作用下将tspci添加到水中,以提供tspci溶液。通过静脉注射将tspci溶液施用至小鼠。图7a示出了静脉注射tspci溶液前裸鼠的nir-ii荧光图像。图7b示出了注射tspci溶液后一秒钟裸鼠的nir-ii荧光图像。图7c示出了注射tspci溶液后两秒钟裸鼠的nir-ii荧光图像。图7d示出了注射tspci溶液后三秒钟裸鼠的nir-ii荧光图像。图7e示出了注射tspci溶液后四秒钟裸鼠的nir-ii荧光图像。图7f示出了注射tspci溶液后五秒钟裸鼠的nir-ii荧光图像。图7a至图7f证实了tspci实现了体内动态nir-ii成像的高对比度和穿透深度。
由此描述了本发明主题,显然可以以许多方式对本发明主题进行修改或改变。这些修改和改变不应被认为是脱离本发明主题的精神和范围,并且旨在将所有这些修改和改变包括在所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!