重组几丁聚糖水解酵素及其用于制造几丁寡糖的方法
本发明涉及一种几丁聚糖水解酵素,尤其涉及一种芽孢杆菌的重组几丁聚糖水解酵素。
背景技术:
几丁质(chitin)广泛存在节肢动物的外骨骼,例如虾壳、蟹壳、乌贼软骨及真菌的细胞壁中,是由n-乙酰葡萄糖胺(n-acetylglucosamine)以β-1,4糖苷键所聚合而成的天然聚合物。几丁质是地球上产量仅次于纤维素与木质素的生物质,但由于几丁质结构排列紧密而不溶于水,不利于人们利用,所以过去常被认定为是废弃物。不过,近来的研究发现几丁质的衍生物具有较高的溶解度,使几丁质可被加以利用而不再被视为废弃物,其中,几丁质去乙酰化后的产物几丁聚糖(chitosan)在酸性环境下能溶于水中,大幅提升可被利用的程度,因此被广泛应用到多种产业及商品上,例如保养品、保健食品、药物、生医器材及农业等。
几丁寡糖(chito-oligosaccharides)是几丁聚糖的水解产物,且几丁寡糖是由2至20个葡萄糖胺单体所键结而成的。几丁寡糖具有小于几丁聚糖的分子量(约数百至数千),且具有相对于几丁聚糖较佳的水溶性。目前已知几丁寡糖可活化植物体中的抗病基因,使抗病基因大量表现,在植物防御系统中扮演举足轻重的角色。此外,几丁寡糖还具有多种生物活性,例如:降低胆固醇、抗微生物与提升免疫机能等,更有研究指出含有六个单体的几丁寡糖(几丁六糖)具有抗肿瘤细胞的功效。
一般而言,制造几丁寡糖的方式主要有化学法、物理法及酵素法,其中物理法效率不高而化学法较便宜,所以目前市面上贩卖的几丁寡糖多为化学法水解的产物。但是以化学法进行水解不仅需要使用大量强酸及强碱,且水解的产物不具专一性,并以单糖为主要产物,不利于其他单一种几丁寡糖,如几丁二糖、几丁三糖的制造。反之,酵素法具有较高专一性,所以以酵素法水解几丁聚糖有较高的机会获得单一种几丁寡糖,以应用特定几丁寡糖的生物活性。然而,几丁聚糖水解酵素的水解产物仍包含多种几丁寡糖,故实有必要提供一种可生产单一种几丁寡糖的几丁聚糖水解酵素。
技术实现要素:
本发明的一态样在于提供一种重组几丁聚糖水解酵素,其水解产物包含以几丁二糖及/或几丁三糖为主的几丁寡糖。
本发明的另一态样在于提供一种几丁寡糖的制造方法,其利用上述重组几丁聚糖水解酵素水解几丁聚糖水溶液,以获得以几丁二糖及/或几丁三糖为主的水解产物。
根据本发明的上述态样,提出一种重组几丁聚糖水解酵素,包含如序列辨识编号(seqidno):1至6所示序列的任一者的氨基酸序列。
在一实施例中,前述重组几丁聚糖水解酵素水解的水解产物可包含几丁寡糖,其中几丁寡糖可包含几丁二糖及/或几丁三糖,且前述几丁二糖及/或几丁三糖于几丁寡糖的含量可例如为至少60%。
在另一实施例中,前述seqidno:1及2所示序列的重组几丁聚糖水解酵素的水解产物包含几丁三糖。
在又一实施例中,前述seqidno:3至6所示序列的重组几丁聚糖水解酵素的水解产物包含几丁二糖。
在再一实施例中,前述重组几丁聚糖水解酵素可例如内切型酵素。
在再一实施例中,前述重组几丁聚糖水解酵素在酸碱值ph4到7之间具有至少60%的酵素活性。
根据本发明的另一态样,提出一种几丁寡糖的制造方法,包含提供几丁聚糖水溶液,并利用如seqidno:1至6所示序列的任一者的重组几丁聚糖水解酵素水解前述几丁聚糖水溶液,以获得水解产物。接着,进行沉淀步骤,以由前述水解产物获得几丁寡糖,其中几丁寡糖包含几丁二糖及/或几丁三糖。
在一实施例中,前述如seqidno:1及2所示序列的任一者的重组几丁聚糖水解酵素的水解产物包含几丁三糖。
在一实施例中,前述seqidno:3至6所示序列的任一者的重组几丁聚糖水解酵素的水解产物包含几丁二糖。
在一实施例中,前述重组几丁聚糖水解酵素在ph4到7之间具有至少70%的酵素活性。
应用本发明的重组几丁聚糖水解酵素,可生产以几丁二糖及/或几丁三糖为主的几丁寡糖,以降低后续纯化程序与成本而增加可应用性。
附图说明
为让本发明的上述和其他目的、特征、优点与实施例能更明显易懂,所附图式的详细说明如下:
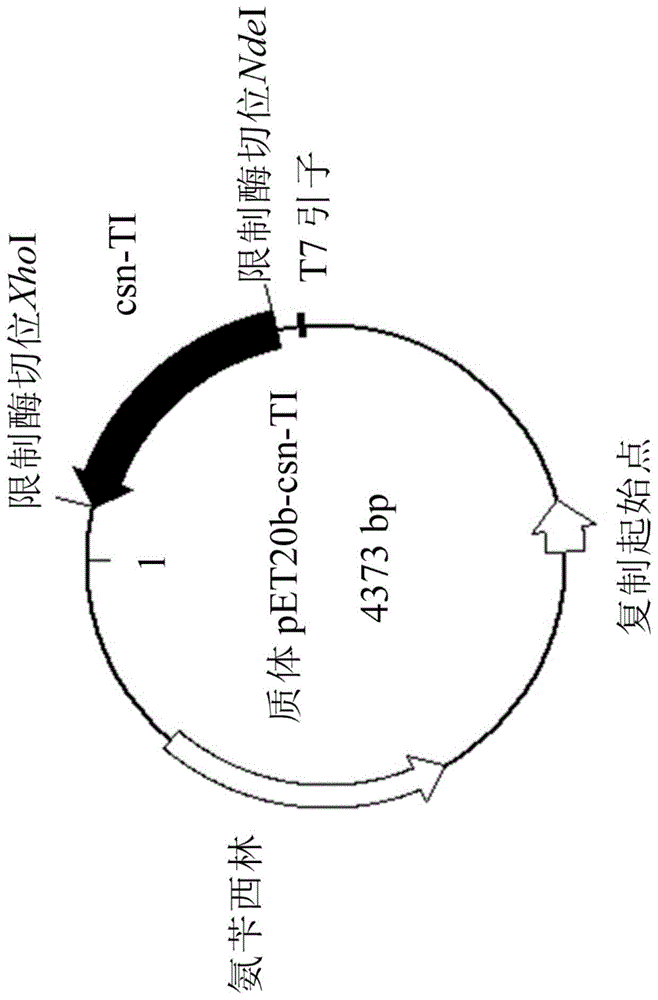
图1为pet20b-csn-ti的质粒图谱。
图2a与图2b分别为第一粗萃酵素(图2a)与第二粗萃酵素(图2b)的sds-page电泳图。
图3显示各种几丁聚糖水解酵素的水解产物。
图4为各种几丁聚糖水解酵素水解几丁聚糖24小时后的产物比例柱形图。
图5a与图5b分别表示野生型酵素bwt(图5a)与突变型酵素ti-d(图5b)的酸碱耐受性。
图6a与图6b分别表示野生型酵素bwt(图6a)与突变型酵素ti-d(图6b)经不同酸碱值处理后酵素溶液中可溶性蛋白质的相对含量。
图7a与图7b分别显示于不同ph值下野生型酵素bwt(图7a)与突变型酵素ti-d(图7b)的活性。
图8a与图8b分别表示野生型酵素bwt(图8a)与突变型酵素ti-d(图8b)于不同温度的耐受性。
图9a与图9b分别表示野生型酵素bwt(图9a)与突变型酵素ti-d(图9b)不同温度下的活性。
图10a与图10b分别表示野生型酵素bwt(图10a)与突变型酵素ti-d(图10b)长时间作用后水解产物以tlc分析的结果。
图11为野生型酵素bwt与突变型酵素ti-d的水解型式图。
图12a至图12d分别表示突变型酵素ti-d开口状态的示意图(图12a)、闭口状态的示意图(图12b)、开口状态表面电子云图(图12c)以及闭口状态表面电子云图(图12d)。
图13为几丁聚糖水解酵素bwt与基质结合模拟图。
图14为几丁聚糖水解酵素ti-d与基质结合模拟图。
图15为几丁聚糖水解酵素ti-d水解基质产生几丁二糖与几丁四糖或几丁三糖的模拟示意图。
图16为几丁聚糖水解酵素ti-d水解基质产生几丁二糖与几丁四糖的模拟示意图。
图17a与图17b分别为野生型酵素bwt(图17a)与突变型酵素ti-d(图17b)不同反应时间的几丁寡糖摩尔浓度变化。
图18为纯化产物的冻干粉末的寡糖分析结果。
图19显示纯化产物的几丁二糖、几丁三糖与几丁四糖的比例。
其中,附图标记:
111/113/171/173/175:曲线
401/403/405/407/191/193/195:直条
具体实施方式
本发明提供一种重组几丁聚糖水解酵素,可生产以几丁二糖及/或几丁三糖为主的几丁寡糖。
在一实施例中,重组几丁聚糖水解酵素是以芽孢杆菌mh-k1几丁聚糖水解酵素(seqidno:7)为模板,改变部分的序列,从而形成的突变型酵素(或称重组几丁聚糖水解酵素)。前述重组几丁聚糖水解酵素可包含第一突变区(由seqidno:7中第74个至第78个氨基酸序列改变而成)与位于基质结合位内的第二突变区(由seqidno:7第175~176个氨基酸序列改变而成),借此改变野生型酵素的立体结构及/或与几丁聚糖的亲和力,进而影响水解后各产物的比例。
上述重组几丁聚糖水解酵素序列改变的态样不限,可例如插入(insertion)或置换(substitution)。在一实施例中,重组几丁聚糖水解酵素是在野生型酵素的第一突变区进行插入。前述插入的氨基酸种类及个数不限,可例如1~3个氨基酸残基。在一实施例中,插入的氨基酸残基的电性和在中性环境中(ph7.0)为负。在一实施例中,重组几丁聚糖水解酵素的第一突变区的氨基酸序列可例如由天门冬氨酸(asparaticacid,asp,d)、苏氨酸(threonine,thr,t)、组氨酸(histidine,his,h)及脯氨酸(proline,pro,p)所组成的序列dthxpd,其中x表示插入的氨基酸片段,且x是由x1和d所构成,而x1是0、h或包含麸氨酸(glutamate,e)的eh片段。
在另一实施例中,重组几丁聚糖水解酵素可在野生型酵素的第二突变区进行置换。前述置换后的氨基酸种类并无特别限制。在一实施例中,重组几丁聚糖水解酵素的第二突变区可为原本的片段将丙氨酸(alanine,ala,a)与白氨酸(leucine,leu,l)(al)置换成苏氨酸与异白氨酸(isoleucine,ile,i)(ti)。
在一实施例中,前述重组几丁聚糖水解酵素是如序列辨识编号(seqidno):1至6所示序列的任一者的氨基酸序列。
在一实施例中,以前述重组几丁聚糖水解酵素水解的水解产物包含几丁寡糖。相对于习知重组几丁聚糖水解酵素水解的水解产物包含多种几丁寡糖,本发明的重组几丁聚糖水解酵素可提高水解产物的特定几丁聚糖的比例,也就是说重组几丁聚糖水解酵素水解可较专一地生产单一种几丁寡糖。在一些具体例中,特定几丁聚糖可包括几丁二糖及/或几丁三糖,且几丁二糖及/或几丁三糖于几丁寡糖的含量可例如为至少60%。
在一实施例中,在前述第一突变区的前述序列dthxpd中插入d所获得的重组几丁聚糖水解酵素,其水解产物包含该几丁三糖。在一实施例中,前述几丁聚糖水解酵素的氨基酸序列可例如seqidno:1及2所示的序列。
在另一实施例中,在前述第一突变区的前述序列dthxpd中插入hd或ehd所获得的重组几丁聚糖水解酵素,其水解产物包含该几丁二糖。在一实施例中,前述重组几丁聚糖水解酵素的氨基酸序列可例如seqidno:3至6所示的序列。
值得注意的是,前述重组几丁聚糖水解酵素是内切型酵素,而非外切型酵素,也就是说,在上述第一突变区及上述第二突变区是改变基质与重组几丁聚糖水解酵素结合的位置的重要位点,因此在第一突变区进行插入及/或在第二突变区置换,可改变水解产物的几丁寡糖的比例。
在一实施例中,前述重组几丁聚糖水解酵素在酸碱值ph4至7之间具有酵素活性,较佳为ph5.5至6.5。所述“酵素活性”以酵素活性单位(u)表示,1u表示酵素在37℃下每分钟可水解出1μmol的还原端。在本文中,以在特定反应条件(例如ph值、反应温度、反应时间等)下,几丁聚糖水解酵素的酵素活性的相对高峰值定义为100%酵素活性。
本发明另外提供一种几丁寡糖的制造方法,包含提供几丁聚糖水溶液并以上述重组几丁聚糖水解酵素水解该几丁聚糖水溶液,以获得水解产物。接着,进行沉淀步骤,以由水解产物获得几丁寡糖。沉淀方法不拘,可例如以异丙醇于-20℃进行沉淀步骤。前述几丁寡糖包含几丁二糖及/或几丁三糖。
在一实施例中,以如seqidno:1及2所示序列的重组几丁聚糖水解酵素进行水解,以获得几丁三糖。在另一实施例中,以如seqidno:2至6所示序列的重组几丁聚糖水解酵素进行水解,以获得几丁二糖。
在一实施例中,以前述重组几丁聚糖水解酵素进行水解的酸碱值较佳为ph4至ph7,可获取产量相对高峰值的70%的产物。
以利用数个实施例以说明本发明的应用,然其并非用以限定本发明,本发明技术领域中具有公知常识者,在不脱离本发明的精神和范围内,当可作各种的更动与润饰。
一、实验方法
1.药品配制
lb培养液:每1l含10g胰水解蛋白(tryptone)、5g酵母提取物(yeastextract)及5gnacl(lba培养液为含有0.1mg/ml氨苄青霉素(ampicillin)的lb培养液)。
lb培养基:每1l的lb培养液添加20g琼脂(agar)(lba培养基为含有0.1mg/ml氨苄青霉素的lb培养基)。
5倍(×)m9培养液:每1l含有30gna2hpo4、15gkh2po4、2.5gnacl及5gnh4cl。
tss缓冲液:每1l含73mllb培养液、20ml50%聚乙二醇(poly(ethyleneoxide),peg)8000、5ml二甲基亚砜(dimethylsulfoxide,dmso)及2ml的1mmgso4。
5×kcm缓冲液:每1l含37.25gkcl、22.05gcacl2及5.075gmgcl2。
磷酸缓冲溶液(phosphatebuffer,ph7):1mnah2po4和1mna2hpo4以1:2.24比例混合以做为1m储存液,使用时稀释至20mm。
退染剂:50%乙醇(ethanol)、40%乙酸(aceticacid)、10%二次水(ddh2o)。
1%几丁聚糖:每100ml含有1g几丁聚糖和0.7mlaceticacid。
3,5-二硝基水杨酸(dinitrosalicylicacid,dns)试剂:每1l含300g酒石酸钾钠、4.8g3,5-dinitrosalicylicacid及25.35gnaoh。
薄层层析(tlc)展开液:28%氨水溶液(ammoniawater)和1-丙醇(propanol)以2:1.5的比例混合使用。
2.质粒(plasmid)的选用
本实验选用的质粒为pet20b-csn-ti,请参见图1。图1为pet20b-csn-ti的质粒图谱。质粒全长4373bp,包含mh-k1几丁聚糖水解酵素的基因片段783bp,经转译转录作用后可生成具有260个氨基酸、分子量约29.1kda的几丁聚糖水解酵素(以下简称酵素)。前述mh-k1几丁聚糖水解酵素基因片段是源自于如基因库(genbank):baa01474.2所示的b.circulansmh-k1几丁聚糖水解酵素的基因序列,将对应信号肽的核酸片段的移除后,加入转译起始密码子atg,从而获得野生型几丁聚糖水解酵素(bwt)。前述野生型酵素bwt的氨基酸序列是如序列辨识编号(seqidno):7的序列所示,分子量约29.1kda。接着,以上野生型酵素bwt的核酸序列为模板,利用如序列辨识编号(seqidno):8及9所示的引物(primer)进行饱和突变(saturationmutagenesis),以将野生型酵素序列中的第175个氨基酸(丙氨酸,a)与第176个氨基酸(白氨酸,l)进行置换突变。以原位筛选法比较置换突变后的酵素的水解产物,其中,突变型酵素ti的水解产物具有比野生型酵素的水解产物较高的几丁三糖,前述突变型酵素ti中分别是将a、l置换成异白氨酸(i)及苏氨酸(t),前述突变型酵素ti的序列如seqidno:10所示的。将突变型酵素ti的核酸序列克隆后获得质粒pet20b-csn-ti。
3.基因定点突变(site-directedmutagenesis)
以pet20b-csn-ti质粒做为模板,使用如seqidno11至16或表1所示的引物进行聚合酶链锁反应(polymerasechainreaction,pcr)使第一突变区发生氨基酸片段d、hd或ehd的插入突变。pcr条件设定为:95℃加热5分钟,95℃变性30秒、55℃黏合1分钟、68℃延长10分钟,重复16个循环,10分钟内从68℃降温至15℃。加20μlpcr产物于8μl10×的pcr缓冲溶液、51.5μl无菌水及0.5μldpni以配制总体积80μl的混合液。将前述混合液置于37℃反应2小时,以55℃加热10分钟后进行冰浴。接着,在混合液中加入20μl的5×kcm缓冲液,并与感受态细胞(competentcell)大肠杆菌escherichiacolidh5α的菌液混合以进行转化(transformation)步骤。于37℃震荡培养1小时后,将所有菌液涂布于lba培养基上,再置于37℃进行隔夜培养。
挑选经隔夜培养的lba培养基上的单一菌落,接种到5mllba培养液中,并于37℃培养约12小时后,再抽取质粒。进行转化步骤使质粒转化至e.colibl21(de3)中,再以原位筛选法筛选带有插入片段的质粒,并进行核酸定序,以确认突变后的氨基酸序列。经定点突变后的突变型酵素分别为ti-d、ti-hd及ti-ehd,其序列分别如seqid:2、4及6所示。
表1
4.质粒的转化
4.1感受态细胞(competentcells)的制备
上述感受态细胞的制备如下:取单一感受态细胞的菌落(e.colidh5α或e.colibl21(de3))接种至5mllb培养液中,于37℃进行起始培养约12小时。取1ml经起始培养的菌液至100mllb培养液进行放大培养,即于37℃进行震荡培养至菌液的600纳米的光密度值(opticdensity,od)达到0.5(约2小时)。接着,进行冰浴5分钟,再以每分钟5000转的转速(rotationperminute,rpm)离心10分钟并去除上清液以获得菌体(pellet),并以1ml冰的tss缓冲液悬浮(suspend)菌体。每100μl分装成1管,急速冷冻(盐酒精或液态氮)后保存于-80℃。
4.2质粒的转化(transformation)
上述转化是使用热休克法(heatshock)进行。混合1μl(约60μg)质粒、20μl5×kcm缓冲液及79μl无菌水以获得质粒混合液,并冰浴5分钟。将100μl质粒混合液加入100μl感受态细胞的菌液中,轻轻搅拌混匀后冰浴20分钟,再以42℃恒温水浴加热45秒后,迅速置于冰上2分钟。接着,加入800μllb培养液并于37℃进行轻摇培养达1小时。以10至1000倍体积lb培养液序列稀释以获得稀释菌液,再分别涂布100μl稀释菌液于lba培养基,于37℃进行隔夜培养。
5.原位筛选法(in-situscreening)
5.1几丁聚糖水解酵素检测盘(chitosanase-detectionagarplate)的制备
秤取3.20g的几丁聚糖于含有338ml无菌水的1l血清瓶中混匀,另外秤取8g琼脂(agar),于含有300ml无菌水的1l血清瓶中混合,再取160ml的5×m9培养液于250ml的血清瓶中,以形成几丁聚糖溶液。将上述几丁聚糖溶液以121℃灭菌达20分钟后,保温于70℃。一边搅拌几丁聚糖溶液,一边缓缓加入1.7ml冰醋酸,再使用磁石快速搅拌溶解后的几丁聚糖溶液,同时缓慢加入灭菌后的160ml5×m9培养液,此时几丁聚糖溶液呈白色混浊状。接着,加入1.6ml1mmgso4与80μl1mcacl2并混匀,并与保温于70℃的几丁聚糖溶液混合均匀(使用磁石搅拌),一边搅拌一边使用1ml微量吸取器将气泡取出。将去除气泡的几丁聚糖溶液以每一盘15ml分装至培养皿中,静置至几丁聚糖溶液凝固后使用uv照射20分钟,再置于4℃备用。此为0.4%几丁聚糖水解酵素检测盘(chengandli,2000)。
5.2原位筛选法的产物组成分析
将上述几丁聚糖水解酵素检测盘以划分为36格,每格1平方厘米,再以接种环将带有质粒的单一菌落点于划分完成的几丁聚糖水解酵素检测盘后,将几丁聚糖水解酵素检测盘静置于37℃至透明环(clearzone)产生。挖取约5μl的透明环边缘的胶体至1.5ml微量离心管中,再加入5μl的无菌水并捣碎胶体,以获得捣碎液。以微量移液器吸取0.5μl的捣碎液,并点处于薄层层析(tlc)片上,重复点处捣碎液共5次。接着,以体积比2:1的氨水溶液及正丙醇做为展开液,于55℃进行展开达20分钟后使用100℃加热板烤干。以0.1%茚三酮(ninhydrin)浸湿tlc片后,于100℃加热至tlc片呈色。
6.几丁聚糖水解酵素基因的诱导表达
接种带有质粒的单一菌落于含5mllba培养液的试管中,进行37℃震荡培养12小时后获取培养菌液。将上述培养菌液加入到50mllba培养液中并加入50μl1m异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-1-thiogalatopyranoside,iptg),于37℃诱导基因表达2.5小时,接着以4℃、12000rpm离心10分钟,取得iptg诱导菌(iptg-inducedcells)。
7.几丁聚糖水解酵素的取得与纯化
7.1第一粗萃法
将上述iptg诱导菌用5ml的20mm磷酸缓冲溶液(phosphatebuffer,ph7)进行再悬浮(re-suspension)。使用超音波细胞破碎机以最高功率400瓦(w)的20%的功率进行超音波破菌达10分钟,期间每作功1秒停止2秒,以获取第一溶菌液(lysate)。将上述第一溶菌液于4℃以12000rpm进行离心步骤达20分钟后收集上清液,并以相同条件再次离心,再次取得的上清液即第一粗萃酵素。
7.2第二粗萃法(选择性沉淀法)
将iptg诱导菌离心后用5ml0.3mnah2po4(ph4.5)进行再悬浮,再以超声波细胞破碎机以最大功率400w的20%的功率进行破菌达10分钟,期间每作功1秒停止2秒以获得第二溶菌液。将第二溶菌液于4℃以12000rpm进行离心达20分钟,取上清液并静置在4℃冰箱达12小时。以相同条件再次离心,再次取得的上清液即第二粗萃酵素。
7.3快速蛋白质液相层析仪(fastperformanceliquidchromatography,fplc)液相层析法
将上述第二粗萃酵素以孔径0.22μm的滤膜过滤,再利用载留分子量(molecularweightcutoff,mwco)6千道尔顿(killodalton,kd)的半透膜以20mm、ph7.0的磷酸缓冲溶液进行透析达12小时后,离心备用。接着利用阴离子交换树脂管柱(hitraptmin5mlq-sepharose,amershambiosciences,纽泽西州008855,美国)纯化目标蛋白质(几丁聚糖水解酵素)。纯化前,先以20mm、ph7.0的磷酸缓冲溶液25ml平衡管柱,再将透析后的第二粗萃酵素通入管柱中,并以上述磷酸缓冲溶液流洗管柱至流洗液的吸亮度a280信号平稳。之后以含或不含浓度不大于1000mm的氯化钠(nacl)的20mm、ph7.0磷酸缓冲溶液进行梯度流洗,以收集酵素液,其中酵素液是经原位筛选法检测后,具有几丁聚糖水解酵素的酵素活性的波峰范围的流洗液。
8.蛋白质分析
为了分析几丁聚糖水解酵素的纯度及分子量大小,以12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)分离不同分子量的蛋白质,再以考马斯亮蓝(coomassiebrilliantblue)g-250染色,之后以退染剂与水交互退染至sds-page的背景透明。利用影像分析仪分析几丁聚糖水解酵素占总蛋白量的百分比。蛋白质浓度使用蛋白质分析套组(proteinassaykit,bio-rad,加利福尼亚94547,美国)测定,并以小牛血清蛋白(bovineserumalbumin)做为标准绘制标准曲线。
9.酵素活性分析
酵素活性分析是使用二硝基水杨酸(dinitrosalicylic-acid,dns)试剂测定几丁聚糖经酵素反应后的还原糖含量。将几丁聚糖水解稀释并于37℃预热3分钟,以1:1的比例和1%几丁聚糖以混匀后,于37℃反应30分钟。加入等体积的dns试剂混匀,以95℃加热15分钟后,于4℃以12,000rpm进行离心达5分钟。取200μl上清液以微量分析仪测定od540nm。以2至12mm的葡萄糖胺做标准品,绘制标准曲线。
10.薄层层析法(tlc)分析产物组成
将tlc片(merck,tlcsilicagel60)裁切成8cm宽、8cm高的大小,并于对应tlc展开液液面的地方下方1cm处画样品起始线。将0.2u/ml酵素与1%几丁聚糖以1:1的比例混合后,静置于37℃反应。将不同反应时间的产物及2mm、4mm或6mm的葡萄糖胺的适当体积(0.5至1μl)点处于tlc片上并以80℃烘干tlc片。将tlc片置于展开槽内使用tlc展开液进行层析,当tlc展开液到达tlc片顶端时取出tlc片以停止反应。接着将tlc片以120℃烤干,再将0.3%茚三酮(ninhydrin)喷在tlc片后,再次烤干tlc片直到tlc片呈色。
将呈色后的tlc片使用影像分析软件进行量化。以2mm、4mm或6mm葡萄糖胺做为定量标准,进行几丁二糖、几丁三糖、几丁四糖、几丁五糖及几丁六糖等几丁寡糖的定量后,计算浓度,并换算成百分比。
11.蛋白质结构仿真与预测
11.1蛋白质三级结构仿真
以分子结构可视化软件(pymol)仿真b.circulansmh-k1几丁聚糖水解酵素,其中几丁聚糖水解酵素在糖苷水解酶(glycosidehydrolase,gh)46家族中已知的蛋白质结晶结构包含对应蛋白质数据库编号(proteindatabankidentity,pdbid)1qgi与4olt的结构。寻找适合进行插入的位点,并利用分子仿真软件swiss-model(http://swissmodel.expasy.org/)仿真突变型酵素的结构及与基质结合的变化。
11.2酵素与基质对接(docking)模拟
利用分子对接(moleculardocking)软件igemdock(version2.1)模拟水解作用进行时基质于几丁聚糖水解酵素的位置。在蛋白基质对接(proteinliganddocking)下,于preparebindingsite接口下选择酵素结构(.pdb),于preparecompounds接口下选择基质结构(.mol)。于dockingaccuracysetting分别设定populationsize为400、generations为80且numberofsolutions为10,并进行随机对接模拟。
12.酵素的ph与温度的耐受性测试
以0.04mol/l磷酸、乙酸与硼酸配制博瑞坦-罗比森缓冲液(britton-robinsonbuffer),并以0.2mnaoh调整ph值至所需的酸碱值,以获得酸碱缓冲溶液。
12.1ph值耐受性试验
将待测定酵素与不同ph值的酸碱缓冲溶液依体积比例1:2(例如:几丁聚糖水解酵素100μl与酸碱缓冲溶液200μl)混合,在37℃放置60分钟,以获得反应酵素。在ph6.0的环境下以反应酵素进行水解,以分析酵素的酵素活性。
12.2酵素较佳反应ph值测定
将几丁聚糖水解酵素与不同ph值的酸碱缓冲溶液依1:2的比例(例如:几丁聚糖水解酵素100μl与酸碱缓冲溶液200μl)混合成酵素溶液,在37℃放置5分钟后,再与1%几丁聚糖以1:1的比例(例如:酵素溶液300μl与1%几丁聚糖300μl)混匀,于37℃反应30分钟,再加入等体积的dns试剂混匀,以95℃加热15分钟后,于4℃以12,000rpm离心达5分钟。取200μl上清液以微量分析仪测定od540nm的吸光值。
12.3酵素温度耐受性试验
将几丁聚糖水解酵素与1%几丁聚糖分别放置于不同的温度下反应60分钟,再进行酵素活性分析。
12.4较佳温度测定
将几丁聚糖水解酵素与1%几丁聚糖以1:1的比例混匀,并于不同温度下反应30分钟后,加入等体积的dns试剂混匀,再以95℃加热15分钟后,以4℃、12,000rpm离心5分钟。取200μl上清液以微量分析仪测定od540nm的吸光值。
13.量产几丁寡糖
13.1量产几丁聚糖酵素
将带有质粒的单一菌落接种于含5mllba培养液的试管中,经过37℃震荡培养12小时后,加入50mllba培养液中于37℃继续培养8小时,接着在常温下以5000rpm离心10分钟以获得菌块,再将菌块加入到500mllba培养液中并加入500μl1miptg,于37℃诱导基因表达2.5小时,接着以4℃、12,000rpm离心10分钟,以取得大量iptg诱导菌。
13.2量产几丁寡糖
取500g几丁聚糖加入9.65l的水搅拌悬浮,搅拌过程中加入350ml的醋酸,以获得几丁聚糖液。加强搅拌强度直到几丁聚糖液变成黏稠状。取2500u的几丁聚糖酵素加入几丁聚糖液中,于常温下进行水解反应达48至72小时以获得水解产物。定时取样并以tlc分析水解产物。
13.3ipa沉淀法
将上述水解产物以naoh调整ph值成ph4、ph7或ph12。取适当的水解产物与异丙醇(ipa)以1:7的比例分别于室温与低温的环境进行沉淀后,以4℃、12000rpm离心并去除上清液体,再利用冷冻干燥机进行冻干,以获得水解产物沉淀物。
二、实验结果
根据前述实验设计及方法,相关的实验结果如下:
1几丁聚糖水解酵素的结构仿真与突变
1.1突变型酵素的选择
以野生型酵素(bwt)为模板并进行饱和突变,以获得突变型酵素,再利用原位筛选法比较突变型酵素的水解产物中各种几丁寡糖的比例。结果显示,突变型酵素ti的水解产物中几丁三糖的摩尔数占58%,高于野生型酵素bwt的30%。
1.2插入突变的设计
已知在几丁聚糖水解酵素中插入氨基酸片段可影响几丁聚糖水解酵素与基质结合的方式,从而改变水解产物中不同几丁寡糖的比例。此外,已知带有电荷的氨基酸残基(residues)可影响几丁聚糖水解酵素与基质的结合方式。因此,通过在几丁聚糖水解酵素上插入带有负电的氨基酸片段,可改变几丁聚糖水解酵素与基质结合的结构,进而改变水解产物中不同几丁寡糖的比例。以结构生物信息学网络服务器swiss-model网站(网址:https://swissmodel.expasy.org/)模拟在突变型酵素ti氨基酸序列中第32/33个与第143/144个氨基酸之间或其周围进行插入突变而模拟酵素经插入突变后的结构。在本实施例中,插入突变进行于突变型酵素ti氨基酸的第76个和第77个氨基酸之间。
上述带有负电的氨基酸片段包含至少一带有负电的氨基酸,可例如天门冬氨酸(asparticacid,d)与麸氨酸(glutamicacid,e),并可选择性地包含一个带正电的组氨酸(histidine,h)作为中间联接。
1.3插入突变及其序列
在本实施例中,进行插入突变以在突变型酵素ti的核酸序列中插入至多9个核酸。为了提升突变的成功率,以循序渐进的方式进行突变。首先,用第一引物对ti-d-f与ti-d-r以突变型酵素ti的核酸序列为第一模板进行pcr以获得突变型酵素ti-d的核酸序列,再用第二引物对ti-hd-f与ti-hd-r以突变型酵素ti-d的核酸序列为第二模板使进行prc,从而获得突变型酵素ti-hd的核酸序列。接着以第三引物对ti-ehd-f与ti-ehd-r以突变型酵素ti-hd的核酸序列做为第三模板进行突变,获得突变型酵素ti-ehd的核酸序列。将上述核酸序列进行定序与比对,结果请参照表3。突变型酵素ti-d、ti-hd、ti-ehd的氨基酸序列分别如seqid:2、4与6所示。
表3、突变型酵素的核苷酸序列比对
2.几丁聚糖水解酵素的生产与纯化
将质粒转化到e.colibl21(de3)之中,并进行放大培养与离心,再分别使用20mm磷酸缓冲溶液(ph7)与0.3mnah2po4(ph4.5)两种不同缓冲液进行第一粗萃法与第二粗萃法(选择性沉淀法)以获得第一粗萃酵素与第二粗萃酵素。将第一粗萃酵素与第二粗萃酵素以sds-page蛋白质电泳进行分析,请参阅图2a及图2b。图2a及图2b分别为第一粗萃酵素(图2a)与第二粗萃酵素(图2b)的sds-page电泳图,其中第1泳道(lane)与第8泳道都是标准品(standards),第2泳道至第6泳道分别是突变型酵素ndti(如seqidno:17所示)、ti、ti-d、ti-hd与ti-ehd,第7泳道是野生型酵素bwt。计算酵素的蛋白质分子量,bwt的分子量为29082da,突变型酵素ti-d、ti-hd及ti-ehd的分子量分别为29227da、29364da及29493da。如图2a及图2b所示,第一粗萃酵素与第二粗萃酵素中皆包含几丁聚糖水解酵素且突变型酵素的分子量随着插入氨基酸的增加而增加。此外,不管是野生型酵素bwt、突变型酵素ti、ti-d、ti-hd及ti-ehd都是胞内可溶的酵素。
请如图2a与图2b所示,第二粗萃法(选择性沉淀法)所获得的第二粗萃酵素(图2b)中,酵素的纯度高于第一粗萃酵素。使用选择性沉淀法时,沉淀物的总量会增加,但沉淀物不是目标蛋白几丁聚糖水解酵素,而是其他蛋白质,因此使用选择性沉淀法可达到保留酵素并去除其他蛋白的目的,在大量生产几丁寡糖时,可以做为快速纯化的方法。
3.几丁聚糖水解酵素的水解产物分析
以浓度0.02u/ml的野生型酵素bwt、突变型酵素ti、ndti、ti-d、ti-hd及ti-ehd将1%的几丁聚糖溶液于37℃进行水解达24小时后,进行tlc分析上述几丁聚糖水解酵素的水解产物,其结果请参见图3。图3显示各种几丁聚糖水解酵素的水解产物,其中第1泳道是野生型酵素bwt,第2泳道至第6泳道分别是突变型酵素ti、ndti、ti-d、ti-hd及ti-ehd,第7泳道是标准品,第8泳道至第10泳道分别是2mm、4mm及6mm的葡萄糖胺(glucosamine,glcn)。如图3所示,突变型酵素中,ti-d的水解产物含量较高者为几丁三糖,ti-hd的水解产物含量较高者为几丁二糖与几丁三糖,ti-ehd的水解产物含量较高者为几丁二糖。由此可见,ti-d、ti-hd及ti-ehd与ti的水解产物组成不相同。以tlc片上2mm、4mm及6mm的葡萄糖胺作标准品以软件定量水解产物的浓度定量并绘制成柱形图。请参见图4,其为各种几丁聚糖水解酵素与几丁聚糖作用24小时后的水解产物比例柱形图,其中横轴由左至右分别代表各种酵素及标准品,上述标准品是几丁寡糖混合物,包含几丁二糖、几丁三糖、几丁四糖及几丁五糖,纵轴是表示几丁二糖、几丁三糖、几丁四糖及几丁五糖占水解产物或几丁寡糖混合物的百分比,直条401、直条403、直条405及直条407分别几丁二糖、几丁三糖、几丁四糖及几丁五糖。如图4所示,突变型酵素ti-d的水解产物中,几丁三糖的比例高达90%,相比于野生型酵素bwt或者是突变型酵素ti与ndti的水解产物都显着上升。突变型酵素ti-hd的水解产物组成与bwt相似但无几丁四糖的产出。突变型酵素ti-ehd的水解产物中,几丁二糖的比例可达到90%以上,显示突变型酵素ti-ehd生产几丁二糖具有专一性。
4.突变型酵素ti-d特性分析
4.1突变型酵素ti-d液相层析法纯化
为了得到更高纯度的突变型酵素ti-d,将第二粗萃酵素以液相层析法进行纯化(fplc)。液相层析法如第【0066】段至第【0067】段所述,其中,具有酵素活性的波峰约于导电度12.5ms/cm时流出,此时磷酸缓冲溶液所含的nacl浓度约为200mm。
将fplc纯化后的酵素、第一粗萃酵素与第二粗萃酵素以sds-page进行电泳,并以影像分析软件计算出几丁聚糖水解酵素占总蛋白质的比例,分别为约35%、55%及95%。
4.2不同纯化方式得到突变型酵素ti-d比较
表4显示以上述三种纯化方式得到的几丁聚糖水解酵素纯度与活性的比较,其中纯化倍率是以第一粗萃法的比活性为1计算的相对值。如表4所示,以fplc萃取的酵素的总蛋白量与总活性虽然较低,但比活性较高,纯化倍率高于第一粗萃酵素的2倍。
表4、以不同纯化方式获得的酵素的活性与纯度的比较
将不同方式获得的几丁聚糖水解酵素以相同酵素活性水解几丁聚糖后,分析水解产物的组成,结果显示以不同纯化方式所得的酵素的水解产物的组成比例无显着差异。为了减少纯化步骤并兼顾酵素的纯度,以第二粗萃法(选择性沉淀法)进行酵素纯化。
4.3ph耐受性与较佳反应ph值
为了找出较适合几丁聚糖水解酵素保存及/或作用的条件以进行量产,对几丁聚糖水解酵素进行温度及酸碱的耐受性测试。所述“耐受性”是指酵素经不同酸碱及/或温度处理后,能维持原有的活性的性质。几丁聚糖水解酵素对酸碱环境的耐受性测试结果请参照图5a与图5b,其分别表示野生型酵素bwt(图5a)与突变型酵素ti-d(图5b)的酸碱耐受性,其中横轴表示环境ph值,纵轴是表示酵素活性,并以图5a中,ph5的酵素活性做为100%。如图5a及图5b所示,野生型bwt酵素活性在ph4到10之间具有80%以上的酵素活性,突变型酵素ti-d则在ph5到10之间具有80%以上的酵素活性。因此,突变型酵素ti-d的保存环境的较佳酸碱值在ph5至10之间,若环境ph值低于4则不利于酵素的保存。
特别的是,在酸性环境中,不论是野生型酵素或是突变型酵素,其活性皆随着ph值的降低而下降,但相对低峰值却出现在ph3而非ph2。实验中观察到几丁聚糖水解酵素在ph3的环境中会产生沉淀物,且沉淀的发生不可逆,也就是即使在ph6的环境下,沉淀物仍不溶于水。
为了探讨沉淀物的成分,将经不同酸碱处理的酵素调整ph值至6后,离心取上清液并测量蛋白质含量。请参见图6a与图6b,其分别表示野生型酵素bwt(图6a)与突变型酵素ti-d(图6b)经不同酸碱值处理后酵素溶液中可溶性蛋白质的含量,其中横轴表示ph值,纵轴是表示可溶性蛋白质量相对总蛋白质量的比例。如图6a与图6b所示,ph3的时候蛋白含量显着下降,表示酵素在ph值3时沉淀,导致如图5a及图5b所示的结果。
接着请参见图7a与图7b,其分别显示于不同ph值下,野生型酵素bwt(图7a)与突变型酵素ti-d(图7b)的活性,其中横轴表示环境ph值,纵轴是表示酵素活性,并以图7b在ph6的酵素活性做为100%。如图7a与图7b所示,野生型酵素bwt与突变型酵素ti-d在ph6时具有较佳活性。当环境偏向酸性时,酵素活性会渐降低,而当环境偏向碱性时,由于做为基质的几丁聚糖不溶于碱,几丁聚糖水解酵素无法对基质进行良好的水解反应,无法得到几丁聚糖水解酵素的真实的活性。
在先前的酸碱值耐受性实验中,在ph3的环境中,酵素活性因为几丁聚糖水解酵素的沉淀而下降,但在较佳反应ph值实验里,几丁聚糖水解酵素在ph3时的活性仍比在ph2时的活性高,这是因为在较佳反应ph值实验中,ph值的改变与水解作用几乎同时进行,因此即使几丁聚糖水解酵素在环境酸碱值为ph3时会因沉淀而失去活性,几丁聚糖水解酵素在完全失去活性前已经先水解完一部份的几丁聚糖。因此,在ph3时依然能测到几丁寡糖的生成。
4.4温度耐受性与较佳反应温度
为了测试酵素对温度的耐受性,将酵素置于各种温度环境下一小时后,在室温进行反应并测定活性。请参见图8a与图8b,其分别表示野生型酵素bwt(图8a)与突变型酵素ti-d(图8b)不同温度的耐受性,其中横轴表示环境温度,纵轴是表示酵素活性,并以图8a中30℃的酵素活性做为100%。如图8a与图8b所示,野生型酵素btw与突变型酵素ti-d在20℃至40℃的温度下都能维持80%的活性。而当温度超过40℃之后,酵素活性便会大幅度下降,即使回到原温度活性也无法还原,突变型酵素ti-d甚至在50℃就已经没有了活性。因此几丁聚糖水解酵素保存要在温度较低的环境下。
将野生型bwt与突变型酵素ti-d置于不同的温度下测试酵素活性,结果发现50℃为较佳反应温度。请参见图9a与图9b,其分别表示野生型酵素bwt(图9a)与突变型酵素ti-d(图9b)于不同温度下的活性,其中横轴表示温度,纵轴是表示酵素活性,并以50℃的酵素活性做为100%。如图9a与图9b所示,几丁聚糖水解酵素在50℃具有较佳活性,但考虑到酵素在40℃度以上的耐受性较低,40℃以上不利于几丁聚糖水解酵素的长时间反应,故以37℃为较佳的反应温度。
4.5野生型酵素bwt与突变型酵素ti-d的长时间水解反应
为了将几丁聚糖水解酵素用于大量生产上,实有必要分析几丁聚糖水解酵素与基质长时间作用后产物的组成。请参见图10a与图10b,其分别为野生型酵素bwt(图10a)与突变型酵素ti-d(图10b)长时间作用后水解产物以tlc分析的结果。如图10a所示,bwt于反应初期(16小时)的水解产物少且有少量几丁五糖的存在,但随着反应时间的增加,水解产物亦增加,在58小时后几乎没有几丁五糖。而突变型酵素ti-d的水解产物在反应初期(16小时)包含高比例的几丁三糖,并且几丁三糖的比例随着反应时间的增加仍显着地高于其它几丁寡糖。因此,推测突变型酵素ti-d的水解方式与bwt不同。
4.6野生型酵素bwt与突变型酵素ti-d水解形式
为了证实突变型酵素ti-d的水解方式不同于野生型bwt,利用酵素水解出还原端的能力以及浊度曲线的关系进行判断。由于dns可与糖类基质的还原端作用呈色,故dns的呈色反应可用于测定酵素的活性。另一方面,若用碱终止酵素的水解反应,会使还没被水解的几丁聚糖沉淀,因此可以透过浊度(od600nm)的测量得知几丁聚糖未被水解的含量。以dns呈色反应对浊度作图可得酵素的水解型式图。请参见图11,其为野生型酵素bwt与突变型酵素ti-d的水解型式图,其中横轴表示dns呈色反应的吸光值(od540nm),纵轴表示前述定义的浊度(od600nm),曲线111与曲线113的点分别表示野生型酵素bwt与突变型酵素ti-d。
几丁聚糖水解酵素可分为内切型(endo-chitinase)外切型(exo-chitinase),其中内切型是从基质中间而非两端进行水解,因此能迅速将长链状的几丁聚糖水解成易溶于水的几丁寡糖,故可使混浊的长链状几丁聚糖溶液迅速变成澄清透明的短链状几丁寡糖溶液;此外,由于几丁聚糖水解酵素可持续水解短链状几丁寡糖而释出更多还原端,所以在od600nm(浊度)几乎为零时,表示od540nm(还原端)依然在上升,如图11中的bwt(曲线111)所示。外切型酵素是由基质的端点进行水解,因此即使还原端因水解作用而增加,水解产物中依然包含长链状几丁聚糖,所以水解型式图中,外切型酵素与相较于同活性的内切酵素,曲线右移。
如图11所示,分别代表突变型酵素ti-d与野生型酵素bwt的曲线111与曲线113走势十分的相似且符合内切型的水解型式图,表示ti-d与bwt皆为内切型基质。
4.7突变型酵素ti-d水解基质模拟
几丁聚糖水解酵素的立体结构包含上半区(upperdomain)、下半区(lowerdomain)及位于上半区与下半区之间的基质结合裂口(substrate-bindingcleft)。当基质与几丁聚糖水解酵素结合时,几丁聚糖水解酵素中与基质结合的位置称为基质次结合区(subsite),其中对应还原端的单元糖的基质次结合位命名为(+n),反之在非还原端对应还原端者命名为(-n),水解发生在对应(-1)与(+1)的单元糖之间。当酵素在水解基质的过程中发生立体结构的改变(conformationalchange)而具有开口或闭口的结构。在模拟基质对接(docking)时,若使用开口结构,几丁聚糖水解酵素的基质结合区域较大,许多氨基酸对基质有影响的表现并非水解时的情况。此外,酵素于闭口型态时原先结构上的氨基酸位置会有所改变,要了解这种情形下酵素与基质的对接,必须要重新模拟酵素开口状态与闭口状态的结构,才能对基质进行对接模拟。
因此,选用对应蛋白质数据库编号4olt的结构进行结构仿真,请参见图12a至图12d,其分别是突变型酵素ti-d开口状态的示意图(图12a)、闭口状态的示意图(图12b)、开口状态表面电子云图(图12c)以及闭口状态表面电子云图(图12d)。如图12a与图12b的示意图所示,当基质接近几丁聚糖水解酵素的基质结合裂口时,上半区与下半区互相靠近而基质与几丁聚糖水解酵素结合于基质结合裂口中。如图12c至图12d的表面电子云图所示,闭口时基质结合裂口会被包覆起来。
以闭口状态的结构对基质进行十次的对接模拟,可以发现基质结合裂口集中在野生型酵素bwt的中间的位置,请参见图13,其为野生型酵素bwt与基质结合的结构仿真图。如图13所示,十个不同结合方式的结构仿真结果中,野生型酵素bwt与基质的仿真位置与基质次结合位(+2)至(-4)基本吻合。依照酵素切位对基质水解产物预测,以几丁六糖做基质时的水解产物是平均由1.5与4.5个单糖键结的几丁寡糖。图14是突变型酵素ti-d与基质结合的模拟图,其中基质往左边偏移了大约一个糖位,而水解产物是平均由2.75与3.25个单糖键结的几丁寡糖。这表示本发明的较佳实施例(突变型酵素ti-d)成功改变酵素与基质结合的位置。
参考实际水解产物情况,计算对接模拟后基质被酵素水解后的糖类种类。野生型酵素bwt的几丁二糖、几丁三糖与几丁四糖的摩尔数比例为3:3:1,突变型酵素ti-d的几丁二糖、几丁三糖与几丁四糖的摩尔数比例为1:3:1。实际以tlc分析的水解产物中各种几丁寡糖的比例,其中野生型酵素bwt的几丁二糖、几丁三糖与几丁四糖的摩尔数比例为4:3:1,突变型酵素ti-d的几丁二糖、几丁三糖与几丁四糖的摩尔数比例为1:8:1。模拟与实际实验的结果相似。
针对产物为几丁二糖与几丁四糖或几丁三糖的情形进行模拟分析。请参见图15,其为突变型酵素ti-d水解基质产生几丁二糖与几丁四糖或几丁三糖的模拟示意图。如图15所示,当水解产物为几丁二糖与几丁四糖时,表示基质是以平行于基质结合裂口的方向进入基质结合裂口。但是当产物为几丁三糖时,基质却是以倾斜的方向进入基质结合裂口之中,且基质的末端位置会靠近酵素插入天门冬氨酸的位置。这是由于本发明较佳实施例(突变型酵素ti-d)中,插入的氨基酸带负电而吸引带正电的几丁聚糖基质,使基质往天门冬氨酸靠近。再者,本发明较佳实施例中的突变型酵素ti-d亦具有如同突变型酵素ti中使酵素对基质亲和力下降的ti突变位点(对应(-2)次基质结合位),使得基质原先对应(-1)至(-3)的次基质结合位因缺乏向下的吸引力而往上倾斜进入。在突变型酵素ti-d中,氨基酸插入的位置在原先(-3)与(-4)次基质结合位之间。综合上述,由于基质以倾斜的方向与酵素结合,再加上插入的天门冬氨酸的吸引,刚好使得突变型酵素ti-d能够将几丁寡糖切成几丁三糖,故本实施例中突变型酵素ti-d虽然是内切型的酵素,却可专一地产生几丁三糖。突变型酵素ti-d的水解产物中除了几丁三糖,还有含量相对几丁三糖较少的几丁二糖与几丁四糖。从结构上,在插入的天门冬氨酸的位点后方包含一个带正电的组氨酸。请参见图16,其为突变型酵素ti-d水解基质产生几丁二糖与几丁四糖的模拟示意图。当基质是由中间被水解或是如果基质末端没有被插入的氨基酸吸引,而是由酵素下方进入的基质结合位,基质会被上述组氨酸向下推,而形成了拱型的结构,使突变型酵素ti-d的水解方式与酵素bwt的水解方式相似而产生几丁二糖与几丁四糖。
5.大量产物分析
5.1几丁寡糖量产
关于以酵素进行长时间水解的结果,请参阅图10a与图10b及实验结果第4.5点。
复请参见图17a与图17b,其为野生型bwt(图17a)与突变型酵素ti-d(图17b)不同反应时间的几丁寡糖摩尔浓度变化,并对几丁二糖(曲线171)反应72小时的浓度做为100%。图17a与图17b分别为定量图10a与图10b所示的tlc分析结果,并对几丁二糖(曲线171)、几丁三糖(曲线173)与几丁四糖(曲线175)进行绘制。如图17a,野生型bwt的水解产物中,几丁二糖在任何时间点皆具有较高的浓度比例,几丁三糖与几丁四糖的浓度比例较少。此外,到了反应的后期几丁四糖浓度的上升斜率减少,而几丁二糖的上升斜率增加,这是因为几丁四糖被水解成几丁二糖。突变型酵素ti-d的产物中,几丁三糖的产量在反应之初便显着高于几丁二糖与几丁四糖,且在任意时间点几丁三糖的浓度都高于几丁二糖与几丁四糖。当反应72小时后,几丁三糖的比例可达到总产物的80%。
5.2几丁三糖量产物纯化
为了回收水解产物,将反应后的水溶液的酸碱值调整至ph4(酸性)、ph7(中性)或ph12(碱性)进行纯化,并以ipa使水解产物沉淀。离心并去除上清液后,利用冷冻干燥机进行冻干。取20ml的上清液以测量产物含量,从而计算产物纯化率,其中在酸性环境与碱性环境中进行纯化,产物纯化率都接近80%。但如果加入ipa于-20℃静置24小时,产物纯化率可达到90%。然而,以碱性进行纯化,所得的产物在进行回溶后,会发生快速产生褐化的现象,产物中的寡糖比例也容易发生变化,因此在纯化时不需要特别改变产物的酸碱值,而是要控制温度-20℃以下进行。
为了确认纯化后产物中的寡糖是否发生改变,将以不同纯化方式取得的产物冻干粉末,各取0.1g回溶到1ml的无菌水中,并以tlc进行分析。请参照图18,其为纯化产物的冻干粉末的分析结果,其中除了最右边泳道的-20℃,ph12,皆于室温下进行纯化。
接着请参照图19,其显示纯化产物的几丁二糖、几丁三糖与几丁四糖的比例,是根据图18中tlc测定到的纯化寡糖产物定量,并计算产物几丁二糖、几丁三糖与几丁四糖所占产物总量比例绘制而成,其中横轴表示纯化条件,纵轴表示几丁寡糖占纯化产物总量的比例,标准品是包含几丁二糖、几丁三糖与几丁四糖的混合物,直条(bar)191、直条193与直条195分别表示几丁二糖、几丁三糖与几丁四糖。如图19所示,在碱性、-20℃的条件下,纯化产物中几丁三糖占纯化产物总量的比例相对较高。在其他条件下,突变型酵素ti-d的纯化产物中,几丁三糖的比例虽然略有下降,但依然是三种几丁寡糖中含量相对较多者,占纯化产物总量的70%。
以上所述仅为本发明的较佳实施例,凡依本发明权利要求书所做的均等变化与修饰,皆应属本发明的涵盖范围。
序列表
<110>高雄科技大学
<120>重组几丁聚糖水解酵素及其用于制造几丁寡糖的方法
<160>17
<210>1
<211>261
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌(bacilluscirculans)几丁聚糖水解酵素al-d
<400>1
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisaspproaspgly
65707580
proaspleuphelysalatyraspalaalalysglyalaserasnpro
859095
seralaaspglyalaleulysargleuglyileasnglylysmetlys
100105110
glyserileleugluilelysaspserglulysvalphecysglylys
115120125
ilelyslysleuglnasnaspalaalatrparglysalamettrpglu
130135140
thrphetyrasnvaltyrileargtyrservalgluglnalaarggln
145150155160
argglyphethrseralavalthrileglyserphevalaspthrala
165170175
leuasnglnglyalathrglyglyseraspthrleuglnglyleuleu
180185190
alaargserglyserserserasnglulysthrphemetlysasnphe
195200205
hisalalysargthrleuvalvalaspthrasnlystyrasnlyspro
210215220
proasnglylysasnargvallysglntrpaspthrleuvalaspmet
225230235240
glylysmetasnleulysasnvalaspsergluilealaglnvalthr
245250255
asptrpglumetlys
260
<210>2
<211>261
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素ti-d
<400>2
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisaspproaspgly
65707580
proaspleuphelysalatyraspalaalalysglyalaserasnpro
859095
seralaaspglyalaleulysargleuglyileasnglylysmetlys
100105110
glyserileleugluilelysaspserglulysvalphecysglylys
115120125
ilelyslysleuglnasnaspalaalatrparglysalamettrpglu
130135140
thrphetyrasnvaltyrileargtyrservalgluglnalaarggln
145150155160
argglyphethrseralavalthrileglyserphevalaspthrthr
165170175
ileasnglnglyalathrglyglyseraspthrleuglnglyleuleu
180185190
alaargserglyserserserasnglulysthrphemetlysasnphe
195200205
hisalalysargthrleuvalvalaspthrasnlystyrasnlyspro
210215220
proasnglylysasnargvallysglntrpaspthrleuvalaspmet
225230235240
glylysmetasnleulysasnvalaspsergluilealaglnvalthr
245250255
asptrpglumetlys
260
<210>3
<211>262
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素al-hd
<400>3
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhishisaspproasp
65707580
glyproaspleuphelysalatyraspalaalalysglyalaserasn
859095
proseralaaspglyalaleulysargleuglyileasnglylysmet
100105110
lysglyserileleugluilelysaspserglulysvalphecysgly
115120125
lysilelyslysleuglnasnaspalaalatrparglysalamettrp
130135140
gluthrphetyrasnvaltyrileargtyrservalgluglnalaarg
145150155160
glnargglyphethrseralavalthrileglyserphevalaspthr
165170175
alaleuasnglnglyalathrglyglyseraspthrleuglnglyleu
180185190
leualaargserglyserserserasnglulysthrphemetlysasn
195200205
phehisalalysargthrleuvalvalaspthrasnlystyrasnlys
210215220
proproasnglylysasnargvallysglntrpaspthrleuvalasp
225230235240
metglylysmetasnleulysasnvalaspsergluilealaglnval
245250255
thrasptrpglumetlys
260
<210>4
<211>262
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素ti-hd
<400>4
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhishisaspproasp
65707580
glyproaspleuphelysalatyraspalaalalysglyalaserasn
859095
proseralaaspglyalaleulysargleuglyileasnglylysmet
100105110
lysglyserileleugluilelysaspserglulysvalphecysgly
115120125
lysilelyslysleuglnasnaspalaalatrparglysalamettrp
130135140
gluthrphetyrasnvaltyrileargtyrservalgluglnalaarg
145150155160
glnargglyphethrseralavalthrileglyserphevalaspthr
165170175
thrileasnglnglyalathrglyglyseraspthrleuglnglyleu
180185190
leualaargserglyserserserasnglulysthrphemetlysasn
195200205
phehisalalysargthrleuvalvalaspthrasnlystyrasnlys
210215220
proproasnglylysasnargvallysglntrpaspthrleuvalasp
225230235240
metglylysmetasnleulysasnvalaspsergluilealaglnval
245250255
thrasptrpglumetlys
260
<210>5
<211>263
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素al-ehd
<400>5
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisgluhisasppro
65707580
aspglyproaspleuphelysalatyraspalaalalysglyalaser
859095
asnproseralaaspglyalaleulysargleuglyileasnglylys
100105110
metlysglyserileleugluilelysaspserglulysvalphecys
115120125
glylysilelyslysleuglnasnaspalaalatrparglysalamet
130135140
trpgluthrphetyrasnvaltyrileargtyrservalgluglnala
145150155160
argglnargglyphethrseralavalthrileglyserphevalasp
165170175
thralaleuasnglnglyalathrglyglyseraspthrleuglngly
180185190
leuleualaargserglyserserserasnglulysthrphemetlys
195200205
asnphehisalalysargthrleuvalvalaspthrasnlystyrasn
210215220
lysproproasnglylysasnargvallysglntrpaspthrleuval
225230235240
aspmetglylysmetasnleulysasnvalaspsergluilealagln
245250255
valthrasptrpglumetlys
260
<210>6
<211>263
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素ti-ehd
<400>6
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisgluhisasppro
65707580
aspglyproaspleuphelysalatyraspalaalalysglyalaser
859095
asnproseralaaspglyalaleulysargleuglyileasnglylys
100105110
metlysglyserileleugluilelysaspserglulysvalphecys
115120125
glylysilelyslysleuglnasnaspalaalatrparglysalamet
130135140
trpgluthrphetyrasnvaltyrileargtyrservalgluglnala
145150155160
argglnargglyphethrseralavalthrileglyserphevalasp
165170175
thrthrileasnglnglyalathrglyglyseraspthrleuglngly
180185190
leuleualaargserglyserserserasnglulysthrphemetlys
195200205
asnphehisalalysargthrleuvalvalaspthrasnlystyrasn
210215220
lysproproasnglylysasnargvallysglntrpaspthrleuval
225230235240
aspmetglylysmetasnleulysasnvalaspsergluilealagln
245250255
valthrasptrpglumetlys
260
<210>7
<211>260
<212>prt
<213>芽孢杆菌(bacilluscirculans)
<400>7
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisproaspglypro
65707580
aspleuphelysalatyraspalaalalysglyalaserasnproser
859095
alaaspglyalaleulysargleuglyileasnglylysmetlysgly
100105110
serileleugluilelysaspserglulysvalphecysglylysile
115120125
lyslysleuglnasnaspalaalatrparglysalamettrpgluthr
130135140
phetyrasnvaltyrileargtyrservalgluglnalaargglnarg
145150155160
glyphethrseralavalthrileglyserphevalaspthralaleu
165170175
asnglnglyalathrglyglyseraspthrleuglnglyleuleuala
180185190
argserglyserserserasnglulysthrphemetlysasnphehis
195200205
alalysargthrleuvalvalaspthrasnlystyrasnlyspropro
210215220
asnglylysasnargvallysglntrpaspthrleuvalaspmetgly
225230235240
lysmetasnleulysasnvalaspsergluilealaglnvalthrasp
245250255
trpglumetlys
260
<210>8
<211>30
<212>dna
<213>人工序列
<220>
<223>突变型ti饱和突变上游引子
<220>
<221>misc_feature
<222>(14,15,17,18)
<223>n=a或g或c或t
<220>
<221>misc_feature
<222>(13,16)
<223>m=a或c
<400>8
tttgtcgatacgmnnmnnaatcaaggcgct30
<210>9
<211>30
<212>dna
<213>人工序列
<220>
<223>突变型ti饱和突变下游引子
<220>
<221>misc_feature
<222>(13,14,16,17)
<223>n=a或g或c或t
<220>
<221>misc_feature
<222>(15,18)
<223>k=t或u
<400>9
agcgccttgattnnknnkcgtatcgacaaa30
<210>10
<211>260
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素ti
<400>10
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisproaspglypro
65707580
aspleuphelysalatyraspalaalalysglyalaserasnproser
859095
alaaspglyalaleulysargleuglyileasnglylysmetlysgly
100105110
serileleugluilelysaspserglulysvalphecysglylysile
115120125
lyslysleuglnasnaspalaalatrparglysalamettrpgluthr
130135140
phetyrasnvaltyrileargtyrservalgluglnalaargglnarg
145150155160
glyphethrseralavalthrileglyserphevalaspthrthrile
165170175
asnglnglyalathrglyglyseraspthrleuglnglyleuleuala
180185190
argserglyserserserasnglulysthrphemetlysasnphehis
195200205
alalysargthrleuvalvalaspthrasnlystyrasnlyspropro
210215220
asnglylysasnargvallysglntrpaspthrleuvalaspmetgly
225230235240
lysmetasnleulysasnvalaspsergluilealaglnvalthrasp
245250255
trpglumetlys
260
<210>11
<211>27
<212>dna
<213>人工序列
<220>
<223>突变型ti-d定点突变上游引子(ti-d-f)
<400>11
agagatacccatgatcccgatggcccg27
<210>12
<211>27
<212>dna
<213>人工序列
<220>
<223>突变型ti-d定点突变下游引子(ti-d-r)
<400>12
cgggccatcgggatcatgggtatctct27
<210>13
<211>30
<212>dna
<213>人工序列
<220>
<223>突变型ti-ed定点突变上游引子(ti-hd-f)
<400>13
agagatacccatgaggatcccgatggcccg30
<210>14
<211>30
<212>dna
<213>人工序列
<220>
<223>突变型ti-ed定点突变下游引子(ti-hd-r)
<400>14
cgggccatcgggatcctcatgggtatctct30
<210>15
<211>33
<212>dna
<213>人工序列
<220>
<223>突变型ti-ehd定点突变上游引子(ti-ehd-f)
<400>15
agagatacccatgagcacgatcccgatggcccg33
<210>16
<211>33
<212>dna
<213>人工序列
<220>
<223>突变型ti-ehd定点突变下游引子(ti-ehd-r)
<400>16
cgggccatcgggatcgtgctcatgggtatctct33
<210>17
<211>260
<212>prt
<213>人工序列
<220>
<221>重组芽孢杆菌几丁聚糖水解酵素ndti
<400>17
metalaserproaspaspasnpheserprogluthrleuglnpheleu
151015
argasnasnthrglyleuaspglygluglntrpasnasnilemetlys
202530
leuileasnlysprogluglnaspaspleuasntrpilelystyrtyr
354045
glytyrcysgluaspilegluaspgluargglytyrthrileglyleu
505560
pheglyalathrthrglyglyserargaspthrhisproaspglypro
65707580
aspleuphelysalatyraspalaalalysglyalaserasnproser
859095
alaaspglyalaleulysargleuglyileasnglylysmetlysgly
100105110
serileleugluilelysaspserglulysvalphecysglylysile
115120125
lyslysleuglnasnaspalaalatrparglysalamettrpgluthr
130135140
phetyrasnvaltyrileargtyrservalgluglnalaargglnarg
145150155160
glyphethrseralavalthrileglyserphevalaspthrthrile
165170175
asnglnglyalaasnaspglyseraspthrleuglnglyleuleuala
180185190
argserglyserserserasnglulysthrphemetlysasnphehis
195200205
alalysargthrleuvalvalaspthrasnlystyrasnlyspropro
210215220
asnglylysasnargvallysglntrpaspthrleuvalaspmetgly
225230235240
lysmetasnleulysasnvalaspsergluilealaglnvalthrasp
245250255
trpglumetlys
260
- 还没有人留言评论。精彩留言会获得点赞!