一种修饰泛素并抑制泛素化通路的方法与流程
本发明涉及生命科学和微生物蛋白功能及应用技术领域,具体涉及对泛素分子特异性修饰的新方式以及效应蛋白ctec作为adp核糖基转移酶的酶学活性以及该酶在研究adp核糖基化修饰中的作用。
背景技术:
adp核糖基化(adpr)是一种可逆的调控机制,广泛存在于病毒、细菌和大部分真核生物体内。adp核糖基转移酶(arts)将二磷酸腺苷(adp)核糖基的基团从nad转移到底物蛋白上,并释放烟酰胺。adpr调节细胞许多重要的生理过程,如dna损伤修复、转录、细胞分裂、增殖和细胞死亡等。此外,adpr还参与了许多人类疾病的发病过程,包括神经系统疾病、癌症和细菌或病毒的感染。细菌中也存在着arts,比如致病性白喉杆菌和霍乱弧菌产生的白喉(dtx)和霍乱(ctx)外毒素等,这些毒素在细菌的致病性中起到重要的作用。arts根据nad结合及催化的保守氨基酸序列分为两类,分别为hyearts和rsearts。在细菌的hyearts中,组氨酸(h)和腺苷核糖上的两个羟基以及烟酰胺上的氨基形成氢键,酪氨酸(y)和烟酰胺上的苯环形成pi-pi堆积,谷氨酸(e)对于催化形成的中间产物起到稳定的作用。而在rsearts中,精氨酸(r)和nad的二磷酸形成静电相互作用,丝氨酸(s)和烟酰胺核糖基上的一些位点形成氢键,谷氨酸行使着与hyearts中一样的催化活性。
泛素化是真核细胞中普遍存在的翻译后修饰。ub首先被泛素激活酶e1在atp和mg2+的参与下被激活。e1利用atp产生腺苷酸,然后将ubc末端的甘氨酸残基通过硫酯键转移到半胱氨酸残基上。在e1介导的ub活化之后,ub被转移到泛素结合酶e2的半胱氨酸残基上。在不同类型的e3连接酶的催化作用下,ub形成不同形式的多聚泛素链连接到底物蛋白上,发挥不同的生理功能。比如k48链参与蛋白质降解、k63链参与信号转导,线性链参与nf-κb信号通路等。泛素化作为重要的蛋白质翻译后修饰,一直是细胞生物学和肿瘤生物学研究的重点和热点。泛素-蛋白酶体途径及去泛素化途径在细胞信号转导和肿瘤发生发展的过程中起到了重要的作用。某些类型的肿瘤细胞对泛素通路的阻断非常敏感,会迅速诱发凋亡而死亡。因此,对肿瘤细胞中泛素化通路的抑制将会成为抗肿瘤治疗的新靶点。
在与宿主共同进化的过程中,致病菌也进化出了特殊的蛋白质分泌系统,如iii型分泌系统(t3sss)可以将毒性效应蛋白导入宿主细胞,在侵染过程中干扰宿主的免疫反应相关的信号通路。紫色色杆菌(chromobacteriumviolaceum)是一种条件性革兰氏阴性病原菌,广泛分布在热带及亚热带的水或者土壤中,因能分泌紫色的紫色杆菌素而闻名。人体因皮肤接触或者饮食误入感染紫色色杆菌后,会在几天内引发严重的肝脓肿,随后全身性多器官发生脓肿病症,迅速地发展成系统性疾病,临床症状表现为发热、腹痛、组织坏死及内脏脓肿,继而发展成败血症,死亡率超过50%。紫色色杆菌的感染初期症状不明显,但发展非常迅猛,对多种抗生素具有很强的耐药性,临床诊治方面临了诸多的挑战。
紫色色杆菌菌株atcc12472于2003年被全基因组测序,发现该菌拥有两个iii型分泌系统,分别为cpi-1/1a和cpi-2,其组成成份与沙门氏菌spi-1和spi-2分泌系统在蛋白质序列上存在很大的相似性,表明cpi-1/1a和cpi-2分泌系统在紫色色杆菌感染过程中可能发挥类似沙门氏菌spi-1和spi-2分泌系统的功能。与一起编码在基因组同一区域的cpi-2不同,编码cpi-1/1a的基因岛在紫色色杆菌的基因组上并不在一起,而是分布在两个区域。cpi-1在基因组上位于cpi-2的下游,由cv2615至cv2642这28个读码框组成,全长31004bp。cpi-1a位于cpi-1上游200kb处,读码框从cv2416至cv2424,全长4190bp。cpi-2位于读码框cv2574至cv2610之间,在cpi-1的上游,全长40291bp。紫色色杆菌iii型效应蛋白的具体数量目前尚不完全清楚,目前已经鉴定出来的效应蛋白共有13个,其中只有个别效应蛋白功能被揭示。本发明所公开的效应蛋白ctec(cv1467)即为其中的一种,但除了基因序列已知(ncbi:accessionae016825),目前没有任何表明其活性、功能的研究报道,仅知道该蛋白是可以被紫色色杆菌通过iii型分泌系统分泌的。(miki,t.,iguchi,m.,akiba,k.,hosono,m.,sobue,t.,danbara,h.,andokada,n.(2010).chromobacteriumpathogenicityisland1typeiiisecretionsystemisamajorvirulencedeterminantforchromobacteriumviolaceum-inducedcelldeathinhepatocytes.molmicrobiol77,855-872.)
病原菌中有多个效应蛋白被报道具有干扰泛素化途径的活性,比如作为一种去泛素化酶或泛素连接酶、对泛素分子或泛素结合酶ubc13进行脱氨修饰等。先前研究发现嗜肺军团菌的side家族效应蛋白可以对泛素第42位的精氨酸进行adp核糖基化修饰,并进一步将修饰后的泛素分子单磷酸核糖化,从而共价连接到底物蛋白的丝氨酸残基上,该过程不需要e1和e2参与,也不依赖atp作为能量来源,是一种全新的泛素化修饰。虽然该类效应蛋白也对泛素进行精氨酸adp核糖基化修饰,但是这种修饰作用不是最终的产物,只是催化的一个中间过程。与本发明所涉及的adp核糖基转移酶的功能存在很大的差别,同时本发明涉及的蛋白在泛素的修饰位点和底物特异性等方面与已报道的side家族蛋白完全不同。(qiu,j.,sheedlo,m.j.,yu,k.,tan,y.,nakayasu,e.s.,das,c.,liu,x.,andluo,z.q.(2016).ubiquitinationindependentofe1ande2enzymesbybacterialeffectors.nature533,120-124.)
技术实现要素:
本发明的目的在于提供一种修饰泛素并抑制泛素化通路的方法。
采用的技术方案是:一种修饰泛素并抑制泛素化通路的方法,将含有条件性致病菌的的效应蛋白基因的重组真核表达载体导入目的真核细胞中,使所述目的真核细胞中的泛素被单adp核糖基化,泛素化通路受到抑制。
通过blast序列比对分析,发现紫色色杆菌(chromobacteriumviolaceum)的ctec存在着同源蛋白,分别来自伯克氏菌(burkholderiaubonensis)和珊瑚球菌(corallococcus),这里称这两种菌的效应蛋白分别为chbu(ncbi,accession:kvo09808)和chcs(ncbi,accession:wp_121752092)。实验结果显示ctec、chbu和chcs在nad存在的情况下,利用活性谷氨酸活性残基,特异性地修饰ub,而不修饰sumo和nedd8,从而确定该adp核糖基转移酶是一类家族蛋白,并存在与多种病原菌中。
所述泛素为泛素分子(ub),泛素分子(ub)的66位的苏氨酸残基被单adp核糖基化。
本发明的有益效果是:本发明通过细菌iii型分泌系统分泌的效应蛋白家族对泛素分子进行苏氨酸单adp核糖基化,adp核糖基化会抑制蛋白质泛素化过程,干扰细胞内泛素介导的信号通路,从而引起细胞功能紊乱。肿瘤细胞内的泛素化通路通常比较活跃,因此通过抑制泛素化对杀死肿瘤细胞具有意义。本发明方法将在杀死肿瘤细胞和调节细胞信号通路中发挥重要作用。
附图说明
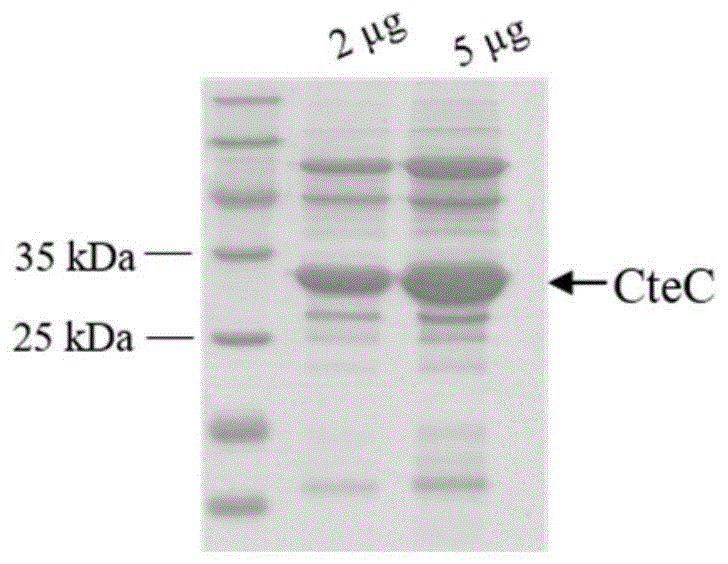
图1为ctec重组蛋白的12%sds-page蛋白胶图;
图2为ctec依赖于nad对ub的修饰作用图;
图3为adpr抗体识别ctec修饰后的ub图;
图4为ctec与其他adp核糖基转移酶的氨基酸序列比对图;
图5为ctec突变体转染至细胞后对内源ub的修饰作用图;
图6为ctec修饰后的ub的质谱分析图。图中显示在66位的苏氨酸上有adpr修饰;
图7为ctec修饰后的ub的结构图;
图8为ctec对sumo和nedd8无修饰作用实验结果图;
图9为adpr-ub对泛素链形成的影响实验结果图;
图10为ctec对tnfα刺激下细胞内iκbα降解情况的实验结果图;
图11为ctec对细胞内gfpu积累的影响实验结果图;
图12为chbu和chcs对ub的修饰作用结果图;
图13为chbu和chcs对ub的修饰位点及特异性结果图;其中a,b表示chbu对ubt66a无修饰作用;c,d表示chcs对ubt66a无修饰作用;e表示chbu不能修饰sumo和nedd8;f表示chbu不能修饰sumo和nedd8;
具体实施方式
实施例1
ctec重组蛋白的表达与纯化
1、构建表达质粒
以chromobacteriumviolaceumatcc12472菌株的基因组dna为模板,根据ncbi上的基因序列(cv_1647)设计引物f1:gataggatccatgctatttttcaccggtctgc(seqidno.1)和r1:gatactcgagttagaccgacgccaactcctg(seqidno.2)进行pcr扩增获得ctec全长目的片段。
将ctec全长目的片段通过酶切(酶切位点为bamh1和xho1)、连接的方法构建至卡那霉素抗性的原核表达质粒prsf-duet-his-sumo载体(该载体在prsf-duet1(novagen)的基础上在his标签后插入了sumo蛋白)中得到prsf-duet1-his-sumo-ctec。his标签蛋白可以用ni磁珠进行亲和纯化,sumo蛋白可以被ulp1酶特异性识别,以便后续标签蛋白的切除。
2、蛋白表达
将prsf-duet1-his-sumo-ctec转化到大肠杆菌bl21(de3)菌株中,从平板上挑取单菌落接种于5mllb培养基中,37℃摇至od600为0.8左右,转接至1llb培养基中,继续摇至od600为0.8左右,加入终浓度为0.1mm的iptg,18℃振荡培养16小时,收集菌体。
3、蛋白纯化及鉴定
菌体经预冷的缓冲液(50mmtris-hclph8.0,150mmnacl,2mmdtt)洗涤后,悬浮于40ml缓冲液中。超声破碎菌体细胞,裂解液于18000rpm离心1小时,获得上清液。用ni柱进行亲和纯化后,用400ml含20mm咪唑的缓冲液冲洗ni柱,去除杂蛋白,用30ml含300mm咪唑的缓冲液将蛋白从ni柱上洗脱下来,用ulp1酶过夜酶切。将洗脱液过脱盐柱,去除咪唑,重新与ni柱亲和,去除sumo标签蛋白。将洗脱液进一步过已平衡好的hitrapq柱(平衡缓冲液组分:50mmtris-hclph8.0),分步收集穿出组分得到ctec蛋白。经12%sds-page鉴定,如图1所示,ctec重组蛋白纯度大于90%,表达的ctec蛋白大小为31kda。
实施例2:效应蛋白ctec对泛素分子的adp核糖基化修饰作用
在15μl反应体系中(反应缓冲液为20mmhepesph7.4,150mmnacl),加入1μm的ub(该蛋白纯化方式同参考文献wanetal.,2019,doi:10.1038/s41564-019-0454-1)和0.1μm的实施例1纯化得到的ctec蛋白,设置nad浓度梯度分别为0、0.25、2.5、25、250、2500μm,37℃反应30分钟后,分别跑15%sds-page和8%nativepage,若ub发生了修饰反应,可在15%sds-page胶上发生向上的迁移,在8%nativepage上发生向下的迁移。体外生化实验表明,ctec对ub的修饰作用需要依赖nad作为配体(图2),并且修饰后的ub可以被adpr的抗体(mabe1016,millipore)识别(图3)。通过序列比对分析,发现ctec与一些arts相似,具有保守的“rsemotif”(图4)。为了检验ctec的rsemotif,我们分别将ctec的r65、e220、s97位点突变为丙氨酸(a)制备得到突变体ctecr65a、ctecs97a和ctece220a,具体地,ctece220a制备方法如下:在ctec的e220位上设计点突变引物:5’-gtggagccgaccgcggccaaaatctgc(seqidno.3),3’-gcagattttggccgcggtcggctccac(seqidno.4),首先以菌dna为模板,分别用f1/3’和r1/5’两对引物进行第一轮pcr,获得两个目的片段,再以这两个片段为模板,用f1/r1引物进行第二轮pcr,得到突变体ctece220a片段。突变体ctecr65a、ctecs97a制备方法相同。将得到的突变体ctecr65a、ctecs97a、ctece220a和ctec全长片段分别在n端加上flag标签蛋白并构建至真核载体prk5-myc中。hek293t细胞种于12孔板中,在细胞密度为80%左右时,每孔转染1μg质粒,以及转染试剂jetprime2μl。同时转染空载(vector)作为阴性对照进行ctec突变体对细胞内源ub修饰活性的实验。结果如图5所示,将r65和e220突变为丙氨酸(a)后,ctec不能使ub在15%sds-page上发生向上的迁移,将s97突变为丙氨酸(a)后,ctec仍能使ub发生向上的迁移。
通过对修饰后的ub进行质谱鉴定及结构解析,确认ctec对ub进行了单adp核糖基化修饰,并且修饰位点为66位的苏氨酸(图6、图7)。鉴定出ctec是一类adp核糖基转移酶,活性位点为220位的谷氨酸。
ub的t66位在其他类泛素蛋白分子并不保守,按照上述实验方法对sumo(该蛋白由实施例1中涉及的prsf-duet-his-sumo质粒纯化获得)和nedd8(该蛋白构建至pgex-6p-2载体,通过gst树脂亲和纯化后,用prescission过夜酶切后获得,cuietal.,2010,doi:10.1126/science.1193844)进行体外生化实验,结果表明ctec在biotin-nad的存在下并不能修饰sumo和nedd8(图8)。biotin-nad即在nad分子上连接了biotin(生物素)分子,这样nad即可被biotin的抗体所识别。
实施例3效应蛋白ctec对泛素分子的adp核糖基化修饰对泛素化通路以及宿主细胞的影响。
泛素分子通过级联反应形成不同形式的泛素链后参与到各种信号通路中。采用不同的e2和e3会形成特定形式的泛素链。本实施例采用ubch5c和ipah3合成k48链,采用uev1a、ubc13和traf6合成k63链。(本实施例中所涉及的蛋白质粒信息及纯化方法参见wanetal.,2019,doi:10.1038/s41564-019-0454-1)实验结果表明ctec修饰后的ub体外形成k48和k63链的效率大大降低(图9)。
nf-κb信号通路在细胞免疫反应中起到重要作用,而iκbα的降解是检测该通路是否激活的一个指标。具体实验如下:
(1)hek293t细胞种于12孔板中,在细胞密度为80%左右时,每孔转染1μgprk5-myc-flag-ctecwt/e220a(全长ctec/e220a突变体)质粒,以及转染试剂jetprime2μl。同时转染空载(vector)作为阴性对照。
(2)转染20h后,用tnfα(10ng/ml)分别刺激5,10,15分钟,将细胞用细胞裂解液(25mmhepes7.4,150mmnacl,1%tritonx-100,cocktail)收集起来,在冰上裂解15分钟后,12000rpm,4℃离心15分钟,收集细胞上清,用于westernblot检测。
(3)本实验中不同处理样品的iκbα的水平显示nf-κb的激活情况;tubulin作为常见的内参抗体显示每个样品蛋白上样量的一致性;flag显示ctec在细胞内的表达水平。实验结果发现转染ctec的质粒的细胞iκbα的降解得到了有效的抑制(图10)。
泛素-蛋白酶体系统在蛋白质降解中起到了重要的作用,gfpu是检测该系统是否受到抑制的一种方法,可以通过gfp的信号强度,来判断系统功能是否正常。具体实验如下:
(1)实验采用稳转细胞系mcherry-p2a-gfpu293a细胞(制备参考guoetal.,2011,doi.org/10.1073/pnas.1113170108),该细胞在正常情况下gfpu会不断被泛素-蛋白酶体系统降解,显示很弱的荧光信号。但当泛素-蛋白酶体系统功能发生障碍时,则可以观察到绿色荧光信号的积累,通过westernblot检测gfp的表达水平可显示出gfpu的积累程度。
(2)hek293t细胞种于12孔板中,在细胞密度为80%左右时,每孔转染1μgprk5-myc-flag-ctecwt/e220a质粒,以及转染试剂jetprime2μl。同时转染空载(vector)作为阴性对照,在细胞培养基中加入浓度为5μm的mg132为阳性对照,该试剂为常用的一种蛋白酶体抑制剂。
(3)转染20h后,将细胞用细胞裂解液(25mmhepes7.4,150mmnacl,1%tritonx-100,cocktail)收集起来,在冰上裂解15分钟后,12000rpm,4℃离心15分钟,收集细胞上清,用于westernblot检测。
(4)本实验中不同处理样品的gfp的水平显示绿色荧光的积累水平;tubulin作为常见的内参抗体显示每个样品蛋白上样量的一致性;anti-flag免疫显色显示ctec在细胞内的表达水平。实验结果发现转染ctecwt的质粒的细胞gfpu产生了显著的积累(图11)。
上述两个实验均说明效应蛋白ctec能抑制泛素通路。发现修饰后的ub从e1转移到e2的能力降低、体外合成多聚泛素链的效率减弱。对细胞内泛素介导的信号通路产生严重影响。
实施例4
通过序列比对分析及体外生化实验确认本发明所涉及的adp核糖基转移酶是一类家族,在多种菌中均存在。
通过ncbi的blast分析,发现ctec存在着同源蛋白,分别来自于伯克氏菌(burkholderiaubonensis)和珊瑚球菌(corallococcus),这里称这两个菌的效应蛋白分别为chbu(ncbi,accession:kvo09808)和chcs(ncbi,accession:wp_121752092)(图4)。这两个蛋白的纯化方式同实施例1。其中chbu与ctec的同源性较高,并且也有保守的“rsemotif”,而chcs和ctec的同源性仅有24%,并且只有“re”两个保守位点,缺少丝氨酸。但体外生化实验表明,chbu和chcs均可以修饰ub的t66残基,活性位点也为e(谷氨酸残基),并且对类泛素蛋白分子sumo和nedd8也无修饰作用(图12、图13)。其中chbu的活性谷氨酸残基位于第205位,chcs的活性谷氨酸残基位于第211位。值得注意的是,珊瑚球菌对多种真菌具有抑制作用,而不属于人类的致病菌。进一步说明本发明所涉及的蛋白家族在细菌中存在的广谱性,对其功能的研究将有着更大的意义。
序列表
<110>浙江大学
<120>一种修饰泛素并抑制泛素化通路的方法
<141>2020-01-20
<160>4
<170>siposequencelisting1.0
<210>1
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>1
gataggatccatgctatttttcaccggtctgc32
<210>2
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>2
gatactcgagttagaccgacgccaactcctg31
<210>3
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>3
gtggagccgaccgcggccaaaatctgc27
<210>4
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>4
gcagattttggccgcggtcggctccac27
- 还没有人留言评论。精彩留言会获得点赞!