一种快速检测猪瘟病毒(CSFV)的RDA方法及试剂盒与流程
35bp保守序列为探针序列,5’端标记发光基团,3’端标记淬灭基团,第5-10位碱基中任一位置用四氢呋喃残基(thf)替代。第二种方案为:探针长度为 46-52 个核甘酸,其中至少 30 个位于 thf 位点的 5’端,另外至少 15 个位于其 3’端。通过系列实验比对,两种探针设计方案均适用于rda荧光检测方法,在检测的灵敏度和特异性上无明显差异。
[0008]
所述核苷酸序列为seq id no .1的探针,其5’端标记发光基团,3’端标记淬灭基团,第5-10位碱基中任一位置用四氢呋喃残基(thf)替代,其具体信息如下:csfv-p1(seq id no .1):5
’-
fam-gaaga[thf]tggcccctatgccgtgcagaccca-bhq1
ꢀ-3′
所述核苷酸序列为seq id no .2的探针,在5’端起第36位碱基t标记fam或者其他发光基团,第37位碱基用四氢呋喃残基(thf)替代,第38位碱基标记bhq1或者其他淬灭基团,3’端进行c3-spacer阻断修饰,其具体信息如下:csfv-p2(seq id no .2):5
’-
gttaaggtgcacgcattggatggaagactggcccc[fam-dt][thf][bhq1-dt]gccgtgcagaccca[c3-spacer]
ꢀ-3’
所述引物对核苷酸序列如seq id no .3和seq id no .4所示,所述靶标序列如seq id no .5所示,其具体信息如下:csfv-f1(seq id no .3): 5
’-
gcactgaaggagaacacgagtgcttgatc
ꢀ-3’
;csfv-r1(seq id no .4): 5
’-
tagttgaaagtgcaggaagttttccttac-3’。
[0009]
本发明另一个目的在于,提供一种基于恒温扩增技术的检测猪瘟病毒的试剂盒。
[0010]
所述试剂盒包括核酸提取试剂、恒温扩增反应模块、阳性对照和阴性对照,以及所述的探针及所述的引物。
[0011]
优选地,所述恒温扩增反应模块为恒温扩增反应混合试剂的冻干粉试剂。
[0012]
优选地,所述恒温扩增反应混合试剂为rpa或重组酶依赖型扩增技术(recombinase-dependent amplification,rda)恒温扩增反应混合试剂。
[0013]
本发明另一个目的在于,提供一种基于重组酶依赖型扩增技术(recombinase-dependent amplification,rda)的检测猪瘟病毒的试剂盒。
[0014]
重组酶依赖型扩增技术(recombinase-dependent amplification,rda)通过以下技术方案实现:本发明利用生物信息学方法,对批量的蛋白结构进行分析模拟和高通量虚拟筛选,并通过大量的生物学实验验证,最终找到了新的稳定性高的重组酶组合。具体地,本发明开发了一种新的重组酶组合为重组酶kx和辅助蛋白ky,所述重组酶kx,其核苷酸序列如seq id no.6所示,氨基酸序列如seq id no.7所示,辅助蛋白ky的核苷酸序列如seq id no.8所示,氨基酸序列如seq id no.9所示。
[0015]
所述重组酶kx可以替代rpa反应中重组酶uvsx或reca使用,所述ky蛋白可以替代rpa反应中uvsy蛋白使用。
[0016]
重组酶kx与t4 uvsx 蛋白序列同源性为50%(201/395)。基于此重组酶组合,本团队开发了一种新的稳定性高、特异性强的重组酶依赖型扩增技术(rda)的检测方法和检测系统。本发明中重组酶kx的制备工艺简单,产量和稳定性大幅提高,量产成本低。且基于此重组酶组合开发的扩增技术,所需引物短(18-30bp),对靶标序列的长度要求低,适用性广。进一步的,该技术对核酸靶标序列的检测特异性好、灵敏度高,可在25-42℃的恒温条件下
ng/μl、单链结合蛋白gp32 100-1000 ng/μl、链置换dna聚合酶3-100 ng/μl、核酸外切酶30~200u、肌酸激酶0.1-0.8 mg/ml、磷酸肌酸25-75 mm、tris缓冲液20-100mm、peg2.5%-10%、醋酸钾或醋酸钠0-150 mm、datp 1-5 mm、dntps 150-600 nm each、dtt 1-12 mm、探针150nm-600nm、引物对150-600nm。
[0031]
优选地,tris-缓冲液为tris-tricine。
[0032]
优选地,tris
-ꢀ
tricine的浓度为100mm。
[0033]
所述核酸提取试剂包括buffer a、buffer b。buffer a为样本裂解液,含有tris-hcl缓冲体系、naoh、sds、edta、异硫氰酸胍、tween80、曲拉通;buffer b含有tris缓冲体系、氯化钾、氯化镁;阳性对照为含有猪瘟病毒(csfv)的靶标基因质粒,阴性对照为空载体puc57质粒。
[0034]
本发明再一个目的在于,提供一种基于重组酶依赖型扩增技术的检测猪瘟病毒的检测方法。
[0035]
所述检测方法包括以下步骤:提取待测样品的提取待测,以待测样品的核酸为模板,在猪瘟病毒的引物对、探针及rda冻干粉试剂、buffer a和buffer b存在下进行实时荧光rda反应,根据实时荧光rda扩增曲线分析待测样品;其中所述探针的核苷酸序列如seq id no .1或seq id no .2所示; 其中反应温度为25-42℃,反应时间大于10分钟。
[0036]
优选的,包含以下步骤:1)样本处理将20μl buffer a和5μl 阳性对照/阴性对照/待检样本(猪口鼻分泌物/血液/组织)震荡混匀,室温静置10-15min;2)体系配制及检测加入25μl buffer b,震荡混匀后将50μl混合液加入rda恒温扩增反应模块中,盖上管盖震荡离心,立即检测;反应程序为:39℃ 1分钟,30个循环,每分钟采集荧光信号,30min完成检测;3)结果判定按反应体系产生的荧光值达到阈值的时间即阈值时间(time threshold,tt)为进行结果判读。
[0037]
①
阳性对照:有典型的扩增曲线出现,tt值<25,为有效结果;
②
阴性对照:无扩增曲线出现,或tt值≥30,为有效结果;
③
被检样本:a.若tt值<25,判断为阳性;b.若tt值≥30,判断为阴性;c.若25≤tt值<30,判为可疑,需重复检测进行确认;再次检测结果仍然是25≤tt值<30,应参照阴性对照tt值,若阴性对照tt值≥30,则判断为阳性。
[0038]
从以上技术方案可以看出,本发明实施例具有以下优点:1、本发明提供的试剂盒可以检猪口鼻分泌物、血液、组织里的猪瘟病毒rna,具有操作简单、快速、灵敏的特点,为猪瘟病毒的快速检测筛查提供有效的技术手段。
[0039]
2、本发明提供的试剂盒采用rda恒温扩增检测方法,在37~42℃条件下均可实现靶基因的有效扩增,不需变温,不需复杂仪器。反应时间短,20-30min即可完成反应,特异性
为100%,检测灵敏度为10 copies/μl。
[0040]
3、本发明rda方法中重组酶kx 蛋白和ky蛋白在扩增过程中对靶标序列具有高度特异性,只有引物和模板序列完全互补才启动扩增,使扩增的特异性大大提高,从而实现无本底背景的高效恒温核酸扩增。
附图说明
[0041]
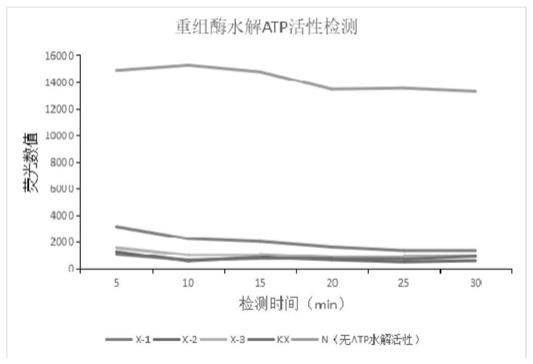
图1为本发明实施例1重组酶筛选中4个蛋白的atp水解活性结果图。
[0042]
图2为本发明实施例1重组酶筛选中 4个蛋白的恒温扩增反应的琼脂糖凝胶图。
[0043]
图3为本发明实施例1中kx蛋白三维结构图。
[0044]
图4为本发明实施例1中ky蛋白七聚体三维结构图。
[0045]
图5为本发明实施例1中rda荧光法检测试剂盒的结果图。
[0046]
图6为本发明实施例2中rda荧光法检测试剂盒灵敏度测试结果图。
[0047]
图7为本发明实施例3中rda荧光法检测试剂盒特异性测试结果图。
[0048]
图8为本发明实施例4中rda荧光法检测试剂盒37度稳定性测试结果图。
[0049]
图9为本发明实施例4中rda荧光法检测试剂盒37度稳定性测试结果图。
[0050]
图10为本发明实施例4中rda荧光法检测试剂盒37度稳定性测试结果图。
[0051]
图11为本发明实施例4中rda荧光法检测试剂盒37度稳定性测试结果图。
具体实施方式
[0052]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。对于本领域技术人员来说,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
[0053]
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为市购。
[0054]
除非另有说明,本发明采用的免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna等是本领域的常规技能。参见萨姆布鲁克( sambrook )、弗里奇( fritsch )和马尼亚蒂斯( maniatis ),《分子克隆:实验室手册》( molecμlar cloning:a laboratory manual ),第2次编辑( 1989 );《当代分子生物学实验手册》( current protocols in molecμlar biology )( f .m .奥苏贝尔( f .m .ausubel )等人编辑,( 1987 ));《酶学方法》( methods in enzymology )系列(学术出版公司):《pcr2:实用方法》( pcr 2:a practical approach )( m .j .麦克弗森( m .j .macpherson )、b .d .黑姆斯( b .d .hames )和g .r .泰勒( g .r .taylor )编辑( 1995 ))、哈洛( harlow )和拉内( lane )编辑( 1988 )《抗体:实验室手册》( antibodies ,a laboratory manual ),以及《动物细胞培养》( animal cell cμlture )(r .i .弗雷谢尼(r .i .freshney )编辑(1987 ))。
[0055]
实施例1 一种猪瘟病毒(csfv)的rda荧光法检测试剂盒(1)重组酶kx和ky蛋白的获取已报道的重组酶uvsx稳定性差,难以量产和长期保存,为了解决这一问题,本研发团队
利用生物信息学方法,通过对大批量的蛋白结构进行分析模拟,最终找到了一种新的重组酶kx及其辅助蛋白ky。
[0056]
在本实施例中,研发团队通过提取重组酶结构中的关键功能位点信息,如dna结合位点、atp水解位点等,映射到蛋白质三维空间结构,获取二级结构信息和三级结构信息,通过综合一级结构序列的功能残基、二级结构特征和三级结构空间距离,构建了一个用于重组酶蛋白结构筛选的数据模型。通过从swissprot、pdb数据查找在一级结构与重组酶蛋白匹配的模板,初步筛选出312个蛋白序列,然后分别进行二级结构和三级结构比对,计算相似性分值,根据相似性评分排名,模拟筛选出了15个疑似有重组酶活性的蛋白。
[0057]
将这15个蛋白分别构建重组蛋白表达载体,分别表达纯化后,检测其水解atp的能力,其中有4个蛋白有atp水解活性,分别为kx、x-1、x-2、x-3蛋白。实验中使用萤火虫荧光素酶 atp 生物发光检测试剂盒,严格按照说明书的操作进行实验,结果如图1所示。
[0058]
将有atp水解活性4个蛋白配制成恒温扩增体系进行扩增反应,结果如图2所示,n为阴性对照,p为加入t4uvsx扩增的阳性对照,1~4分别加入的蛋白为kx、x-1、x-2、x-3,其中只有kx蛋白有扩增活性。kx蛋白源自escherichia phage pht4a噬菌体,其三维结构图如图3所示。
[0059]
以同样的方法,我们筛选出了重组酶kx源自escherichia phage pht4a噬菌体的辅助蛋白ky,其三维结构图如图4所示。其中辅助蛋白ky需以七聚体的形式发挥活性作用。
[0060]
最终获得用于rda扩增的重组酶kx,其核苷酸序列如seq id no.6所示,氨基酸序列如seq id no.7所示;重组酶ky,其核苷酸序列如seq id no.8所示,氨基酸序列如seq id no.9所示。
[0061]
(2)猪瘟病毒检测引物及探针设计与筛选通过ncbi(www.ncbi.nlm.nih.gov)查找猪瘟病毒全基因序列,使用clone manager软件和blast进行同源性比对和序列分析,从中选择在本病原的种内保守,种间变异的序列做为靶标区域。经过对多种猪瘟病毒的全基因组序列比对和同源性分析后,最终选择保守的e2基因作为靶标基因(参考序列genbank登录号:mh880912.1),以此目的片段进行rda检测引物和探针设计。委托上海捷瑞生物工程有限公司合成靶标基因dna质粒,引物和探针序列。筛选出猪瘟病毒e2基因高度保守序列如下:5
’-
gcactgaaggagaacacgagtgcttgatcggcaacaccaccgttaaggtgcacgcattggatggaagactggcccctatgccgtgcagacccaaagaaatcatctctagtgcgggacctgtaaggaaaacttcctgcactttcaacta-3’(seq id no .5)本实施例中采用rda技术引物设计原则进行设计,上游引物和下游引物长度18-30bp,根据猪瘟病毒e2基因保守序列,设计上游引物和下游引物各3条,引物序列如下:上游引物csfv-f1:5
’-
gcactgaaggagaacacgagtgcttgatc
ꢀ-3’
上游引物csfv-f2:5
’-
actgaaggagaacacgagtgcttgatcggc
ꢀ-3’
上游引物csfv-f3:5
’-
gagaacacgagtgcttgatcggcaacacca-3’下游引物csfv-r1:5
’-ꢀ
tagttgaaagtgcaggaagttttccttac-3’下游引物csfv-r2: 5
’-
ccttacaggtcccgcactagagatg-3’下游引物csfv-r3:5
’-
gtgcaggaagttttccttacaggtcccgc-3’3对引物两两配对形成9个组合进行最佳引物组合筛选。
[0062]
组合1:csfv-f1和csfv-r1;组合2:csfv-f1和csfv-r2 组合3:csfv-f1和csfv-r3组合4:csfv-f2和csfv-r1;组合5:csfv-f2和csfv-r2 组合6:csfv-f2和csfv-r3组合7:csfv-f3和csfv-r1;组合8:csfv-f3和csfv-r2 组合9:csfv-f3和csfv-r3通过一系列的实验筛选和评价,确定组合1(csfv-f1和csfv-r1) 为最佳引物组,具体为:csfv-f1(seq id no .3): 5
’-
gcactgaaggagaacacgagtgcttgatc
ꢀ-3’
;csfv-r1(seq id no .4): 5
’-
tagttgaaagtgcaggaagttttccttac-3’。
[0063]
在rda荧光检测技术中,我们采用两种方案设计rda荧光标记探针,第一种方案如下:在靶标区域选择25-35bp保守序列为探针序列,5’端标记发光基团,3’端标记淬灭基团,第5-10位碱基中任一位置用四氢呋喃残基(thf)替代,本实施例中所述核苷酸序列为seq id no .1的探针,其5’端标记发光基团,3’端标记淬灭基团,第5位碱基中任一位置用四氢呋喃残基(thf)替代,其具体信息如下:csfv-p1(seq id no .1):5
’-
fam-gaaga[thf]tggcccctatgccgtgcagaccca-bhq1
ꢀ-3′
第二种方案为:探针长度为 46-52 个核甘酸,其中至少 30 个位于 thf 位点的 5’端,另外至少 15 个位于其 3’端。本实施例中所述核苷酸序列为seq id no .2的探针,其5’端起第36位碱基t标记fam或者其他发光基团,第37位碱基用四氢呋喃残基(thf)替代,第38位碱基标记bhq1或者其他淬灭基团,3’端进行c3-spacer阻断修饰,其具体信息如下:csfv-p2(seq id no .2):5
’-
gttaaggtgcacgcattggatggaagactggcccc[fam-dt][thf][bhq1-dt]gccgtgcagaccca[c3-spacer]
ꢀ-3’
通过系列实验比对,两种探针设计方案均适用于rda荧光检测方法,在检测的灵敏度和特异性上无明显差异,其中第一种探针设计时所需靶标保守序列较短,对核酸序列要求低,本专利后续的实施例,以第一种探针csfv-p1(seq id no .1)为检测探针,配制rda恒温扩增反应体系。
[0064]
(3)一种猪瘟病毒(csfv)rda检测方法的建立本专利构建一种基于重组酶依赖型扩增技术(rda)检测猪瘟病毒(csfv)的试剂盒,包括核酸提取试剂,rda恒温扩增反应模块,阳性对照和阴性对照,其中核酸提取试剂包括buffer a和buffer b, buffer a为样本裂解液,含有tris-hcl缓冲体系、naoh、sds、edta、异硫氰酸胍、tween80、曲拉通,buffer b含有tris缓冲体系、氯化钾、氯化镁;rda恒温扩增反应模块中反应体系最优配比如表1所示,包含了本实施例所述的荧光标记探针及所述的引物;阳性对照为含有猪瘟病毒(csfv)的靶标基因质粒,阴性对照为空载体puc57质粒。
[0065]
表1 rda恒温扩增反应模块反应体系配比序号组分终浓度1tris-tricine(ph7.9)100mm2醋酸钾50mm3peg20000或peg350005%4dtt2mm5dntps200nmeach
6datp2mm7反转录酶200u8肌酸激酶(creatinekinase)0.2mg/ml9磷酸肌酸(creatinephosphate)50mm10链置换dna聚合酶50ng/ul11gp32蛋白300ng/ul12重组酶kx120ng/ul13辅助蛋白ky60ng/ul14核酸外切酶50u15上游引物500nm16下游引物500nm17荧光标记探针300nm18醋酸镁14mm所述反应体系的反应条件为:25-42℃下反应10-60min。
[0066]
最佳反应条件为:39℃反应30min。
[0067]
本实施例中对收集的经荧光定量pcr验证为猪瘟病毒(csfv)rna阳性的3例拭子或分泌物样本,使用本专利的rda荧光法检测试剂盒测试。
[0068]
具体操作如下:步骤一、样本处理。将20μl buffer a和5μl 阳性对照/阴性对照/待检分泌物样本震荡混匀,室温静置10-15min;步骤二、体系配制及检测。加入25μl buffer b,震荡混匀后将50μl混合液加入rda荧光法反应模块中,盖上管盖震荡离心,立即检测;反应程序为:39℃ 1分钟,30个循环,每分钟采集荧光信号,30min可完成检测;步骤三、结果判定。
[0069]
①
阳性对照:有典型的扩增曲线出现,tt值<25,为有效结果;
②
阴性对照:无扩增曲线出现,或tt值≥30,为有效结果;
③
被检样本:a.若tt值 < 25,判断为阳性;b.若tt值≥30,判断为阴性;c.若25≤tt值<30,判为可疑,需重复检测进行确认;再次检测结果仍然是25≤tt值<30,应参照阴性对照tt值,若阴性对照tt值≥30,则判断为阳性。
[0070]
检测结果如表2和图5所示,阳性对照、阴性对照符合
“①
阳性对照:有典型的扩增曲线出现,tt值<25,为有效结果;
②
阴性对照:无扩增曲线出现,或tt值≥25,为有效结果”的内容,各样本的tt值均小于25,判断为阳性。
[0071]
表2 试剂盒检测方法的建立 阴性对照阳性对照样本1样本2样本3tt值-8.0611.9324.8920.67结果表明,本实施例建立的rda荧光法检测试剂盒的检测方法能够对猪分泌物中的猪瘟病毒(csfv)rna进行检测。
[0072]
实施例2 rda荧光法检测试剂灵敏度测试阳性对照为含有猪瘟病毒(csfv)保守基因的puc57-e2质粒,阴性对照为空载体puc57质粒。
[0073]
具体操作如下:步骤一、将阳性对照质粒稀释到10^4c,再10倍梯度稀释分别稀释成10^3c、10^2c、10^1c。
[0074]
步骤二、样本处理。将步骤一各浓度的质粒各取5μl在ep管中,同时取阴性对照5μl在另一ep管中,分别加入20μl buffer a,震荡混匀,室温静置10-15min;步骤三、体系配制及检测。各管加入25μl buffer b,震荡混匀后将50μl混合液加入rda荧光法反应模块中,盖上管盖震荡离心,立即检测;反应程序为:39℃ 1分钟,30个循环,每分钟采集荧光信号;步骤四、结果判定。判定标准:
①
阳性对照:有典型的扩增曲线出现,tt值< 25,为有效结果;
②
阴性对照:无扩增曲线出现,或者tt值≥ 25,为有效结果;
③
被检样本:a.若tt值< 25,判断为阳性;b.若tt值≥30,判断为阴性;c.若25≤tt值<30,判为可疑,需重复检测进行确认;再次检测结果仍然是25≤tt值<30,应参照阴性对照tt值,若阴性对照tt值≥30,则判断为阳性。
[0075]
结果如表3和图6所示。阴性对照tt值为na,符合判定标准中“无扩增曲线出现,或tt值 ≥ 25”的内容。10^4c、10^3c、10^2c、10^1c的tt值均 < 25min,根据结果判定标准,10^4c、10^3c、10^2c、10^1c结果均为阳性。
[0076]
即,rda荧光法检测试剂盒的灵敏度达到10个拷贝。
[0077]
表3 灵敏度测试结果 阴性对照10^410^310^210^1tt值-8.0611.9324.8925.03实施例3 rda荧光法检测试剂特异性测试将临床上收集1例猪伪狂犬病毒(prv)、1例猪圆环病毒(pcv)、1例猪细小病毒(ppv)、3例猪瘟病毒(cfsv),4种共6例经荧光定量pcr验证为对应病原体阳性的样本进行检测,检验试剂盒的特异性。
[0078]
具体操作如下:步骤一、样本处理。将以上6例阳性样本各取5μl在ep管中,同时取试剂盒的阳性对照、阴性对照各5μl在新的ep管中,分别加入20μl buffer a,震荡混匀,室温静置10-15min;步骤三、体系配制及检测。各管加入25μl buffer b,震荡混匀后将50 μl混合液加入rda荧光法反应模块中,盖上管盖震荡离心,立即检测;反应程序为:39 ℃ 60秒,30个循环,每60秒采集荧光信号;步骤四、结果判定。判定标准:
①
阳性对照:有典型的扩增曲线出现,tt值< 25,为有效结果;
②
阴性对照:无扩增曲线出现,或者tt值 ≥ 25,为有效结果;
③
被检样本:a.若tt值< 25,判断为阳性;b.若tt值≥30,判断为阴性;c.若25≤tt值<30,判为可疑,需重复检测进行确认;再次检测结果仍然是25≤tt值<30,应参照阴性对照tt值,若阴性对照tt值≥30,则判断为阳性。
[0079]
结果如表4和图7所示。阳性对照、阴性对照符合
“①
阳性对照:有典型的扩增曲线出现,tt值<25,为有效结果;
②
阴性对照:无扩增曲线出现,或tt值≥25,为有效结果”的内容。对应样本的tt值均小于25,判断为阳性; tt≥30或没有检测到信号,判定为阴性。
[0080]
结果证明,本方法及本方法所含试剂盒有优秀的特异性。
[0081]
表4 特异性测试结果实施例4 rda荧光法检测试剂盒稳定性测试液态的试剂需在低温下保存,且不能反复冻融。本试剂盒将rda荧光法反应模块在真空干燥成粉状试剂,冻干后的粉状试剂能在常温下保存,节约了冷链运输和低温保存的成本,操作更为简易。本实施例对rda 荧光检测试剂盒的稳定性进行验证。
[0082]
具体操作如下:将含有冻干试剂的八连管密封于含有干燥剂的铝箔袋中,保存于37℃恒温箱。分别于0天、30天、90天、180天,取2个反应孔进行测试。
[0083]
步骤一、样本处理。试剂盒的阳性对照/阴性对照各取5μl在ep管中,分别加入20μl buffer a,震荡混匀,室温静置10-15min;步骤二、体系配制及检测。各管加入25μl buffer b,震荡混匀后将50 μl混合液加入rda荧光法反应模块中,盖上管盖震荡离心,立即检测;反应程序为:39 ℃ 60秒,30个循环,每60秒采集荧光信号;步骤三、结果判定。判定标准:
①
阳性对照:有典型的扩增曲线出现,tt值< 25,为有效结果;
②
阴性对照:无扩增曲线出现,或者tt值≥ 25,为有效结果;
③
被检样本:a.若tt值< 25,判断为阳性;b.若tt值≥30,判断为阴性;c.若25≤tt值<30,判为可疑,需重复检测进行确认;再次检测结果仍然是25≤tt值<30,应参照阴性对照tt值,若阴性对照tt值≥30,则判断为阳性。
[0084]
结果如表5和图8、图9、图10、图11所示。分别对保存了0天、30天、90天、180天的rda荧光法反应模块试剂冻干粉进行测试,各个tt值均小于25,根据结果判定标准,本专利的试剂盒中试剂冻干后,在0天、30天、90天、180天的检测结果均为阳性。表明本专利的试剂盒中
试剂冻干后,在37℃中能稳定保存至少3个月。
[0085]
表5 37℃保存稳定性 0天30天90天180天阴性对照
----
阳性对照9.4510.2611.6512.03以上所述仅为本发明的较佳实施范例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1