用于检测丙型流感和丁型流感的双重TaqManqPCR检测方法与流程
本发明属于分子检测技术领域,具体涉及一种用于检测丙型流感病毒和丁型流感病毒的双重taqman探针qpcr检测方法。
背景技术:
流行性感冒病毒(influenzavirus)根据核蛋白和机制蛋白的抗原性不同分为甲(a)、乙(b)、丙(c)、丁(d)四型,其中甲型流感病毒(influenzaavirus,iav)在人与猪之间或禽类与猪之间的传播已使其在猪群中出现了几个自主循环的谱系,其在全世界家猪群体中广泛传播,由于iav可引起急性呼吸道疾病,且临床上会出现病毒和细菌混合感染的现象,进一步加剧患病动物的临床症状,对畜牧业产生巨大的经济损失。
丙型流感病毒(influenzacvirus,icv)首先在人和猪中被发现,最近也在牛群中发现。已有研究提示icv在人与猪间存在种间传播,其跨宿主传播能力以及更广的宿主范围使其对畜牧业和公共卫生的潜在威胁可能会超出我们的预期。
丁型流感病毒(influenzadvirus,idv)首先在猪群中发现,后续研究认为牛是其天然宿主,并在牛场工人体内检测到血清学阳性。同时idv能够在雪貂和豚鼠之间复制和传播,而雪貂是人类流感病毒感染的模型。值得注意的是idv表现出比icv更广泛的细胞和宿主趋向,并其内部基因存在不断重配。这些研究表明其拥有跨宿主传播和成为人畜共患病的潜力。
icv与idv的同源性约为50%,但并无抗体交叉性,两者在全球广泛传播,都可感染主要的畜牧动物牛和猪。并且icv可感染人,idv抗体阳性也在人体内检测到,两者都具有成为人畜共患病原的潜力,对畜牧业和公共卫生具有极大的潜在威胁,但是目前对两种病毒的监测和研究仍较少,所以建立一种针对icv和idv的简便、高效、经济的双重检测方法,用以对猪和人类进行病毒检测和预防监测。
qpcr检测技术相比于普通pcr检测具有灵敏度高、精确度好、耗时短、无需电泳便可直接分析结果等优点,开发双重qpcr检测方法能够极大地缩短了检测过程中的物料成本和检测人员的时间成本,尤其适用于大规模的样品检测和混合感染的样品检测,在临床监测中有巨大优势。但是,由于双重qpcr在一个体系中同时存在两对引物及探针,为了保证其有效进行,两对引物和探针之间就必须要保持高度的特异性以避免出现非特异性的扩增产物和荧光信号,并且还必须要保持相对一致的扩增效率以便于对模板量进行测算。另外,模板中更为复杂的核酸环境,不同引物对所要求的不同的退火温度也都是制约双重qpcr检测方法建立的重要因素。所以,建立一种双重taqman探针法qpcr检测方法具有很高的研究和临床实用价值,但实现起来颇具难度。
技术实现要素:
解决的技术问题:针对现有技术中缺少用于检测丙型流感病毒(icv)和丁型流感病毒(idv)的双重检测方法这一技术问题,本发明提供了一种用于检测丙型流感病毒和丁型流感病毒的双重taqman探针qpcr检测方法。
技术方案:
用于检测丙型流感病毒和丁型流感病毒的qpcr引物组,包括用于检测丙型流感病毒的引物对及taqman探针、用于检测丁型流感病毒的引物对及taqman探针,具体地:
所述用于检测丙型流感病毒的引物对及taqman探针的核苷酸序列如下所示:
icv-np(f):5’-aagagccatgcaaggaattga-3’
icv-np(r):5’-tctgcgatgacatttagagcttc-3’
icv-np-probe:5’-vic-aaagcgtttcctggacctttaa-mgb-3’;
所述用于检测丁型流感病毒的引物对及taqman探针的核苷酸序列如下所示:
idv-pb1(f):5’-ccctcctacaggaacagagttttc-3’
idv-pb1(r):5’-gcgttgatacaactgcctcg-3’
idv-pb1-probe:5’-fam-aggaacccctttacacagtttgagaagacag-bhq1-3’。
一种用于检测丙型流感病毒和丁型流感病毒的qpcr试剂盒,包含上述qpcr引物组。
进一步地,上述试剂盒还包括反转录试剂和qpcrmix。
一种用于检测丙型流感病毒和丁型流感病毒的双重taqman探针qpcr检测方法,包括以下步骤:
步骤1,获取待检样品的cdna:提取鼻咽拭子样品或呼吸道组织病料的总rna,反转录为cdna模板;
步骤2,使用2对qpcr引物和taqman探针进行检测:将上述引物对和taqman探针置于qpcr反应体系中,以步骤1中获得的cdna作为模板,进行pcr扩增,收集荧光信号;
步骤3,根据机器测算的荧光信号及cq值判断样品中是否有icv(vic)、idv(fam),cq值大于35的结果判断为阴性。
进一步地,步骤1中反转录使用revertaidfirststrandcdnasynthesiskit进行,其反应总体系为20μl,包括:1μlrandomhexamerprimer、1μloligo(dt)18primer、5μlnuclease-freewater、5μl总rna,混匀后65℃孵育5min,冰浴3min,继续加入:4μl5×reactionbuffer、2μl10×dntp预混液、1μlrevertaidm-mulvreversetranscriptase(rt)和1μlribolockrnaseinhibitor(ri)。
进一步地,步骤1中反转录的反应程序为:25℃5min,42℃60min,70℃5min,反应后得到cdna模板。
进一步地,步骤2中qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl。其中各条引物浓度和探针浓度均为10μm,体系总体积为20μl。
进一步地,步骤2中pcr扩增的反应程序设置为:荧光通道设置为:通道1:fam,通道2:vic;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,同时以荧光定量pcr仪器收集荧光信号。
有益效果:与现有技术相比,本发明具有以下技术效果:
1、最多能够在一个pcr反应管中同时检测出icv和idv,为这两种流感病毒的检测提供了一种简便、高效和经济的方法;
2、本发明利用建立的双重taqman探针法qpcr检测方法对各靶标病毒阳性样品进行检测,检测结果与单一的qpcr检测结果一致,进一步证明了本发明方法的可行性。同时经过验证得知,本申请对每一种病原的检测灵敏度能够达到初始模板浓度为每微升1×101个拷贝(copies/μl),同时具有极佳的特异性和重复性;
3、本发明中检测方法的建立,为该类病的防控提供了可靠依据,从而很大程度上降低了单重qpcr检测的工作量,工作效率得到了大幅度地提升;
4、本发明中建立的检测方法重复性,灵敏性较高,可直接用于临床检测,通过对icv和idv的快速高效检测,从而同时对这两种流感病毒进行诊断和监控。
附图说明
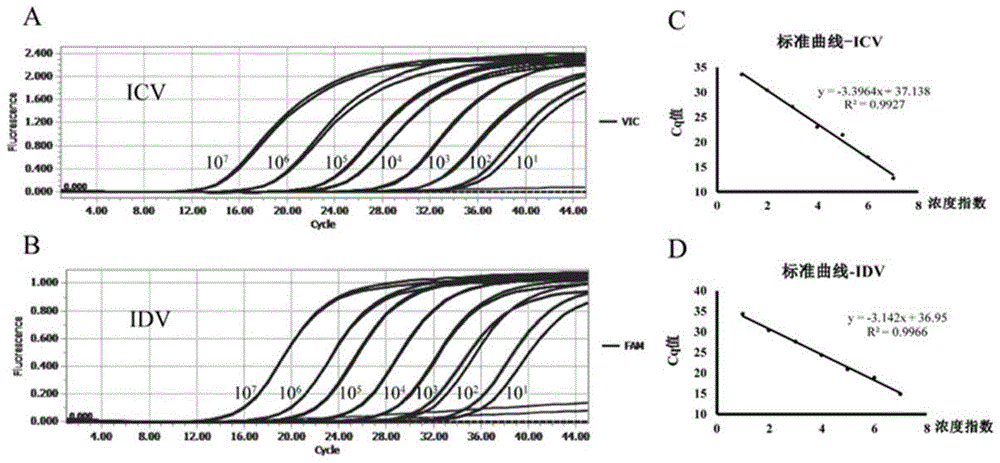
图1为实施例1中双重taqmanqpcr检测方法的标准品和标准曲线的制备。图a-b分别为icv、idv的质粒标准品由1×107copies/μl-1×101copies/μl7个浓度梯度的荧光扩增曲线,图c-d分别为icv、idv的标准品稀释的标准曲线。
图2为实施例1中双重taqmanqpcr检测方法检测单种病原的灵敏性试验结果图。图a-b分别为icv-np、idv-pb1的质粒标准品由最高浓度1×107copies/μl10倍梯度检测的结果图。
图3为实施例1中双重taqmanqpcr检测方法大量重复检测单种病原的低浓度标准品(1×102copies/μl,1×101copies/μl和1×100copies/μl)的结果。图a-c分别代表icv、idv的1×102copies/μl、1×101copies/μl和1×100copies/μl质粒标准品大量重复单种病原检测的结果图。
图4为实施例1中双重taqmanqpcr检测方法最适合反应体系探索试验结果图。图a-b分别代表当不同引物浓度和探针组成的双重体系同时检测icv的浓度为1×107copies/μl的标准品质粒和idv的浓度为1×101copies/μl的标准品质粒荧光强度结果图。
图5为实施例1中两种病原同浓度共感染模拟试验结果图。图a-g为标准品质粒从1×107copies/μl到1×101copies/μl共7个梯度浓度的共感染模拟结果图。
图6为实施例1中两种病原不同浓度共感染模拟试验结果图。图a为idv的1×107copies/μl标准品质粒和icv的1×101copies/μl标准品质粒的共感染模拟结果图,图b为icv的1×107copies/μl标准品质粒和idv的1×101copies/μl标准品质粒的共感染模拟结果图。
图7为实施例1中特异性试验结果图。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
以下实施例中所采用的icv和idv的质粒载体购自宝生物工程(大连)有限公司(pmd18-t载体),其对应的重组质粒标准品由本实验室连接制备而成。
实施例1
检测方法的构建及验证
(1)对目前已有的所有icv的np基因和idv的pb1基因序列分别进行序列比对;
(2)使用软件oligo7.0辅助针对icvnp基因和idvpb1基因的保守区域进行引物与探针的设计;
(3)将设计完成的多对引物与探针序列交由生物公司进行合成;
(4)使用每一对引物和探针对相同的质粒标准品进行taqman荧光定量检测和sybrgreen荧光定量检测;
(5)挑选出扩增效率最高以及产物特异性最高的那一对引物和探针进行后续实验。
具体序列如下:
用于检测丙型流感病毒的引物对及taqman探针的核苷酸序列如下所示:
icv-np(f):5’-aagagccatgcaaggaattga-3’(seqidno.1)
icv-np(r):5’-tctgcgatgacatttagagcttc-3’(seqidno.2)
icv-np-probe:5’-vic-aaagcgtttcctggacctttaa-mgb-3’(seqidno.3)
用于检测丁型流感病毒的引物对及taqman探针的核苷酸序列如下所示:
idv-pb1(f):5’-ccctcctacaggaacagagttttc-3’(seqidno.4)
idv-pb1(r):5’-gcgttgatacaactgcctcg-3’(seqidno.5)
idv-pb1-probe:5’-fam-aggaacccctttacacagtttgagaagacag-bhq1-3’(seqidno.6)
1、标准曲线的建立
(1)制备稀释倍数为10倍、浓度为1×107copies/μl-1×101copies/μl的icv和idv的质粒标准品;
(2)将上述质粒标准品置入qpcr反应体系,使用上述引物与探针,进行pcr扩增,收集荧光信号;
(3)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl;
(4)qpcr反应程序:荧光通道设置为:对icv进行qpcr时通道为vic,对idv进行qpcr时通道为fam;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号;
(5)得到icv、idv的质粒标准品由1×107copies/μl-1×101copies/μl7个浓度梯度的荧光扩增曲线和icv、idv的标准品稀释的标准曲线。
如图1所示,图a和图b分别为icv、idv的质粒标准品由1×107copies/μl-1×101copies/μl7个浓度梯度的荧光扩增曲线,图c-d分别为icv、idv的标准品稀释的标准曲线。由此可知,用于测试本发明检测方法的质粒标准品已经成功建立,从而说明本发明检测方法数据的可靠性。
2、灵敏度试验
(1)制备稀释倍数为10倍、浓度为1×107copies/μl-1×101copies/μl的icv和idv的质粒标准品;
(2)将上述质粒标准品置入qpcr反应体系,使用上述引物与探针,进行pcr扩增,收集荧光信号;
(3)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl;
(4)qpcr反应程序:荧光通道设置为:对icv进行qpcr时通道为vic,对idv进行qpcr时通道为fam;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号;
(5)得到icv、idv的质粒标准品由1×107copies/μl-1×101copies/μl7个浓度梯度的荧光扩增曲线,得到浓度为1×101copies/μl的质粒扩增的cq值已接近35;
(6)制备浓度为1×100copies/μl的icv和idv的质粒标准品;
(7)将1×102copies/μl,1×101copies/μl,1×100copies/μl三个浓度的质粒标准品置入qpcr反应体系中,设置15个相同体系进行重复试验,使用上述引物与探针,进行pcr扩增,收集荧光信号;
(8)统计1×102copies/μl,1×101copies/μl,1×100copies/μl三个浓度的icv和idv的质粒标准品的qpcr结果阳性率,满足95%以上阳性率的质粒标准品浓度认为是该检测方法的最低可检测浓度。
表1双重taqmanqpcr检测方法检测单种病原的灵敏性试验结果
a
b
表1中a为icv、idv的质粒标准品由最高浓度1×107copies/μl10倍梯度检测的结果cq值,ntc为阴性对照孔,nd指判定为检测阴性。b为双重taqmanqpcr检测方法大量重复检测单种病原的低浓度标准品(1×102copies/μl,1×101copies/μl和1×100copies/μl)的结果,并将其阳性检出率参照95%阳性检出率进行对比。
图2为icv-np、idv-pb1的质粒标准品由最高浓度1×107copies/μl10倍梯度检测的结果。
图3为icv、idv的1×102copies/μl、1×101copies/μl和1×100copies/μl质粒标准品大量重复单种病原检测的结果。
由图2、图3和表1可知,本发明的双重qpcr检测方法在检测单种病原时灵敏度在检测1×101copies/μl标准品浓度时较为稳定。
3、最适合反应体系探索
(1)使用浓度为1×107copies/μl的icv质粒标准品和浓度为1×101copies/μl的idv质粒标准品,置入qpcr反应体系,每个体系使用不同浓度的引物,进行pcr扩增,收集荧光信号;
(2)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)分别加入0.2μl、0.25μl、0.3μl、0.35μl、0.4μl、0.45μl、0.5μl、0.55μl、0.6μl;
(3)qpcr反应程序:荧光通道设置为:通道1:fam,通道2:vic;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号;
(4)得到1×107copies/μl的icv质粒标准品和浓度为1×101copies/μl的idv质粒标准品在不同引物浓度体系中的荧光扩增曲线,找到cq值最低的体系,该体系中的引物浓度则为本发明的最佳引物浓度。
表2双重taqmanqpcr检测方法最适合反应体系探索
表2为不同引物组成的双重体系同时检测icv的浓度为1×107copies/μl的标准品质粒和idv的浓度为1×101copies/μl的标准品质粒的cq值结果。
表3双重taqmanqpcr检测方法最适合反应体系探索试验结果
由图4和表2、表3可知,采用不同组合的引物浓度进行试验,当探针终浓度为200nm,引物终浓度为800nm时该多重qpcr反应的荧光强度最高,且cq值也相对最低。
4、共感染检测模拟
(1)制备稀释倍数为10倍,浓度为1×107copies/μl-1×101copies/μl的icv和idv的质粒标准品;
(2)将相同浓度的icv和idv质粒标准品置于qpcr体系中,使用上述引物及探针,进行pcr扩增,收集荧光信号;
(3)将idv的1×107copies/μl质粒标准品和icv的1×101copies/μl质粒标准品置于qpcr体系中,使用上述引物及探针,进行pcr扩增,收集荧光信号;
(4)将icv的1×107copies/μl质粒标准品和idv的1×101copies/μl质粒标准品置于qpcr体系中,使用上述引物及探针,进行pcr扩增,收集荧光信号;
(5)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl;
(6)qpcr反应程序:荧光通道设置为:通道1:fam,通道2:vic;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号;
图5为两种病原同浓度共感染模拟试验结果图。图a-g为标准品质粒从1×107copies/μl到1×101copies/μl共7个梯度浓度的共感染模拟结果图。
图6两种病原不同浓度共感染模拟试验结果图。图a为idv的1×107copies/μl标准品质粒和icv的1×101copies/μl标准品质粒的共感染模拟结果图;图b为icv的1×107copies/μl标准品质粒和idv的1×101copies/μl标准品质粒的共感染模拟结果图。
由图5和图6可知,用本发明的双重检测方法检测最低浓度下的2重感染,结果均正常,说明本发明的方法完全可以用于共感染检测当中。
5、特异性试验
(1)使用rt-pcr检测pcv2、pcv3、jev、csfv、iav、ttsuv1、ttsuv2、prrsv阳性的临床样品;
(2)使用单重qpcr检测icv和idv质粒标准品,进行pcr扩增,收集荧光信号;
(3)将pcv2、pcv3、jev、csfv、iav、ttsuv1、ttsuv2、prrsv阳性的临床样品以及icv和idv质粒标准品分别置于双重qpcr体系中,使用上述引物及探针,进行pcr扩增,收集荧光信号;
(4)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl;
(5)qpcr反应程序:荧光通道设置为:通道1:fam,通道2:vic;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号。
表4特异性试验结果
由上表可知,本发明的双重taqmanqpcr检测方法同时检测pcv2、pcv3、jev、csfv、iav、ttsuv1、ttsuv2、prrsv的阳性临床样品,结果显示只有目标样品icv、idv被检测出阳性。
由图7和表4可知,用本发明的检测方法同时检测多种呼吸道疾病的病原,发现只有目标病原被正常检出,其他呼吸道疾病病原均不能被检出,说明本发明的检测方法具有很好的特异性。
6、稳定性
(1)制备稀释倍数为10倍,浓度为1×107copies/μl-1×101copies/μl的icv和idv的质粒标准品;
(2)将相同浓度的质粒标准品置入双重qpcr反应体系,使用上述引物与探针,进行pcr扩增,收集荧光信号,每次设置3个相同的体系作为重复,共进行三次重复实验;
(3)qpcr反应体系为:10μl2×aceqqpcrprobemastermix,icv-np(f)、icv-np(r)、idv-pb1(f)、idv-pb1(r)各0.2μl,icv-np-probe、idv-pb1-probe各0.1μl,cdna模板2μl,ddh2o加至体系总体积为20μl;
(4)qpcr反应程序:荧光通道设置为:通道1:fam,通道2:vic;温控程序设置为:95℃预变性10min;[95℃变性10s,55℃退火10s,72℃延伸20s]45个循环,以荧光定量pcr仪器收集荧光信号;
(5)得到1×107copies/μl-1×101copies/μl7个浓度梯度的icv、idv的质粒标准品双重qpcr荧光扩增曲线;
(6)计算三次重复实验中1×107copies/μl-1×101copies/μl7个浓度梯度的icv、idv质粒标准品扩增cq值的变异系数,判断该检测方法的稳定性。
表5分别用双重taqmanqpcr检测方法同时检测icv、idv
由上表可知,各个浓度梯度的变异系数(cv值)均小于2%,说明本发明的检测方法具有高稳定性。
序列表
<110>南京农业大学
<120>用于检测丙型流感和丁型流感的双重taqmanqpcr检测方法
<130>20200220
<160>6
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
aagagccatgcaaggaattga21
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>2
tctgcgatgacatttagagcttc23
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
aaagcgtttcctggacctttaa22
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
ccctcctacaggaacagagttttc24
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcgttgatacaactgcctcg20
<210>6
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>6
aggaacccctttacacagtttgagaagacag31
- 还没有人留言评论。精彩留言会获得点赞!