丙酮酸羧化酶作为毛兰素靶点蛋白的应用的制作方法
本发明属于生物医药技术领域,具体涉及丙酮酸羧化酶作为毛兰素靶点蛋白的应用。
背景技术:
丙酮酸羧化酶(pc)是生物素依赖性酶家族的成员。天然哺乳动物的丙酮酸羧化酶是由四个相同的亚基组成的四聚体,每个亚基具有1178个氨基酸(129kda)。丙酮酸羧化酶通过两步反应催化丙酮酸转化为草酰乙酸,这是重要的线粒体回补途径。tca循环中间体可用于生物合成,例如,柠檬酸盐用作乙酰基供体,用于从头脂肪酸或胆固醇合成;草酰乙酸也用作天冬氨酸生产的底物;而α-酮戊二酸可直接转化为谷氨酸。因此,丙酮酸羧化将确保生物合成旺盛的细胞中这些底物的可用性。研究发现,沉默pc表达将影响多种肿瘤细胞的增殖和小鼠模型中肿瘤的生长,而pc表达的上调会使癌细胞对谷氨酰胺饥饿处理更具抗性;pc也是β细胞葡萄糖传感系统的一部分,抑制胰岛素瘤细胞中的pc表达会削弱葡萄糖诱导的胰岛素释放;而病毒感染和复制也需要宿主pc的支持,抑制宿主细胞中的pc表达会显著抑制hsv1病毒的复制。
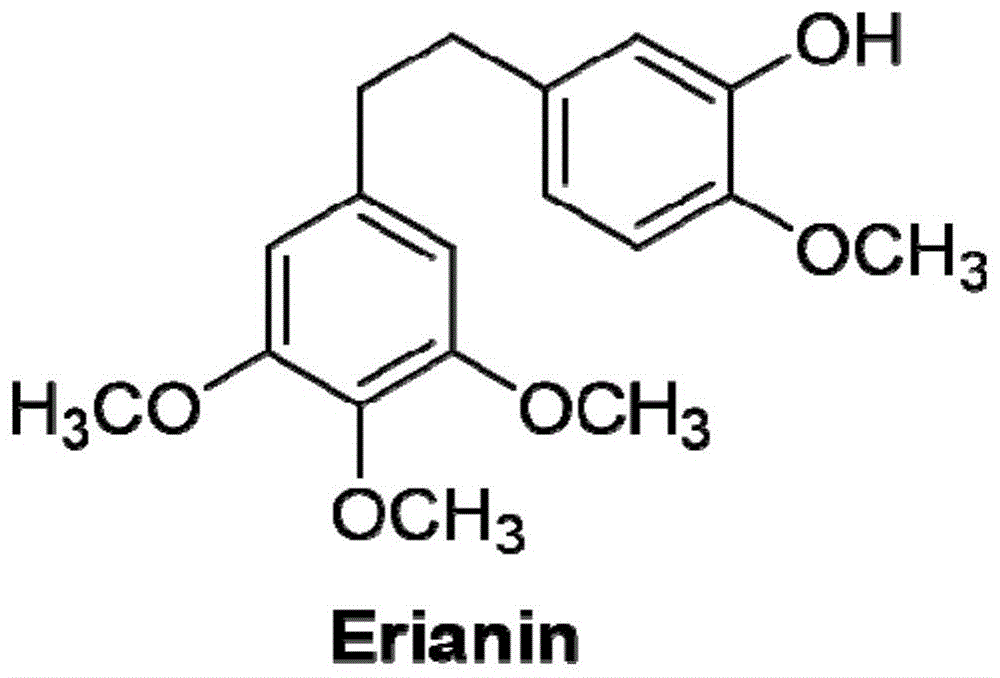
毛兰素(erianin)是一种提取自名贵中药材铁皮石斛和鼓槌石斛的天然小分子化合物,分子量为318.363,其结构式如图1所示。除石斛外,在毛兰属植物e.carinata中也能分离纯化得到毛兰素。传统中医临床上常将毛兰素作为解热剂和镇痛剂使用。据文献报道,毛兰素的处理可诱导多种肿瘤细胞的凋亡或自噬,并降低肿瘤细胞的迁移能力以及肿瘤血管生成能力;对金黄色葡萄球菌感染以及糖尿病肾病也有一定作用,鉴于其多种优点,毛兰素已经成为癌症治疗的重要研究分子。
目前的研究发现,毛兰素能引起bcl-xl、mcl-1和bcl-2的下调,bim的上调,引起parp的断裂,触发caspase的级联反应,进而诱导人膀胱癌ej细胞的凋亡;通过人骨肉瘤中的ros/jnk信号传导途径诱导细胞周期g2/m期阻滞,引起细胞凋亡和自噬;通过调节erk1/2信号传导和基于线粒体的凋亡途径来抑制细胞增殖并促进宫颈癌细胞凋亡;以jnk/sapk依赖性方式抑制内皮代谢,产生抗肿瘤作用和抗血管生成等作用。毛兰素作为传统中药成分对多种肿瘤细胞具有增值抑制作用,因此发现其靶点在其药物研发过程中具有广阔的应用前景,但目前为止毛兰素具体的作用靶点尚未报道,诱导肿瘤细胞凋亡的具体机制也未完全阐明。
技术实现要素:
针对上述现有技术,本发明通过一系列实验,将丙酮酸羧化酶确定为毛兰素的靶点蛋白,为毛兰素的药物开发,药理、毒理的阐明奠定了基础,具有广阔的应用前景。
本发明中鉴定丙酮酸羧化酶是毛兰素的靶点蛋白并制备丙酮酸羧化酶,包括以下过程:
(1)活性探针与非活性探针的制备:
l-赖氨酸中的α-氨基和羧基先与cu2+形成络合物,boc酸酐选择性地保护ε-氨基得到n-ε-boc-l-赖氨酸。在1h-咪唑-1-磺酰叠氮盐酸盐作叠氮化试剂和催化量硫酸铜的条件下,n-ε-boc-l-赖氨酸中的α-氨基发生重氮转移反应得到叠氮化合物,与活性小分子(采用羟乙基修饰毛兰素c-7位所得的毛兰素活性类似物)缩合后又进一步脱boc保护基与光交联基团缩合得到活性探针。非活性探针由非活性小分子(采用羟乙氧基修饰毛兰素a环中的c-5所得的毛兰素非活性类似物)中的末端醇羟基按照常规的方法修饰成氨基,然后与叠氮化物缩合得到。
(2)蛋白质体外结合实验:
分别将活性探针和非活性探针与hepg2细胞裂解液共同孵育,在4℃下于紫外交联仪中进行交联反应,探针蛋白复合物中的叠氮基团与炔基化生物素报告基团通过cuaac(cu催化的叠氮和块基的环加成反应)化学反应偶联,随后与strepbeads进行孵育。经洗涤和洗脱后,样品被sds-page(sds-聚丙烯酰胺凝胶电泳)分离和银染,同时通过wb用生物素抗体检测报告基团。活性探针组的特异性条带和与之相对应的非活性探针组中的条带进行切胶回收,经胰蛋白酶消化后送公司进行质谱分析。
(3)毛兰素与丙酮酸羧化酶的分子对接:
使用discoverystudio2016v16.1将hpc序列在pdb_nr95数据库中进行了blastsearch,选择其中整体同源性最高的spc(staphylococcusaureuspyruvatecarboxylase)为模板使用homologymodeling模块进行同源建模,用molprobity分析并优化后得到hpc蛋白结构。将同源建模得到的hpc蛋白结构文件用discoverystudio2016v16.1打开,并去除水分子后,用macromolecules模块中的工具去除蛋白冗余构象,补充非完整氨基酸残基,并为hpc蛋白加氢。然后使用fromreceptorcavities定义了共116个蛋白活性位点,以寻找毛兰素可能的结合部位。利用libdock将毛兰素分别与各个活性位点对接。
(4)细胞实验:
构建表达flag-pc蛋白的慢病毒表达载体plvx-puro-flag-pc,共转染plvx-puro-flag-pc和慢病毒包装质粒pspax2、pmd2.g至hek293t细胞中,得到的重组慢病毒悬液感染hek293t细胞进行flag-pc重组慢病毒的鉴定。将获得的flag-pc重组慢病毒感染人肝癌hepg2细胞,经puromycin筛选后,得到puro抗性的细胞,利用wb检测flag-pc蛋白的表达情况。将获得的稳定表达flag-pc的肝癌hepg2细胞株一部分冻存,一部分用于后续实验。
以相同浓度梯度的毛兰素分别处理hepg2细胞和过表达pc蛋白的hepg2/flag-pc细胞,48h后通过mtt检测细胞的存活率。
利用invitrogen公司的在线软件设计了两个人丙酮酸羧化酶基因(nm_000920.3)的干扰rna片段,合成shrna的引物片段,再将退火后得到的shrna双链dna片段连接到pentrtm/u6载体的多克隆位点中,构建了两个pc基因的rna干扰载体,pentrtm/u6-shpc。将其与pblock-it3-dest共转染到hek293t细胞中,获得重组慢病毒并感染肝癌细胞株hepg2,72h后westernblotting检测pc表达情况。
以相同浓度梯度的毛兰素分别处理hepg2细胞和感染shpc慢病毒的hepg2细胞,24h后通过mtt检测细胞的存活率。
(5)体外实验:
将hepg2/flagpc稳定细胞株进行大量传代培养,裂解细胞获得含flag-pc的细胞总蛋白。将anti-flag亲和纯化凝胶装柱并清洗后,在层析柱中加满蛋白裂解液,重复上样2~3次可以尽可能增加蛋白与凝胶结合量;用10~20倍柱体积的tbs清洗,3×flag多肽竞争性亲和洗脱,得到纯度非常高的flag-pc蛋白。
将丙酮酸、atp、nahco3、苹果酸脱氢酶、nadh、乙酰coa混合溶解待用;置于37℃预热5分钟。在1ml石英比色皿中使用移液器加入50μl样品,950μl工作液,立即混匀,记录340nm处初始吸光值a1和2min后的吸光值a2,计算δa=a1-a2。每mg组织蛋白每分钟消耗1nmolnadh定义为一个酶活力单位。按公式pc(u/mgprot)=[δa×v反总÷(ε×d)×109]÷(v样×cpr)÷t=1608×δa÷cpr计算pc酶活。
本发明的有益效果是:本发明克服现有技术的缺陷,首次提供丙酮酸羧化酶的为毛兰素靶点的证据及验证方法。本发明公开了毛兰素的靶点,包括毛兰素探针的靶点蛋白捕获,毛兰素靶点为丙酮酸羧化酶的分子模拟对接,毛兰素靶点为丙酮酸羧化酶的细胞及体外证据,并对丙酮酸羧化酶进行了制备,可用于毛兰素药理毒理的分析并为一般药物分子靶标鉴定提供参考,意义重大。
附图说明
图1为毛兰素的分子结构。
图2为丙酮酸羧化酶的预测结构。
图3和图4为毛兰素与丙酮酸羧化酶的分子对接。
具体实施方式
下面结合实施例对本发明的具体实施方式做详细的说明。
实施例1:模拟预测丙酮酸羧化酶的结构
本实施例所用软件为biovia公司的discoverystudio2016v16.1,hpc蛋白的序列信息来自于ncbi数据库,blast数据库为pdb_nr95。
实验过程如下:
s1:通过ncbi数据库查询需要建模的hpc蛋白的氨基酸序列,然后在discoverystudio2016v16.1软件中新建hpc的蛋白质序列文件;使用protocol里sequenceanalysis中的blastsearch模块,在pdb_nr95数据库中查找hpc的同源蛋白;在找到的具有同源性的蛋白质结构中查看e-value值,越小同源性越高,选择同源性较高的一个或多个蛋白作为模板,将模板序列添加到hpc序列窗口中,使用alignmultiplesequenceprotocol进行序列比对。
s2:load模板结构,使用homologybuildingprotocol进行同源建模。
s3:利用discoverystudio2016v16.1的cleanprotein工具去除蛋白冗余构象,补充非完整的氨基酸残基,为蛋白加氢,hpc蛋白的预测结构如图2所示;利用fromreceptorcavities模块定义受体hpc蛋白的活性位点。
实施例2:通过分子对接证实毛兰素能与丙酮酸羧化酶相互作用
本实施例的对接过程包括以下步骤:
s1:利用sketching工具,构建毛兰素小分子的初始结构,cleangeometry进一步构建毛兰素的几何三维结构。
s2:利用dockligands(libdock)工具执行分子对接计算,ligandinteractions观察对接pose的非键相互作用。defineligand并show2ddiagram打开配体-蛋白相互作用二维平面图,更直观的观察丙酮酸羧化酶与毛兰素的相互作用及关键的氨基酸和基团。
s3:有48个蛋白活性位点能与毛兰素产生较稳定的pose,其中能产生libdockscore大于75pose的site有28个,大于100的有6个。表明毛兰素可能在多个活性位点处与hpc蛋白结合。libdockscore最高的两个site中的毛兰素小分子分别位于四聚体蛋白的bc链和ad链的界面处,化学环境几乎一样。hpc蛋白通过天冬氨酸残基的常规氢键与π-阴离子互作,甲硫氨酸残基的π-二硫键和π-烷基互作以及天冬氨酸、谷氨酸、丝氨酸和赖氨酸残基的碳氢氢键与毛兰素形成了相对稳定的复合结构;毛兰素与丙酮酸羧化酶的分子对接示意图如图3和图4所示。
实施例3:通过体内细胞实验证实丙酮酸羧化酶是毛兰素的靶点蛋白
本实施例通过体内细胞实验证实丙酮酸羧化酶是毛兰素的靶点蛋白。实验过程如下:
s1:利用invitrogen公司的在线软件设计人丙酮酸羧化酶基因(nm_000920.3)的干扰rna片段。
s2:合成shrna的引物片段,再将退火后得到的shrna双链dna片段连接到pentrtm/u6载体的多克隆位点中。
s3:将干扰载体与pblock-it3-dest共转染到hek293t细胞中,72h后收获重组慢病毒。
s4:将慢病毒液按1:1的比例与培养基混合感染肝癌细胞株hepg2,72h后westernblot检测pc表达量变化。
s5:将shpc重组慢病毒感染的hepg2细胞与正常的hepg2细胞进行相同梯度的毛兰素处理,24h后,mtt法检测细胞存活率。结果显示,pc蛋白的沉默明显降低了毛兰素对hepg2细胞的生长抑制作用。
实施例4:通过体外酶活实验证实毛兰素能够抑制纯化的丙酮酸羧化酶活性
本实施例通过体外酶活实验证实毛兰素可以抑制纯化的丙酮酸羧化酶活性。本实施例中的pc片段来自origene公司的cdna表达载体产品pcmv6-entry-pc。实验过程如下:
s1:以质粒pcmv6-entry-pc为模板进行pcr扩增反应,同时引入蛋白纯化标签flag;将flag-pc片段与plvx-puro慢病毒表达载体连接。
s2:将plvx-puro-flag-pc与两个包装质粒pspax2和pmd2.g共转染至hek293t细胞中,72h后收获慢病毒液;将病毒液与dmem完全培养基以1:1混合,加入10μg/ml的polybrene,感染48h后通过westernblot检测感染效率。
s3:plvx-puro-flag-pc病毒液感染hepg2细胞48h后加入含0.5μg/ml的puromycin筛选培养基继续培养至出现可见克隆。
s4:将筛选到的hepg2/flagpc稳定细胞株进行大量传代培养,裂解细胞获得含flag-pc的细胞总蛋白;利用anti-flag亲和纯化凝胶纯化得到纯度非常高的flag-pc蛋白,并与毛兰素在37℃孵育2h。
s5:将丙酮酸、atp、nahco3、苹果酸脱氢酶、nadh、乙酰coa混合溶解待用;置于37℃预热5min。在1ml石英比色皿中使用移液器加入50μl样品,950μl工作液,立即混匀,记录340nm处初始吸光值a1和2min后的吸光值a2,计算δa=a1-a2。每mg组织蛋白每分钟消耗1nmolnadh定义为一个酶活力单位。按公式pc(u/mgprot)=[δa×v反总÷(ε×d)×109]÷(v样×cpr)÷t=1608×δa÷cpr计算pc酶活;
s6:结果显示,在与毛兰素共孵育后,利用分光光度法检测pc蛋白的活性,发现无论在hepg2和hepg2/flag-pc的细胞裂解液中,还是在纯化的flag-pc蛋白中,毛兰素处理后,pc的酶活性均显著下降,这进一步说明毛兰素能够与pc蛋白相互作用并抑制其酶活性。
虽然结合实施例对本发明的具体实施方式进行了详细地描述,但不应理解为对本专利的保护范围的限定。在权利要求书所描述的范围内,本领域技术人员不经创造性劳动即可作出的各种修改和变形仍属本专利的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!