一种用于治疗肿瘤的高分子聚合物及其制备方法与应用与流程
本发明属于药物技术领域,具体涉及一种用于治疗肿瘤的高分子聚合物及其制备方法与应用。
背景技术:
1998年首次报道,由双链rna(dsrna)引发的特定基因表达受抑现象被称为rna干扰作用(rnainterference,rnai)。由此拉开了小干扰sirna(smallinterferingrna,或shortinterferingrnas,sirna)研究的序幕,特别是在2004年,首例基于含有sirna的试剂进入临床实验,这无疑给sirna的发展带来了崭新的动力与希望。由于使用rnai技术可以特异性剔除或关闭特定基因的表达,所以小干扰sirna已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的治疗领域。
小干扰sirna应用在肿瘤治疗领域时,需要通过纳米载体将小干扰sirna输送到肿瘤细胞进行靶向治疗。其中生理环境敏感型高分子纳米基因载体凭借低毒、低免疫反应、安全、靶向性和易于组装等诸多优点,成为研究的热点,基因治疗必须要通过载体由外界达到靶细胞,外源基因转入胞浆,外源基因转入细胞核这三道屏障。生理环境敏感型高分子纳米基因载体有多种类型。有关传输sirna的研究,很多集中在peg的分子量与密度影响溶酶体逃逸方面,两性霉素b促进溶酶体逃逸,还原-ph双重敏感电位翻转胶束,实现血液长循环靶向性输送sirna。
溶酶体逃逸对于sirna的传输是一个重要的生物学障碍,在提高溶酶体膜变形效果、膜表面的空洞作用或者膜易破裂性能,来促进载体溶酶体逃逸效果传输sirna显得非常重要。
然而,对于目前的高分子纳米基因载体,其聚合物负载sirna形成基因载体后,经内吞进入细胞后,一方面难以从内吞体和溶酶体中逃逸且有被rna酶降解的风险,另一方面包含载基因载体的内吞体或溶酶体容易转变为小泡,通过外排作用排出体外,从而导致细胞内sirna的有效浓度较低,这是sirna传输亟待解决的关键问题。另外一个值得关注的问题,由于肿瘤组织的异质性和高组织间质压力,纳米载体在肿瘤组织中往往滞留在血管附近,难以渗透到肿瘤组织深部。
技术实现要素:
本发明的目的之一,是提供一种用于治疗肿瘤的高分子聚合物的制备方法。本发明的制备方法产物效率高,产生的副产物少。
本发明解决上述技术问题的技术方案如下:一种用于治疗肿瘤的高分子聚合物的制备方法,包括以下步骤:
步骤1:合成pegma-(raft)
称取149.0mg的4-氰基-4-(硫代苯甲酰)戊酸和4.00g的单体pegma,以1,4-二氧六环为溶剂溶解,再加入8.8mg的引发剂aibn,去除氧气,在温度为70℃反应8h,反应结束后,冷却至室温,经除杂、浓缩和冻干后,得到浅红色固体,即pegma-(raft);
步骤2:合成pegma-b-pdpa-(raft)
称取2.00g步骤1得到的pegma-(raft),加入2.13g的dpa,以1,4-二氧六环为溶剂,加入8.8mg的引发剂aibn,去除氧气,在温度为70℃反应8h,反应结束后,冷却至室温,经除杂、浓缩和冻干后,得到浅红色固体,即pegma-b-pdpa-(raft);
步骤3:合成pegma-b-pdpa-b-pdmaema-(raft)
称取1.60g步骤2得到的pegma-b-pdpa-raft,加入0.983g的dmaema,以1,4-二氧六环为溶剂,加入8.8mg的引发剂aibn,去除氧气,在温度为75℃反应时间8h,反应结束后,冷却至室温,经除杂、浓缩和冻干后,得到浅红色固体,即pegma-b-pdpa-b-pdmaema-(raft);
步骤4:脱硫反应
称取3.01g步骤3得到的pegma-b-pdpa-b-pdmaema-(raft),以1,4-二氧六环为溶剂,加入8.8mg的引发剂aibn,去除氧气,在温度为75℃反应8h,反应结束后,冷却至室温,经除杂、浓缩和冻干后,得到白色固体,即pegma-b-pdpa-b-pdmaema;
步骤5:合成高分子聚合物mal-pmdm
称取0.1g步骤4得到的pegma-b-pdpa-b-pdmaema,加入二氯甲烷溶解,加入92.8mg的dcc和54.98mg的dmap,充分摇匀溶解,过滤,再加入0.05gmal-peg-oh,密封并搅拌,在温度为25℃反应48h,经除杂、浓缩和冻干后,得到高分子聚合物mal-pmdm。
本发明的用于治疗肿瘤的高分子聚合物的制备方法的有益效果是:
能够非常高效地制备得到用于治疗肿瘤的高分子聚合物,产生的副产物少,制备得到的高分子聚合物可应用到治疗肿瘤靶向药物载体上,可有效地负载sirna;该高分子聚合物的细胞毒性小,能够提高载体的稳定性,同时提高细胞摄取能力,提高转染能力,载体的组成与结构具有克服溶酶体生物学屏障的能力,可以有效地从细胞溶酶体逃逸,实现药物的准确运输。
在上述技术方案的基础上,本发明还可以做如下改进。
进一步,在步骤1-步骤5中,所述去除氧气具体为:充入氮气,再以液氮冷冻,冷冻时抽真空除氧气完成后,再充入氮气至常压结束,重复循环三次。
采用上述进一步方案的有益效果是:能够有效的去除氧气,避免氧气对反应造成影响,提高了反应成功效率。
进一步,在步骤1-步骤5中,所述除杂具体为:加入溶剂1,4-二氧六环,在透析袋中透析除去杂质。
采用上述进一步方案的有益效果是:能够有效的去除杂质,提高合成物的纯度。
进一步,所述除杂还包括:将透析袋放入超纯净水中,经二次透析,除去1,4-二氧六环。
采用上述进一步方案的有益效果是:能够去除溶剂,减去分离纯化过程。
进一步,所述透析袋的截留分子量为3500da-14000da。
采用上述进一步方案的有益效果是:过滤透析效果好。
进一步,所述mal-peg-oh的分子量为2000da。
采用上述进一步方案的有益效果是:能够更好的负载sirna。
本发明的目的之二,是提供一种用于治疗肿瘤的高分子聚合物。
本发明解决上述技术问题的技术方案如下:一种采用如上述的用于治疗肿瘤的高分子聚合物的制备方法制备得到的高分子聚合物。
本发明的目的之三,是提供一种治疗肿瘤的药物载体sirna-pmdm。
本发明解决上述技术问题的技术方案如下:一种治疗肿瘤的药物载体sirna-pmdm,包括如上述的用于治疗肿瘤的高分子聚合物的制备方法制备得到的高分子聚合物。
本发明的目的之四,是提供一种治疗肿瘤的药物载体sirna-pmdm的制备方法。
本发明解决上述技术问题的技术方案如下:一种如上述的治疗肿瘤的药物载体sirna-pmdm的制备方法,包括如下步骤:
取聚合物mal-pmdm以ph值为5.0的pbs缓冲溶液溶解,采用聚醚砜(pes)滤膜过滤,再加入sirna复合0.5h,再采用聚醚砜(pes)滤膜过滤,调节ph值为7.4,以截留分子量为100kda的超滤管,低速超滤,除去杂质,得到治疗肿瘤的药物载体sirna-pmdm。
本发明的治疗肿瘤的药物载体sirna-pmdm的有益效果是:所负载的sirna具有较好干扰效,能够有效的对肿瘤细胞进行靶向治疗。
本发明的目的之五,是提供一种治疗肿瘤的药物载体sirna-pmdm-irgd。
本发明解决上述技术问题的技术方案如下:一种治疗肿瘤的药物载体sirna-pmdm-irgd,包括如上述的用于治疗肿瘤的高分子聚合物的制备方法制备得到的高分子聚合物。
本发明的目的之六,是提供一种治疗肿瘤的药物载体sirna-pmdm-irgd的制备方法。
本发明解决上述技术问题的技术方案如下:一种如上述的治疗肿瘤的药物载体sirna-pmdm-irgd的制备方法,包括如下步骤:
称取聚合物mal-pmdm,以ph值为5.0的pbs缓冲溶液溶解,采用聚醚砜滤膜过滤,再加入sirna复合0.5h,再采用聚醚砜滤膜过滤,调节ph值为7.4,以截留分子量为100kda的超滤管进行低速超滤,除去杂质,即得到药物载体sirna-pmdm的胶束溶液;
称取irgd,采用还原剂tcep打开irgd部分交联的巯基,除去还原剂tcep,将其加入到所述药物载体sirna-pmdm的胶束溶液中,在温度为25℃反应4h,以截留分子量为100kda的超滤管进行低速超滤,除去杂质,即得到治疗肿瘤的药物载体sirna-pmdm-irgd。
本发明的治疗肿瘤的药物载体sirna-pmdm-irgd的制备方法的有益效果是:
本纳米载体具有靶向性高,能够有效将药物运输至癌细胞,能够从溶酶体的吞噬中逃逸,避免药物失去效果,同时本纳米载体稳定性高,转染能力高,通过本载体能够提高药物对肿瘤的治疗效果。
附图说明
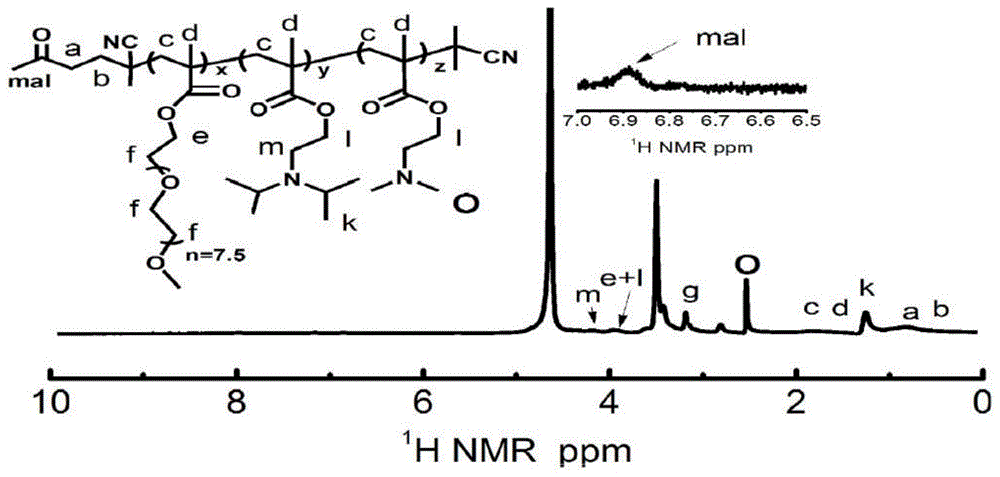
图1为本发明的聚合物mal-pmdm的1h-nmr谱图;
图2为本发明的pegma-b-pdpa-b-pdmaema的1h-nmr谱图;
图3为本发明的pegma-b-pdpa-b-pdmaema-(raft)的1h-nmr谱图;
图4为本发明的pegma-b-pdpa-(raft)的1h-nmr谱图;
图5为本发明的pegma-(raft)的1h-nmr谱图;
图6为本发明治疗肿瘤的药物载体sirna-pmdm的扫描电镜图;
图7为本发明治疗肿瘤的药物载体sirna-pmdm-irgd的扫描电镜图;
图8为本发明治疗肿瘤的药物载体sirna-pmdm-irgd正常状态效果图;
图9为本发明溶酶体靠近治疗肿瘤的药物载体sirna-pmdm-irgd的效果图;
图10为本发明溶酶体进入治疗肿瘤的药物载体sirna-pmdm-irgd的效果图;
图11为本发明治疗肿瘤的药物载体sirna-pmdm-irgd从溶酶体逃逸的效果图。
具体实施方式
下面通过具体实施例和对比例对本发明做进一步的详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
需要注意的是,本发明中的“包括”意指其除所述成分外,还可以包括其他成分,所述的“包括”,还可以替换为封闭式的“为”或“由……组成”。
实施例
本实施例提供一种用于治疗肿瘤的高分子聚合物的制备方法,包括以下步骤:
步骤1:合成pegma-(raft)
称取149.0mg的4-氰基-4-(硫代苯甲酰)戊酸和4.00g的单体pegma,以1,4-二氧六环为溶剂溶解,再加入8.8mg的引发剂aibn,充入氮气,再以液氮冷冻,冷冻时抽真空除氧气完成后,再充入氮气至常压结束,重复循环三次,去除氧气等助燃剂,在温度为70℃下,反应8h,反应结束后,冷却至室温,加入溶剂1,4二氧六环,在截留分子量为3500da的透析袋中透析除去单体、寡聚体或引发剂等杂质,透析袋放入超纯净水中,经二次透析,除去1,4二氧六环,得到高分子溶液,经浓缩和冻干后,得到浅红色固体,即pegma-(raft)。具体反应式如下:
步骤2:合成pegma-b-pdpa-(raft)
称取2.00g步骤1得到的pegma-(raft),加入2.13g的dpa,以1,4-二氧六环为溶剂,加入8.8mg的引发剂aibn,充入氮气,再以液氮冷冻,冷冻时抽真空除氧气完成后,再充入氮气至常压结束,重复循环三次,去除氧气等助燃剂,在温度为70℃下,反应8h,反应结束后,冷却至室温,加入溶剂1,4-二氧六环,在截留分子量为7000da的透析袋中透析除去单体、寡聚体或引发剂等杂质,透析袋放入超纯净水中,经二次透析,除去1,4-二氧六环,得到高分子溶液,经浓缩和冻干后,得到浅红色固体,即pegma-b-pdpa-(raft)。具体反应式如下:
步骤3:合成pegma-b-pdpa-b-pdmaema-(raft)
称取1.60g步骤2得到的pegma-b-pdpa-raft,加入0.983g的dmaema,以1,4-二氧六环为溶剂,加入8.8mg的引发剂aibn,充入氮气,再以液氮冷冻,冷冻时抽真空除氧气完成后,再充入氮气至常压结束,重复循环三次,去除氧气等助燃剂,在温度为75℃下,反应时间8h,反应结束后,冷却至室温,加入溶剂1,4-二氧六环,在截留分子量为14000da的透析袋中透析除去单体、寡聚体或引发剂等杂质,透析袋放入超纯净水中,经二次透析,除去1,4-二氧六环,得到高分子溶液,经浓缩和冻干后,得到浅红色固体,即pegma-b-pdpa-b-pdmaema-(raft)。具体反应式如下:
步骤4:脱硫反应
称取3.01g步骤3得到的pegma-b-pdpa-b-pdmaema-(raft),以1,4-二氧六环为溶剂,加入8.8mg引发剂aibn,充入氮气,再以液氮冷冻,冷冻时抽真空除氧气完成后,再充入氮气至常压结束,重复循环三次,去除氧气等助燃剂,在温度为75℃下,反应8h,反应结束后,冷却至室温,加入溶剂1,4-二氧六环,在截留分子量为14000da的透析袋中透析除去单体、寡聚体或引发剂等杂质,透析袋放入超纯净水中,经二次透析,除去1,4二氧六环,得到高分子溶液,经浓缩和冻干后,得到白色的固体,即得到pegma-b-pdpa-b-pdmaema;
步骤5:合成mal-pmdm
称取0.1g步骤4得到的pegma-b-pdpa-b-pdmaema,加入二氯甲烷溶解,加入92.8mg的n,n′-二环己基碳二亚胺(dcc)和54.98mg的4-二甲氨基吡啶(dmap),充分摇匀溶解,过滤除去不溶物质,再加入0.05gmal-peg-oh,密封并搅拌,在25℃下反应48h,放入截留分子量为14000da透析袋中,在甲醇中透析,除去杂质,再将透析袋放入超纯净水中,以水透析除去甲醇,经浓缩和冻干后,得到聚合物mal-pmdm,即mal-pegma-b-pdpa-b-pdmaema。
具体反应式如下:
本实施例还提供对采用上述制备方法制备的聚合物mal-pmdm(mal-pegma-b-pdpa-b-pdmaema)进行表征。
(1)聚合物的核磁表征
聚合物的组成以核磁共振进行测定。以d2o或者dmso-d6为溶剂,1h-nmr:mercury-plus300超导核磁共振波谱仪(varian)。用于研究溶液中聚合物的样品1h-nmr谱图。具体如图1-图5所示:
图1表示mal-pmdm的图谱;
图2表示pegma-b-pdpa-b-pdmaema的图谱;
图3表示pegma-b-pdpa-b-pdmaema-(raft)的图谱;
图4表示pegma-b-pdpa-(raft)的图谱;
图5表示pegma-(raft)的图谱。
从图1可以看出,7.5ppm-7.9ppm,为raft试剂cpta主链上苯环氢的核磁峰,0.6ppm与0.7ppm分别归属为端位hoocch2ch2-,3.6ppm归属为侧链的ch3(ch2ch2o)-亚甲基氢的核磁峰,1.0ppm归属为(ch3)2chnch2ch2o-甲基的氢的核磁峰,2.5ppm归属为(ch3)2nch2ch2o-甲基的氢的核磁峰,6.9ppm归属为马来酰亚胺基团碳-碳双键氢的核磁峰。据此分析,本实施例成功制备得到pmdm与mal-pmdm。
本实施例还提供一种采用聚合物mal-pmdm制备治疗肿瘤的药物载体sirna-pmdm,包括如下步骤:
取聚合物mal-pmdm以ph值为5.0的pbs缓冲溶液溶解,采用聚醚砜(pes)滤膜过滤,再加入sirna复合0.5h,聚合物mal-pmdm与sirna按照n/p值为2/1-4/1进行复合,再采用聚醚砜(pes)滤膜过滤,调节ph值为7.4,以截留分子量为100kda的超滤管,低速超滤,除去杂质,得到治疗肿瘤的药物载体sirna-pmdm。
本实施例还提供一种采用聚合物mal-pmdm制备治疗肿瘤的药物载体sirna-pmdm-irgd,包括如下步骤:
称取聚合物mal-pmdm,以ph值为5.0的pbs缓冲溶液溶解,采用聚醚砜滤膜过滤,再加入sirna复合0.5h,聚合物mal-pmdm与sirna按照n/p值为2/1-4/1进行复合,再采用聚醚砜滤膜过滤,调节ph值为7.4,以截留分子量为100kda的超滤管进行低速超滤,除去杂质,即得到sirna-pmdm载体的胶束溶液。
取irgd,采用还原剂tcep打开irgd部分交联的巯基,除去还原剂tcep,将其加入到所述sirna-pmdm载体的胶束溶液中,在温度为25℃下,反应4h,以截留分子量为100kda的超滤管,低速超滤,除去杂质,制备得到治疗肿瘤的药物载体sirna-pmdm-irgd。
对制备的sirna-pmdm载体胶束和sirna-pmdm-irgd载体胶束进行电镜扫描,制备浓度约0.5mg·ml-1的样品,滴一小滴样品溶液到铜网上,自然晾干,然后用2%的醋酸铀溶液染色1min,把溶液吸干。在philipscm120透射电镜下观察。得到如图6和图7所示。
另外本实施例对制备的sirna-pmdm-irgd载体胶束的溶酶体逃逸现象进行检测,具体检测结果如下:
载体通过内吞或吞噬作用进入细胞后,在酸性囊泡中积累,早期形成内涵体,晚期形成溶酶体,最后降解或者重新将其转运回细胞的表面。一般情况下,载体须具有缓冲内涵体ph值降低的能力,pmdm中的叔胺吸收h+,可以实现这个目标,同时为了达到电荷平衡和物质浓度平衡,细胞质中的cl-和水将会源源不断的流入“质子海绵效应”。
lysotrackergreen为一种溶酶体染色试剂,具有溶酶体趋向性,在溶酶体的弱酸性环境中发出绿色荧光。因此,通过细胞核染色试剂dapi和细胞溶酶体染色试剂lysotrackergreen的共同应用,可以观察纳米载体进入细胞的过程,载体复合以cy3标记的sirna,称为cy3sirna-pmdm-irgd。具体如图8-图11所示。
从图8-图11可以看出,irgd修饰后的载体cy3sirna-pmdm(红色)可以从溶酶体(绿色)逃逸出去。由此证明,irgd修饰后的载体cy3sirna-pmdm-irgd,由于irgd修饰易于进入细胞,另外载体中的pegma具有稳定载体功能,疏水层pdpa具有稳定载体和破溶酶体的作用。此外,聚合物中链段pdmaema也有破溶酶体的作用。载体虽然带有负电荷,但是由于载体被irgd修饰之后,易于进入细胞进行转染。另外,聚合物所构造的载体cy3sirna-pmdm-irgd具有很好的溶酶体功能,而在同样的情况下,如图11所示,红光与绿光是分离的,表明仅仅有少量的载体cy3sirna-pmdm-irgd在溶酶体中,大部分的cy3sirna-pmdm-irgd已经成功从溶酶体逃逸。
由此可见,对于高分子纳米载体,通过肿瘤穿透多肽irgd修饰后,通过介导的作用,提高细胞摄取能力,同时提高转染能力,载体的组成与结构具有克服溶酶体生物学屏障的能力,进一步提高基因治疗肿瘤的效果,具有重要的意义。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!