产(R)-3-羟基丁酸的重组肠道菌及其构建方法与流程
本发明涉及生物技术和肠道微生物领域,具体涉及一种在肠道菌中构建生产3-羟基丁酸(3hb)通路的方法,及其改善肠道健康减少疾病的(大健康领域)应用。
背景技术:
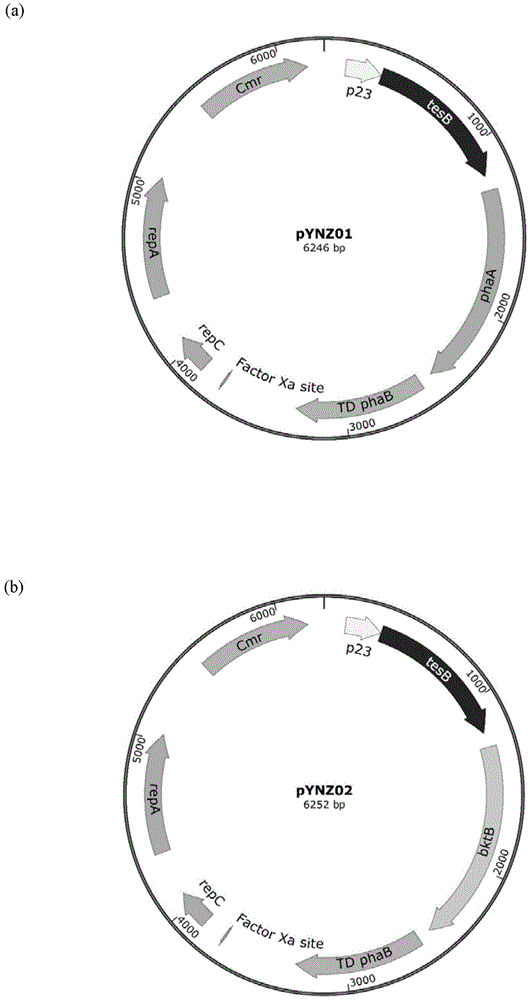
:1.3hb在生命活动中扮演的重要作用3-羟基丁酸(3hb)是动物酮体的主要组成成分,人体中3hb的主要来源为脂肪酸氧化,该步骤发生于肝脏,而肝脏细胞无法有效的降解3hb。3-hb是手性化合物,存在r型(d型)和s型(l型)两种异构体。由于3-hb合成和分解途径的羟基丁酰脱氢酶的特异性,动物体只能合成和利用(r)-3-hb。s型仅能以3-hb-coa的化合物作为中间产物短暂存在于肝脏细胞的线粒体中。饥饿时3hb会大量产生,3hb是饥饿时大脑/肌肉重要的能量来源。有报道称3hb的水平与癫痫,糖尿病,肠炎等疾病密切相关,体内/病灶处3hb浓度的升高对以上疾病有显著的治疗作用(youmyh,nguyenky,grantrw,etal.theketonemetaboliteβ-hydroxybutyrateblocksnlrp3inflammasome–mediatedinflammatorydisease[j].naturemedicine,2015,21(3):263.)。外源的3-hb在多种疾病模型中均起到重要的改善作用。体内实验表明,补充3-hb能够减缓肿瘤的生长、延长被试者的生存期限。3-hb还能通过增加心肌葡萄糖的摄取和血流量增强心肌健康,在心肌缺血或再灌注损伤模型中,3-hb起到了保护心肌的作用。对于大脑代谢功能减退疾病比如阿尔兹海默症(ad),每天外源给予10-20g的3-hb表现出了治疗效果。ad是由中央神经系统神经元的糖代谢受损引起的,由于酮体的吸收不需要依赖胰岛素的调控,故可以弥补神经元缺乏的能量。人体的血酮只需要超过0.2mm,即可代替葡萄糖为神经元提供能量。在神经退行性疾病中,血酮的升高可以缓解细胞凋亡。外源3-hb的治疗能够减少癫痫患者发作的次数,被应用于难治型癫痫的治疗中(mcnallyma,hartmanal.ketonebodiesinepilepsy[j].journalofneurochemistry,2012,121(1):28-35.)。生酮饮食因其明显的3-hb浓度提升作用,已成为癫痫病人的饮食首选。有报道称3hb的水平与肠炎等疾病密切相关。在单核细胞中,3-hb可以调控nlrp3炎症小体介导的白细胞介素-1β和白细胞介素-18,减轻炎症反应,因此存在治疗自身免疫疾病的潜能。不仅如此,外源3-hb作为治疗剂的安全性同样得到了证实。根据stubbs等人的实验,受试者可以耐受连续五天、每天三次口服剂量高达714mg/kg的(r)-3-hb。对高胰岛素血症导致低血糖的患儿,2个月和6个月大的婴儿分别可以耐受口服4g和8g的3-hb治疗(pleckob,stoeckler-ipsiroglus,schobere,etal.oralβ-hydroxybutyratesupplementationintwopatientswithhyperinsulinemichypoglycemia:monitoringofβ-hydroxybutyratelevelsinbloodandcerebrospinalfluid,andinthebrainbyinvivomagneticresonancespectroscopy[j].pediatricresearch,2002,52(2):301)。2.肠道微生物作为治疗的给药途径的优势近年来,随着生活水平的提升,人们对健康领域的关注程度越来越高。而肠道微生物的研究更成为了疾病及健康研究的热门领域。如果能够通过改造肠道微生物直接生产药物,进而治疗人类疾病,这将会是与传统药物治疗齐名的新型疾病治疗手段,具有相当大的开拓意义。口服与静脉注射是目前给药的常用方式,但该方式同时也具有缓释效果差,药效短的弊端。如果工程改造肠道微生物使其自发性的生产小分子药物,则可以达到普通给药方法难以企及的缓释效果,药效有大大提升的可能。尽管3hb能够用于治疗各种疾病,但是肠道微生物在3hb合成方面贡献微乎其微。技术实现要素:针对现有技术的上述缺陷,发明人经过深入研究,获得了以下发明构思:1)使用分子生物学方法定向改造肠道微生物,使其以日常食物为底物自发生产小分子药物3hb(特别是(r)-3-hb);2)通过动物实验确定小分子药物3hb(特别是(r)-3-hb)在肠道中的持续产生能够治疗相应疾病。更具体地,本发明人设想以肠道益生菌为底盘菌,构建过表达3hb的生产通路。工程菌在结直肠中直接以食物为底物生产3hb,3hb经肠道吸收后会提升个体3hb水平,进而达到治疗疾病的效果。这样的给药方式,不需要长期反复服药,相比传统的口服(无法起到长期效果,口感差)和静脉注射(操作复杂,无缓释效果)具有巨大的优势。该工程菌可在肠道生产3hb,并可能带来对疾病的显著治疗效果,工程菌可能作为3hb可治疗疾病的药物上市,服用该工程菌作为保健品可部分替代生酮饮食的效果。因此,本发明提供以下各项:1.重组肠道菌,其包含生产3-羟基丁酸(3hb)的合成通路。优选所述肠道菌的野生型本身不能合成3-羟基丁酸(3hb)。2.根据以上1所述的重组肠道菌,其包含优选外源引入的酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因。在本发明的一个实施方案中,所述3-羟基丁酸(3hb)的合成通路包括酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因以生产3-羟基丁酸(3hb)(特别是(r)-3-hb)。应当指出,所述酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因中的一个或多个可以是内源性的或外源性的,这取决于使用的具体肠道菌。3.根据以上2所述的重组肠道菌,其中所述肠道菌还被敲除了乳酸脱氢酶基因。本领域技术人员公知敲除乳酸脱氢酶基因的方法,例如通过同源重组来实现。在一个特别优选的实施方案中,通过使用质粒pre112-ldha来敲除肠道菌(特别是大肠杆菌)中的乳酸脱氢酶基因。4.根据以上2所述的重组肠道菌,其中所述酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因在一个或多个质粒上表达或者被整合到所述肠道菌的基因组中表达。在一个特别优选的实施方案中,本发明的重组肠道菌包括质粒pynz01-pynz10中任一个,特别优选pynz01、pynz03、pynz04、pynz09、pynz10。在另一个特别优选的实施方案中,通过使用质粒pre112-i1将所述酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因(即3hb合成通路)整合到肠道菌(特别是大肠杆菌)的基因组中。5.根据以上1-4中任一项所述的重组肠道菌,其中所述肠道菌为肠道益生菌,诸如选自大肠杆菌、乳杆菌、乳酸乳球菌、嗜热链球菌、凝结芽孢杆菌、双歧杆菌、粪肠球菌或其组合,优选选自大肠杆菌(e.coli)nissle1917(更优选消除内源隐秘质粒后的e.colinissle1917)、乳杆菌(lactobacillusgasseri)atcc33323和凝结芽孢杆菌(bacilluscoagulans)dsm1。6.根据以上5所述的重组肠道菌,其包含来源于罗氏真养菌的酰基辅酶a合成酶基因phaa(优选seqidno.1所示的phaa),乙酰乙酰辅酶a还原酶基因phab(优选seqidno.2所示的phab)和来源于大肠杆菌的硫解酶基因tesb(优选seqidno.3所示的tesb)。7.根据以上6所述的的重组肠道菌,其中所述酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因在p23启动子和/或j23119启动子下表达。8.根据以上6或7所述的的重组肠道菌,其中所述酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因被整合到所述肠道菌(优选大肠杆菌)的malek基因间的非编码区。9.一种制备根据以上1-8中任一项所述的重组肠道菌的方法,所述方法包括在肠道菌中引入3-羟基丁酸(3hb)的合成通路,特别是酰基辅酶a合成酶基因、乙酰乙酰辅酶a还原酶基因和/或硫解酶基因的步骤,和任选地敲除所述肠道菌的乳酸脱氢酶基因的步骤。优选地,所述方法包括以上2-8中任一项所述的附加特征。10.根据以上1-8中任一项所述的重组肠道菌在制备药物中的应用,所述药物用于治疗肠炎、肠癌、阿尔兹海默症、肥胖、糖尿病、高血压、自身免疫疾病、癫痫、心肌缺血、再灌注损伤和/或动脉粥样硬化。发明详述针对现有口服3hb技术的不足,本发明的发明人经过反复的研究和实验验证,发明了一种重组肠道菌以及在肠道益生菌中生产3hb的方法。根据本发明的一个方面,提供了一种方法,为通过如下a)-d)中至少一种方法构建重组肠道益生菌,在重组肠道益生菌体内实现3hb的生产:a)该肠道益生菌可为大肠杆菌e.colinissle1917,可为消除内源隐秘质粒后的e.colinissle1917,可为乳杆菌lactobacillusgasseriatcc33323,可为凝结芽孢杆菌bacilluscoagulansdsm1或其他种属的肠道益生菌,例如大肠杆菌、乳杆菌、乳酸乳球菌,嗜热链球菌,凝结芽孢杆菌,双歧杆菌,粪肠球菌等;b)在肠道益生菌中表达酰基辅酶a合成酶(acyl-coasynthetase)基因、乙酰乙酰辅酶a还原酶(acetoacetyl-coareductase)基因和硫解酶(thiolase)基因,实现3hb的生产;c)在肠道益生菌中利用强度不同的启动子,调控b)中所示蛋白的表达强度,提高3hb合成能力,实现3hb的有效生产;d)在肠道益生菌中利用基因编辑手段(基因敲除,基因敲低,异源基因整合基因组等)改变细胞代谢过程,实现3hb的有效生产。根据本发明的另一个方面,提供了一种重组菌,是将肠道益生菌作为出发菌进行如下1)-2)的任一改造得到的:1)将启动子,酰基辅酶a合成酶(acyl-coasynthetase)基因、乙酰乙酰辅酶a还原酶(acetoacetyl-coareductase)基因和硫解酶(thiolase)基因导入肠道益生菌中,获得重组菌;2)敲除内源的乳酸脱氢酶基因,将启动子,酰基辅酶a合成酶(acyl-coasynthetase)基因、乙酰乙酰辅酶a还原酶(acetoacetyl-coareductase)基因和硫解酶(thiolase)基因导入肠道益生菌中,获得重组菌;和任选地3)将2)中所述的启动子和基因整合到肠道益生菌基因组中。上述方法中,该肠道益生菌可为大肠杆菌e.colinissle1917,可为消除内源隐秘质粒后的e.colinissle1917,可为乳杆菌lactobacillusgasseriatcc33323,可为凝结芽孢杆菌bacilluscoagulansdsm1或其他种属的肠道益生菌,例如乳酸乳球菌,嗜热链球菌,凝结芽孢杆菌,双歧杆菌,粪肠球菌等。敲除内源的乳酸脱氢酶基因具体可通过导入特异dna分子,通过同源重组的方法来实现,所述特异dna分子具有对应于乳酸脱氢酶基因上游的同源臂和对应于乳酸脱氢酶基因下游的同源臂。敲除内源的乳酸脱氢酶的编码基因具体可通过导入特异质粒实现。所述特异质粒为具有所述特异dna分子的质粒。所述特异质粒具体可如序列表的序列pre112-ldha所示。3hb合成通路的基因组整合具体可通过导入特异dna分子,通过同源重组的方法来实现,例如,所述特异dna分子具有对应于malek基因间隔区上游的同源臂和对应于malek基因间隔区下游的同源臂。3hb合成通路的基因组整合具体可通过导入特异质粒实现。所述特异质粒为具有所述特异dna分子的质粒。所述特异质粒具体可如序列表的序列pre112-i1所示。本发明的酰基辅酶a合成酶(acyl-coasynthetase)基因、乙酰乙酰辅酶a还原酶(acetoacetyl-coareductase)基因和硫解酶(thiolase)基因可以独立地各自在一个或多个启动子的控制下表达。所述启动子包括但不限于p23启动子。所述p23启动子如序列表的序列pynz01中第123-337位核苷酸所示。但不限于该具体形式。所述启动子还包括但不限于j23119启动子。所述j23119启动子如序列表的序列pynz10中第127-228位核苷酸所示。但不限于该具体形式。所述特异性酰基辅酶a合成酶(phaa蛋白)基因的一种具体形式如序列表的序列pynz01中第1283-2461位核苷酸所示。但不限于该具体形式。所述乙酰乙酰辅酶a还原酶(phabtd蛋白)基因的一种具体形式如序列表的序列pynz01中第2539-3285位核苷酸所示。但不限于该具体形式。所述乙酰乙酰辅酶a还原酶(phabre蛋白)基因的一种具体形式如序列表的序列pynz04中第2539-3279位核苷酸所示。但不限于该具体形式。所述硫解酶(tesb蛋白)基因的一种具体形式如序列表的序列pynz01中第338-1198位核苷酸所示。但不限于该具体形式。本发明提供的重组菌和方法,对于增强肠道益生菌的潜在医疗价值以及3hb的进一步医疗应用有重要意义。附图说明图1为质粒pynz01-pynz10(a-j)的结构示意图。图2为质粒pre112-ldha的结构示意图。图3为质粒pre112-i1的结构示意图。图4.seqidno.4-pynz01序列(6246bp)图5.seqidno.5-pynz02序列(6252bp)图6.seqidno.6-pynz03序列(6246bp)图7.seqidno.7-pynz04序列(6240bp)图8.seqidno.8-pynz05序列(7380bp)图9.eqidno.9-pynz06序列(6954bp)图10.seqidno.10-pynz07序列(5778bp)图11.seqidno.11-pynz08序列(6221bp)图12.seqidno.12-pynz09序列(6131bp)图13.seqidno.13-pynz10序列(6131bp)图14.seqidno.14-pre112-ldha序列(7095bp)图15.seqidno.15-pre112-i1序列(10951bp)序列说明seqidno.1为来源于罗氏真养菌的酰基辅酶a合成酶基因phaaphaa基因:atgactgacgttgtcatcgtatccgccgcccgcaccgcggtcggcaagtttggcggctcgctggccaagatcccggcaccggaactgggtgccgtggtcatcaaggccgcgctggagcgcgccggcgtcaagccggagcaggtgagcgaagtcatcatgggccaggtgctgaccgccggttcgggccagaaccccgcacgccaggccgcgatcaaggccggcctgccggcgatggtgccggccatgaccatcaacaaggtgtgcggctcgggcctgaaggccgtgatgctggccgccaacgcgatcatggcgggcgacgccgagatcgtggtggccggcggccaggaaaacatgagcgccgccccgcacgtgctgccgggctcgcgcgatggtttccgcatgggcgatgccaagctggtcgacaccatgatcgtcgacggcctgtgggacgtgtacaaccagtaccacatgggcatcaccgccgagaacgtggccaaggaatacggcatcacacgcgaggcgcaggatgagttcgccgtcggctcgcagaacaaggccgaagccgcgcagaaggccggcaagtttgacgaagagatcgtcccggtgctgatcccgcagcgcaagggcgacccggtggccttcaagaccgacgagttcgtgcgccagggcgccacgctggacagcatgtccggcctcaagcccgccttcgacaaggccggcacggtgaccgcggccaacgcctcgggcctgaacgacggcgccgccgcggtggtggtgatgtcggcggccaaggccaaggaactgggcctgaccccgctggccacgatcaagagctatgccaacgccggtgtcgatcccaaggtgatgggcatgggcccggtgccggcctccaagcgcgccctgtcgcgcgccgagtggaccccgcaagacctggacctgatggagatcaacgaggcctttgccgcgcaggcgctggcggtgcaccagcagatgggctgggacacctccaaggtcaatgtgaacggcggcgccatcgccatcggccacccgatcggcgcgtcgggctgccgtatcctggtgacgctgctgcacgagatgaagcgccgtgacgcgaagaagggcctggcctcgctgtgcatcggcggcggcatgggcgtggcgctggcagtcgagcgcaaa(seqidno:1)seqidno.2为来源于罗氏真养菌的乙酰乙酰辅酶a还原酶基因phabphab基因:atgactcagcgcattgcgtatgtgaccggcggcatgggtggtatcggaaccgccatttgccagcggctggccaaggatggctttcgtgtggtggccggttgcggccccaactcgccgcgccgcgaaaagtggctggagcagcagaaggccctgggcttcgatttcattgcctcggaaggcaatgtggctgactgggactcgaccaagaccgcattcgacaaggtcaagtccgaggtcggcgaggttgatgtgctgatcaacaacgccggtatcacccgcgacgtggtgttccgcaagatgacccgcgccgactgggatgcggtgatcgacaccaacctgacctcgctgttcaacgtcaccaagcaggtgatcgacggcatggccgaccgtggctggggccgcatcgtcaacatctcgtcggtgaacgggcagaagggccagttcggccagaccaactactccaccgccaaggccggcctgcatggcttcaccatggcactggcgcaggaagtggcgaccaagggcgtgaccgtcaacacggtctctccgggctatatcgccaccgacatggtcaaggcgatccgccaggacgtgctcgacaagatcgtcgcgacgatcccggtcaagcgcctgggcctgccggaagagatcgcctcgatctgcgcctggttgtcgtcggaggagtccggtttctcgaccggcgccgacttctcgctcaacggcggcctgcatatgggctaa(seqidno:2)seqidno.3为来源于大肠杆菌的硫解酶基因tesbtesb基因:atgagtcaggcgctaaaaaatttactgacattgttaaatctggaaaaaattgaggaaggactctttcgcggccagagtgaagatttaggtttacgccaggtgtttggcggccaggtcgtgggtcaggccttgtatgctgcaaaagagaccgtccctgaagagcggctggtacattcgtttcacagctactttcttcgccctggcgatagtaagaagccgattatttatgatgtcgaaacgctgcgtgacggtaacagcttcagcgcccgccgggttgctgctattcaaaacggcaaaccgattttttatatgactgcctctttccaggcaccagaagcgggtttcgaacatcaaaaaacaatgccgtccgcgccagcgcctgatggcctcccttcggaaacgcaaatcgcccaatcgctggcgcacctgctgccgccagtgctgaaagataaattcatctgcgatcgtccgctggaagtccgtccggtggagtttcataacccactgaaaggtcacgtcgcagaaccacatcgtcaggtgtggatccgcgcaaatggtagcgtgccggatgacctgcgcgttcatcagtatctgctcggttacgcttctgatcttaacttcctgccggtagctctacagccgcacggcatcggttttctcgaaccggggattcagattgccaccattgaccattccatgtggttccatcgcccgtttaatttgaatgaatggctgctgtatagcgtggagagcacctcggcgtccagcgcacgtggctttgtgcgcggtgagttttatacccaagacggcgtactggttgcctcgaccgttcaggaaggggtgatgcgtaatcacaattaa(seqidno:3)seqidno.4为pynz01序列(6246bp)seqidno.5为pynz02序列(6252bp)seqidno.6为pynz03序列(6246bp)seqidno.7为pynz04序列(6240bp)seqidno.8为pynz05序列(7380bp)seqidno.9为pynz06序列(6954bp)seqidno.10为pynz07序列(5778bp)seqidno.11为pynz08序列(6221bp)seqidno.12为pynz09序列(6131bp)seqidno.13为pynz10序列(6131bp)seqidno.14为pre112-ldha序列(7095bp)seqidno.15为pre112-i1序列(10951bp)具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。3-羟基丁酸标样:sigma–aldrich,usa.产品目录号55397。英文缩写:3hb代表3-羟基丁酸。实施例中的培养基配方:lb培养基:含10g/lnacl,10g/l蛋白胨(购自英国oxiod公司,产品目录号lp0042)、5g/l酵母提取物(购自英国oxiod公司,产品目录号lp0021)、余量为水,高压蒸汽灭菌。mrs培养基:干粉购自英国oxiod公司,产品目录号cm1175,52g干粉溶于1l蒸馏水中,115℃高压蒸汽灭菌15min。在实际培养过程中,可向上述培养基中加入一定浓度的抗生素以维持质粒的稳定性,常用抗生素包括:氯霉素母液(25mg/ml)。若需获得固体培养基,则在上述液体培养基的基础上添加1.5%琼脂,灭菌后冷却至60℃,按需求添加适量抗生素,混匀后倒平板。实施例中的e.colinissle1917大肠杆菌(kruisw,p,pokrotnieksj,etal.maintainingremissionofulcerativecolitiswiththeprobioticescherichiacolinissle1917isaseffectiveaswithstandardmesalazine[j].gut,2004,53(11):1617-1623.)电转方法:1.大肠杆菌e.colinissle1917电转感受态制备1)取保存于-80℃冰箱的菌种甘油管,划线接种lb培养基平板,37℃培养12h;2)摇瓶培养至od600=0.5左右;3)冰上放置10min,4℃,4000g离心10min,收集菌体,倒掉上清。加入20ml预冷的10%甘油溶液重悬菌体;4)4℃,4000g离心10min,收集菌体,倒掉上清。加入20ml预冷的10%甘油溶液再次重悬菌体;5)4℃,4000g离心10min;倒掉上清,每瓶(200ml菌液)预留1.2ml10%无菌甘油水上清液,重悬菌体;6)分装至1.5ml离心管中待用,每管分装50μl。2.大肠杆菌e.colinissle1917电转方法1)加入100ng质粒,混匀后加入电击杯中,电转条件为1.8kv。随后立即加入600μl无抗lb培养基。2)37℃摇床上活化1.5h,涂布抗性平板。实施例中的lactobacillusgasseriatcc33323电转方法:1)过夜37℃静置培养菌液,以1:100比例接种至含1%甘氨酸的mrs培养基中(20ml培养基中加入200ul种子液),37℃静置培养至od≈0.2。2)冰上放置10min。3)4000g4℃离心10min,弃上清。4)在预冷的10%甘油中重悬(加入10ml),4000g离心10min,弃上清,重复1次。5)在预冷的10%甘油中重悬(加入200μl),分装为一管50μl,立即进行电转。6)感受态和电击杯均置于冰上,感受态中加入1μl质粒,电压为1.25kv,连续电击10次,随后立即加入1mlmrs培养基,37℃静置培养3h,涂抗性平板。7)克隆生长至可见需72h左右。实施例中的bacilluscoagulansdsm1(zhangc,zhouc,assavasirijindan,etal.non-sterilizedfermentationofhighopticallypured-lacticacidbyageneticallymodifiedthermophilicbacilluscoagulansstrain[j].microbialcellfactories,2017,16(1):213)电转方法:1)过夜37℃静置培养菌液,以1:100比例接种至含1%甘氨酸的ypd培养基中(20ml培养基中加入200ul种子液),37℃静置培养至od≈0.8。2)冰上放置10min。3)4000g4℃离心10min,弃上清。4)在预冷的10%甘油中重悬(加入10ml),4000g离心10min,弃上清,重复1次。5)在预冷的10%甘油中重悬(加入200μl),分装为一管50μl,立即进行电转。6)感受态和电击杯均置于冰上,感受态中加入1μl质粒,电压为1.75kv,连续电击2次,随后立即加入1mlypd培养基,37℃静置培养3h,涂抗性平板。7)克隆生长至可见需72h左右。实施例中制备大肠杆菌种子液的方法:1)菌种活化取保存于-80℃冰箱的菌种甘油管,划线接种至lb培养基平板,有无抗性以实际情况而定,37℃培养12h。2)一级种子从完成步骤1的平板上挑取接单菌落,接种于20ml无抗lb培养基或20ml含25mg/l氯霉素的液体lb培养基,37℃、200rpm振荡培养12h。3)二级种子取步骤2得到的一级种子液,按照1%的接种量接种于20ml无抗lb培养基或20ml含25mg/l氯霉素的液体lb培养基,37℃、200rpm振荡培养12h。实施例中制备乳杆菌种子液的方法:1)菌种活化取保存于-80℃冰箱的菌种甘油管,划线接种至mrs培养基平板,有无抗性以实际情况而定,37℃静置培养12h。2)一级种子从完成步骤1的平板上挑取接单菌落,接种于20ml无抗mrs培养基或20ml含10mg/l氯霉素的液体mrs培养基,37℃静置培养12h。3)二级种子取步骤2得到的一级种子液,按照1%的接种量接种于20ml无抗mrs培养基或20ml含10mg/l氯霉素的液体mrs培养基,37℃静置培养12h。实施例中制备凝结芽孢杆菌种子液的方法:1)菌种活化取保存于-80℃冰箱的菌种甘油管,划线接种至ypd培养基平板,有无抗性以实际情况而定,37℃静置培养12h。2)一级种子从完成步骤1的平板上挑取接单菌落,接种于20ml无抗ypd培养基或20ml含7mg/l氯霉素的液体ypd培养基,37℃静置培养12h。3)二级种子取步骤2得到的一级种子液,按照1%的接种量接种于20ml无抗ypd培养基或20ml含7mg/l氯霉素的液体ypd培养基,37℃静置培养12h。实施例中构建基因敲除株及整合基因组的方法:1)转化自杀质粒pre112-ldha或pre112-i12)电转方法如上所示,涂布含25mg/l氯霉素的lb平板,37℃培养12h。3)同源重组4)挑取单菌落,验证发生单交换后,在含10%蔗糖的lb平板上划线,12h后生长出单菌落,挑取单菌落验证敲除结果。hplc检测3hb浓度的方法。发酵上清液12000g离心1min,取上清并稀释至原浓度六分之一,经0.22μm滤膜过滤后进行hplc实验,机器型号为岛津lc-20,色谱柱为aminexhpx-87h,检测器为rid-10a示差检测器,流动相为5mm硫酸水溶液,流速为0.5ml/min,样品中3hb浓度由标样峰面积的标准曲线计算获得。实施例1应用重组益生大肠杆菌escherichiacolinissle1917生产3-羟基丁酸(3hb)一、重组大肠杆菌的构建1.质粒pynz01-pynz14的构建pynz系列质粒的骨架为pnz8148(质粒参见zhangj,fury,hugenholtzj,etal.glutathioneprotectslactococcuslactisagainstacidstress[j].appl.environ.microbiol.,2007,73(16):5268-5275)制备质粒pynz01,如序列表的序列pynz01所示。质粒pynz01的序列示意图如图1中a所示,为环形质粒。序列表的序列pynz01中,第127-337位核苷酸为p23启动子(genbankaccessionno.m24763.1)及其rbs,第338-1198位核苷酸为tesb基因(genbankaccessionno.m63308.1),第1283-2461位核苷酸为phaa基因(genbankaccessionno.fj897461.1),第2539-3285位核苷酸为phabtd基因(genbankaccessionno.egp18919.1)。制备质粒pynz02,如序列表的序列pynz02所示。质粒pynz02的结构示意图如图1中b所示,为环形质粒。序列表的序列pynz02中,第127-337位核苷酸为p23启动子及其rbs,第338-1198位核苷酸为tesb基因,第1283-2467位核苷酸为bktb基因(genbankaccessionno.af026544.2),第2545-3291位核苷酸为phabtd基因。制备质粒pynz03,如序列表的序列pynz03所示。质粒pynz03的结构示意图如图1中c所示,为环形质粒。序列表的序列pynz03中,第127-337位核苷酸为p23启动子及其rbs,第338-1198位核苷酸为tesb基因,第1283-2461位核苷酸为thla基因(genbankaccessionno.af072734.1),第2539-3285位核苷酸为phabtd基因。制备质粒pynz04,如序列表的序列pynz04所示。质粒pynz04的结构示意图如图1中d所示,为环形质粒。序列表的序列pynz04中,第127-337位核苷酸为p23启动子及其rbs,第338-1198位核苷酸为tesb基因,第1283-2461位核苷酸为thla基因,第2539-3279位核苷酸为phabre基因(genbankaccessionno.fj897462.1)。制备质粒pynz05,如序列表的序列pynz05所示。质粒pynz05的结构示意图如图1中e所示,为环形质粒。序列表的序列pynz05中,第127-337位核苷酸为p23启动子及其rbs,第338-1243位核苷酸为ptb基因(genbankaccessionno.ae001437.1),第1271-2338位核苷酸为buk基因(genbankaccessionno.ae001437.1),第2423-3601位核苷酸为phaa基因,第3679-4419位核苷酸为phabre基因。制备质粒pynz06,如序列表的序列pynz06所示。质粒pynz06的结构示意图如图1中f所示,为环形质粒。序列表的序列pynz06中,第127-337位核苷酸为p23启动子及其rbs,第338-1912位核苷酸为pct基因(genbankaccessionno.kt199425.1),第1997-3175位核苷酸为phaa基因,第3253-3993位核苷酸为phabre基因。制备质粒pynz07,如序列表的序列pynz07所示。质粒pynz07的结构示意图如图1中g所示,为环形质粒。序列表的序列pynz07中,第127-337位核苷酸为p23启动子及其rbs,第338-736位核苷酸为ycia基因(genbankaccessionno.cp047127.1),第1264-2442位核苷酸为phaa基因,第2077-2817位核苷酸为phabre基因。制备质粒pynz08,如序列表的序列pynz08所示。质粒pynz08的结构示意图如图1中h所示,为环形质粒。序列表的序列pynz08中,第127-318位核苷酸为p32启动子及其rbs,第319-1179位核苷酸为tesb基因(genbankaccessionno.cp047127.1),第821-1999位核苷酸为phaa基因,第2520-3260位核苷酸为phabre基因。制备质粒pynz09,如序列表的序列pynz09所示。质粒pynz09的结构示意图如图1中i所示,为环形质粒。序列表的序列pynz09中,第127-228位核苷酸为j23110启动子(genbankaccessionno.mg649435.1)及与上文相同的rbs,第229-1089位核苷酸为tesb基因,第1174-2352位核苷酸为phaa基因,第2430-3170位核苷酸为phabre基因。制备质粒pynz10,如序列表的序列pynz10所示。质粒pynz10的结构示意图如图1中j所示,为环形质粒。序列表的序列pynz10中,第127-228位核苷酸为j23119启动子及与上文相同的rbs,第229-1089位核苷酸为tesb基因,第1174-2352位核苷酸为phaa基因,第2430-3170位核苷酸为phabre基因。制备质粒pre112-ldha,如序列表的序列pre112-ldha所示。质粒pre112-ldha的结构示意图如图2所示,为环形质粒。序列表的序列pre112-ldha中,第62-463位核苷酸为sacb基因的启动子(genbankaccessionno.fj437239.1),第464-1885位核苷酸为sacb基因(genbankaccessionno.fj437239.1),第2009-2452位核苷酸为r6kγ复制子,第5130-6109位核苷酸为ldha基因上游同源臂,第6110-7051位核苷酸为ldha基因下游同源臂。制备质粒pre112-i1,如序列表的序列pre112-i1所示。质粒pre112-i1的结构示意图如图3所示,为环形质粒。序列表的序列pre112-i1中,第93-482位核苷酸为r6kγ复制子,第510-955位核苷酸为sacb基因的启动子,第956-2377位核苷酸为sacb基因,第3125-4103位核苷酸为malek基因上游同源臂,第4104-7256位核苷酸为3hb合成基因簇,第7257-8315位核苷酸为malek基因下游同源臂。重组菌e.colinissle1917的构建将上述的质粒pynz01、pynz02、pynz03、pynz04、pynz05、pynz06、pynz07、pynz08、pynz09和pynz10通过电转化方式分别转入大肠杆菌e.colinissle1917中,方法如实施方式部分所示,得到的重组菌分别命名为ecny-1、ecny-2、ecny-3、ecny-4、ecny-5、ecny-6、ecny-7、ecny-8、ecny-9和ecny-10。敲除株ecnδldha的构建将上述质粒pre112-ldha通过电转化方式转入大肠杆菌e.colinissle1917中,方法如实施方式部分所示。通过同源重组的方式得到敲除株ecnδldha。将质粒pynz04通过电转化方式转入ecnδldha菌株中,得到的重组菌命名为ecny-11。3hb合成通路整合基因组菌株的构建将上述质粒pre112-i1通过电转化方式转入大肠杆菌e.colinissle1917中,方法如实施方式部分所示。通过同源重组的方式得到重组株ecn3hb。二、e.colinissle1917的前期表征1.制备e.colinissle1917的种子液。2.微氧培养实验取0.5ml步骤1得到的种子液,接种于含9.5mllb培养基的10ml无菌试管中,密封后37℃、静置培养48小时。或取0.5ml步骤1得到的种子液,接种于含5g/l3hb的9.5mllb培养基中,调节ph至7左右,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表1。可得到结论:e.colinissle1917在天然条件下不会生产3hb;e.colinissle1917对于3hb有微弱的降解能力,但不影响其作为3hb生产底盘菌的使用。表1大肠杆菌e.colinissle1917微氧发酵生产的实验结果菌株培养基3hb浓度(g/l)无lbnde.colinissle1917lbnd无lb+5g/l3hb5.06±0.18e.colinissle1917lb+5g/l3hb4.54±0.21nd表示没有检测到相应单体的特征峰。三、应用重组e.colinissle1917生产3-羟基丁酸并优化酰基辅酶a合成酶1.分别制备对照菌e.colinissle1917、重组大肠杆菌ecny-1、ecny-2和ecny-3的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,lb培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。液相色谱结果显示,3hb标样的出峰时间为16.2min,利用重组大肠杆菌所生产的3hb的保留时间与标样一致。结果见表2。e.colinissle1917中导入3hb合成通路后,在微氧状态下可以生产出3hb。对比来源于cupriavidusnecatorh16的bktb基因和来源于clostridiumacetobutylicumatcc824的thla基因,来源于cupriavidusnecatorh16的phaa基因在上述发酵条件下表现最好,可以生产得到0.33g/l的3hb。表2大肠杆菌e.colinissle1917微氧发酵生产3hb的实验结果菌株3hb产量(g/l)e.colinissle1917ndecny-10.33±0.03ecny-20.05±0.01ecny-30.15±0.03nd表示没有检测到相应单体的特征峰。四、优化乙酰乙酰辅酶a还原酶以提高3hb产量1.分别制备对照菌e.colinissle1917、重组大肠杆菌ecny-1和ecny-4的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,lb培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表3。对比来源于halomonas.bluephagenesistd01的phab基因,来源于cupriavidusnecatorh16的phab基因在上述发酵条件下表现最好,可以生产得到0.63g/l的3hb。表3重组大肠杆菌优化乙酰乙酰辅酶a还原酶后3hb的生产结果nd表示没有检测到相应单体的特征峰。五、优化硫酯酶以提高3hb产量1.分别制备对照菌e.colinissle1917、重组大肠杆菌ecny-4、ecny-5、ecny-6和ecny-7的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,lb培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表4。与来源于clostridiumacetobutylicumatcc824的ptb-buk基因、pct基因,来源于e.colik12的ycia基因相比,来源于e.colik12的tesb基因在上述发酵条件下表现最好。表4重组大肠杆菌优化硫酯酶后3hb的生产结果菌株3hb产量(g/l)e.colinissle1917ndecny-40.61±0.02ecny-50.27±0.01ecny-60.22±0.03ecny-70.06±0.01nd表示没有检测到相应单体的特征峰。六、优化启动子类型以提高3hb产量1.分别制备对照菌e.colinissle1917、重组大肠杆菌ecny-4、ecny-8、ecny-9和ecny-10的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,lb培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表5。与来源于streptococcuscremoris的弱启动子p32,来源于bacillussubtilis的弱启动子j23110相比,强启动子p23和j23119的表现更好。表5重组大肠杆菌优化启动子后3hb的生产结果菌株3hb产量(g/l)e.colinissle1917ndecny-40.64±0.05ecny-80.13±0.01ecny-90.24±0.01ecny-100.56±0.02nd表示没有检测到相应单体的特征峰。七、敲除ldha基因以提高3hb产量1.分别制备对照菌ecnδldha、重组大肠杆菌ecny-4和ecny-11的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,lb培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表6a。敲除乳酸脱氢酶ldha后,重组菌的3hb产量上升至0.92g/l。表6a重组大肠杆菌敲除ldha基因后3hb的生产结果nd表示没有检测到相应单体的特征峰。八、e.colinissle1917整合3hb合成通路1.分别制备对照菌e.colinissle1917和重组菌ecn3hb的种子液。2.微氧培养实验取0.5ml步骤1得到的重组大肠杆菌和对照菌种子液,接种于含9.5mllb培养基的10ml无菌试管中,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表6b。基因组整合3hb通路后,重组菌的3hb产量为至0.24g/l。表6b大肠杆菌e.colinissle1917整合基因组后3hb的生产结果菌株3hb产量(g/l)e.colinissle1917ndecn3hb0.24±0.01nd表示没有检测到相应单体的特征峰。实施例2应用重组益生乳杆菌lactobacillusgasseriatcc33323生产3-羟基丁酸一、重组乳杆菌的构建将上述的质粒pynz01和pynz04通过电转化方式分别转入乳杆菌lactobacillusgasseriatcc33323中,方法如实施方式部分所示,得到的重组菌分别命名为lagy-1和lagy-2。二、应用重组lactobacillusgasseriatcc33323生产3-羟基丁酸1.分别制备对照菌lactobacillusgasseriatcc33323、重组乳杆菌lagy-1和lagy-2的种子液。2.微氧培养实验取0.5ml步骤1得到的种子液,接种于含9.5mlmrs培养基的10ml无菌试管中,mrs培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表7。可得到结论肠道益生乳杆菌具有发酵生产3hb的能力。表7重组乳杆菌3hb生产结果菌株3hb产量(g/l)lactobacillusgasseriatcc33323ndlagy-10.004±0.001lagy-20.006±0.001nd表示没有检测到相应单体的特征峰。实施例3应用重组益生凝结芽孢杆菌bacilluscoagulansdsm1生产3-羟基丁酸1.分别制备对照菌bacilluscoagulansdsm1、重组凝结芽孢杆菌bacy-1和bacy-2的种子液。2.微氧培养实验取0.5ml步骤1得到的种子液,接种于含9.5mlypd培养基的10ml无菌试管中,ypd培养基中根据需求加入相对应的抗生素,密封后37℃、静置培养48小时。培养结束后,进行3hb含量的测定。进行两次重复试验,每次重复试验设置三个生物学平行样品,结果取平均值。结果见表8。可得到结论肠道益生凝结芽孢杆菌具有发酵生产3hb的能力。表8重组凝结芽孢杆菌3hb生产结果菌株3hb产量(g/l)bacilluscoagulansdsm1ndbacy-10.03±0.005bacy-20.07±0.011nd表示没有检测到相应单体的特征峰。实施例4应用产3-羟基丁酸重组益生菌治疗动物疾病模型一、应用产3-羟基丁酸重组益生菌治疗动物肠癌模型1.分别制备对照菌e.colinissle1917和重组菌ecn3hb的种子液。2.小鼠模型的构建实验动物:c57雌性小鼠,8周龄,体重18-20g,自北京维通利华公司购买。结肠癌造模方法采用aom/dss给药方案:腹腔注射aom(氧化偶氮甲烷)溶液(aom用量为10mg/kg小鼠体重)。aom给药一周后,持续一周以饮水方式给药25mg/mldss(硫酸葡聚糖钠盐)溶液,每只鼠保证每天至少饮入5mldss溶液,dss溶液给予结束后,连续饮用正常水14天,给予dss溶液和水的步骤为一个循环,连续进行三个循环。3.重组益生菌治疗实验取60只肠癌模型小鼠,随机分为3组:未处理组(20只),灌胃野生型e.colinissle1917组(20只),灌胃ecn3hb组(20只)。小鼠第8天开始进行aom/dss给药方案。灌胃野生型e.colinissle1917组:小鼠灌胃野生型e.colinissle1917菌液200μl,细菌数量约为1×108个。灌胃ecn3hb组:小鼠灌胃ecn3hb菌液200μl,细菌数量约为1×108个。第60天处死小鼠。实验结束后取出小鼠的结肠,统计肿瘤数量。结果如表9所示。统计小鼠体重,结果如表10所示。统计小鼠结肠长度,结果如表11所示。可见灌胃生产3hb的细菌对于小鼠肠癌有治疗作用。表9重组肠道菌治疗后肠癌肿瘤数量菌株肿瘤数量(个)无7.1±2.5e.colinissle19176.6±1.9ecn3hb3.2±1.1表10重组肠道菌治疗后肠癌小鼠体重菌株小鼠体重(g)无14.7±2.1e.colinissle191717.2±2.3ecn3hb20.4±1.8表11重组肠道菌治疗后肠癌小鼠结肠长度二、应用产3-羟基丁酸重组益生菌治疗动物动脉粥样硬化模型1.分别制备对照菌e.colinissle1917和重组菌ecn3hb的种子液。2.小鼠模型的构建apoe敲除小鼠购买于北大医学部的实验动物中心,5周龄60只,喂养同样的高脂食物:含有40%脂肪,1.25%胆固醇,0.5%胆汁酸。高脂饲料适应性喂养即可完成小鼠动脉粥样硬化模型的构建。3.重组益生菌治疗实验取60只动脉粥样硬化模型小鼠,随机分为3组:未处理组(20只),灌胃野生型e.colinissle1917组(20只),灌胃ecn3hb组(20只)。高脂饲料适应性喂养1周后,灌胃益生菌。灌胃野生型e.colinissle1917组:小鼠灌胃野生型e.colinissle1917菌液200μl,细菌数量约为1×108个。灌胃ecn3hb组:小鼠灌胃ecn3hb菌液200μl,细菌数量约为1×108个。第60天处死小鼠。实验结束后取小鼠的主动脉,主动脉用pbs清洗两遍后,进行大体油红o染色实验,具体步骤如下:1)小心地剔除主动脉周围脂肪及其他组织。2)沿主动脉弓弯曲将主动脉纵向剖开。3)配制新鲜油红o工作液并用滤膜过滤两遍,将纵向剖开的主动脉浸入油红o工作液中,室温放置2个小时。4)用70%乙醇脱色,直至无病变处血管壁变透明,斑块处仍然是鲜红色为止,水洗3次去除乙醇。5)沿剪开处将主动脉铺在黑色平板上,统计斑块体积占比。结果如表12所示。可见灌胃生产3hb的细菌对于小鼠动脉粥样硬化有治疗作用。表12重组肠道菌治疗动脉粥样硬化结果三、应用产3-羟基丁酸重组益生菌治疗动物肥胖模型1.分别制备对照菌e.colinissle1917和重组菌ecn3hb的种子液。2.小鼠模型的构建apoe敲除小鼠购买于北大医学部的实验动物中心,5周龄60只,喂养同样的高脂食物:含有40%脂肪,1.25%胆固醇,0.5%胆汁酸。高脂饲料适应性喂养即可完成小鼠肥胖模型的构建。3.重组益生菌治疗实验取60只肥胖模型小鼠,随机分为3组:未处理组(20只),灌胃野生型e.colinissle1917组(20只),灌胃ecn3hb组(20只)。,高脂饲料适应性喂养1周后,灌胃益生菌。灌胃野生型e.colinissle1917组:小鼠灌胃野生型e.colinissle1917菌液200μl,细菌数量约为1×108个。灌胃ecn3hb组:小鼠灌胃ecn3hb菌液200μl,细菌数量约为1×108个。随后继续高脂喂养9周,第70天处死小鼠。实验过程中定期监控小鼠体重变化与身体状况,每天记录小鼠采食量。结果表明可见灌胃生产3hb的细菌可以明显降低apoe敲除小鼠体重,且不影响apoe敲除小鼠的摄食量,详见表13。表13重组肠道菌治疗肥胖结果菌株小鼠体重(g)平均进食量(g)无29.3±1.22.8±0.3e.colinissle191728.8±0.92.6±0.5ecn3hb21.5±1.82.6±0.6以上实施例仅为本发明的示例性实施例,不用于限制本发明,本发明的保护范围由权利要求书限定。本领域技术人员可以在本发明的实质和保护范围内,对本发明做出各种修改或等同替换,这种修改或等同替换也应视为落在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1