同时检测8种动物成分的引物、试剂盒及检测方法和应用与流程
本发明属于基因检测领域,具体涉及一步法同时检测食品或饲料中的猪、牛、羊、鸡、鸭、兔、狐狸、貂等8种动物源性成分的引物组合物、试剂盒及其检测方法和应用。
背景技术:
食品安全是当今社会高度关注的热点话题。随着人民生活水平的提高,肉及肉制品在饮食结构中所占的比重越来越大。不法商家常常采用以次充好、掺杂使假等手段来降低肉及肉制品的成本,攫取不当利润,导致当前市场中肉及肉制品中假冒伪劣现象突出。市场中常见的肉类掺杂使假手段是用规模化饲养的价廉的动物肉(如鸡肉、鸭肉)来假冒质优价高的牛羊肉,甚至用不可食用的肉类(如狐狸肉、貂肉等)来假冒牛、羊肉和猪肉、兔肉等。
肉类的掺杂使假现象严重扰乱了市场正常秩序,侵害了消费者的正当权益,甚至危害人民生命财产安全,引发严重的食品安全问题及其他问题。人们食用了假冒伪劣肉制品后,可能因产品中含有某些致病微生物或对人体有毒有害的成分,导致生病、中毒等状况发生,或使有些对个别种类的肉类过敏的人群在不知情的情况下食用了过敏原,引发过敏性疾病。这就要求建立准确高效的肉类鉴定方法,在此基础上,食品监管部门才能加大监管以确保食品安全,保障消费者免受肉类造假带来的对权益和健康的侵害。
同样,饲料中也存在肉类蛋白原料掺杂使假情况。国内外均报道过用低值肉肉类蛋白原料假冒高值肉类蛋白原料的现象,或使用动物内脏、羽毛粉、骨粉等代替鱼粉等情况,扰乱了饲料行业的正常秩序,增加了养殖患病风险等。这也要求建立准确高效的肉类鉴定方法,在此基础上,农业监管部门才能加大监管力度以确保饲料安全,从而保障养殖安全和畜产品安全。
快速、准确、便捷、高效、经济的肉类鉴别方法是食品检测和饲料检测领域面临的难题。传统的基于形态学特征(风味、颜色、形状、口味、外观)建立的肉类鉴定方法,如感官分析法、组织学鉴别法等,无法区分不同的动物源成分。基于蛋白质分析建立的肉类鉴别方法,如电泳法、elisa法等,存在分辨率低,易出现假阳性、假阴性结果,而且在食品和饲料加工、熟制过程中,蛋白质经历高温、高压而发生变性,影响检测结果的准确性,导致基于蛋白质分析的检测方法在熟肉制品的成分检测上尤其困难。
虽然在食品、饲料加工过程中,一些用于区分肉类的生物标记会遭到破坏。但dna在所有组织和细胞中具有极高的稳定性和广布性,因此基于dna的肉类鉴定方法具有良好的适用性。基于dna的肉类鉴别方法主要有聚合酶链式反应(pcr)、多重pcr、荧光定量pcr、lamp等。
(1)pcr:能够指数级扩增特定的dna片段,特异性和灵敏度高,可用于鉴定造假肉类原材料和肉制品。经典的pcr是用一对特异性引物来扩增一个目标片段。传统pcr方法鉴定肉类,一次只能用一对引物来鉴定一个物种。对两种以上的肉类及其制品则要分别进行多次pcr检测才能鉴别,耗时长、成本高。
(2)多重pcr:是在同一pcr反应体系里加如2对以上的引物,同时扩增多个核酸片段,用于鉴别含有2种以上的肉类制品。多重pcr的检测效率高于传统pcr。多重pcr检测需要克服的两大难题是多重pcr引物的设计以及多重pcr反应条件的优化,前者以保证引物的特异性,后者确保检测的稳定性。
(3)实时荧光定量pcr:可以对肉制品进行定性或定量分析,灵敏度高。与pcr相比,荧光pcr省略了电泳或测序鉴定步骤。但是荧光pcr需要购置昂贵的荧光定量pcr仪以及昂贵的荧光pcr试剂盒,检测操作过程中还容易出现污染和假阳性结果。况且在多数情况下肉类检测只要求定性检测,定量检测没有现实意义。相比之下,多重pcr更适用于日常生产活动中的肉类检测,荧光pcr检测方法难以在实际中普及推广。
本发明与现有发明的区别:
现有专利cn108330168a公开了基于2个5重pcr反应和微芯片电泳技术鉴别肉或肉制品中是否含有猪、牛、绵羊、山羊、鸡、鸭、狗、狐、貉、猫、鼠、驴、鹿和马14种动物源性成分,但每个多重pcr体系只能鉴定5种动物源成分,而且该专利没有涵盖规模饲养且常见于肉制品中的兔肉。
现有专利cn108411001a公开了可以鉴别狗、鸡、牛、猪、马、驴、狐狸、兔的多重pcr检测引物、试剂盒及鉴定方法,该引物体系可一次性检测多达8个动物种类,但是该专利没有涵盖养殖中规模饲养且常见于肉制品中的羊、鸭、貂等肉类品种。
现有专利cn104498597a根据猪、羊、鸡、老鼠、牛的线粒体细胞色素基因序列,设计特异性引物对,建立了鉴别上述五种动物成分的多重pcr方法,该法不能鉴定鸭、狐狸、貂、兔等大规模饲养且常见于肉制品中的肉类。
现有专利cn103361422a公开了狐狸肉、老鼠肉、猪肉、鸡、鸭的5重pcr检测方法,不能鉴定牛、羊、兔、貂等大规模饲养且常见于肉制品中的肉类。
现有专利cn105506167a公开了用单一通用引物扩增线粒体中的目的片段,再用特定限制性内切酶酶切,根据酶切条带判定物种组成,建立的方法能鉴别猪、牛、羊、鸡、鸭、鼠、鱼等成分,但该专利检测步骤繁琐且没有涵盖日常生活中规模饲养且常见于肉制品中的狐狸、貂、兔等肉类品种。
现有专利cn106811534a公开了采用一对通用pcr引物进行pcr扩增然后进行基因片段测序分析物种类型的方法,可以鉴别鱼、虾、猪、牛、羊、鸡等肉类,但不能鉴定鸭、狐狸、貂、兔等大规模饲养且常见于肉制品中的肉类。
现有专利cn105274099a是采用荧光定量pcr方法实现了对猪、牛、羊、马、貂、鼠、鸡、鸭、狐狸共9种动物源成分进行检测,但是通过3个反应体系进行的,每个反应体系只能检测3重动物源成分。
现有专利cn102899394a公开了耗牛肉、鸡肉、猪肉、兔肉、羊等5种动物成分的lamp检测试剂盒和检测方法,但该发明是将5个独立的检测试剂和检测方法简单组合到一起。
在多重pcr检测体系中增加一种动物成分的检测,就需要增加一对特异性引物,不仅需要保证该对引物只能特异性扩增出该物种且片段大小与其它扩增片段有明显差异,而且要保证该对引物不能与其它引物之间不形成发卡结构或二聚体,引物设计难度呈倍数级增加。同时还要优化多重pcr反应体系和反应程序,以保证能高效扩增出所有目的条带。
技术实现要素:
针对现有技术存在的不足,本发明提供一步法快速鉴定食品或饲料中牛、羊、猪、鸡、鸭、狐狸、水貂和兔等8种动物源性成分的引物组合物、试剂盒及其检测方法,利用本发明的引物组合物、试剂盒及其检测方法可以同时快速鉴定出含有上述1~8种动物源成分。
本发明通过以下技术方案实现:
同时检测8种动物成分的引物、试剂盒及检测方法和应用,其核苷酸序列如下:
(1)羊源特异引物:
上游序列:goat-f:ccaccaactacccacttt,如seqidno:1所示;
下游序列:goat-r:ttgcgtctgttcgtccat,如seqidno:2所示;
(2)牛源特异引物:
上游序列:bovine-f:gcatcattctacccacttt,如seqidno:3所示;
下游序列:bovine-r:cgactattgttggtagaaaag,如seqidno:4所示;
(3)猪源特异引物:
上游序列:pig-f:ttgcccttccatcattac,如seqidno:5所示;
下游序列:pig-r:ctgggatagcatctgttt,如seqidno:6所示;
(4)鸡源特异引物:
上游序列:chicken-f:ggatgatgacaaggacgag,如seqidno:7所示;
下游序列:chicken-r:tagtaaggttatgcggagg,如seqidno:8所示;
(5)鸭源特异引物:
上游序列:duck-f:tagtcatagcaagcctcca,如seqidno:9所示;
下游序列:duck-r:cgtggtattagttatgtggg,如seqidno:10所示;
(6)狐狸源特异引物:
上游序列:fox-f:cctaactatccaaactctcacc,如seqidno:11所示;
下游序列:fox-r:ggccatggtgattatgaa,如seqidno:12所示;
(7)貂源特异引物:
上游序列:mink-f:cctatcaccctttcacttctg,如seqidno:13所示;
下游序列:mink-r:agttagtgctgttgcgtatg,如seqidno:14所示;
(8)兔源特异引物:
上游序列:rabbit-f:ggatgctcaggaggtaga,如seqidno:15所示;
下游序列:rabbit-r:caggtctgatgttgggat,如seqidno:16所示;
本发明提供了引物组合物、taqdna聚合酶、pcr缓冲液的试剂盒,该试剂盒使用方便、快捷、高效、结果准确。
同时检测8种动物成分的引物、试剂盒及检测方法和应用,包括所述引物组合物以及多重pcr反应所必需的反应原料和试剂。
所述的多重pcr反应所必需的反应原料和试剂包括:pcr缓冲液,mgcl2,dntps,taqdna聚合酶、去离子水和肉类dna阳性模板。
所述试剂盒中各组分构成一个25ul的pcr反应体系:10×pcrbuffer2.5μl,25mmol/lmgcl21.6μl,taqdna聚合酶3u,2.5mmol/ldntps2.8μl,各引物对的终浓度为0.08~0.56μmol/l,最后用去离子水定容至25ul。
优选的,狐、羊、鸭的引物对的终浓度各为0.16μmol/l,兔、牛的引物对的终浓度各为0.2μmol/l,貂的引物对的终浓度为0.08μmol/l,猪的引物对的终浓度为0.48μmol/l,鸡的引物对的终浓度为0.56μmol/l。
本发明还提供了同时检测食品或饲料中8种动物源性成分的一步多重pcr检测方法,该方法具有简便、快速、准确、高通量的优点。
一种同时检测食品或饲料中8种动物源成分的多重pcr方法,包括如下步骤:
(1)dna提取方法:肉制品或饲料中的动物源dna提取,需对样品进行前处理,再用优化的十六烷基三甲基溴化铵(ctab)细胞裂解液法从样品中提取总细胞dna,即先称取0.2g样品,加入1ml去离子水,摇晃1min,高速离心,弃上清,在沉淀中加入200μl三氯甲烷,剧烈摇晃重悬沉淀,然后高速离心,小心倾倒出液体,称取0.05g处理的样品沉淀,并将其与500μl2×ctab细胞裂解液(1mol/ltrishcl,4mol/lnacl,0.5mol/ledta,2%ctab,ph8.0)于1.5mlep管中混合均匀,然后65℃水浴3h,每隔15min将ep管取出摇晃30s至1min,水浴完毕后,于ep管中加入等体积事先混匀的酚:氯仿:异戊醇(25:24:1),室温下剧烈摇晃10min,然后10000转离心5min,吸取上层水相,然后加入两倍体积的预冷的无水乙醇,并放于-20℃沉淀10~20min,随后4℃下10000转离心10min,弃上清,加入200μl预冷的70%乙醇,并于室温下轻摇15min,然后4℃下10000转离心10min,弃上清后,将dna沉淀风干,最后加入50μl去离子水溶解dna;
(2)反应体系:优选的,在25ul的pcr反应体系中加入按照所述dna提取方法制备的样品dna1μl,混匀,高速瞬时离心;
(3)反应程序:94℃预变性5min,94℃变性30s,50℃~55.6℃退火55s,72℃延伸90s,共40个循环,最后72℃延伸10min;
优选的,94℃预变性5min,94℃变性30s,55.6℃退火55s,72℃延伸90s,共40个循环,最后72℃延伸10min;
(4)核酸电泳并观察结果:取5μlpcr产物,于1.5%琼脂糖凝胶电泳,然后取出凝胶,置凝胶成像仪中,于紫外灯下观察条带大小,判定结果。
(5)电泳结果判定:琼脂糖凝胶在紫外灯照射下,凝胶中的每一种特异性扩增产物长度代表一种特定的动物源性成分,片段长度为168bp的为牛源性成分检出,片段长度为217bp的为兔源性成分检出,片段长度为303bp的为猪源性成分检出,片段长度为408bp的为羊源性成分检出,片段长度为588bp的为貂源性成分检出,片段长度为707bp的为鸭源性成分检出,片段长度为819bp的为鸡源性成分检出,片段长度为979bp的为狐狸源性成分检出。
上述方法中,所述待检样本可以为冷鲜肉、冻肉、肉类加工制品、动物油脂、饲料原料、肉骨粉、全价饲料等。
所述的引物组合物、试剂盒及其检测方法,可用于所述待检样品中的羊、牛、猪、鸡、鸭、兔、狐狸、貂中的1~8种动物源成分的同时检测。
本发明与与现有的检测技术相比其优点在于:
(1)本发明采用多重pcr技术对肉及肉制品食品及饲料原料中鉴别牛、羊、猪、鸡、鸭、狐狸、貂和兔等8种动物源性成分。通过一步反应就能实现对多达8种动物源成分的同时检测,而这8种动物是国内已经实现规模化养殖且国内肉及肉制品中添加频率最高的动物源成分。本发明方法具有成本低、省时、高效、可同时实现多物种鉴别等优点。目前尚没有一步反应同时检测上述8种动物源成分的多重pcr方面的发明专利。
(2)本发明针对上述8种动物源成分分别选定了不同的线粒体基因作为设计引物的靶基因,如细胞色素c氧化酶亚基ii、12srrna、nadh脱氢酶亚基ii和v等,目的是尽可能提高引物的特异性,从而提高多重pcr检测的特异性和灵敏度,避免相同的靶基因间同源性差异小导致的非特异性扩增影响,本发明通过一个反应体系暨一步反应即可完成8种动物源性成分的定性检测,特别适合混合样品检测。
(3)本发明不需要购置昂贵的仪器及昂贵的检测试剂,检测操作过程中对技术要求不高,容易操作,也不容易出现污染和假阳性结果,多重pcr的结果判定仅需要通过电泳分析观察条带的大小而判断动物源成分的种类,更适用于日常生产活动中的肉类检测,容易在实际中普及推广。
附图说明:
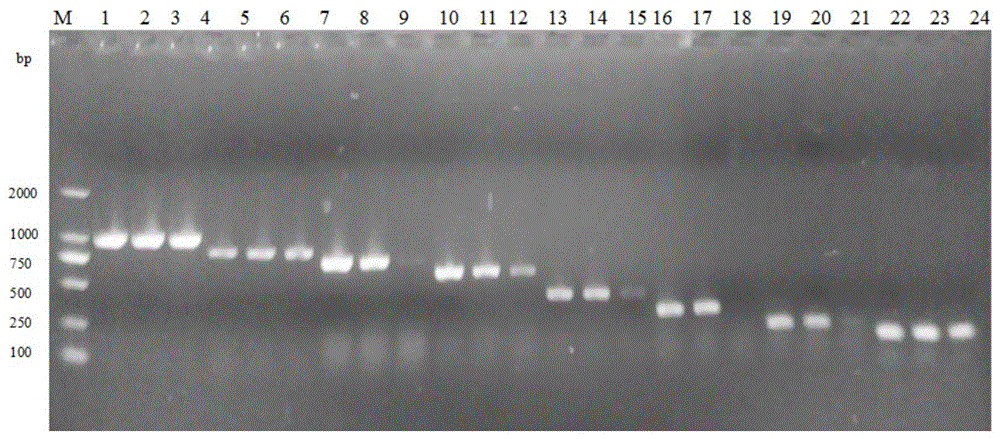
附图1温度梯度pcr产物电泳分析结果。m:dnamarkerdl2000;泳道1、4、7、10、13、16、19、22的pcr退火温度为50℃;泳道2、5、8、11、14、17、20、23的pcr退火温度为55.6℃;泳道3、6、9、12、15、18、21、24的pcr退火温度为60℃。泳道1、2、3为狐狸肉dna;泳道4、5、6为鸡肉dna;泳道7、8、9为鸭肉dna;泳道10、11、12为貂肉dna;泳道13、14、15为羊肉dna;泳道16、17、18为猪肉dna;泳道19、20、21为兔肉dna;泳道22、23、24为牛肉dna。
附图2优化前八重pcr扩增结果。m:100bpdnaladder;5:空白组;1、2、3、4:实验组
附图3多重pcr优化结果。m:100bpdnaladder;5:空白组;1、2、3、4:实验组,tm依次为:54.4℃、55.6℃、56.9℃、58.2℃。
附图4多重pcr对8种动物源成分检测的灵敏度分析。m:100bpdnaladder;5:空白组;1、2:10-1实验组;3、4:10-2实验组。
具体实施方式
下面结合具体实施例,对本发明的具体实施方式作进一步描述。这些实施例仅用于说明而不用于限制本发明的范围。
实施例1:肉类鉴别多重pcr引物设计与质量评估
根据国内规模化养殖现状和市场肉制品中常见的肉类品种,挑选了羊、牛、猪、鸡、鸭、兔、狐狸、貂等8种动物作为研究对象。从genbank数据库检索上述8种动物的线粒体基因(细胞色素c氧化酶亚基ii、12srrna、nadh脱氢酶亚基ii和v)。对不同物种的相同基因的序列用blast软件进行同源比对分析,找出各基因的保守区域。通过比对分析,分别选取细胞色素c氧化酶亚基2基因作为猪、兔源成分鉴别的靶基因,选取nadh脱氢酶亚基5基因作为羊、鸡、狐源成分鉴别的靶基因,选取nadh脱氢酶亚基2基因作为牛、貂源成分鉴别的靶基因,选取12srrna基因作为鸭源成分鉴别的靶基因。上述靶基因在同源序列比对中都显示大于90%的同源性,表明这些基因在同种属中保守性高。
再使用dnaman软件对各基因的非同源序列进行比对,分析各序列间的相似性,依照比对结果确定特异性区域作为pcr扩增的模板,用于设计多重pcr引物。上述基因序列间的匹配度为42.33%,各序列间存在相对特异性区域,可用于设计引物。选择这些种内保守而种间特异的dna序列,用primerpremier和dnaman软件进行引物设计。设计的8种动物成分pcr扩增引物的核苷酸序列见表1。设计的pcr扩增狐、鸡、鸭、貂、羊、猪、兔、牛的dna片段大小依次为979、819、707、588、408、303、217和168bp,引物退火温度为51.1℃~56.9℃。
表1动物源成分的特异性引物序列及目标扩增产物的大小
多重pcr检测方法的成功与否取决于引物质量。多重pcr引物不仅要求保证每对引物只能特异性扩增出该物种的特异片段,且片段大小与其它扩增片段有明显差异,还要保证引物之间不能形成发卡结构或二聚体。每增加一对引物,设计难度呈倍数级增加。同时还要优化多重pcr的反应体系和反应程序,以保证能高效扩增出所有目的条带。
对设计的引物进行质量评估。登录ncbi网站,使用blast模块线上进行引物特异性测试。经blast比对,将筛选出的特异性较好的引物再用thermoscientific网站的引物在线分析工具进行引物二聚体筛查。分析结果表明,各引物序列特异性好,绝大多数引物间不形成二聚体,后续将通过优化反应体系和反应条件,来降低退火温度差异及二聚体对实验结果的影响。
实施例2:dna提取
提取肉制品或饲料中的动物源dna时需对样品进行前处理,再用优化的十六烷基三甲基溴化铵(ctab)细胞裂解液法从样品中提取总细胞dna。先称取0.2g样品,加入1ml去离子水,摇晃1min,高速离心,弃上清,在沉淀中加入200μl三氯甲烷,剧烈摇晃重悬沉淀,然后高速离心,小心倾倒出液体,称取0.05g处理的样品沉淀,并将其与500μl2×ctab细胞裂解液(1mol/ltrishcl,4mol/lnacl,0.5mol/ledta,2%ctab,ph8.0)于1.5mlep管中混合均匀,然后65℃水浴3h,每隔15min将ep管取出摇晃30s~1min,水浴完毕后,于ep管中加入等体积事先混匀的酚:氯仿:异戊醇(25:24:1),室温下剧烈摇晃10min,然后10000转离心5min,吸取上层水相,然后加入两倍体积的预冷的无水乙醇,并放于-20℃沉淀10~20min,随后4℃下10000转离心10min,弃上清,加入200μl预冷的70%乙醇,并于室温下轻摇15min,然后4℃下10000转离心10min,弃上清后,将dna沉淀风干,最后加入50μl去离子水溶解dna。分析dna的完整性、纯度、浓度。
用紫外分光光度计测定dna在260、280nm处的吸光度值,计算a260/a280,获得dna的浓度、纯度。8种动物肉制品采用ctab法提取的dna的浓度、纯度结果见表2。同时对提取的dna样品进行琼脂糖凝胶电泳图谱分析其完整性。通过核酸电泳分析发现,改良的ctab法提取的肉类dna完整性好,电泳分析没有出现dna断裂现象,制备的dna纯度和浓度高,为下一步进行多重pcr检测奠定了基础。用该方法用于提取肉制品及饲料中的动物源dna,效果同样良好,浓度为24.7~420.9ng/μl,纯度为1.6~1.9,能满足pcr检测需要。提取的dna的质量取决于样品中肉类的含量及组份种类的多少。
表2八种动物肉采用ctab法提取的dna的浓度、纯度
实施例3:引物退火温度优化
根据合成引物的理论退火温度,在50℃~60℃范围内进行温度梯度pcr,在该温度范围内设置3个温度梯度。
pcr反应体系为25μl:2.5μl10×pcrbuffer(含mg2+),1.25utaqdna聚合酶,2μl2.5mmol/ldntps,正、反向引物(浓度均为20μmol/l)各0.5μl,1μldna模板,最终用去离子水补足25μl。
pcr反应程序:94℃预变性5min,(94℃变性30s,50℃~60℃退火30s,72℃延伸45s)×25个循环,最后72℃延伸5min。
取5μlpcr产物于1%琼脂糖凝胶电泳后,放入凝胶成像仪中观察条带。
电泳分析结果表明,8对引物在50℃、55.6℃下都能扩增出目的片段,但在60℃下有3对引物扩增不出来,考虑到退火温度升高,pcr扩增的特异性提高,所以最后确定最佳退火温度为55.6℃。结果见附图1。
实施例4:多重pcr反应条件优化
在退火温度固定后,先按照实施例3的反应体系和反应条件作为多重pcr的基础条件进行多重pcr反应,再根据扩增结果调整引物浓度、dntps浓度、mg2+添加量、扩增时间、循环数,进行多重pcr反应条件优化。每次反应设实验重复组、空白组、阳性对照组、阴性对照组。
按照实施例3的反应体系和反应条件进行的多重pcr扩增结果发现,猪dna样品未扩增出条带,其他7条条带也较弱,尤其是牛和兔的条带亮度很低(结果见附图2)。未扩增出条带或条带暗可能是其引物受到其他引物对的抑制,优化时应该增加该引物对的添加量。对于其它7个条带普遍亮度偏低的问题,通过提高退火时间、增加循环数或增加mg2+、dntps浓度进行优化。在初始方案的基础上,增加猪、牛和鸡引物浓度,降低鸭、貂、羊、狐狸、牛的引物浓度,增加dntps浓度,延长退火和延伸时间。经过参数优化后8种动物源成分都获得清晰的条带(见附图3)。
获得最优多重pcr反应体系为:25ul的pcr反应体系:10×pcrbuffer2.5μl,25mmol/lmgcl21.6μl,taqdna聚合酶3u,2.5mmol/ldntps2.8μl,各引物对的终浓度为0.08~0.56μmol/l,dna1μl,最后用去离子水定容至25ul。
最优多重pcr反应程序为:94℃预变性5min,94℃变性30s,55.6℃退火55s,72℃延伸90s,共40个循环,最后72℃延伸10min。
实施例5:多重pcr反应特异性鉴定
每种特定引物应仅能特异性扩增相对应的物种dna,而不能扩增出其它动物物种的dna。试验设置阳性组、阴性组、空白组进行特异性检测。
以狐、鸡、鸭、貂、羊、猪、兔、牛的8对特异性引物组合,分别对8种肉类dna模板逐一进行pcr扩增,结果阳性组都能扩增出来,且条带大小与目的条带的大小一致,而阴性组、空白组未扩增出条带,表明设计的8对引物都具有优良的特异性。
实施例6:pcr产物测序分析
将各引物对通过常规pcr扩增所得到的产物(每管约21μl),送上海生工生物科技有限公司进行基因测序。
将测序结果通过blast与genbank中的序列进行比对,8种动物源成分的扩增条带的测序结果与各自物种靶基因的匹配度均高于96%以上,可判定所有引物都扩增出了目标片段,引物特异性好。
实施例7:多重pcr检测灵敏度性鉴定
将八种阳性dna模板分别进行浓度梯度稀释(10-1~10-6),再利用本发明的多重pcr方法检测可以扩增出的最低模板浓度。设置阳性组、阴性组、空白组作对照。
灵敏度实验结果表明,羊、鸡引物的最低检出限度为0.97ng/μl,鸭引物的最低检出限度为4.88ng/μl,牛引物的最低检出限度为1.01ng/μl,貂引物最低检出限度为0.04ng/μl,兔引物最低检出限度为0.004ng/μl,狐引物的最低检出限度为0.12ng/μl,猪引物的最低检出限度为2.32ng/μl。结果见附图4。
实施例8:多重pcr检测方法用于市场中肉制品真伪鉴别
从济南市某市场采购的冷鲜肉、冷冻肉制品(包括肉串、火腿、烤肠、培根、肉松等)共36份。采用本发明的多重pcr方法及试剂盒,对样品进行dna提取、多重pcr检测,pcr产物于1.5%琼脂糖凝胶电泳后,放入凝胶成像仪中观察条带。
检测结果表明,在36份样品中有24份样品存在造假嫌疑,造假率高达67%,其中羊肉和牛肉的假冒伪劣现象最严重,造假率分别为33%和20%。其次,存在猪肉及鸡肉的造假情况,造假率分别为11%和3%。
序列表
<110>齐鲁工业大学
<120>同时检测8种动物成分的引物、试剂盒及检测方法和应用
<141>2020-03-06
<160>16
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>1
ccaccaactacccacttt18
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
ttgcgtctgttcgtccat18
<210>3
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcatcattctacccacttt19
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgactattgttggtagaaaag21
<210>5
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttgcccttccatcattac18
<210>6
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctgggatagcatctgttt18
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
ggatgatgacaaggacgag19
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
tagtaaggttatgcggagg19
<210>9
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>9
tagtcatagcaagcctcca19
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
cgtggtattagttatgtggg20
<210>11
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>11
cctaactatccaaactctcacc22
<210>12
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>12
ggccatggtgattatgaa18
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
cctatcaccctttcacttctg21
<210>14
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>14
agttagtgctgttgcgtatg20
<210>15
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>15
ggatgctcaggaggtaga18
<210>16
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>16
caggtctgatgttgggat18
- 还没有人留言评论。精彩留言会获得点赞!