基于来那度胺靶向降解EGFR蛋白小分子化合物及其制备与应用的制作方法
本发明涉及一种靶向并降解egfr蛋白的化合物及其制备方法和应用。
背景技术:
泛素-蛋白酶体系统(ubiquitinproteasomesysterm,ups)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解,ups属于一个多步骤反应过程,有多种不同蛋白质参与,蛋白质先被泛素(多肽)标记,然后被蛋白酶体识别和降解。
该系统由泛素、泛素活化酶e1、泛素结合酶e2、泛素连接酶e3、蛋白酶体及其底物(蛋白质)构成。ups特异性降解蛋白质的过程分两个阶段:(1)蛋白底物泛素化:泛素分子由app提供能量,被e1激活转移到e2,然后经e3与特异性蛋白底物结合;(2)蛋白底物降解:被泛素化的蛋白分子能够被蛋白酶体识别,并进入蛋白酶体降解成短链的多肽分子。
蛋白水解靶向嵌合分子(proteolysistargetingchimeras,protacs)是利用一种双功能小分子将目标蛋白和细胞内的e3拉近,从而导致目标蛋白质的降解。protacs包含三部分功能结构:(1)可以与蛋白底物相结合的部分;(2)能够与e3相结合的部分;(3)前两部分的连接链(linker)。细胞内protacs可以同时与靶蛋白及e3结合,使本来不能与e3结合的靶蛋白泛素化,进而被蛋白酶体识别并降解(angew.chem.int.ed.engl,2016,55(6),1996-1973)。
研究证明,来那度胺可以与crbn蛋白结合,crbn蛋白为cul4-rbx1-ddb1-cereblon(crl4crbn)e3泛素连接酶复合物的底物受体蛋白,结合后通过泛素-蛋白酶体途径进行蛋白水解(nature,2014,512(7512):49-53);
当前,在许多实体肿瘤中存在egfr的高表达或异常表达,egfr与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。egfr的过表达在恶性肿瘤的演变进程中起重要作用,胶质细胞、肾癌、肺癌、前列腺癌、胰腺癌、乳腺癌等组织中都有egfr的过表达。egfr已成为有效的抗肿瘤靶点,多个egfr抑制剂已经上市用于多种癌症的治疗。但是目前所用的egfr抑制剂抑制效果有限,且已存在一定的耐药问题,因此,开发出一种可降解egfr蛋白的化合物具有极其重要的临床应用价值。
技术实现要素:
本发明目的在于提供一种靶向泛素化诱导egfr蛋白降解的化合物及其制备方法和应用,该化合物不仅具有优异的egfr蛋白降解作用和抗肿瘤活性,且对人体毒副作用小,可用于制备新型抗肿瘤药物。
本发明的技术方案如下:
一种式(i)所示的靶向泛素化诱导egfr蛋白降解的化合物或其药学上可接受的盐、水合物:
式(i)中,n为1-6的整数,x为o或ch2;优选的,n为2-4的整数,x为o;优选的化合物降解egfr蛋白效果更好,其抗肿瘤活性也更强。
本发明优选的化合物结构式如表1所示:
表1
本发明所述的化合物为一种蛋白水解靶向嵌合分子(protacs),其包括可以与egfr蛋白底物相结合的部分、可以与e3结合的部分以及连接链,利用这种双功能小分子可以将目标蛋白和细胞内的e3拉近,从而使本来不能与e3结合的egfr靶蛋白泛素化,进而被蛋白酶体识别并降解。
本发明还提供了式(i)所示化合物的制备方法,所述制备方法为:
室温(20~30℃)下,将化合物(ii)、化合物(iii)在有机溶剂中混合,然后升温至80-90℃反应10-14h,之后反应液经后处理,得到产物(i);
所述化合物(ii)、化合物(iii)的物质的量之比为1:0.8-1.0;
所述有机溶剂为n,n-二异丙基乙胺或n,n-二甲基甲酰胺,有机溶剂的体积用量以化合物(ii)的质量计为20~40ml/g;
所述后处理的方法为:反应结束后,待反应液降至室温,加入水,用二氯甲烷萃取,合并有机相,经饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩后进行柱层析分离,以二氯甲烷:甲醇(v/v15:1-10:1)的混合溶剂为洗脱剂,收集含目标化合物的洗脱液,蒸除溶剂并干燥,得到产物(i)。
反应式如下:
此外,本发明还包括药物组合物,该组合物含有通式(i)化合物或其药学上可接受的盐、水合物和药物上可接受的赋形剂。所述药物上可接受的赋形剂是指任何可用于药物领域的稀释剂、辅助剂和/或载体。
本发明所述式(i)所示化合物或其药学上可接受的盐、水合物可应用于制备预防或/和治疗癌症的药物。
本发明通过免疫荧光、免疫印迹分析等实验,证实该小分子化合物可以很好的结合egfr蛋白,并通过泛素蛋白酶体途径降解egfr蛋白。
本发明化合物可用于与egfr蛋白酶活性异常表达相关的疾病中的应用,通过体外活性筛选,我们发现本发明化合物具有抗肿瘤活性,因此本发明还公开了上述化合物在制备预防或/和治疗癌症的药物中的应用。所述的癌症为乳腺癌、结肠癌、前列腺癌、胰腺癌、甲状腺乳头状癌、卵巢癌、黑色素瘤、白血病或非小细胞肺癌。优选为非小细胞癌,实验表明该化合物抗非小细胞癌活性极高。
与现有技术相比,本发明具有以下有益效果:
本发明基于来那度胺设计具有靶向egfr蛋白降解嵌合小分子,体外抗肿瘤活性测试及体外egfr蛋白降解活性表明,所述化合物表现出了良好的抗肿瘤活性和egfr蛋白降解水平,可用于预防或/和治疗多种癌症,在医药领域具有良好的应用前景。
附图说明
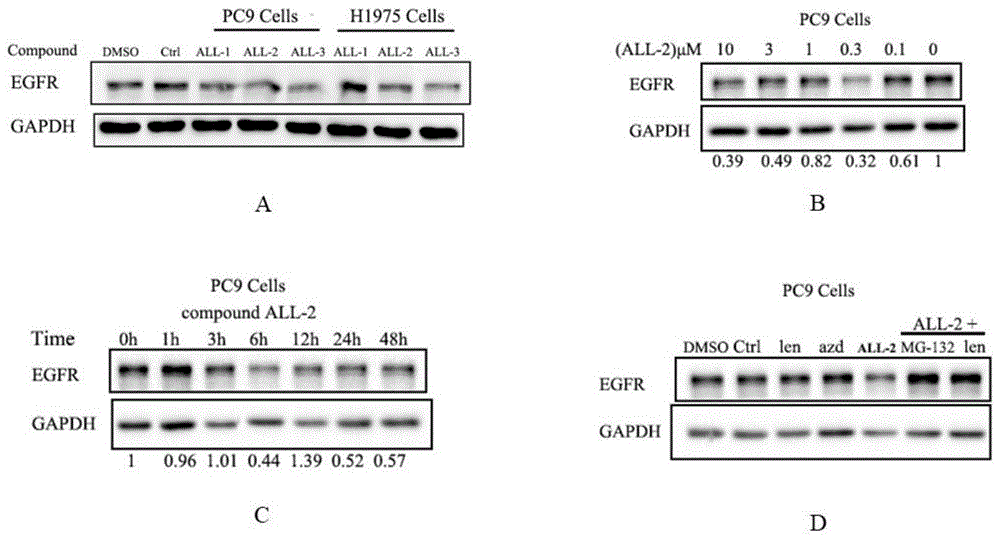
图1westernblot分析egfr蛋白降解情况;
注:图1a给药10μm,24h;图1b给药6h;图1c给药0.3μm;图1d分别预先加入蛋白酶抑制剂mg-132(10μm)和来那度胺(10μm)处理pc9细胞2h后,再分别加入0.1μm化合物2-20,同时设置azd9291(0.1μm)和来那度胺(10μm)阴性对照组。
图2hoechst33342核染结果。
图3高内涵cellcycle程序分析方法及过程。
图4高内涵分析结果示意图例。
图5不同浓度all-2化合物24h时对细胞周期的影响。
图6hoechest33342标记所有细胞核。
图7fitc-annexinv标记凋亡细胞。
图8pi标记坏死细胞图。
图93个波长通道叠加图。
图10不同浓度all-2化合物24h时对细胞凋亡的影响。
图11化合物all-2的免疫荧光图。
图12为实施例2得到的化合物all-1的核磁谱图。
图13为实施例3得到的化合物all-2的核磁谱图。
图14为实施例4得到的化合物all-3的核磁谱图。
具体实施方式
下面通过具体实施例对本发明作进一步的说明,但本发明的保护范围并不仅限于此。
本发明中涉及的缩写词意义为:boc为叔丁氧羰基,dmf为二甲基甲酰胺,dipea为二异丙基乙胺,四丁基溴化铵为四丁基溴化铵,ea为乙酸乙酯,et为乙基,me为甲基,m即摩尔,pe为石油醚,ph为苯基,thf为四氢呋喃,tfa为三氟乙酸,tlc为薄层色谱,nsclc为非小细胞肺癌,wt为野生型。
以下合成路线描述了本发明通式(i)化合物的制备,本发明的化合物都是通过这些路线中描述的方法或通过与其类似的方法制备的,这些方法是有机化学领域普通技术人员熟知的。
按照本发明的通式(i)化合物,合成路线中的具体步骤如下所示:
实施例1:e3配体小分子化合物的制备(化合物6)
(1)化合物2的制备
化合物2a的制备:
将二甘醇(7.0g,66.0mmol)溶于10ml二氯甲烷溶液,加入三乙胺(13.3g,132.2mmol),冰浴下加入对甲苯磺酰氯(15.1g,79.1mmol)。加毕,反应液在室温搅拌12h。6mol/lhcl调节溶液ph=7,二氯甲烷萃取(3×30ml),合并有机相,无水硫酸钠干燥。柱层析得黄色液体产物,产率40%。
1hnmr(500mhz,chloroform-d)δ7.75(d,j=8.4hz,2h),7.31(d,j=8.0hz,2h),4.19–4.09(m,2h),3.62(ddd,j=12.1,5.4,4.1hz,4h),3.48(dd,j=5.3,3.8hz,2h),2.40(s,3h).
化合物2b的制备:
将二缩三乙二醇(5.0g,33.3mmol)溶于10ml二氯甲烷,加入三乙胺(6.7g,66.6mmol),冰浴冷却下加入对甲苯磺酰氯(8.9g,46.6mmol)。加毕,反应液在室温下搅拌12h。6.0mol/lhcl调节溶液ph=7,二氯甲烷萃取(3×30ml),合并有机相,无水硫酸钠干燥。柱层析得黄色液体产物,产率48%。
1hnmr(500mhz,chloroform-d)δ7.79(d,j=8.4hz,2h),7.35(d,j=7.7hz,2h),4.24–4.07(m,2h),3.72–3.66(m,4h),3.65–3.51(m,6h),2.44(s,3h).
化合物2c的制备:
将三缩四乙二醇(5.0g,25.8mmol)溶于20ml二氯甲烷,滴加三乙胺(3.9g,38.7mmol),加入对甲苯磺酰氯(6.0g,36.1mmol),反应液在室温搅拌12h。4mol/lhcl调节溶液ph=7,二氯甲烷萃取(3×30ml),合并有机相,无水硫酸钠干燥。柱层析得黄色液体产物,产率为35%。
1hnmr(500mhz,chloroform-d)δ7.74(d,j=8.4hz,2h),7.48–7.16(m,2h),4.31–3.96(m,2h),3.70–3.61(m,4h),3.60–3.58(m,4h),3.56–3.51(m,6h),2.39(s,3h).
(2)化合物3的制备
化合物3a的制备:
将化合物2a(2.954g,11.3mmol)溶于10ml甲苯,室温下加入四丁基溴化铵(0.181g,0.56mmol)、koh(1.01g,18.1mmol)、溴乙酸叔丁酯(2.7g,13.6mmol)。室温下搅拌反应12h,减压浓缩除去甲苯,加入5ml水,二氯甲烷萃取(3×20ml),合并有机相,无水硫酸钠干燥。柱层析得白色固体,产率73%。
1hnmr(500mhz,chloroform-d)δ7.80(d,j=8.4hz,2h),7.37–7.31(m,2h),4.19–4.14(m,2h),3.98(s,1h),3.72–3.67(m,2h),3.67–3.59(m,4h),2.44(s,3h),1.47(s,9h).
化合物3b的制备:
将化合物2b(3.73g,12.3mmol)溶于10ml甲苯,室温下加入四丁基溴化铵(0.198g,0.6mmol)、koh(1.1g,20.0mmol)、溴乙酸叔丁酯(2.9g,14.7mmol)。室温下搅拌反应12h,减压浓缩除去甲苯,加入5ml水,二氯甲烷萃取(3×20ml),合并有机相,无水硫酸钠干燥。柱层析得白色固体,产率71%。
1hnmr(500mhz,cdcl3)δ7.80(d,j=8.4hz,2h),7.58-7.07(m,3h),4.19-4.12(m,2h),4.01(s,2h),3.73-3.63(m,6h),3.60(s,4h),2.45(s,3h),1.47(s,9h).
化合物3c的制备:
将化合物2c(1.275g,3.3mmol)溶于10ml甲苯溶液中,室温下加入四丁基溴化铵(0.053g,0.17mmol)、koh(0.296g,5.3mmol)、溴乙酸叔丁酯(0.76g,3.9mmol)。室温下搅拌反应12h,减压浓缩除去甲苯,加入5ml水,二氯甲烷萃取(20ml×3),合并有机相,无水硫酸钠干燥,减压浓缩后经柱层析纯化得黄色液体,产率60%。
1hnmr(500mhz,cdcl3):δ7.73(d,j=8.3hz,2h),7.30-7.27(m,2h),4.10-4.08(m,2h),3.96(s,2h),3.66-3.62(m,6h),3.61-3.60(m,4h),3.52-3.50(m,4h),2.39(s,3h),1.41(s,9h).
(3)化合物4的制备
化合物4a的制备:
将化合物3a(2.271g,6.1mmol)溶于5ml丙酮中,室温下加入碘化钠(1.28g,8.5mmol),滴加完毕后转移至70℃下回流并搅拌反应6h。减压浓缩,加入10ml水,用20ml乙酸乙酯萃取3次,无水硫酸钠干燥,合并有机相。得粗品黄色液体,产率92%。
1hnmr(500mhz,chloroform-d)δ4.04(s,2h),3.77(d,j=7.1hz,2h),3.75–3.68(m,4h),3.28(t,j=6.9hz,2h),1.48(s,9h).
化合物4b的制备:
将化合物3b(0.30g,0.72mmol)溶于5ml丙酮中,室温下加入碘化钠(0.15g,1.0mmol)。滴加完毕后转移至70℃下回流搅拌反应6h。减压浓缩,加入5ml水,用10ml乙酸乙酯萃取3次,无水硫酸钠干燥,合并有机相。得粗品黄色液体,粗产率97%。
1hnmr(500mhz,chloroform-d)δ4.03(s,2h),3.76(dd,j=7.3,6.5hz,2h),3.72-3.69(m,4h),3.67(s,4h),3.26(dd,j=7.3,6.5hz,2h),1.47(s,9h).
化合物4c的制备:
将化合物3c(1.0g,2.2mmol)溶于5ml丙酮中,室温下加入碘化钠(0.462g,3.3mmol)。滴加完毕后加热70℃下搅拌反应6h。减压浓缩,加入5ml水,用10ml乙酸乙酯萃取3次,饱和食盐水洗涤3次,无水硫酸钠干燥,合并有机相,得粗品黄色液体,产率94%。
1hnmr(500mhz,chloroform-d)δ4.02(s,2h),3.76(dd,j=7.3,6.5hz,2h),3.74–3.68(m,4h),3.67(d,j=4.3hz,8h),3.27(dd,j=7.3,6.5hz,2h),1.48(s,9h).
(4)化合物5的制备
化合物5a的制备:
将化合物4a(1.252g,3.8mmol)溶于3ml二氯甲烷中,滴加三氟乙酸(8.65g,75.8mmol),滴加完毕后转移至室温下搅拌反应2h。减压浓缩,加入5ml水,用1mol/lnaoh溶液调节ph=10,水相用10ml二氯甲烷洗涤2次,再用6mol/lhcl调节水相ph=2,调节完毕后用15ml乙酸乙酯萃取3次,合并有机相,无水硫酸钠干燥。得无色液体,产率78%。
化合物5b的制备:
将化合物4b(0.229g,0.6mmol)溶于3ml二氯甲烷中,滴加三氟乙酸(1.7g,12.2mmol),滴加完毕后转移至室温下搅拌反应2h。减压浓缩,加入5ml水,用1mol/lnaoh溶液调节ph=10,水相用10ml二氯甲烷洗涤2次,用6mol/lhcl调节水相ph=2,调节完毕后用15ml乙酸乙酯萃取3次,合并有机相,无水硫酸钠干燥。得无色液体,产率80%。
化合物5c的制备:
将化合物4c(0.871g,2.08mmol)置于6ml二氯甲烷中,室温下加入三氟乙酸(4.7g,41.6mmol)。滴加完毕后室温搅拌2h。减压浓缩,加入5ml水,用1mol/lnaoh溶液调节ph=10,用10ml二氯甲烷洗涤2次,水相用6mol/lhcl溶液调节ph=2,用10ml二氯甲烷萃取3次,合并有机相,无水硫酸钠干燥。得无色液体,产率77%。
(5)化合物6的制备
化合物6a的制备:
将化合物5a(0.600g,2.2mmol)置于25ml圆底烧瓶中,置换空气,氩气保护,冰浴下滴加草酰氯(1.53g,10.9mmol)。滴加完毕后转移至室温下搅拌反应2h。减压浓缩,滴加3mln,n-二甲基甲酰胺,加入来那度胺(0.54g,2.08mmol),室温下搅拌反应1h。加入10ml水,用20ml乙酸乙酯萃取3次,合并有机相,饱和食盐水洗涤3次,无水硫酸钠干燥,经柱层析得白色固体产物,产率42%。
1hnmr(500mhz,chloroform-d)δ8.77(s,1h),8.55(s,1h),7.76(dd,j=7.6,1.0hz,1h),7.69(dd,j=8.0,0.9hz,1h),7.50(t,j=7.7hz,1h),5.22(dd,j=13.3,5.1hz,1h),4.46(s,2h),4.19(d,j=1.4hz,2h),3.85–3.80(m,2h),3.79(t,j=6.4hz,2h),3.76–3.70(m,2h),3.24(td,j=6.5,1.5hz,2h),2.92–2.71(m,2h),2.37(qd,j=13.0,5.2hz,1h),2.20(dtd,j=13.0,5.2,2.6hz,1h).
化合物6b的制备:
将化合物5b(0.228g,0.72mmol)置于25ml圆底烧瓶中,置换空气,氩气保护,冰浴下滴加草酰氯(0.502g,3.58mmol)。滴加完毕后转移至室温下搅拌反应2h。减压浓缩,滴加3mln,n-二甲基甲酰胺,加入来那度胺(0.297g,1.15mmol),室温下反应1h,加入5ml水,用10ml乙酸乙酯萃取3次,合并有机相,饱和食盐水洗涤3次,无水硫酸钠干燥,经柱层析得白色固体产物,产率50%。1hnmr(500mhz,chloroform-d)δ8.94(s,1h),8.51(s,1h),7.77(dd,j=7.5,1.0hz,1h),7.66(dd,j=8.0,1.0hz,1h),7.50(t,j=7.7hz,1h),5.22(dd,j=13.3,5.1hz,1h),4.46(s,2h),4.18(d,j=2.1hz,2h),3.82(ddd,j=5.0,2.7,1.2hz,2h),3.79–3.73(m,2h),3.73–3.66(m,2h),3.65–3.56(m,4h),3.11(td,j=6.7,3.7hz,2h),2.92–2.73(m,2h),2.36(td,j=13.0,5.2hz,1h),2.27–2.15(m,1h).
化合物6c的制备:
将化合物5c(307mg,0.84mmol)置于圆底烧瓶中,置换空气,氩气保护,冰浴下滴加草酰氯(0.502g,3.58mmol),滴加完毕后,转移至室温反应2h,减压浓缩,加入n,n-二甲基甲酰胺溶液,加入来那度胺(218mg,0.84mmol),室温下反应1h,加入5ml水,用20ml乙酸乙酯萃取三次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,经柱层析得白色固体,产率47%。1hnmr(500mhz,chloroform-d)δ9.10(s,1h),8.99(s,1h),7.72(dd,j=7.5,1.0hz,1h),7.66(d,j=7.9hz,1h),7.46(t,j=7.7hz,1h),5.17(dd,j=13.3,5.1hz,1h),4.42(d,j=2.1hz,2h),4.15(d,j=3.4hz,2h),3.78-3.76(m,2h),3.71-3.70(m,2h),3.68–3.62(m,4h),3.63–3.57(m,2h),3.54–3.47(m,4h),3.16(t,j=6.8hz,2h),2.83–2.73(m,2h),2.36-2.27(m,1h),2.16-2.11(m,1h).
实施例2:protacs化合物all-1的制备
将实施例1制得的化合物6a(140mg,0.26mmol)溶于5mln,n-二甲基甲酰胺中,加入化合物7(141mg,0.29mmol)、n,n-二异丙基乙胺(101mg,0.78mmol),加热90℃反应8h。加入10ml水,用20ml二氯甲烷萃取三次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,柱层析得黄色固体,产率53%。1hnmr(500mhz,cdcl3)δ9.74(s,1h),9.56(d,j=12.0hz,1h),8.91(s,1h),8.78(d,j=11.5hz,1h),8.37(dd,j=5.4,2.6hz,1h),8.15–7.99(m,1h),7.77(s,1h),7.70(dd,j=7.6,4.7hz,1h),7.64(d,j=7.9hz,1h),7.47–7.34(m,3h),7.17(dd,j=5.3,3.3hz,1h),6.72(s,1h),6.42(dd,j=16.9,1.8hz,1h),5.69(dd,j=9.9,1.8hz,1h),5.13(dt,j=13.4,4.6hz,1h),4.38(d,j=5.5hz,2h),4.07(d,j=2.2hz,2h),3.95(s,3h),3.84(s,3h),3.75–3.51(m,8h),2.94(s,3h),2.83–2.65(m,5h),2.62(d,j=7.1hz,4h),2.40–2.28(m,4h),2.13–2.09(m,1h)ppm.
实施例3:protacs化合物all-2的制备
将实施例1制得的化合物6b(200mg,0.35mmol)溶于5mln,n-二异丙基乙胺中,加入化合物7(186mg,0.38mmol)、n,n-二异丙基乙胺(136mg,1.05mmol),加热90℃反应8h。加入10ml水,用20ml二氯甲烷萃取三次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,柱层析得黄色固体,产率62%。1hnmr(500mhz,cdcl3)δ9.79(s,1h),9.59(s,1h),8.98(d,j=17.9hz,2h),8.38(d,j=5.3hz,1h),8.12–8.01(m,1h),7.79(s,1h),7.75–7.67(m,2h),7.44(t,j=7.8hz,1h),7.41–7.35(m,1h),7.29–7.25(m,3h),7.18(d,j=5.3hz,1h),6.76(s,1h),6.42(dd,j=16.6,1.9hz,1h),5.73–5.65(m,1h),5.16(dd,j=13.3,5.2hz,1h),4.39(s,2h),4.08(d,j=8.5hz,2h),3.96(s,3h),3.85(s,3h),3.67(dt,j=5.3,2.6hz,2h),3.61–3.49(m,5h),3.42(dt,j=16.3,5.6hz,5h),2.91(s,3h),2.83–2.71(m,2h),2.63(s,3h),2.52(s,2h),2.29–2.26(m,4h),2.20–2.06(m,1h)ppm.
实施例4:protacs化合物all-3的制备
将实施例1制得的化合物6c(153mg,0.25mmol)溶于5mln,n-二异丙基乙胺中,加入化合物7(132mg,0.27mmol)、n,n-二异丙基乙胺(104mg,0.8mmol),加热90℃反应8h。加入10ml水,用20ml二氯甲烷萃取三次,合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,柱层析得黄色固体,产率56%。1hnmr(500mhz,chloroform-d)δ9.80(s,1h),9.63(t,j=21.2hz,1h),9.03(d,j=5.1hz,1h),8.38(dd,j=5.4,1.6hz,1h),8.11–7.99(m,1h),7.81(s,1h),7.72(dd,j=7.7,2.1hz,2h),7.46(td,j=7.7,3.3hz,1h),7.42–7.35(m,1h),7.29–7.24(m,3h),7.19(dd,j=5.4,2.7hz,1h),6.76(d,j=8.4hz,1h),6.44(dd,j=16.8,1.9hz,1h),5.70(dd,j=9.8,2.1hz,1h),5.17(ddd,j=13.4,5.2,2.5hz,1h),4.41(d,j=2.2hz,2h),4.19–4.03(m,2h),3.97(s,3h),3.86(s,3h),3.69(q,j=4.7,3.1hz,3h),3.61(q,j=4.4,3.4hz,2h),3.59–3.42(m,7h),3.38(s,4h),3.01–2.88(m,3h),2.86–2.71(m,3h),2.66(s,5h),2.40–2.26(m,4h),2.15(dtd,j=12.7,5.2,2.6hz,1h).
实施例5:活性测定:
(1)mtt法测定protacs化合物对肿瘤细胞增殖抑制活性
本次活性筛选研究主要涉及以下几种非小细胞肺癌细胞株,其名称及特点如下表2所示:
表2非小细胞肺癌(nsclc)细胞系种类及突变位点
将处于对数生长期的肿瘤细胞(h1975、pc9、pc9-ir、hcc827)分别以5×103、5×103、5×103、1×104个细胞接种于96孔板,培育24h,加入不同浓度protacs化合物后,细胞在37℃、5%co2条件下继续培养72小时,每孔加入20ulmtt(5mg/ml)溶液继续培养4h,加入150μldmso,震荡10min后通过酶标仪测定其在490nm波长处的od值并计算ic50,具体结果如下表3所示,化合物all-1~all-3均具有良好的细胞抑制活性,其中化合物all-2的活性最佳,对pc9、pc9-ir、hcc827和h1975细胞的ic50值分别为0.413μm、0.536μm、1.344μm、0.657μm,而化合物all-1和all-3对以上各细胞的抑制活性也在2μm以下。
表3protacs化合物在nsclc细胞中的ic50值
(2)westernblot测定egfr蛋白降解作用
all-2化合物处理pc9细胞48h后,用预冷的pbs洗涤2次,加入适量含1×pmsf和1×complete的ripa裂解液收集细胞,冰上裂解细胞30min后,4℃,12000r/min,30min离心,取上清,即细胞总蛋白。用bca法定量检测蛋白量,用5×蛋白上样缓冲液稀释蛋白后100℃变性5min。蛋白在sds—page电泳分离,转膜,封闭2h,一抗4℃孵育过夜。tbst洗膜,二抗1:2000孵育2h,洗膜,化学发光后显影。实验结果表明(图1a和d),化合物all-1~all-3对pc9和h1975细胞中egfr均具有很好的降解效果,并且是通过泛素化途径进行的;时效和量效实验结果(图1b和c)也表明化合物all-2在6h时,0.3μm就能产生很好的egfr蛋白降解效果。
(3)高内涵原位分析细胞周期
将处于对数生长期的pc9肿瘤细胞以5×103个/孔接种于96孔板,培育24h,加入不同浓度all-2化合物后,细胞在37℃、5%co2条件下继续培养24小时。弃去原培养基,pbs洗2次,每孔加入100μlhoechst33342(5μg/ml,培养基配制),避光15分钟后弃去,再用pbs洗2次,每孔再加入50μl含fitc-annexinv和pi的缓冲液,避光孵育15分钟后立即用高内涵进行显微成像,物镜为10×,设置孔板类型和扫描范围,扫描视野设定为3×3,荧光波长通道选择为dapi(蓝色)、fitc(绿色)、cy3(橘黄色),对每孔扫描,每孔采集5个视野,结束后通过cellcycle和cellhealth程序进行分析,具体结果如图所示(图5和图10)。给药24h后,all-2化合物主要是将细胞阻断在g0/g1期,进而影响细胞的生理活动,并且在0.5μm时就就开始发挥药理作用,40%的细胞就已经开始进入早期凋亡状态;同时间下,并随着浓度的增加晚期凋亡和坏死的细胞也相对增加。
(4)高内涵进行免疫荧光成像分析
pc9细胞培养方法如上(3)步骤所示,给药1μm,5h后弃除培养基,pbs洗2次,0.3%tritonx-100(pbs配制)室温通透10min,pbs浸洗2次,每次3min,加1%bsa,室温封闭30min;弃封闭液,pbs洗2次,每孔加50μl稀释好的egfr一抗于4℃孵育过夜;第二天pbs洗2次,每孔再加50μlfitc标记山羊抗兔igg,避光室温孵育1h,pbs洗2次,dapi复染核5min,pbs再洗2次后于高内涵仪器进行荧光显微成像。结果如图(图11),绿色表示fitc标记的egfr蛋白,蓝色为dapi染色的细胞核,all-2化合物分别作用6h和24h后,细胞内的egfr均已产生降解效果。
- 还没有人留言评论。精彩留言会获得点赞!