一株布鲁氏菌S2疫苗株DnaA基因条件性诱导缺失菌株、其构建方法及应用与流程
本发明涉及生物领域,具体涉及一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株、其构建方法及应用。
背景技术:
布鲁氏菌病是一种威胁人类健康的人畜共患病,其病原体是布鲁氏菌,属于革兰氏阳性菌。其宿主多种多样,以猪,牛,山羊,绵羊等为主的家畜,同时还有海豚在内的海洋动物以及一些其他的野生动物,并且还可以感染给人类,布鲁氏菌可引起怀孕母畜流产,不孕,以及公畜睾丸炎。目前,动物上常用的疫苗,包括流产布鲁氏菌s19和波浪热布鲁氏菌rev.1,在使用上存在血清诊断干扰和残留毒力等缺点。人类感染布鲁氏菌后的主要特征是在感染的慢性阶段反复发热,以及关节疼痛,骨骼肌肉衰弱,严重时可导致人类劳动能力丧失,引起社会负担加重。据统计,全球每年有50多万人感染布鲁氏菌病。既不能通过抗生素治疗康复,也没有疫苗可以安全有效的预防人布鲁氏菌病。
布鲁氏菌的细胞周期,包括单极生长和染色体的有序启动复制,布鲁氏菌细胞周期始于细胞不对称分裂,并产生两个不同的子细胞。子细胞经历一个染色体复制尚未开始的时期,称为间隙期1(g1).而在dna合成阶段,细菌染色体复制已经开始了。染色体复制结束与细胞分裂之间的阶段为g2.当布鲁氏菌被宿主细胞摄取时,细菌首先在g1期被阻断,细菌的生长和染色体复制在到达细胞内增殖室前不久才重新开始。由于细菌的dna复制起始受到严格的时间和空间调控,因此,在进入宿主细胞内,细菌的细胞周期只发现一次。在α-变形杆菌纲中,divkctra调控网络被保存下来控制细菌细胞周期。dnaa蛋白包含dna结合域和atp/adp结合域,是与染色体起源结合并开始染色体复制的启动子。当atp-dnaa在细胞内积累,染色体才开始复制。然而,一旦在细胞中开始复制,atp-dnaa通过dna-loadingb-clamp/hdaa(与dnaa同源)复合物迅速转化为dnaa-adp.同时研究表明,细菌的细胞周期与细菌的毒性相协调。dnaa通过rna-seq参与细菌细胞周期的调控,抑制dnaa表达会引起布鲁氏菌的衰减,在小鼠模型中具有较高的免疫原性。总之,这些研究表明,dnaa参与了布鲁氏菌的体内外毒力,在布鲁氏菌的胞内复制生长过程中发挥重要的作用。
到目前为止,仍没有一种兽用的疫苗可以安全有效的适用于市场,且对人类具有致病性。布鲁氏菌dnaa蛋白作为启动子在细菌细胞周期调控网络中发挥重要作用,但仍未被成功的缺失,其重要原因是由于dnaa是染色体复制的启动子。其对布鲁氏菌的细胞周期具有重要的调控作用。
技术实现要素:
本发明的目的在于提供了一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株、其构建方法及应用。
为实现上述目的,本发明采取的技术方案为:
一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株,该菌株为猪种布鲁氏菌s2dnaa△dnaa,于2019年12月2日保藏在中国典型培养物保藏中心,其保藏号为cctccno:m2019992。
所述菌株为在条件性诱导外源dnaa表达的基础上缺失内源性dnaa基因的布鲁氏菌s2疫苗株,通过以下方法构建:
s1、利用primierprimier5设计dnaa基因上下游引物及扩增引物、骨架载体扩增引物、四环素诱导启动子扩增引物、卡那霉素抗性基因和筛选缺失dnaa基因鉴定引物,引物序列如下:
骨架载体引物:
f:5’-ttgacataagcctgttcggttcgta-3’
r:(5’-cctcccagagcctgataaaaacg-3’)
四环素启动子引物
f:5’-gctctgggaggctgcagcggccgtttccatttaggtgggtac-3’
r:
5’-cttatgtcaactcgagttttaagcttgcatgcggatccccgggtaccgagctctttctcctc
tttaatgaattc-3’
dnaa引物:
f:5’-ttaaagaggagaaagagctcatgacaagcgcccgaacaat-3’
r:
5’-gatccccgggtaccgagctctcacttatcgtcgtcatccttgtaatcggcagcctgatcgttgatgagg-3’
上游同源臂引物:
f:5’-ctgcagggcagaacatatcaggatcgc-3’
r:5’-caagaactctgtagcaccgcttttatcctgcatagaaccctaaat-3’
下游同源臂引物:
f:5’-tccccgaaaagtgccacctgccggcggacttgcacctcgt-3’
r:5’-gaattaaatgaccgacatggagccgc-3’
卡那霉素引物:
f:5’-gggttctatgcaggataaaagcggtgctacagagttcttgaagtgg
tg-3’
r:5’-acgaggtgcaagtccgccggcaggtggcacttttcgggga-3’
相关定量引物:
s2、目的基因的pcr扩增及胶回收
分别用布鲁氏菌s2疫苗菌株的基因组,pbbr1mcs5骨架载体和pg-kje8载体作为模板,用dnaa基因的扩增引物,骨架载体的扩增引物、四环素诱导启动子的扩增引物分别进行pcr扩增反应,扩增出dnaa基因,pbbpzt1骨架载体,四环素诱导的启动子;
反应体系如下:
5×psbuffer5μl;
dntpmixture2μl;
f0.5μl;r0.5μl;
模板1μl;
primestardnapolymerase0.5μl;
ddh2o15.5μl;
pcr反应程序如下:95℃预变性10min;95℃变性30s;58℃退火50s;72℃延伸1min,30个循环;72℃延伸10min;
将pcr产物在1%的琼脂糖凝胶中电泳二十分钟,直至产物跑到中下部即可,然后在切胶仪下分别切下dnaa基因,骨架载体和四环素诱导启动子的目的条带胶块,使用天根生化科技公司生产的dna纯化回收试剂盒回收pcr产物;
s3、重组载体pzt-g+载体构建
将胶回收产物中的pbbr1mcs5骨架载体和四环素诱导启动子置于pcr仪中,在37℃条件下连接30min;连接体系如下:
骨架载体3μl;
四环素诱导启动子4μl;
5×ceiibuffer2μl;
将pbbr1mcs5骨架载体和四环素诱导启动子的连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到lb固体平板上,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净台里,用枪头挑出生长较好的克隆菌落,打到装有20mllb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取pzt-g+重组载体;
将提取出的pzt-g+重组载体用bamh和hindiii在37℃恒温培养箱进行双酶切2h,在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收酶切产物;
s4、dnaa基因黏性末端的获取
将胶回收的dnaa基因在连接仪中连接到19t(simple)载体,连接体系如下:
目的基因1μl;
19tvector4μl;
solution15μl;
反应条件为:16℃连接2h;
将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到已经预热过的含有庆大霉素抗性平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有庆大抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取重组载体19t(simple)-dnaa;
将重组载体19t(simple)-dnaa用bamhi和hindiii放在37℃培养箱中进行双酶切2h,在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下dnaa基因的目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收dnaa基因;
s5、条件诱导载体pzt-g+-dnaa载体构建
将双酶切所得到的dnaa基因和pzt-g+重组载体放在连接仪中以如下的反应体系16℃连接4h,反应体系如下:
pzt-g+重组载体1μl;
dnaa基因4μl;
solution15μl:
将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到已经预热过的g+平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有庆大抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取pzt-g+-dnaa重组载体;
将提取的pzt-g+-dnaa重组载体用hindiii和bamhi在37℃培养箱中进行双酶切,并用1%琼脂糖凝胶电泳鉴定;
s6、筛选四环素诱导外源dnaa表达的布鲁氏菌菌株(s2<dnaa>)
s6.1、布鲁氏菌感受态的制备
(1)选用活化后的布鲁氏菌s2疫苗菌株涂布到tsa平板上,倒扣放置在37℃恒温培养箱中培养72h;
(2)取出平板,在超净工作台中,用枪头挑选出生长状况较好的单克隆菌落,打到装有10mltsb培养液的50ml的离心管中,放置在37℃恒温摇床中,震荡培养24h;
(3)取200μl培养的菌液加到装有20mltsb培养液的50ml离心管中,放置在37℃恒温摇床中震荡培养至od600为0.6;将菌液放置在冰盒上,
(4)离心机提前预冷到4℃,再将所得菌液放到离心机中,5000r/min离心10min,倒掉液体,留下沉淀,迅速放回冰盒,
(5)在超净工作台中,向沉淀中加入放在冰盒里提前预冷的无菌水10ml,在冰上重悬沉淀,4℃离心,转速为5000r/min,离心10min,倒掉液体,留下沉淀;
(6)向所得的沉淀中加入预冷的无菌水10ml,重悬沉淀,4℃离心机里离心,转速为5000r/min,离心10min,弃掉液体,留下沉淀;迅速放回冰盒;
(7)重复步骤(4)(5)这个洗涤过程一次;
(8)在超净工作台里,向所得的沉淀中加入提前放在冰盒里遇冷的10%的甘油10ml,在冰上重悬沉淀,4℃离心机里离心,转速为5000r/min,离心10min,弃掉液体,留下沉淀,迅速放回冰盒;
(9)重复步骤(8)这个洗涤过程一次;
(10)在超净工作台中,向所得沉淀中加入提前在冰盒中预冷的10%的甘油1ml,在冰上重悬沉淀,以每管100μl分装在1.5ml的离心管里,放在-80℃冰箱里保存备用;
s6.2、电转化
(1)将清理干净的电击杯放在4℃冰箱预冷1h,
(2)从-80℃冰箱中取出布鲁氏菌感受态细胞,置于冰上解冻,在冰上,取10l的pzt-g+-dnaa质粒加到100μl的布鲁氏菌感受态中,用枪混合均匀后,加入到电击杯中,冰上放置10min;
(3)打开电转化仪,将电转化仪电压设置为1.8kv;
(4)将在冰上放置10min电击杯推入电转化仪,电击6ms
(5)电击后,向电击杯中迅速加入在37℃水浴锅中预热的tsb培养液1ml,重悬细胞后,转移到1.5ml的离心管里;放置在37℃恒温摇床中,180rpm/min震荡培养24h;
(6)所得菌液离心,去上清,留下沉淀,用200μltsb重悬沉淀,在超净工作台中,将其涂布到庆大霉素抗性的tsa平板上,倒扣放置在恒温培养箱中,培养72h;
s6.3、筛选s2<dnaa>菌株
从37℃恒温培养箱中取出tsa固体平板,用枪头挑出生长状况良好的菌落,接种于10ml离心管中,加入5mltsb庆大霉素和四环素抗性液体培养基,置于37℃恒温摇床中培养约48h;之后通过westernblotting检测dnaa的表达;
s7.自杀载体puc19-k+-dnaa的构建
(1)pcr扩增出dnaa基因的上游同源臂和下游同源臂以及卡那霉素抗性基因,将它们胶回收后,分别与19t(simple)载体以如下的体系16℃连接2h:
目的基因1μl;
19t(simple)vector4μl;
soluton15μl;
(2)将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到含卡那抗性的la平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有卡那抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取重组载体;
(3)将提取得到的重组载体以如下的方式放在37℃的恒温培养箱中进行双酶切操作,酶切时间为2h;其中:
19t(simple)-dnaa上游同源臂使用pst1和xba1,
酶切体系为:psti1.5μl;
xbai1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
19t(simple)-dnaa下游同源臂使用sac1和ecor1,
酶切体系为:
saci1.5μl;ecori1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
19t(simple)-k+使用xba1和sac1进行双酶切,
酶切体系为:
saci1.5μl;
xbai1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
puc19载体使用ecori和psti双酶切,
酶切体系为:
psti1.5μl;
ecori1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
(4)将酶切后的产物放在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收酶切的puc19载体,dnaa上游同源臂基因、dnaa下游同源臂基因、卡那霉素抗性基因;
(5)将胶回收的dnaa上游同源臂基因、dnaa下游同源臂基因、卡那霉素抗性基因和puc19载体以如下的体系放在16℃连接仪中,连接4h:
(6)将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到含卡那抗性的la平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有卡那抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取puc19-k+-dnaa重组质粒;
(7)将提取得到的puc19-k+-dnaa重组载体用psti和ecori进行双酶切鉴定,酶切产物用1%琼脂糖凝胶电泳鉴定;
s8、基于产生的s2<dnaa>菌株,筛选内源性dnaa缺失菌株用布鲁氏菌感受态制备方法制备出s2<dnaa>布鲁氏菌感受态,取10l的puc19-k+-dnaa质粒,加到100l的s2<dnaa>布鲁氏菌感受态中,用枪混合均匀后,加入到电击杯中,冰上放置10min,再将电击杯推进电转仪中,在电压为1.8kv的条件下,电击6ms,电击后,向电击杯中迅速加入在37℃水浴锅中预热的tsb培养液1ml,重悬细胞后,转移到1.5ml的离心管里;放置在37℃恒温摇床中,180rpm/min震荡培养24h;所得菌液离心,去上清,留下沉淀,用200ltsb重悬沉淀,在超净工作台中,将其涂布到卡那霉素抗性的平板上,倒扣放置在恒温培养箱中,培养72h;在超净工作台中,选取生长较好的单个克隆接种到20ml同时具有卡那霉素和四环素抗性的tsb液体培养基中,放置在37℃恒温摇床中,180rpm/min震荡培养48h;最后用westernblotting检测dnaa的表达情况。本发明所述的布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株可用于制备布鲁氏菌减毒疫苗。
本发明提供了一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株,为探究dnaa对布鲁氏菌的致病机制及区分自然感染和人工免疫的特性奠定基础,对预防和控制布病具有重要的意义。
附图说明
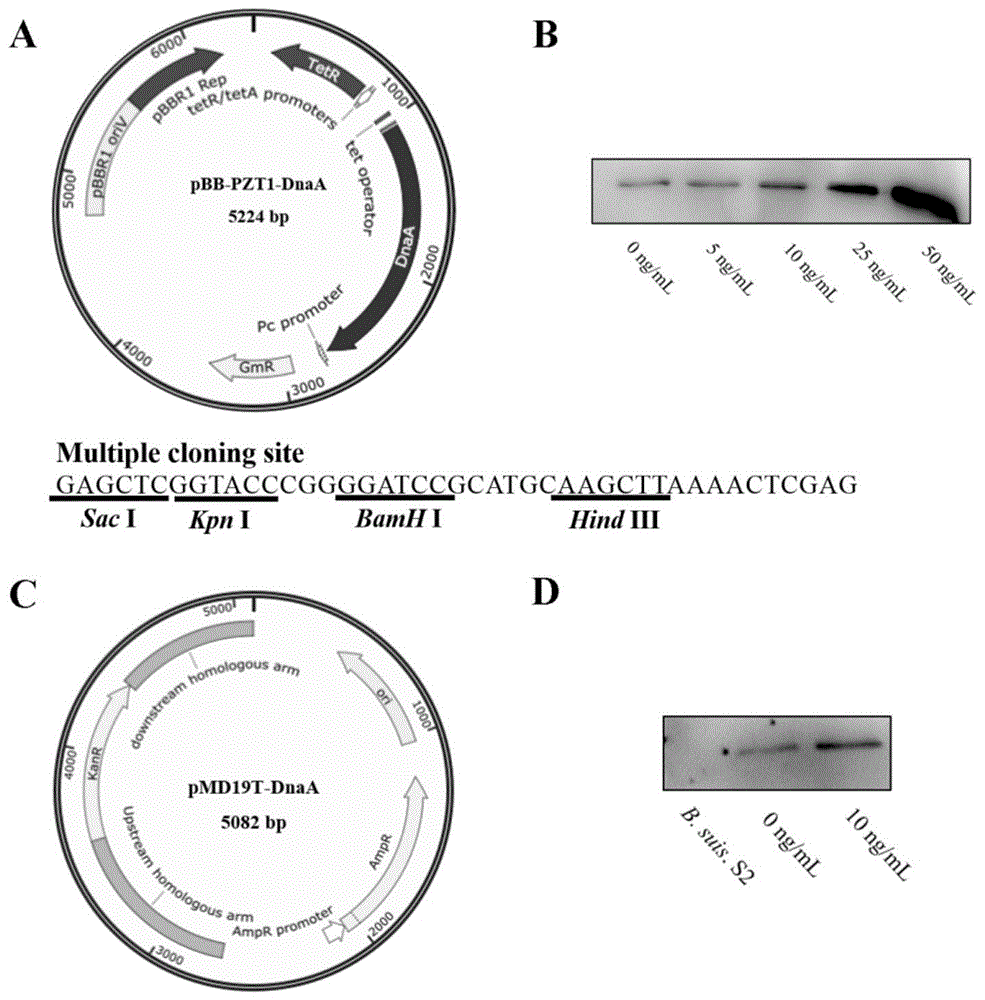
图1为dnaa条件性诱导缺失菌株的筛选;
图中:a:四环素诱导载体pbb-pzt1-dnaa构建示意图;b:westernblotting检测△b.suis.s2<dnaa>菌株中dnaa的表达;c:同源重组载体pmd19t-dnaa构建示意图;d:westernblotting检测野生型和dnaa<dnaa>菌株中dnaa的表达。
图2为dnaa影响布鲁氏菌生物学特性;
图中:a:dnaa对布鲁氏菌体外生长曲线的影响;b:dnaa对布鲁氏菌体外克隆形成的影响;c:不同应激条件下dnaa对布鲁氏菌体外生存的影响;d:dnaa对布鲁氏菌形态的影响。
图3为dnaa影响布鲁氏菌在raw264.7的转运;
图中:a:dnaa对布鲁氏菌在raw264.7中增殖的影响;b:免疫荧光分析dnaa对布鲁氏菌在raw264.7找中转运的影响。
图4为dnaa影响炎症细胞因子的分泌;
图中:a:qrt-pcr检测野生型和△b.suis.s2<dnaa>菌株侵染对raw264.7炎性细胞因子的表达;b和c分别为qrt-pcr检测野生型和△dnaa<dnaa>菌株侵染对raw264.7il-1β(b)和il-6(c)炎性细胞因子的表达;d:elisa检测野生型和△dnaa<dnaa>菌株侵染对raw264.7il-6的分泌;e:westernblotting检测野生型和△dnaa<dnaa>菌株侵染对raw264.7caspase1和nlrp3的表达。
图5为dnaa影响细菌增殖和布鲁氏菌抗体及炎性细胞因子的分泌;
图中:a:野生型和△dnaa<dnaa>菌株侵染小鼠后脾脏载菌量;b:野生型和△dnaa<dnaa>菌株侵染对抗布鲁氏菌抗体分泌的影响;c-h分别为qrt-pcr检测野生型和△dnaa<dnaa>菌株侵染对小鼠ifn-γ(c)、tnf-α(d)、il-1β(e)、il-4(f)、il-6(g)和il-10(h)的表达。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
本发明实施例提供了一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株,该菌株为在条件性诱导外源dnaa表达的基础上缺失内源性dnaa基因的布鲁氏菌s2疫苗株,通过以下方法构建:
s1、利用primierprimier5设计dnaa基因上下游引物及扩增引物、骨架载体扩增引物、四环素诱导启动子扩增引物、卡那霉素抗性基因和筛选缺失dnaa基因鉴定引物,引物序列如下:
骨架载体引物:
f:5’-ttgacataagcctgttcggttcgta-3’
r:(5’-cctcccagagcctgataaaaacg-3’)
四环素启动子引物
f:5’-gctctgggaggctgcagcggccgtttccatttaggtgggtac-3’
r:
5’-cttatgtcaactcgagttttaagcttgcatgcggatccccgggtaccgagctctttctcctc
tttaatgaattc-3’
dnaa引物:
f:5’-ttaaagaggagaaagagctcatgacaagcgcccgaacaat-3’
r:
5’-gatccccgggtaccgagctctcacttatcgtcgtcatccttgtaatcggcagcctgatcgttgatgagg-3’
上游同源臂引物:
f:5’-ctgcagggcagaacatatcaggatcgc-3’
r:5’-caagaactctgtagcaccgcttttatcctgcatagaaccctaaat-3’
下游同源臂引物:
f:5’-tccccgaaaagtgccacctgccggcggacttgcacctcgt-3’
r:5’-gaattaaatgaccgacatggagccgc-3’
卡那霉素引物:
f:5’-gggttctatgcaggataaaagcggtgctacagagttcttgaagtgg
tg-3’
r:5’-acgaggtgcaagtccgccggcaggtggcacttttcgggga-3’
相关定量引物:
s2、目的基因的pcr扩增及胶回收
分别用布鲁氏菌s2疫苗菌株的基因组,pbbr1mcs5骨架载体和pg-kje8载体作为模板,用dnaa基因的扩增引物,骨架载体的扩增引物、四环素诱导启动子的扩增引物分别进行pcr扩增反应,扩增出dnaa基因,pbbpzt1骨架载体,四环素诱导的启动子;
反应体系如下:
5×psbuffer5μl;
dntpmixture2μl;
f0.5μl;r0.5μl;
模板1μl;
primestardnapolymerase0.5μl;
ddh2o15.5μl;
pcr反应程序如下:95℃预变性10min;95℃变性30s;58℃退火50s;72℃延伸1min,30个循环;72℃延伸10min;
将pcr产物在1%的琼脂糖凝胶中电泳二十分钟,直至产物跑到中下部即可,然后在切胶仪下分别切下dnaa基因,骨架载体和四环素诱导启动子的目的条带胶块,使用天根生化科技公司生产的dna纯化回收试剂盒回收pcr产物;
s3、重组载体pzt-g+载体构建
将胶回收产物中的pbbr1mcs5骨架载体和四环素诱导启动子置于pcr仪中,在37℃条件下连接30min;连接体系如下:
骨架载体3μl;
四环素诱导启动子4μl;
5×ceiibuffer2μl;
将pbbr1mcs5骨架载体和四环素诱导启动子的连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到lb固体平板上,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净台里,用枪头挑出生长较好的克隆菌落,打到装有20mllb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取pzt-g+重组载体;
将提取出的pzt-g+重组载体用bamh和hindiii在37℃恒温培养箱进行双酶切2h,在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收酶切产物;
s4、dnaa基因黏性末端的获取
将胶回收的dnaa基因在连接仪中连接到19t(simple)载体,连接体系如下:
目的基因1μl;
19tvector4μl;
solution15μl;
反应条件为:16℃连接2h;
将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到已经预热过的含有庆大霉素抗性平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有庆大抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取重组载体19t(simple)-dnaa;
将重组载体19t(simple)-dnaa用bamhi和hindiii放在37℃培养箱中进行双酶切2h,在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下dnaa基因的目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收dnaa基因;
s5、条件诱导载体pzt-g+-dnaa载体构建
将双酶切所得到的dnaa基因和pzt-g+重组载体放在连接仪中以如下的反应体系16℃连接4h,反应体系如下:
pzt-g+重组载体1μl;
dnaa基因4μl;
solution15μl;
将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到已经预热过的g+平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有庆大抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取pzt-g+-dnaa重组载体;
将提取的pzt-g+-dnaa重组载体用hindiii和bamhi在37℃培养箱中进行双酶切,并用1%琼脂糖凝胶电泳鉴定;
s6、筛选四环素诱导外源dnaa表达的布鲁氏菌菌株(s2<dnaa>)
s6.1、布鲁氏菌感受态的制备
(1)选用活化后的布鲁氏菌s2疫苗菌株涂布到tsa平板上,倒扣放置在37℃恒温培养箱中培养72h;
(2)取出平板,在超净工作台中,用枪头挑选出生长状况较好的单克隆菌落,打到装有10mltsb培养液的50ml的离心管中,放置在37℃恒温摇床中,震荡培养24h;
(3)取200μl培养的菌液加到装有20mltsb培养液的50ml离心管中,放置在37℃恒温摇床中震荡培养至od600为0.6;将菌液放置在冰盒上,
(4)离心机提前预冷到4℃,再将所得菌液放到离心机中,5000r/min离心10min,倒掉液体,留下沉淀,迅速放回冰盒,
(5)在超净工作台中,向沉淀中加入放在冰盒里提前预冷的无菌水10ml,在冰上重悬沉淀,4℃离心,转速为5000r/min,离心10min,倒掉液体,留下沉淀;
(6)向所得的沉淀中加入预冷的无菌水10ml,重悬沉淀,4℃离心机里离心,转速为5000r/min,离心10min,弃掉液体,留下沉淀;迅速放回冰盒;
(7)重复步骤(4)(5)这个洗涤过程一次;
(8)在超净工作台里,向所得的沉淀中加入提前放在冰盒里遇冷的10%的甘油10ml,在冰上重悬沉淀,4℃离心机里离心,转速为5000r/min,离心10min,弃掉液体,留下沉淀,迅速放回冰盒;
(9)重复步骤(8)这个洗涤过程一次;
(10)在超净工作台中,向所得沉淀中加入提前在冰盒中预冷的10%的甘油1ml,在冰上重悬沉淀,以每管100μl分装在1.5ml的离心管里,放在-80℃冰箱里保存备用;
s6.2、电转化
(1)将清理干净的电击杯放在4℃冰箱预冷1h,
(2)从-80℃冰箱中取出布鲁氏菌感受态细胞,置于冰上解冻,在冰上,取10l的pzt-g+-dnaa质粒加到100μl的布鲁氏菌感受态中,用枪混合均匀后,加入到电击杯中,冰上放置10min;
(3)打开电转化仪,将电转化仪电压设置为1.8kv;
(4)将在冰上放置10min电击杯推入电转化仪,电击6ms
(5)电击后,向电击杯中迅速加入在37℃水浴锅中预热的tsb培养液1ml,重悬细胞后,转移到1.5ml的离心管里;放置在37℃恒温摇床中,180rpm/min震荡培养24h;
(6)所得菌液离心,去上清,留下沉淀,用200μltsb重悬沉淀,在超净工作台中,将其涂布到庆大霉素抗性的tsa平板上,倒扣放置在恒温培养箱中,培养72h;
s6.3、筛选s2<dnaa>菌株
从37℃恒温培养箱中取出tsa固体平板,用枪头挑出生长状况良好的菌落,接种于10ml离心管中,加入5mltsb庆大霉素和四环素抗性液体培养基,置于37℃恒温摇床中培养约48h;之后通过westernblotting检测dnaa的表达;
s7.自杀载体puc19-k+-dnaa的构建
(1)pcr扩增出dnaa基因的上游同源臂和下游同源臂以及卡那霉素抗性基因,将它们胶回收后,分别与19t(simple)载体以如下的体系16℃连接2h:
目的基因1μl;
19t(simple)vector4μl;
soluton15μl;
(2)将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到含卡那抗性的la平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有卡那抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取重组载体;
(3)将提取得到的重组载体以如下的方式放在37℃的恒温培养箱中进行双酶切操作,酶切时间为2h;其中:
19t(simple)-dnaa上游同源臂使用pst1和xba1,
酶切体系为:psti1.5μl;
xbai1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
19t(simple)-dnaa下游同源臂使用sac1和ecor1,
酶切体系为:
saci1.5μl;ecori1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
19t(simple)-k+使用xba1和sac1进行双酶切,
酶切体系为:
saci1.5μl;
xbai1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
puc19载体使用ecori和psti双酶切,
酶切体系为:
psti1.5μl;
ecori1.5μl;
10×mbuffer5μl;
质粒30μl;
tb12μl;
(4)将酶切后的产物放在1%的琼脂糖凝胶中电泳鉴定,在切胶仪中切下目的片段,使用天根生化科技公司生产的dna纯化回收试剂盒回收酶切的puc19载体,dnaa上游同源臂基因、dnaa下游同源臂基因、卡那霉素抗性基因;
(5)将胶回收的dnaa上游同源臂基因、dnaa下游同源臂基因、卡那霉素抗性基因和puc19载体以如下的体系放在16℃连接仪中,连接4h:
(6)将连接产物转化到大肠杆菌感受态细胞dh5α中,在37℃恒温摇床上复苏1h后,在超净工作台中,涂布到含卡那抗性的la平板,涂布均匀,将涂过的平板倒扣放置在37℃恒温培养箱,12h后,取出固体平板,在超净工作台里,用枪头挑出生长较好的克隆菌落,打到装有20ml含有卡那抗性的lb液体培养基的50ml离心管中,放置在37℃恒温摇床中培养12h,用天根生化科技公司生产的质粒小提中量试剂盒提取puc19-k+-dnaa重组质粒;
(7)将提取得到的puc19-k+-dnaa重组载体用psti和ecori进行双酶切鉴定,酶切产物用1%琼脂糖凝胶电泳鉴定;
s8、基于产生的s2<dnaa>菌株,筛选内源性dnaa缺失菌株
用布鲁氏菌感受态制备方法制备出s2<dnaa>布鲁氏菌感受态,取10l的puc19-k+-dnaa质粒,加到100l的s2<dnaa>布鲁氏菌感受态中,用枪混合均匀后,加入到电击杯中,冰上放置10min,再将电击杯推进电转仪中,在电压为1.8kv的条件下,电击6ms,电击后,向电击杯中迅速加入在37℃水浴锅中预热的tsb培养液1ml,重悬细胞后,转移到1.5ml的离心管里;放置在37℃恒温摇床中,180rpm/min震荡培养24h;所得菌液离心,去上清,留下沉淀,用200ltsb重悬沉淀,在超净工作台中,将其涂布到卡那霉素抗性的平板上,倒扣放置在恒温培养箱中,培养72h;在超净工作台中,选取生长较好的单个克隆接种到20ml同时具有卡那霉素和四环素抗性的tsb液体培养基中,放置在37℃恒温摇床中,180rpm/min震荡培养48h;最后用westernblotting检测dnaa的表达情况。
1,细菌胞外生长曲线检测
(1),接种:在超净工作台力里,从对应的平板中选取出生长较好的b.suiss2、s2<dnaa>和dnaa<dnaa>单克隆菌株,分别接种在装有20mltsb液体培养基的50ml的离心管中,放在37℃恒温摇床中震荡培养至od600≈1.0,分别再取200μl菌液重新接种到20ml新鲜的tsb液体培养基中,其中,s2<dnaa>和dnaa<dnaa>分别接种到加四环素和不加四环素的tsb液体培养基中。
(2),培养:将第一步所得的五管菌放在37℃恒温摇床中震荡培养,每四个小时收一次菌液,每次收500μl,直到菌液长到72h,放在100℃的沸水中,煮10min灭活,最后一同用酶联免疫检测仪测吸光值。
结果:通过生长曲线检测结果显示,△dnaa能和野生型菌株一样在体外正常的增殖。
2,体外应激实验检测细菌存活率
选取b.suiss2,dnaa<dnaa>加四环素和不加四环素各一株菌株,将其培养至od600≈1.0,倍比稀释后,涂布到tsa平板上,放在37恒温培养箱中,培养72h,进行菌落计数,从而选择出合适的稀释倍数。在合适稀释倍数的菌株里,吸取1ml菌液,离心,弃掉上清,分别用ph5.5的tsb培养液,42℃的tsb培养液,10μg/ml多粘菌素b的tsb培养液,含0.5mmh2o2的tsb培养液,及0.5m的d(-)-sorbitol溶液重悬,同时也要准备三个菌株的未处理组作为对照组。然后,用tsb培养液进行梯度稀释后,均匀的涂布到tsa平板上,倒扣到37℃恒温培养箱中,培养72h,进行菌落计数。试验要重复三次。
结果:通过体外应激试验结果表明,与b.suiss2组相比,△dnaa菌株对酸应激,热应激,多粘菌素b以及渗透压的敏感性显著增加。
3,扫描电镜观察细菌形态
(1),取样:将b.suiss2菌株,s2<dnaa>加四环素和不加四环素各一株菌株,dnaa<dnaa>加四环素和不加四环素各一株菌株,用tsb培养液震荡培养至悬浮状态后,4℃离心,弃掉上清。
(2),漂洗:用2mlph6.8的0.1m的pbs缓冲液重悬沉淀,放置10min,4℃离心,弃掉上清.此清洗步骤重复4次。
(3),固定:用2.5%戊二醇重悬沉淀,在室温下固定过夜。
(4),脱水:用10%,30%,50%,70%,80%,90%的乙醇溶液依次重悬沉淀,放置20min进行脱水操作最后用100%的乙醇溶液脱水3次,每次30min。中间置换:用纯丙酮置换乙醇溶液,置换10-20min,此时,样本可在4℃条件下长期存放。
(5)co2干燥:向样本注入液体二氧化碳。
(6)粘台:样品经二氧化碳干燥后,用牙签将将样本粘到导电胶上,注意区分导电胶的正反面。
(7)喷金-上样观察。
结果:通过电镜扫描结果显示,部分△dnaa菌株的分裂受到抑制,说明,dnaa对b.suiss2菌株的分裂是至关重要的。
3,胞内增殖
将生长状况良好的raw264.7巨噬细胞接种到24孔板中,每个孔接种2×105个细胞,放置细胞培养箱中,37℃恒温培养12h。在超净工作台中,将b.suis.s2菌株,s2<dnaa>加四环素和不加四环素各一株菌株,dnaa<dnaa>加四环素和不加四环素各一株菌株按照100∶1的感染复数(multiplicityofinfection,m01)加到长有生长状况良好的raw264.7巨噬细胞的24孔板中,放置在细胞培养箱中,37℃恒温培养4h。弃掉孔中的培养液,用pbs冲洗三次,加入含有50μg/ml卡那霉素培养液,放置在细胞培养箱中,37℃恒温培养1h。再次弃掉孔中的培养液,加入含有25μg/ml卡那霉素培养液,此时记为感染0h。分别在感染0h、6h、12h、24h、48h后,收集孔中的细胞,加入含有0.5%tritonx-100的pbs1ml,放置在37℃恒温培养箱中裂解细胞10min。将裂解后的细胞进行倍比稀释,然后均匀的涂布到tsa平板,倒扣放置在37℃恒温培养箱中,培养72h后,进行菌落计数。
注意:该实验的每个时间点要设置三个重复。并且,该实验要重复三次。
结果:通过菌落计数结果显示,,在感染后24h和48h后,dnaa<dnaa>菌株胞内增值显著下降,加入四环素的dnaa<dnaa>菌株胞内增值部分恢复到与b.suis.s2菌株相似水平。
4,小鼠免疫
以每个实验组五只老鼠准备6到八周龄的balb/c雌性小鼠,在感染前适应新环境一周以上;b.suiss2,dnaa<dnaa>菌株重悬于tsb液体培养基中,根据小鼠腹腔感染b.suiss2和dnaa<dnaa>的总剂量约为107cfus,通过tsa平板连续稀释确定b.suiss2和dnaa<dnaa>数量。
小鼠感染b.suiss2和dnaa<dnaa>的第1周,第二周和第四周后,每组实验组处死5只老鼠,分离出脾脏,称其重量,以重量来评估脾脏肿大,同时,用he给脾脏染色,评估脾脏得病理特征。收集感染b.suiss2和dnaa<dnaa>第1周,第二周和第四周后得血液样本,血液放置在4℃离心机中,1700g离心10min,放置-80℃保存.用elisa检测血清中的igg,其中用200μl经热杀死的b.suiss2菌株悬浮于pbs中作为抗原,在450nm处测定各组的吸光值。结果:与未感染的小鼠相比,在感染1周后和2周后,b.suiss2组的脾脏体积和重量增加,但在感染4周后完全恢复。感染1,2周后,b.suiss2组的小鼠脾脏肿大明显,感染4周后完全恢复。与b.suiss2组相比,在感染一周后,dnaa<dnaa>组脾脏体积和重量减小,但仅在感染后2周恢复。同样,在感染一周后,与未感染的小鼠相比,dnaa<dnaa>组也出现了明显的脾脏肿大,但与b.suiss2组脾脏肿大程度相比相对较小。此外,与b.suiss2组相比,dnaa<dnaa>组在感染后1周和两周后,脾脏的载菌量减少。he染色显示,与未感染的小鼠相比,b.suiss2组小鼠出现炎症现象,在感染第一周后和第二周后,由于白髓的扩张,红髓和白髓的比例显著的减少,但在感染第四周后,恢复正常。并且在感染第一周和第二周,脾脏组织有明显的细胞增值和肉芽肿。与b.suiss2组相比,dnaa<dnaa>组的小鼠病理特征降低,感染一周后,红髓和白髓的比例减少的最低。感染第二周后,恢复正常。酶联免疫吸附试验(elisa)结果显示,在感染一周和两周后,未感染组和b.suiss2组的布鲁氏菌特定的igg没有显著差异,但dnaa<dnaa>组的布鲁氏菌特定的igg显著高于未感染组和b.suiss2组。为了评价小鼠感染野生菌株,b.suiss2菌株和dnaa<dnaa>菌株后炎症因子的差异,我们用采集的血清进行qrt-pgr检测炎症因子的表达量是否与感染细菌的raw264.7相似。结果显示,b.suiss2组和dnaa<dnaa>组在mrna的水平上,ifn-γ,tnf-α,il-β的表达量均增加,il-4的表达量均减少。并且,dnaa<dnaa>组il-6的表达量显著的高于b.suiss2组和未感染组。这些结果与感染细菌的raw264.7的相似。以上结果显示,在小鼠感染模型中,dnaa使慢性感染所必须的,并参与了布鲁氏菌介导的免疫反应。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
序列表
<110>西北农林科技大学
<120>一株布鲁氏菌s2疫苗株dnaa条件性诱导缺失菌株
<160>67
<170>siposequencelisting1.0
<210>1
<211>25
<212>dna
<213>人工序列()
<400>1
ttgacataagcctgttcggttcgta25
<210>2
<211>23
<212>dna
<213>人工序列()
<400>2
cctcccagagcctgataaaaacg23
<210>3
<211>42
<212>dna
<213>人工序列()
<400>3
gctctgggaggctgcagcggccgtttccatttaggtgggtac42
<210>4
<211>74
<212>dna
<213>人工序列()
<400>4
cttatgtcaactcgagttttaagcttgcatgcggatccccgggtaccgagctctttctcc60
tctttaatgaattc74
<210>5
<211>40
<212>dna
<213>人工序列()
<400>5
ttaaagaggagaaagagctcatgacaagcgcccgaacaat40
<210>6
<211>69
<212>dna
<213>人工序列()
<400>6
gatccccgggtaccgagctctcacttatcgtcgtcatccttgtaatcggcagcctgatcg60
ttgatgagg69
<210>7
<211>27
<212>dna
<213>人工序列()
<400>7
ctgcagggcagaacatatcaggatcgc27
<210>8
<211>45
<212>dna
<213>人工序列()
<400>8
caagaactctgtagcaccgcttttatcctgcatagaaccctaaat45
<210>9
<211>40
<212>dna
<213>人工序列()
<400>9
tccccgaaaagtgccacctgccggcggacttgcacctcgt40
<210>10
<211>26
<212>dna
<213>人工序列()
<400>10
gaattaaatgaccgacatggagccgc26
<210>11
<211>48
<212>dna
<213>人工序列()
<400>11
gggttctatgcaggataaaagcggtgctacagagttcttgaagtggtg48
<210>12
<211>40
<212>dna
<213>人工序列()
<400>12
acgaggtgcaagtccgccggcaggtggcacttttcgggga40
<210>13
<211>20
<212>dna
<213>人工序列()
<400>13
tgcgctcctggatcaacaat20
<210>14
<211>20
<212>dna
<213>人工序列()
<400>14
gccaaaagactgcccaacag20
<210>15
<211>20
<212>dna
<213>人工序列()
<400>15
tgcagagtgcaatccgaact20
<210>16
<211>20
<212>dna
<213>人工序列()
<400>16
taaggggactgccggtgata20
<210>17
<211>20
<212>dna
<213>人工序列()
<400>17
tcaattcggcgatctggacc20
<210>18
<211>20
<212>dna
<213>人工序列()
<400>18
acccttttcgatgcgggaat20
<210>19
<211>20
<212>dna
<213>人工序列()
<400>19
aaggcgtcctattcgctctg20
<210>20
<211>20
<212>dna
<213>人工序列()
<400>20
gtaaatgcccttcgacacgc20
<210>21
<211>20
<212>dna
<213>人工序列()
<400>21
aacgcagtgatcgggaaagt20
<210>22
<211>20
<212>dna
<213>人工序列()
<400>22
attgttgttttggacggcgg20
<210>23
<211>20
<212>dna
<213>人工序列()
<400>23
gatcatcgtttcggcctcct20
<210>24
<211>20
<212>dna
<213>人工序列()
<400>24
tagtcgttcacgcccagttc20
<210>25
<211>20
<212>dna
<213>人工序列()
<400>25
tcaaaacatccgcattcgcc20
<210>26
<211>20
<212>dna
<213>人工序列()
<400>26
tctcgatccttgtcggaagc20
<210>27
<211>20
<212>dna
<213>人工序列()
<400>27
gctttcggtctgaaggctct20
<210>28
<211>20
<212>dna
<213>人工序列()
<400>28
cccagtagtcaaccgaaccc20
<210>29
<211>20
<212>dna
<213>人工序列()
<400>29
agatcgttccttcccgcatc20
<210>30
<211>20
<212>dna
<213>人工序列()
<400>30
tcacaacgtaaggcagcagg20
<210>31
<211>20
<212>dna
<213>人工序列()
<400>31
tttacacgacgaccccgaag20
<210>32
<211>20
<212>dna
<213>人工序列()
<400>32
tatcgagaacgccacggatg20
<210>33
<211>20
<212>dna
<213>人工序列()
<400>33
gtcaacaccggcaagggata20
<210>34
<211>20
<212>dna
<213>人工序列()
<400>34
cttcacccgtaaccgaacca20
<210>35
<211>20
<212>dna
<213>人工序列()
<400>35
caacggaaatcgtgctgcaa20
<210>36
<211>20
<212>dna
<213>人工序列()
<400>36
cggatgagccgaaatctcca20
<210>37
<211>20
<212>dna
<213>人工序列()
<400>37
cgaaaagatggatgcgctgg20
<210>38
<211>20
<212>dna
<213>人工序列()
<400>38
tgttttcggcagccttttcg20
<210>39
<211>20
<212>dna
<213>人工序列()
<400>39
gatgctctattcggtcggca20
<210>40
<211>20
<212>dna
<213>人工序列()
<400>40
catgcgtaaaaggcccgatg20
<210>41
<211>20
<212>dna
<213>人工序列()
<400>41
gtgctgcacaattcggtgtt20
<210>42
<211>20
<212>dna
<213>人工序列()
<400>42
catgaaggcgagcatgaagc20
<210>43
<211>20
<212>dna
<213>人工序列()
<400>43
ctgagagattcggcagggtc20
<210>44
<211>20
<212>dna
<213>人工序列()
<400>44
cacgatgatctggctcgtca20
<210>45
<211>20
<212>dna
<213>人工序列()
<400>45
gattgggaagcggtggatga20
<210>46
<211>20
<212>dna
<213>人工序列()
<400>46
ttgatcgtggtgccggatac20
<210>47
<211>20
<212>dna
<213>人工序列()
<400>47
cgccaccagttcgccatgga20
<210>48
<211>20
<212>dna
<213>人工序列()
<400>48
tacagcccggggagcatcgt20
<210>49
<211>19
<212>dna
<213>人工序列()
<400>49
agcaacaacataagcgtca19
<210>50
<211>18
<212>dna
<213>人工序列()
<400>50
gtggaccactcggatgag18
<210>51
<211>19
<212>dna
<213>人工序列()
<400>51
tctcattcctgcttgtggc19
<210>52
<211>19
<212>dna
<213>人工序列()
<400>52
cacttggtggtttgctacg19
<210>53
<211>20
<212>dna
<213>人工序列()
<400>53
tgacctgggctgtccagatg20
<210>54
<211>20
<212>dna
<213>人工序列()
<400>54
ctgtccattgaggtggagag20
<210>55
<211>21
<212>dna
<213>人工序列()
<400>55
gtgcagcttatcgatgaatcc21
<210>56
<211>21
<212>dna
<213>人工序列()
<400>56
agccatatccacggatgcgac21
<210>57
<211>24
<212>dna
<213>人工序列()
<400>57
ccaggtagctatggtactccagaa24
<210>58
<211>21
<212>dna
<213>人工序列()
<400>58
gatggatgctaccaaactgga21
<210>59
<211>20
<212>dna
<213>人工序列()
<400>59
ggttgccaagccttatcgga20
<210>60
<211>20
<212>dna
<213>人工序列()
<400>60
acctgctccactgccttgct20
<210>61
<211>20
<212>dna
<213>人工序列()
<400>61
tgtctccacaagcgggactt20
<210>62
<211>24
<212>dna
<213>人工序列()
<400>62
tgacaggaaaccctatccagagtt24
<210>63
<211>21
<212>dna
<213>人工序列()
<400>63
tctccacagccaccagattct21
<210>64
<211>18
<212>dna
<213>人工序列()
<400>64
aggaggccaacagacgcc18
<210>65
<211>18
<212>dna
<213>人工序列()
<400>65
ctgacctagagggtatcg18
<210>66
<211>26
<212>dna
<213>人工序列()
<400>66
cgacatctcccacagagttgtaatcc26
<210>67
<211>23
<212>dna
<213>人工序列()
<400>67
ggcacctgaagttgacattttgc23
- 还没有人留言评论。精彩留言会获得点赞!