用于扩增核酸样品的等温方法与流程
本申请要求2014年7月16日提交的、名称为“Isothermal Methods for Amplifying Nucleic Acid Samples”的美国临时申请序列号62,025,345的权益和优先权,所述申请以引用的方式整体并入本文中。
背景
1.发明领域。
本发明提供了核酸扩增和检测反应的方法,其适用于快速病原体检测或疾病诊断。
2.背景信息。
基于核酸核苷酸序列互补性的核酸分析方法可直接分析遗传性状。因此,这些方法是用于鉴定遗传疾病、癌症、微生物等的非常强大的手段。然而,检测样品中以极少量存在的靶基因或核酸不太容易,且因此,靶基因或其检测信号的扩增是必需的。因此,体外核酸扩增技术(NAAT)是在研究和诊断的许多领域中用于检测和分析少量核酸的极有价值的和强大的工具。
NAAT技术允许以高灵敏度和特异性检测并量化样品中的核酸。NAAT技术可用于确定具体的模板核酸在样品中的存在,如通过进行具体的NAAT之后扩增产物(即扩增子)的存在所指示。反之,任何扩增产物的不存在指示模板核酸在样品中的不存在。这类技术在诊断应用中非常重要,例如用于判定病原体是否存在于样品中。因此,NAAT技术适用于检测和量化用于感染性和遗传疾病的诊断的特异性核酸。
可根据工序的温度要求对NAAT进行分组。例如,聚合酶链反应(PCR)是作为体外扩增核酸技术的最常见方法。此方法被坚定地确立为借助于基于指数扩增作用的高灵敏度的极佳检测方法。此外,由于扩增产物可作为DNA回收,所以此方法被广泛地应用为支持如基因克隆和结构测定的遗传工程技术的重要工具。然而,在PCR方法中,温度循环或专门的温度控制器是实践所必需的;扩增反应的指数进展在量化上造成问题;并且样品和反应溶液容易被外界污染,从而容许核酸错误地混合以用作模板(参见R.K.Saiki等人1985.Science 230,1350-1354)。其他基于PCR的扩增技术,例如,基于转录的扩增(D.Y.Kwoh等人1989.Proc.Natl.Acad Sci.USA 86,1173-1177)、连接酶链反应(LCR;D.Y.Wu等人1989.Genomics 4,560-569;K.Barringer等人1990.Gene 89,117-122;F.Barany.1991.Proc.Natl.Acad.Sci.USA88,189-193)、以及限制扩增(美国专利号5,102,784)同样需要温度循环。
近年来,已经开发了许多等温核酸扩增技术(iNAAT)。换句话说,这些技术不依赖热循环来驱动扩增反应。等温扩增技术通常利用具有链置换活性的DNA聚合酶,因此消除为PCR所需的高温解链循环。这允许等温技术与PCR相比更快且更为能源有效,且还允许更简单且由此成本更低的仪器装备,因为不需要快速温度循环。举例来说,方法如链置换扩增(SDA;G.T.Walker等人1992.Proc.Natl.Acad.Sci.USA 89,392-396;G.T.Walker等人1992.Nuc.Acids.Res.20,1691-1696;USP 5,648,211和EP 0 497 272,所有公开内容以引用的方式并入本文中);自动维持序列复制(3SR;J.C.Guatelli等人1990.Proc.Natl.Acad.Sci.USA 87,1874-1878,其以引用的方式并入本文中);以及Qβ复制酶系统(P.M.Lizardi等人1988.BioTechnology 6,1197-1202,其以引用的方式并入本文中)是等温反应(也参见Nucleic Acid Isothermal Amplification Technologies–A Review.Nucleosides,Nucleotides and Nucleic Acids,2008.v27(3):224-243,其以引用的方式并入本文中)。
在SDA方法中,将专门的DNA聚合酶用于合成互补链,从与某一核苷酸序列模板的3'-侧互补的扩增引物开始,并且包括扩增引物上游的一个或多个缓冲引物以置换双股链(如果在序列模板的5'-侧处有的话)。因为在5'-侧处的双股链被新合成的互补链置换,所以此项技术被称作SDA方法。在PCR方法中重要的改变温度步骤在SDA方法中可通过将限制酶识别序列预先插入到退火序列中作为引物来消除。也就是说,由限制酶生成的切口产生3'-OH基团,该基团充当合成互补链的起点,并且先前合成的互补链通过链置换合成被释放作为单股链,接着再次被利用作为模板用于后续的互补链合成。以此方式,在PCR方法中重要的复杂温度控制在SDA方法中并不需要。
然而,在SDA方法中,除链置换型DNA聚合酶之外,还应使用生成切口的限制酶。对于另外的酶的这种要求是导致成本较高的主要原因。此外,因为限制酶并不被用于双股链的裂解,而是用于引入切口(也就是说,仅一条链的裂解),所以dNTP衍生物如α-硫基dNTP应被用作合成的底物以致使另一条链对酶的消化有抗性。因此,通过SDA的扩增产物具有不同于天然核酸的结构,并且这对于用限制酶的裂解或扩增产物应用于基因克隆是一种限制。在此方面中,这也是造成成本较高的主要原因。另外,当SDA方法应用于未知序列时,存在以下可能性:与用于引入切口的限制酶识别序列相同的核苷酸序列可存在于待合成的区域中。在此情况下,完整的互补链有可能被阻止进行合成。
环介导的等温扩增(LAMP)是另一种等温核酸扩增技术。在LAMP中,使用两个或三个引物组及除复制活性之外具有高链置换活性的聚合酶在60-65℃的恒温下扩增靶序列。(参见Nagamine K,Hase T,Notomi T(2002)."Accelerated reaction by loop-mediated isothermal amplification using loop primers".Mol.Cell.Probes 16(3):223–9;及USP 6,410,278,其以引用的方式并入本文中)。
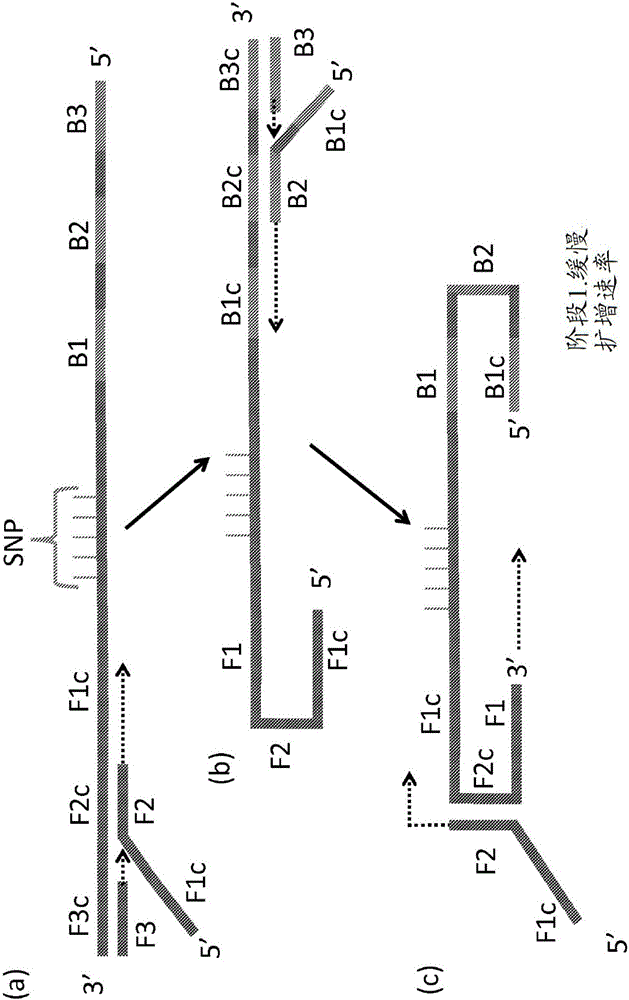
LAMP最初被发明并制定作为对四个引物具有严格要求的等温扩增:两个环生成引物(相应地包含F1、F2及B1、B2引发位点的FIP和BIP)和两个“置换引物”(F3和B3)(图1)。然而,在此实施方式中,LAMP技术对于大部分实际应用来说太过缓慢。为了提高基于LAMP的测定的速度,LAMP的发明者们提出了另外的“环引物”,所述环引物当连同LAMP中使用的其他引物一起添加时,造成显著更快的测定。目前,LAMP的常用实施方案需要总共六个引物:两个环生成引物、两个置换引物及两个“环引物”(LB和LF)。
由于这些引物作用的特殊性质,在LAMP中产生的DNA的量显著高于基于PCR的扩增。反应可通过测量浊度或通过使用嵌入染料的荧光实时进行追踪。染料分子嵌入或直接标记DNA,并且又可与最初存在的拷贝数相关联。因此,LAMP也可以定量。因此,LAMP提供归因于其简易性、耐用性及低成本的主要优点,并且具有在护理领域中或临床医师现场护理时用作简单筛选测定的潜能。
LAMP测定的引物设计因此需要选择靶核酸序列的八个分隔区域(FIP和BIP引物各自包括两个引物结合位点),其中BIP/FIP和环引物对它们彼此之间的定位具有显著限制。“环引物”必须分别被严格地定位在B2与B1位点及F2与F1位点之间,并且必须在一个具体的方向上取向。此外,在引物设计中必须十分当心以避免所需六个引物之间的引物-二聚体(当FIP和BIP引物在长度上一般大于40个核苷酸时尤其困难)。因此,LAMP引物设计极其有挑战性,尤其当靶向含有复杂的二级结构的高度多晶型标记物和序列时。而且,因为LAMP使用靶向基因组相当小的区段内的6个(或8个)区域的4个(或6个)引物,且因为引物设计经受众多限制,所以难以“通过肉眼”设计用于LAMP的引物组。软件一般用于辅助LAMP引物设计,尽管引物设计限制意味着与PCR相比存在较少自由度来选择靶位点。在诊断应用中,这必须与选择适当靶标(例如,在高度变化的病毒基因组中的保守位点、或者对于具体病原体菌株具有特异性的靶标)的需要保持平衡。
已经观察到LAMP比PCR对于复杂样品(如血液)中的抑制剂敏感性较小,这可能是由于使用不同的DNA聚合酶(通常Bst DNA聚合酶,而非在PCR中的Taq聚合酶)。LAMP主要适用作为诊断或检测技术,但不适用于克隆或无数其他通过PCR进行的分子生物学应用。
并且,LAMP的多重途径相对未开发。在LAMP中每个靶标的较大引物数目提高多重靶标组的引物-引物相互作用的可能性。LAMP的产物是靶区域的一系列多联体(concatemer),在凝胶上产生特征性“梯带”或带型,而非PCR中的单一条带。虽然当用LAMP检测单个靶标时这不是个问题,但“传统的”(终点)多重PCR应用(其中靶标的身份通过凝胶上的条带尺寸证实)在LAMP中并不可行。在LAMP中的多重性通过选择具有限制位点的靶区域并且在凝胶上运行之前消化以使得每种产物产生不同尺寸的片段来实现,不过此途径向实验设计和方案中增加了复杂性。链置换DNA聚合酶在LAMP中的使用还排除了使用水解探针,例如TaqMan探针,其依赖Taq聚合酶的5'-3'核酸外切酶活性。
近年来,研究者已开发了修改过的LAMP技术,称为STEM。LAMP-STEM系统利用“Stem引物”,其涉及LAMP扩增子(或“哑铃”)的茎部分。Stem引物可用作LAMP“环引物”的一种替代物(参见图2)。当除环生成和置换引物之外使用时,Stem引物在对环引物的速度和灵敏度中提供相似益处。(参见Gandelman等人,Loop-Mediated Amplificaiton Accelerated by Stem Primers.Int.J.Mol.Sci.2011,v12:9108-9124,及US 2012/0157326,其以引用的方式并入本文中)。Stem引物的这个有益作用是惊人的,因为它们不结合至单链DNA环,这定义了LAMP技术的本质。Stem引物可以任一取向使用,不需要B2/B1或F2/F1位点以特定距离间隔,可以是多重的,并且允许F1和B1位点比在LAMP中彼此更加远离地定位。
STEM引物显著地促进仅包含环生成和置换引物的LAMP。它们独自或与其他STEM引物或甚至环引物协同使用。Stem引物添加到LAMP中对速度和灵敏度都具有积极效果。在一些情况下,它们改善在低拷贝数下的再现性。Stem引物的作用可经由LAMP的建议机制而合理化。它们与扩增子的单链区域瞬时退火并且再复制用于BIP/FIP引物的整个结合位点。另外的独特特性是当Stem引物划定扩增子时另外的强分子内自引发。
一般说来,Stem引物的定位与环引物的定位相比受到较少限制。涉及选择至少八个结合位点的相当有挑战性的引物设计由此被简化。此外,Stem引物就茎长度、取向及B1-B2和F1-F2位点之间的距离而言对引物设计施加较少限制。与依赖置换引物参与的假设的LAMP机制相反,Stem引物可偶而允许完全不使用置换引物,但并不清楚其中的原因。这对于引物设计有着显著意义,因为其允许省略一种置换引物或必要时甚至两种的能力。
在许多情形如现场护理诊断时,有利的是能够使用单一测定同时扩增和检测单一样品中的多重靶标。这通常是通过使用连接至每个不同靶引物组或探针上的不同染料组合同一管中的多重靶标的扩增来完成。这种十分常见的方法具有两个明显的缺点。其一,因为所有引物共同在一种溶液中,所以它们彼此交叉反应并生成二聚体及其他将干扰结果的假产物的可能性极高。这通过费力地筛选引物组的许多组合以找到不进行交叉反应的那个来克服。
此方法的第二主要限制在于存在可当在同一溶液中时单独检测的有限的染料。因为从染料发出的光的波长具有一定的带宽,所以每种染料的发射光谱为了特异性和可靠的检测必须与其他充分分离。实际上,这将每个扩增反应限于5种或6种不同靶标的检测。
可检测来自同一样品的较高数目的靶标而不损害灵敏度的技术对许多应用如呼吸道感染筛选组来说是巨大的改进,其中约20种不同靶标为全面测试所需。另一个实例是肺结核,其中必须筛选约20个不同等位基因以便准确地且特异性地判定对两种一线药物中任一种的抗性的存在。
概述
本发明提供了一种改进的核酸扩增技术(NAAT),其是稳定的、成本有效的,在引物放置和设计中提供灵活性,并且还在低拷贝数下显示出增加的速率、灵敏度及再现性。如本文所述的方法对于实时检测目标核酸区域以便例如诊断疾病或感染是有利的。
如本文所述的方法提供第一阶段速率减缓的等温预扩增,接着是多个离散的第二阶段扩增及对来自第一阶段初级扩增子扩增产物的产物直接并行进行的检测反应。至少一个第二阶段反应包括位点或序列特异性二级引物(“位点特异性引物”),其中如果模板包含位点特异性引物的互补位点,那么位点特异性引物扩增反应在相对于第一阶段反应和第二阶段反应(其中不添加二级引物)两者的较快速率下进行。在某些实施方案中,至少一个第二阶段反应包括具有碱基对错配的二级引物(“错配引物”),例如3’错配核苷酸(“3’错配引物”),其中位点特异性引物扩增反应在相对于第一阶段反应、第二阶段反应(其中不添加二级引物)及第二阶段错配引物反应的较快速率下进行。
例如,完成第一阶段区域特异性预扩增步骤,然后将反应分到多个反应室中,其中在每个室中借助于例如3'端匹配/错配或退火温度差异引入不同组的二级引物,例如环或茎引物,这些引物是位点特异性敏感的,以便速度高得多的指数反应仅在二级引物正确地与样品序列匹配时发生。在扩增速率上的显著差异可通过例如嵌入染料的实时荧光测量来检测,且因此,在同一目标区域内的多个位点特异性反应可用单一测定单独鉴定。
因此,一方面,本发明提供两阶段核酸扩增反应,其包括:提供靶核酸模板和至少一种引物,所述引物在靠近待扩增的目标区域处与靶核酸模板退火;进行第一阶段核酸扩增(或“预扩增(pre-amp)”)反应以扩增目标区域(扩增子)。在某些实施方案中,提供正向和反向引物并且用于合成和扩增目标区域或目标扩增子。
随后,在一个或多个第二阶段扩增反应中利用预扩增反应产物(“扩增的目标区域”),其中这些反应中的至少一个包括位点特异性二级引物,以便只有当位点特异性引物的互补序列(即位点特异性目标区域)存在于来自阶段一的扩增的目标区域(即,来自阶段一的目标核酸区域对于目标位点呈阳性)中时才发生快速扩增。如本文所述,扩增产物在每个第二阶段反应中的出现可同时和实时检测并比较,其中相对于第一阶段反应、第二阶段反应(其中不添加二级引物)及第二阶段错配引物反应的快速扩增速率指示位点特异性目标区域的存在。
在某些实施方案中,位点特异性引物包含在除3’端以外的位点处的核苷酸错配。
在某些实施方案中,多个第二阶段核酸扩增反应并行进行。在一个优选实施方案中,位点特异性引物反应与其中使用相似的位点特异性引物但在其核酸序列中包含错配的单独反应并行进行和监测。
另一方面,描述了一种方法,其包括利用第一阶段扩增产物或初级扩增子进行多个单独的或离散的第二阶段扩增反应,其中检测第二阶段扩增反应的速率并在至少一个具有与初级扩增子模板上的目标位点或序列互补的位点特异性引物的反应与具有二级引物的反应之间比较,所述二级引物退火于相同位点但包含碱基对错配(在本文中“错配引物”),其中相对于另一个的更快反应速率指示目标特异性位点或区域的存在或不存在。在又一些实施方案中,将第二阶段扩增反应的速率检测并在以下反应之间比较,至少一个具有与初级扩增子模板上的目标位点或序列互补的位点特异性引物的反应、具有错配引物的反应及没有二级引物的反应,其中相对于另一个反应的更快反应速率指示目标特异性位点或区域的存在或不存在。
在某些实施方案中,错配引物是错配Stem引物。在本文所述的任何实施方案中,错配引物包含至少一个错配的核苷酸(即不与模板互补的核苷酸)。在某些实施方案中,错配核苷酸处于错配引物的3’端处(“3’错配引物)。
在某些实施方案中,位点特异性引物和错配引物在它们的3'端处包含对多等位基因或多态位点有特异性或互补的核苷酸,以便根据核酸模板包含哪个等位基因或多态性,位点特异性引物可包含3'端核苷酸错配,并且错配引物可含有3'端互补核苷酸。换言之,在某些实施方案中,所述方法包括进行多个第二阶段扩增反应,其中每个反应包含位点特异性引物。然而,如本文所述,仅那些在其3'端处包含与目标位点互补的引物的扩增反应将在相对于第一阶段反应并且相对于包含3'错配的第二阶段反应的提高的速率下进行。
在某些实施方案中,所述方法包括进行多个第二阶段扩增反应,其中每个相应反应包含位点特异性引物。在某些实施方案中,位点特异性引物对于不同的多等位基因或多态位点有特异性。在这类配置中,所述方法提供一种同时确定多个多态性的存在或不存在的多重方法。
在某些实施方案中,所述方法包括并行进行至少一个另外的第二阶段扩增反应,其中不添加另外的引物,并且实时监测和比较以下反应之间的第二阶段扩增反应的速率:包含位点特异性引物的反应、包含错配引物的反应及不包含引物的反应,其中相对于其他的提高的反应速率指示目标特异性位点或区域的存在。
在某些实施方案中,所述方法包括大致同时进行多个单独的或离散的第二阶段扩增反应。在某些另外的实施方案中,离散反应包含相同或不同的位点特异性引物。在某些实施方案中,离散反应包含多个位点特异性引物或位点特异性引物的组合(即“多重反应”)。
虽然若干方面和实施方案涉及两阶段扩增方案,但本发明不限于此。实际上,本文所述的方法是建立在以下惊人发现上:目标特异性位点或序列在靶核酸区域中的存在可通过位点特异性或序列特异性(即互补)引物相对于错配引物的较慢扩增反应速率的提高的扩增速率来检测,所述错配引物(而对于错配碱基)与相同靶区域退火。因此,可进行任何数目的另外的扩增步骤,例如3、4、5、6、7、8、9个等,且因此,可检测任何数目的目标位点、区域或序列。类似地,关于每个待进行的相应位点特异性引物反应,可进行平行错配引物反应并且监测两个反应的扩增速率。
在本文所述的任何方面或实施方案中,第一阶段扩增反应可包含位点特异性引物,以便第一阶段预扩增反应对于特定的目标位点有选择性,并且只有当那个位点或区域存在于样品中时模板的快速扩增才在第二或稍后阶段扩增反应中进行。
在本文所述的任何方面或实施方案中,第二阶段(或稍后阶段)扩增反应可包含多重位点特异性引物(即“多重反应”)。通过使用差异性标记的位点特异性寡核苷酸,可在同一反应内检测和比较(即多重)不同的扩增产物。
另一方面,本发明提供一种用于检测和比较核酸扩增的方法,所述方法包括:提供第一反应室;在第一反应室中进行如本文所述的第一阶段预扩增反应;将一定量或体积的第一阶段预扩增反应直接引入到多个第二反应室中,其中至少一个第二反应室包含位点特异性引物,且至少一个第二反应室包含错配引物;以及在每个第二反应室中进行如本文所述的第二阶段扩增反应;并且同时检测和比较每个反应的扩增速率,其中在位点特异性引物中相对于错配引物反应的更快扩增速率指示目标位点的存在。
在本文所述的任何实施方案中,阶段一和阶段二的扩增反应在同一反应容器或室中相继地进行。在某些实施方案中,相继地进行扩增反应,但在不同的反应容器或室中。在一个优选实施方案中,第二阶段反应在多个容器或室中并行进行,并且检测和比较。
在本文所述的任何实施方案中,靶核酸模板被包含在合适的缓冲剂中并引入包含环形成引物的容器中。在又一些实施方案中,来自第一阶段扩增反应的混合物被引入包含位点特异性或错配引物的容器中。
在另外的实施方案中,在包括与一个或多个另外的容器或室流体连通的通道的容器或室中进行第一阶段扩增反应,所述另外的容器或室包含用于进行第二阶段扩增反应的引物(即位点特异性引物、位点特异性Stem引物;错配引物、错配Stem引物等)。在又一些实施方案中,第一阶段反应室包括与一个或多个另外的容器或室单向流体连通的通道,所述另外的容器或室包含用于进行第二阶段扩增反应的引物。
在本文所述的任何方面或实施方案中,第一阶段扩增反应是等温核酸扩增反应。在某些实施方案中,第二阶段扩增反应是等温核酸扩增反应。在另外的实施方案中,第一阶段扩增反应和第二阶段扩增反应都是等温核酸扩增反应。在某些实施方案中,第一阶段和/或第二阶段扩增反应是基于LAMP的等温扩增反应。在一个优选实施方案中,第一阶段扩增是基于LAMP的等温扩增反应且第二阶段是基于LAMP-STEM的等温扩增反应。
在本文所述的任何方面或实施方案中,错配引物包含3’末端核苷酸错配。在某些实施方案中,如本文所述的位点特异性引物在3’终端包含与靶核酸模板中的目标核苷酸互补的核苷酸。
另一方面,本发明提供一种诊断遗传疾病、SNP、病毒或微生物感染的两阶段方法,其中所述方法包括从待测试的受试者提供核酸样品,进行如本文所述的两阶段扩增反应,其中位点特异性引物对于与遗传疾病、突变、SNP、病毒或细菌中的至少一个有关的目标区域或核苷酸有特异性,且其中位点特异性引物相对于错配引物的提高的扩增速率指示具有关于遗传疾病、突变、SNP、病毒或微生物的等位基因的受试者。在某些实施方案中,所述微生物是细菌。
在某些实施方案中,诊断疾病或病原性感染的方法包括用适当的治疗剂(例如,抗生素、药物等)治疗经测试对目标核苷酸呈阳性的患者的步骤。
在本文所述的任何方面或实施方案中,所述方法进一步包括检测扩增子形成的步骤。在某些实施方案中,扩增反应混合物包含荧光标记的dNTP或荧光DNA嵌入染料。在某些实施方案中,通过测量荧光的增加实时检测扩增子的形成。
在本文所述的任何方面或实施方案中,核酸模板包含多个引物结合区,其中所述引物充当合成起点并且界定待使用聚合酶扩增的多核苷酸区(即,“扩增子”)。
在本文所述的任何实施方案中,所述方法进一步包括在扩增反应中添加至少一种置换或缓冲引物。
在本文所述的任何实施方案中,靶核酸模板包含基因组DNA、cDNA或RNA或其片段,来自病毒、植物、微生物或多细胞生物体,例如哺乳动物,如人类。在某些实施方案中,基因组DNA来自于病原性病毒或微生物,例如细菌或古生菌。在某些实施方案中,靶核酸模板来自于结核杆菌(MTB或TB)。在某些另外的实施方案中,靶核酸模板来自于rpoB基因,该基因来自MTB。在另外其他实施方案中,靶核酸模板是rpoB13.5F6。
在本文所述的任何实施方案中,所述方法进一步包括添加至少一种环引物,所述环引物与扩增子的第一环或第二环中的区域互补。
在本文所述的任何实施方案中,第一扩增反应通过加热步骤继续进行,其中将靶核酸模板和引物加热至大约95℃持续约1分钟至约15分钟。在某些实施方案中,将靶核酸模板和引物加热至大约95℃持续约5分钟至约10分钟。
在本文所述的任何实施方案中,扩增反应在约50℃至约75℃的温度下进行。在某些实施方案中,扩增反应在约55℃至约65℃的温度下进行。
在本文所述的任何实施方案中,位点特异性引物(例如,位点特异性Stem引物)是处于正向。在某些实施方案中,位点特异性引物是处于反向。在另外的实施方案中,正向和反向位点特异性引物都包括在反应中。
在本文所述的任何实施方案中,3’SNP特异性核苷酸包含在环形成引物、置换引物或环引物中的至少一种内。
在本文所述的任何实施方案中,引物或核苷酸试剂包含化学修饰。
在本文所述的任何实施方案中,第一阶段和第二阶段扩增反应在同一反应容器或室中相继地进行。在某些实施方案中,第一阶段和第二阶段扩增反应(及任何后续扩增反应)相继地进行,但在不同的反应室中。
在本文所述的任何实施方案中,引物可包含核酸内切酶限制位点、或用于切口酶的识别元件。
在本文所述的任何实施方案中,所述扩增反应可包括包含第一和第二区段的发夹引物,其中所述第一区段与模板上的引物结合区基本上互补且第二区段包含与引物中的另一区基本上互补的序列;
在本文所述的任何实施方案中,扩增反应可包含环提供引物,该引物包含发夹引物,其中反向重复序列被接头区分隔开。
在本文所述的任何实施方案中,扩增反应可包含嵌合引物。
效用的先前一般领域仅作为实例给出并且不意图限制本公开及所附权利要求的范围。本领域普通技术人员根据本发明的权利要求、内容及实施例将理解与本发明的组合物、方法及方法有关的另外的目标和优点。例如,本发明的各种方面和实施方案可以许多组合形式使用,所有都明确地由本发明所涵盖。这些另外的优点、目标及实施方案都明确地包括在本发明的范围内。本文中用于阐明本发明背景且在具体情况下提供关于实践的其他细节的出版物及其他材料以引用的方式并入。
附图简述
并入本说明书中并构成本说明书的一部分的附图说明了本发明的若干实施方案并且与说明书一同用于解释本发明的原理。附图仅仅是用于说明本发明的实施方案,而不意图限制本发明。本发明的更多目标、特征及优点将由以下详细说明连同附图一起变得显而易见,这些附图示出了本发明的说明性实施方案,其中:
图1.环介导的等温扩增(LAMP)的一般原理的图示。在如本文所述的示例性方法中,进行基于LAMP方法的第一阶段等温扩增反应,其包括FIP和BIP“环形成引物”(LFP)(分别包含F1c和F2、B1c和B2引发位点)、及“置换引物”(F3和B3)。LAMP反应产生“哑铃”结构的多联体(c)。如本文所述,初始LAMP反应在相对较慢速率下进行。
图2.如本文所述的示例性修改过的LAMP-STEM技术的一般原理的图示。如本文所述,进行LAMP-STEM扩增反应作为第二阶段。反应包括至少一种“位点特异性Stem引物”,该引物与来自阶段一的扩增反应的扩增子中的目标位置或序列互补。位点特异性Stem引物反应与单独的扩增反应并行进行,所述单独的扩增反应包含具有错配的Stem引物,例如,在其3'端处的错配(“错配Stem引物”);并且同时监测和比较两个反应,其中位点特异性Stem引物反应相对于错配Stem引物反应的扩增速率的提高指示在扩增子(或其多联体)中存在目标位点,并且其中当位点特异性Stem引物反应的速率与错配Stem引物反应相同或比错配Stem引物反应慢时其指示不存在目标位点。
图3.如本文所述的另一示例性修改过的LAMP-STEM技术的一般原理的图示。该技术类似于图2中所描绘的,但除SNP-Stem引物之外还进一步包括“环引物”。参见WO0028082,其以引用的方式并入本文中。
图4.示出了被配置用于进行如本文所述的两阶段扩增方法的示例性系统。在此实施例中,在中央室中进行第一阶段反应,其与一个或多个另外的室连通(例如,流体连通)。在一个优选实施方案中,第一阶段反应混合物被均匀地分布在其中发生第二阶段扩增反应的一个或多于一个另外的室中。
图5.102和106个起始拷贝的实时理论信号及10x第二阶段扩增效率对比第一阶段反应效率。上图在对数标度上显示两个指数反应速率,且下图在线性标度上显示它们。纵轴表示存在的扩增子的拷贝数目;输入材料和扩增材料两者。此轴线还表示可使用嵌入染料生成并检测的信号。水平虚线表示测量可通过所述染料生成的荧光信号的仪器的检测极限。两幅图的水平轴线表示以分钟为单位的时间。8分钟时间点是第二阶段引物添加到反应中时的点。如果第二阶段引物与通过第一反应生成的初级扩增子内的位点匹配,这便是加速反应起始之时,它是由log图中斜率增加的线来表示。在log图上较低斜率线的连续性指示如果二级引物不与扩增子内的目标位点匹配那么将存在信号。
图6.示出了由于Stem引物中的错配碱基所致的对扩增速率的影响。(a)左图例示了包含3’端错配的Stem引物,其代表对目标SNP无特异性的引物。对比匹配的或SNP-特异性Stem引物(“SNP-Stem引物”),3'错配诱导扩增反应中的延迟。扩增速率的提高在右图中例示,其中虚线表示达到荧光最大斜率(tmax1)之时的最早时间(t),并且ΔCt1表示在SNP-Stem引物与3'端错配Stem引物之间的至tmax的时间滞后。(b)右图例示了如本文所述的另一实施方案,其中Stem引物(SNP-Stem引物和3'端错配引物)在其序列中含有另一个碱基对错配。第二错配向扩增的右侧(即,减小速率)移位(ΔCt2)并且延迟至tmax2的时间。
图7.使用Bio-Rad CFX实时PCR仪器的处理过的荧光迹线,其示出了匹配的Stem引物(即,SNP-Stem引物)LAMP反应(n=4)和错配的Stem引物LAMP反应(n=4)。
图8.示出了根据如本文所述的示例性方法所观察到的提高的扩增速率。(a)提供示出了匹配的Stem引物(即SNP-STEM)反应(淡迹线)和错配的Stem引物反应(深迹线)的原始迹线。(b)量化周期(Cq;参见Hellemans等人,2007)是从拟合的原始迹线起计算作为最大斜率点。将匹配引物的Cq连同错配的Stem引物(深色点)和无Stem引物的LAMP(“哑铃”)反应(开环)一起绘图(淡色点)。
详述
以下为提供用于帮助本领域技术人员实践本发明的详细说明。本领域普通技术人员可在不背离本公开的精神或范围下在本文所述的实施方案中进行修改和改动。本文所提及的所有出版物、专利申请、专利、图和其他参考文献都以引用的方式清楚地整体并入。
本发明提供一种改进的核酸扩增技术(NAAT),且尤其是iNAAT,其是稳定的、成本有效的、在引物放置和设计中提供灵活性,并且还在低拷贝数下具体说来与例如SDA或LAMP相比显示出增加的速率、灵敏度及再现性。
如上所述,有利的是具有一个平台,其将扩增样品分到多个单独的反应中,因此不存在染料或引物的干扰,以使得更多测试可根据样品可靠地进行。为了在不稀释样品且由此减小灵敏度或诱导多个反应室之间的不均匀性下完成此举,样品中的核酸应在分配给最终反应区域之前稍微扩增。这将确保所有下游反应室具有足量的起始DNA(或RNA)以便可靠地提供一个有意义的结果。
完成此举的一种已知方式是使用初始PCR反应,该反应扩增含有目标区域但稍微较大的产物,接着分配那个产物以分隔仅扩增每个小目标区域(或SNP)的下游反应。此被称为嵌套式PCR,因为每个靶序列或SNP是“嵌套”在较大的扩增区域内。如果使用此方法,那么通常需要稀释步骤,以便预扩增引物不会污染最终的反应和检测步骤。稀释步骤是自动化仪器中非常不希望有的,因为其需要另外的流体来源及样品流体的另外操纵。这要简单得多且因此更为有利,以便能够使用含有直接在最终扩增和检测反应中的预扩增样品的流体。
完成此举的另一种方式是在预扩增引物中使用Irma而非胸腺嘧啶,接着使用酶(其破坏尿嘧啶)破坏后续步骤中的引物,然后使用所生成的预扩增但无引物的溶液用于最终的扩增和检测步骤。此方法的优点是不需要引入稀释剂,但需要另外的酶,所述酶可以干燥和固定化(冻干)形式提供,这比稀释步骤更为简单:进一步期望使用不需要温度循环(等温)的方法。这是因为等温扩增反应倾向于比温度循环反应(如PCR)要更快,且因为等温要求造成较低成本和较低电力的仪器。
用于预扩增样品的另一种已知方法是使用全基因组扩增,由此样品中的所有遗传物质都同等地扩增。这是使用短(6或7个碱基)引物的文库完成,所述引物文库代表几乎所有的可能的序列且可因此覆盖所有的基因组。几乎所有的核酸样品都将被来自除目标以外的生物体的核酸污染,且有时存在与目标遗传物质相比超过108倍过量的此不需要的遗传物质。
因此,对于此方法,为此预扩增方法所需的绝大多数扩增资源将被不希望有的污染DNA的扩增所消耗。并且在目标核酸内,在最终扩增反应中仅测试很少一部分(通常.01%或更少)基因组,所以全基因组扩增方法在非信息基因组区域处以超过1012倍进一步被错过导向(miss-directed)。另外,全基因组扩增方法采取相对较长时间(数小时),且需要高浓度的特殊的、高度加工的链置换酶,这为测定增加了成本。如果使用此方法预扩增太多的物质,这可在高度污染的样品中发生,那么阳性信号可产生最终的检测区,即使不存在目标DNA。需要稀释步骤来防止此假阳性信号,这为采用此技术的仪器的流体处理系统增加了成本和复杂性。
不具有以上另外测定要求及其相关缺点的方法是优选的。
如本文所述的方法提供低速等温预扩增,接着是高速位点特异性扩增和检测步骤。举例来说,如本文所述的示例性方法包括第一阶段慢速等温反应,紧接着是单独的或第二阶段快速指数等温扩增反应,该反应是以相对于第一反应的提高的速率进行。
在另一实施例中,在环引物或茎引物不存在下,使用LAMP系统完成区域特异性预扩增步骤,因此导致非常慢的指数反应速度。一旦(在预定的时间帧内)实现大致100-100,000x的扩增,便将反应分到多个反应室中,其中在每个室中借助于例如3'端匹配/错配或退火温度差异引入不同组的位点特异性敏感的环或茎引物,以便速度高得多的指数反应仅在环或茎引物正确地与样品序列匹配时发生。在扩增速率上的显著差异可通过例如嵌入染料的实时荧光测量来检测,且因此,在同一目标区域内的多个位点特异性反应可用单一测定单独鉴定。
因此,一方面,本发明提供两阶段核酸扩增反应,其包括:提供靶核酸模板和至少一种引物,所述引物在待扩增的目标区域附近与靶核酸模板退火;进行第一阶段核酸扩增(或“预扩增”)反应以扩增目标区域(扩增子)。在某些实施方案中,提供正向和反向引物并且用于合成和扩增目标区域或目标扩增子。
随后,在一个或多个第二阶段扩增反应中利用预扩增反应产物(“初级扩增子”或“目标扩增区域”),其中这些反应中的至少一个包括位点或序列特异性二级引物(“位点特异性引物”),以便只有当位点特异性引物的互补序列(即位点特异性目标区域)存在于来自阶段一的初级扩增子或扩增的目标区域中时才发生快速扩增。换言之,来自阶段一的目标核酸区域对目标位点呈阳性。如本文所述,扩增产物在每个第二阶段反应中的出现可同时和实时检测并比较,其中相对于第一阶段反应、第二阶段反应(其中不添加二级引物)及第二阶段错配引物反应的快速扩增速率指示位点特异性目标区域的存在。
显然,因为在某些实施方案中,扩增的区域在第一阶段和第二阶段反应中是相同的,所以有利的是在存在来自第一阶段扩增反应的可测量产物而不能检测到第二阶段扩增产物之前很好地引入第二阶段扩增反应引物。
如本文所述的方法提供第一阶段慢速等温预扩增,接着是多个离散的第二阶段扩增和检测反应,所述第二反应直接对来自第一阶段扩增的产物并行进行。至少一个第二阶段反应包括位点特异性二级引物,其中如果初级扩增子模板包含位点特异性引物的互补位点,那么位点特异性引物扩增反应在相对于第一阶段反应和第二阶段反应(其中不添加二级引物)两者的较快速率下进行。在某些实施方案中,至少一个第二阶段反应包括具有错配核苷酸的二级引物(“错配引物”),例如3’错配(“3’错配引物”),其中位点特异性引物扩增反应在相对于第一阶段反应、第二阶段反应(其中不添加二级引物)及第二阶段错配引物反应的较快速率下进行。
例如,本发明提供一种方法,其中进行第一阶段区域特异性预扩增步骤,然后将反应分到多个反应室中,其中在至少一个室中借助于例如3'端匹配/错配或退火温度差异引入位点特异性敏感的二级引物,例如环或茎引物,以便速度高得多的指数反应仅在二级引物正确地与样品序列匹配时发生。在扩增速率上的显著差异可通过例如嵌入染料的实时荧光测量来检测,且因此,在同一目标区域内的多个位点特异性反应可用单一测定单独鉴定。
除非另外定义,本文所用的全部技术和科学术语都具有本发明相关领域的普通技术人员通常理解的相同含义。本发明中所用的术语仅仅是用于描述具体的实施方案,而不意图限制本发明。
当提供一个数值范围时,应该理解的是介于该范围的上下限间的每一个中间值(除非文中另外清楚地指出,否则所述中间值是下限单位的十分之一,如在含有许多碳原子的组的情况下,提供落在此范围内的每个碳原子数)和任何其他所说明的或者在所说明的范围中的中间值都被包括在本发明内。这些较小范围的上下限可独立地被包括在该较小的范围中,且在所说明范围内明确地排除极限值的条件下也被包括在本发明内。当所述范围包括所述上下限中的一个或两个时,排除了那些所包括的上下限中的一个或两个的范围也包括在本发明范围内。
以下术语被用于描述本发明。在术语并未在本文中特别定义的情况下,该术语被本领域普通技术人员给予本领域公知的含义,本领域技术人员将该术语在上下文中应用于描述本发明的其用途中。
除非上下文另外清楚地指示,如本文和所附权利要求书中所用的冠词“一个(种)”在本文中用于指代一个或多于一个(即至少一个)该冠词的语法对象。举例来说,“一个要素”意指一个要素或多于一个要素。
如在本文说明书和权利要求书中所用的短语“和/或”应理解为指这样结合起来的要素中的“任一个或二者”,即在一些情况下联合性地存在而在其他情况下分离性地存在的要素。用“和/或”列出的多个要素应以相同的方式理解,即这样结合起来的要素中的“一个或多个”。除了通过“和/或”措辞所具体指出的要素之外,可任选地存在另外的要素,而不论与所具体指出的要素是否相关。因此,作为非限制性实例,当与开放式表述如“包括”联合使用时,表述“A和/或B”在一个实施方案中可仅有A(任选地包括除了B以外的要素);在另一实施方案中,可仅有B(任选包括除了A以外的要素);在又一实施方案中,可表示A和B二者(任选包括其他要素);等等。
如本文说明书和权利要求书中所用,“或”应理解为具有与如上所定义的“和/或”相同的含义。举例来说,当在列表中分列项目时,“或”或“和/或”应该认为是包括性的,即包括要素列表或大量要素中的至少一个,而且包括多于一个,并且任选地包括另外的未列出的项目。只有明确表示相反含义的术语,如“仅仅之一”或“正好之一”或当在权利要求中使用“由...组成”时,将表示包括要素列表或大量要素中的正好一个要素。一般说来,当前面有排他术语如“两者之一”、“其一”、“仅有其一”或“恰好其一”时,本文使用的术语“或”应理解为表示排他的替代方案(即“一个或另一,但非两者”)。
在权利要求书以及上面的说明书中,所有过渡性表述如“包含”、“包括”、“载有”、“具有”、“含有”、“涉及”、“持有”、“含”等均应理解为开放性的,即理解为指包括但不限于。只有过渡性表述“由...组成”和“基本上由...组成”分别为封闭式或半封闭式的过渡性表述,如美国专利局专利审查手册第2111.03部分所规定。
关于一个或多个要素的列表,本说明书和权利要求书中用到的表述“至少一个”应理解为指选自所述要素列表中的任何一个或多个要素的至少一个要素,但不一定包含所述要素列表内明确列举的每个要素中的至少一个,也不排除所述要素列表中要素的任何组合。此定义还允许可任选地存在除表述“至少一个”所修饰的要素列表内明确指出的要素以外的要素,无论与那些明确指出的要素相关或不相关。因此,作为非限制性实例,“A和B中的至少一个”(或等同地,“A或B中的至少一个”,或等同地,“A和/或B中的至少一个”)在一个实施方案中可表示至少一个A,任选地包括多于一个A,但不存在B(并且任选地包括除了B以外的要素);在另一个实施方案中,可表示至少一个B,任选地包括多于一个B,但不存在A(并且任选地包括除了A以外的要素);在又一个实施方案中,可表示至少一个A,任选地包括多于一个A,以及至少一个B,任选地包括多于一个B(并且任选地包括其他要素);等等。
还应理解,除非上下文另外指出,在本文所述的包括多于一个步骤或动作的某些方法中,方法的步骤或动作顺序不一定限于所述方法的步骤或动作顺序。
除非另有陈述,如本文所用的术语“化合物”是指本文所公开的任何特定化合物并且包括互变异构体、位置异构体、几何异构体、及适用时立体异构体,包括其光学异构体(对映异构体)及其他立体异构体(非对映异构体),以及在上下文中适用时其药学上可接受的盐和衍生物(包括前药形式)。在上下文的使用中,术语化合物一般指的是单一化合物,而且还可包括其他化合物,如立体异构体、位置异构体和/或光学异构体(包括外消旋混合物)以及所公开的化合物的特定对映异构体或对映异构体富集的混合物。在上下文中的术语还指的是已被修饰以促进化合物施用和递送到活性位点的化合物的前药形式。注意到,在描述本化合物时,尤其描述众多取代基及与其相关的变量。本领域普通技术人员应理解本文所述的分子是一般如下文所述的稳定化合物。当示出键时,双键和单键都在所示化合物的情形中展示。
术语“患者”或“受试者”在说明书通篇中用于描述动物,优选人或驯养动物,提供用根据本发明的组合物对其进行的治疗,包括预防性治疗。对于治疗针对某种具体动物如人患者的感染、病状或疾病状态而言,术语患者是指所述特定动物,包括驯养动物,如狗或猫或农畜,如马、母牛、绵羊等。一般说来,在本发明中,除非另有说明或从术语使用的上下文中所暗示,术语患者是指人患者。
术语“有效”被用于描述当在其预定用途的情形中使用时实现预期结果的化合物、组合物或组分的量。术语有效包括所有其他有效量或有效浓度术语,其另外描述或用于本发明应用中。
术语“核酸”、“多核苷酸”及“寡核苷酸”是指核苷酸的生物聚合物,并且除非上下文中另外指示,包括修饰的和未修饰的核苷酸,及DNA和RNA两者。例如,在某些实施方案中,核酸是肽核酸(PNA)。通常,使用DNA作为用于扩增的核酸模板进行本文所述的方法。然而,其核苷酸被人工衍生物取代的核酸或来自天然DNA或RNA的修饰的核酸也包括在本发明的核酸中,在所述核酸用作合成互补链的模板的限度内。本发明的核酸一般包含在生物样品中。生物样品包括动物、植物或微生物组织、细胞、培养物及排泄物、或其提取物。在某些方面中,生物样品包括细胞内寄生虫基因组DNA或RNA,如病毒或支原体。核酸可来源于包含在所述生物样品中的核酸。例如,基因组DNA、或由mRNA合成的cDNA、或基于来源于生物样品的核酸扩增的核酸优选用于所述方法中。
术语“引物”或“寡核苷酸引物”可指的是满足以下要求的短多核苷酸:其必须形成足以与所需核酸模板退火的互补碱基配对,并且得到充当互补链在3'-末端处的合成起点的--OH基团。因此,其主链不一定限于经由磷酸二酯键的那个。举例来说,其可包含具有S而非O作为基于肽键的主链或肽核酸的硫代磷酸酯衍生物。碱基可以是能够互补碱基配对的那些。在自然界中,存在5个碱基,亦即A、C、T、G及U,但碱基可以是类似物,如溴脱氧尿苷。如本文所用的寡核苷酸不仅可用作合成起点,而且用作合成互补链的模板。术语多核苷酸包括寡核苷酸,其具有相对较短的链长度。显然,引物不必完全互补,以便退火至多核酸上的结合位点。
在某些实施方案中,引物与结合位点序列互补。在其他实施方案中,引物包含一个或多个错配核苷酸(即不与结合位点互补的碱基)。在又一些实施方案中,引物可包含不与同引物与其退火的多核酸的反向链互补的多核酸退火的区段。在某些实施方案中,引物在长度上是2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70或更多个核苷酸。在一个优选实施方案中,引物包含2至100个核苷酸。
寡核苷酸可用于与相同或不同生物体中的基因组DNA或cDNA序列杂交。本领域技术人员将理解,各种程度的杂交严格性可用于测定中。可检测的结合所需的互补性程度(序列同一性)将根据杂交介质和/或洗涤介质的严格性而变化。随着杂交条件变得更严格,在探针与要发生的双链体形成的靶标之间必须存在更大程度的互补性。严格性程度可通过以下一个或多个来控制:温度、离子强度、pH及部分变性溶剂如甲酰胺的存在。例如,杂交严格性方便地通过经由例如将甲酰胺浓度操控在0%至50%范围内改变反应物的极性而变化。通过降低杂交的严格性可以补偿探针和引物中的微小序列变化。
“互补性”是指一个核酸通过传统的沃森-克里克或其他非传统类型与另一个核酸序列形成一个或多个氢键或与其杂交的能力。如本文所用的杂交是指分子在低、中等、或高度严格条件下仅与特定的核苷酸序列的结合、成双链或杂交,包括当那个序列存在于复杂的混合物(例如总细胞)DNA或RNA中时。参见,例如Ausubel等人,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,N.Y.,1993
如果在多核苷酸的某些位置处的核苷酸能够与在反平行的DNA或RNA链中的相同位置处的核苷酸形成沃森-克里克配对,那么所述多核苷酸与所述DNA或RNA分子在那个位置处彼此互补。当在每个分子中的足够数量的相应位置被可彼此杂交或退火以实现所需过程的核苷酸占据时,多核苷酸与DNA或RNA分子彼此“基本上互补”。互补序列是能够在严格条件下退火以提供充当合成互补链的起点的3'-末端的序列。
“正向引物结合位点”和“反向引物结合位点”是指正向和反向引物所结合至的模板DNA和/或扩增子上的区域。引物用于划定在扩增期间以指数方式扩增的原始模板多核苷酸的区域。在一些实施方案中,另外的引物可结合至正向引物和/或反向引物的5'区域。当使用这类另外的引物时,正向引物结合位点和/或反向引物结合位点可包括这些另外的引物的结合区以及引物本身的结合区。例如,在一些实施方案中,所述方法可使用一个或多个另外的引物,所述引物结合至位于正向和/或反向引物结合区的5'处的区域。这类方法公开于例如WO0028082中,所述专利公开了“置换引物”或“外部引物”的用途。
在本发明中使用的术语“模板”意指充当核酸扩增技术中用于合成互补链的模板的核酸。具有与模板互补的核苷酸序列的互补链具有作为对应于模板的链的含义,但两者之间的关系仅仅是相对的。也就是说,根据本文所述的方法,作为互补链合成的链可再次用作模板。换言之,互补链可变成模板。在某些实施方案中,模板来源于生物样品,例如植物、动物、病毒、微生物、细菌、真菌等。在某些实施方案中,动物是哺乳动物,例如人患者。
“患者样品”是指从患者处采集的任何样品并且可包括血液、粪便、拭子、痰液、肺泡灌洗液、组织样品、尿液或脊髓液。其他合适的患者样品及提取它们的方法为本领域技术人员所熟知。样品所采集自的“患者”或“受试者”可以是人或非人动物。当样品不被明确地称为患者样品时,该术语也包括采集自其他来源的样品。实例包括来自表面的拭子、水样品(例如废水、海水、湖水、饮用水)、食物样品、美容产品、医药产品、发酵产物、细胞和微生物培养物及其中需要检测微生物的其他样品。
在本发明中,使用核酸的术语“合成”和“扩增”。在本发明中的核酸合成意指核酸从充当合成起点的寡核苷酸的伸长或延伸。如果不仅此合成而且其他核酸的形成及由此形成的核酸的伸长或延伸反应连续地发生,那么一系列这些反应全被称为扩增。
“同一性”正如本领域所知的,是指通过比较序列而确定的两个或更多个多肽序列、或两个或更多个多核苷酸序列之间的关系。在本领域中,“同一性”还意指多肽或多核苷酸序列之间的序列相关性程度,如通过所述序列链之间的匹配所确定。“同一性”和“相似性”可容易地通过已知方法计算,所述方法包括但不限于,Computational Molecular Biology,Lesk,A.M.,编著,Oxford University Press,New York,1988;Biocomputing:Informatics and Genome Projects,Smith,D.W.,编著,Academic Press,New York,1993;Computer Analysis of Sequence Data,第I部分,Griffin,A.M.,和Griffin,H.G.,编著;Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academic Press,1987;以及Sequence Analysis Primer,Gribskov,M.和Devereux,J.,编著,M Stockton Press,New York,1991;以及Carillo,H.,和Lipman,D.,Siam J.Applied Math.,48:1073(1988)中描述的那些。另外,同一性百分比的值可从使用AlignX component of Vector NTI Suite 8.0(Informax,Frederick,Md.)的默认设置生成的氨基酸和核苷酸序列比对中获得。
测定同一性的优选方法被设计来得出测试序列之间的最大匹配。测定同一性和相似性的方法都编纂在公众可获得的计算机程序中。测定两个序列之间的同一性和相似性的优选计算机程序方法包括但不限于GCG程序包(Devereux,J.等人,Nucleic Acids Research 12(1):387(1984))、BLASTP、BLASTN和FASTA(Atschul,S.F.等人,J.Molec.Biol.215:403-410(1990))。BLAST X程序可公开获自NCBI及其他来源(BLAST Manual,Altschul,S.等人,NCBINLM NIH Bethesda,Md.20894:Altschul,S.等人,J.Mol.Biol.215:403-410(1990))。公知的Smith Waterman算法也可用于测定同一性。
“单核苷酸多态性”(SNP)是通常发生在群体(例如1%)内的DNA序列变化,其中在基因组(或其他共享序列)中的单核苷酸-A、T、C或G-在生物学物种的成员或成对染色体之间不同。例如,来自不同个体(AAGCCTA至AAGCTTA)的两个经测序的DNA片段在单核苷酸中含有差异(即,存在两个等位基因)。几乎所有常见的SNP都仅具有两个等位基因。SNP可存在于DNA的编码、非编码或基因间区域中。SNP的基因组分布是不均匀的;相比在编码区中,SNP更常出现于非编码区中,或一般说来,其中自然选择起作用并且‘固定’构成最有利的遗传适应性的SNP的等位基因(消除其他变体)。其他因子,像遗传重组和突变率,也可测定SNP densi。编码序列内的SNP不一定改变所产生的蛋白质的氨基酸序列,由于遗传密码的简并性。
在编码区中的SNP具有两种类型,同义和非同义SNP。同义SNP不影响蛋白质序列,而非同义SNP改变蛋白质的氨基酸序列。非同义SNP具有两种类型:错义和无义。不在蛋白质编码区域中的SNP仍然可以影响基因剪接、转录因子结合、信使RNA降解、或非编码RNA的序列。由此类SNP实现的基因表达被称为eSNP(表达SNP)并且可在该基因的上游或下游。
至于基因,存在SNP的生物信息学数据库。dbSNP是来自国家生物技术信息中心(NCBI)的SNP数据库。Kaviar是来自多个数据源(包括dbSNP)的SNP的一览表。SNPedia是支持个人基因组注释、解释及分析的wiki-style数据库。OMIM数据库描述了多态性与疾病(例如,以文本形式给出疾病)之间的关联性,人类基因突变数据库提供了引起或与人类遗传疾病有关的基因突变及功能性SNP,并且GWAS Central允许用户在一个或多个基因组范围的关联研究中目测查询实际的概要水平关联数据。国际SNP Map工作组通过比对Genebank中的大插入克隆的基因组序列对侧接每个SNP的序列进行绘图。另一个数据库是国际人类基因组单体型图计划(International HapMap Project),其中研究人员鉴定Tag SNP以便能够确定存在于每个受试者中的单倍型的集合。
通过所采用的扩增技术产生的多核酸一般被称为“扩增子”或“扩增产物”。所产生的扩增子的特性根据实践中的NAAT而显著不同。例如,NAAT如PCR可产生基本上相同尺寸和序列的扩增子。其他NAAT产生尺寸非常不同的扩增子,其中扩增子由不同数量的重复序列构成以便扩增子是不同长度的多联体的集合。来自所述多联体的重复序列将反映作为进行中的测定的对象的多核酸的序列。
在本说明书中,简单表述“5'-侧”或“3'-侧”是指充当模板的核酸链的那侧,其中5'端一般包括磷酸基且3'端一般包括游离的-OH基团。
术语“疾病状态或病状”用于描述任何疾病状态或病状,具体说来,与遗传异常有关或由于存在致病生物如病毒、细菌、古生菌、原生动物或多细胞生物体所致的那些。
方法
如本文所述,已经惊人地且出人意料地发现使用引物进行两阶段核酸扩增反应允许目标核酸序列的快速实时检测,所述引物根据目标特异性序列的存在或不存在提供差异反应速率,这种方法为现场护理诊断提供优势。
一方面,本发明提供两阶段核酸扩增反应,其包括:提供靶核酸模板和至少一种引物,所述引物在待扩增的目标区域附近与靶核酸模板退火;进行第一阶段核酸扩增(或预扩增)反应以扩增目标区域(扩增子)。在某些实施方案中,提供正向和反向引物并且用于合成和扩增目标区域或目标扩增子。
随后,在一个或多个离散的第二阶段核酸扩增反应中利用预第一阶段扩增反应产物(“初级扩增子”或“目标扩增区域”),其中在至少一个第二阶段反应中包括位点特异性引物,以便只有当位点特异性引物的互补序列(即目标位点特异性区域)存在于初级扩增子中时才发生快速或加速扩增。换句话说,如果第二阶段扩增反应的速率相对于阶段一反应、及缺少另外的引物的任何第二阶段反应、和/或具有错配引物的第二阶段反应是加速的,那么来自阶段一的目标核酸区域对于目标位点呈阳性。
因此,根据本文所述的某些方法,第二阶段反应的速率相对于第一通过特异性引物结合序列的存在而选择性地提高,所述特异性引物结合序列与第二阶段引物(在本文中,“位点特异性引物”)的3’端完全互补或至少是互补的。在某些实施方案中,相对扩增反应速率如下:第二阶段位点特异性引物扩增>>第一阶段扩增反应。在又一些实施方案中,相对扩增反应速率如下:第二阶段位点特异性引物扩增>>第一阶段反应≈第二阶段错配引物扩增。如本文所用,术语“错配引物”一般指的是具有不与模板上的引物结合位点互补的3'端核苷酸的引物。
如上所指出,第一阶段与第二阶段之间,以及第二阶段位点特异性引物对比第二阶段错配引物之间的差异相对扩增反应速率对于能够选择性地检测目标位点的存在(即扩增)是重要的。例如,图5示出了第一阶段预扩增反应相对缓慢地进行至阈值信号水平(即,Cq更长)。然而,在互补引物存在下,第二阶段扩增反应以指数方式进行(即,互补引物的Cq比第一阶段反应和第二阶段错配引物反应两者的Cq更快)。
在某些实施方案中,第二阶段扩增速率是指数的。在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应速率比第二阶段错配引物反应快至少约5、10、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、500、1000、10000、100000倍或更大倍数。在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应速率比第二阶段错配引物反应快约5、10、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、500、1000、10000、100000倍或更大倍数。
在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应所得到的Cq(至阳性反应检测的时间)比第二阶段错配引物反应快至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、500%、1000%、10000%或更多。在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应所得到的Cq(至阳性反应检测的时间)比第二阶段错配引物反应快约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、500%、1000%、10000%或更多。在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应所得到的Cq(至阳性反应检测的时间)比第二阶段错配引物反应快至少约25%。在本文所述方法的某些实施方案中,第二阶段位点特异性引物反应所得到的Cq(至阳性反应检测的时间)比第二阶段错配引物反应快约10%至约1000%、约20%至约500%、或约25%至约100%。然而,重要因素在于时间上的差异足以超过系统的可变性以便确信地区分哪个第二阶段反应是匹配的(即,第二阶段引物与模板上的引物结合位点互补,特别是3'端处)。
如下所述,在某些实施方案中,第一阶段扩增反应是相对缓慢的基于LAMP的扩增。在另一些实施方案中,第二阶段扩增反应是相对快速的基于LAMP-STEM的扩增,其中反应速率通过将位点特异性Stem引物结合至目标位点来提高。因此,如本文所述的方法提供稳定、快速、有效及高度特异性的所需基因序列的扩增。所需扩增子的扩增可通过任何已知方法监测或检测,包括例如嵌入染料、标记试剂等。
在某些实施方案中,位点特异性引物是位点特异性Stem引物。在某些实施方案中,错配引物是错配Stem引物。在本文所述的任何实施方案中,错配引物包含至少一个错配核苷酸(即不与模板互补的核苷酸)。在某些实施方案中,错配核苷酸处于错配引物的3’端(“3’错配引物”)。
在某些实施方案中,位点特异性引物和错配引物在它们的3'端处分别包含对多等位基因或多态位点中的一个形式有特异性或互补的核苷酸,以便根据核酸模板包含哪个等位基因或多态性,位点特异性引物可包含3'端核苷酸错配,并且错配引物可含有3'端互补核苷酸。换言之,在某些实施方案中,所述方法包括进行多个第二阶段扩增反应,其中每个反应包含对特定的等位基因有特异性的引物。然而,如本文所述,仅那些在其3'端处包含与目标位点互补的二级引物的扩增反应将在相对于第一阶段反应并且相对于包含3'错配的第二阶段反应的提高的速率下进行。
在某些实施方案中,所述方法包括进行多个第二阶段扩增反应,其中每个相应反应包含位点特异性或等位基因特异性引物。在某些实施方案中,在每个相应的第二阶段扩增反应中的每个位点特异性引物对不同的等位基因、突变或多态性有特异性。在这类配置中,所述方法提供一种同时确定多个多态性的存在或不存在的多重方法。如所述的方法因此尤其便于区分多等位基因、基因型、分化体、形式、组、亚组、类别、物种或株系。例如,某些致病菌与非致病株系或物种密切相关。因此,在一个示例性方面中,本发明提供包括多个第二阶段反应的方法,其中每个相应反应包含对目标位点或等位基因有特异性的引物(或引物对),其允许同时确定例如微生物的物种和株系。
举例来说,在一个实施方案中,本发明提供一种两阶段核酸扩增和实时检测方法,所述方法包括:
a.提供靶核酸模板和至少一种引物,所述引物在靠近待扩增的目标区域处与靶核酸模板退火;
b.进行第一阶段核酸扩增反应以扩增所述目标区域,由此形成初级扩增子;
c.将(b)分成至少两个反应,二级位点特异性引物包括在至少一个所述反应中,所述二级位点特异性引物与在初级扩增子中并界定目标位点的位点特异性引物结合区(即,目标位点特异性区)互补,并且包括其中不含二级引物的至少一个反应;
d.进行第二核酸扩增反应,由此扩增目标区域;以及
e.实时检测并比较位点特异性引物反应和错配引物反应的扩增速率,其中在位点特异性引物反应中相对于错配引物反应的提高的扩增速率指示目标位点的存在。在某些实施方案中,提供正向和反向引物并且用于合成和扩增目标区域或目标扩增子。
在本文所述的任何方面或实施方案中,错配引物包含3’末端核苷酸错配。在本文所述的任何方面或实施方案中,位点特异性引物在3’末端包含与靶核酸模板中的目标核苷酸互补的核苷酸。在某些实施方案中,位点特异性引物包含在除3’端以外的位点处的核苷酸错配。
在某些实施方案中,多个第二阶段核酸扩增反应并行进行。在一个优选实施方案中,位点特异性引物反应与其中使用相似的位点特异性引物但在其核酸序列中包含错配的分离反应并行进行和监测。换言之,在一个反应中,位点特异性引物与靶核酸上的目标位点完全互补,并且在另一个反应中,引物退火于相同位点,但包含错配,例如3’端错配。本发明者已发现,在位点特异性引物中的错配减缓扩增反应速率,这样足以使得通过直接实时检测或监测并且同时比较两个扩增反应,有可能鉴定存在于核酸样品中的序列变化的存在或不存在。换句话说,第二扩增反应的速率基于与位点特异性引物互补的序列的存在选择性地得到提高或抑制。不受任何特定理论的约束,据信第二阶段扩增的速率通过利用位点特异性引物得到提高,因为该位点特异性引物充当另一个延伸起点。
另一方面,描述了一种方法,其包括利用第一阶段扩增产物进行多个单独的或离散的第二阶段扩增反应,其中第二阶段扩增反应的速率在以下反应之间比较,至少一个具有与模板上的目标区域或序列互补的位点特异性引物的反应与具有退火于相同位点但包含碱基对错配(在本文中“错配引物”)的引物的反应,其中相对于另一个的更快反应速率指示目标特异性位点或区域的存在或不存在。
在某些实施方案中,所述方法包括与其中不添加另外的引物的位点特异性和错配扩增反应并行进行至少一个另外的第二阶段扩增反应,并且实时监测和比较以下反应之间的扩增速率:包含位点特异性引物的第二阶段扩增反应、包含错配引物的反应及不包含引物的反应,其中相对于其他的提高的反应速率指示目标特异性位点或区域的存在。
本发明中使用的靶模板可为包含合适的引物结合区的任何多核酸,所述引物结合区允许扩增目标多核酸。本领域技术人员应理解,正向和反向引物结合位点需要以一定方式定位在靶模板上以使得正向引物结合区和反向引物结合区定位在分别将要在有义和反义链上扩增的序列的5'处。
靶模板可以是单链或双链的。当靶模板是单链多核酸时,本领域技术人员应理解靶模板最初将仅包含一个引物结合区。然而,第一引物的结合将造成互补链的合成,该互补链则含有第二引物结合区。
靶模板可来源于RNA分子,在此情况下,RNA需要在实践本发明方法之前转录成DNA。用于转录RNA的合适试剂在本领域中是公知的并且包括但不限于逆转录酶。
如本文所述的方法可用任何NAAT实践。举例来说,DNA或RNA扩增的已知方法包括但不限于聚合酶链反应(PCR)及相关扩增工艺(参见,例如授予Mullis等人的美国专利号4,683,195、4,683,202、4,800,159、4,965,188;授予Tabor等人的4,795,699和4,921,794;授予Innis的5,142,033;授予Wilson等人的5,122,464;授予Innis的5,091,310;授予Gyllensten等人的5,066,584;授予Gelfand等人的4,889,818;授予Silver等人的4,994,370;授予Biswas的4,766,067;授予Ringold的4,656,134)及RNA介导的扩增,其将反义RNA用于靶序列作为双链DNA合成的模板(授予Malek等人的美国专利号5,130,238,商品名称NASBA),这些参考文献的全部内容以引用的方式并入本文中(参见,例如Ausubel,同上;或Sambrook,同上。)。
举例来说,聚合酶链反应(PCR)技术可用于扩增本发明的多核苷酸序列及直接来自基因组DNA或cDNA文库的相关基因。PCR及其他体外扩增方法也可适用于例如克隆编码待表达的蛋白质的核酸序列,以使得核酸用作检测所需mRNA在样品中的存在的探针,用于核酸测序,或用于其他目的。足以指导本领域技术人员进行体外扩增方法的技术的实例见于以下文献中:Berger,同上,Sambrook,同上,及Ausubel,同上,以及Mullis等人,美国专利号4,683,202(1987);及Innis等人,PCR Protocols A Guide to Methods and Applications,编著,Academic Press Inc.,San Diego,Calif.(1990)。可商购获得的用于基因组PCR扩增的试剂盒在本领域中是已知的。参见,例如Advantage-GC Genomic PCR Kit(Clontech)。另外,例如,T4基因32蛋白(Boehringer Mannheim)可用于改善长PCR产物的产率。
在某些方面中,本文所述的方法中利用的NAAT是等温核酸扩增技术。一些等温扩增技术取决于作为扩增工艺的一部分的转录,例如基于核酸序列的扩增(NASBA;美国专利号5,409,818)和转录介导的扩增(TMA;美国专利号5,399,491),而其他取决于解旋酶或重组酶的作用,分别例如解旋酶依赖性扩增(HDA;WO2004027025)和重组酶聚合酶扩增(RPA;WO03072805),而另一些则取决于某些DNA聚合酶的链置换活性,例如链置换扩增(SDA;美国专利号5,455,166)、环介导的等温扩增(LAMP;WO0028082、WO0134790、WO0224902)、嵌合体置换反应(RDC;WO9794126)、滚环扩增(RCA;Lizardi,P.M.等人Nature Genetics,(1998)19.225-231)、核酸的等温嵌合扩增(ICAN;WO0216639)、SMart扩增工艺(SMAP;WO2005063977)、线性等温多聚化扩增(LIMA;Isothermal amplification and multimerization of DNA by Bst DNA polymerase,Hafner G.J.,Yang I.C.,Wolter L.C.,Stafford M.R.,Giffard P.M,BioTechniques,2001,第30卷,第4期,第852-867页)、以及如美国专利号6,743,605(在本文中被称为‘模板再引发扩增’或TRA)和WO9601327(在本文中被称为‘自延伸扩增’或SEA)中所述的方法。
这些NAAT的特征是在于,它们经由引物或引物组的作用提供多核酸的拷贝并且通过反向引物或引物组提供所述拷贝的再拷贝。这使得能够在指数速率下生成原始多核酸的拷贝。一般说来,参考NAAT,有助于将通过方法检测的核酸的物理碎片与以下物质区分开:由此原始核酸制成的第一拷贝、由此原始核酸制成的拷贝的第一拷贝、一份拷贝的此拷贝的其他拷贝。为了清楚起见,来源于本身被分析的样品的核酸被称为“靶核酸模板”。参考本文所述的两阶段方法,第一阶段引物依赖性扩增反应与第二阶段反应相比相对缓慢。
如熟练技术人员应理解,生成引物的扩增子导致扩增子通过靶核酸模板的重复扩增反应以及扩增子本身的引发的进一步生成。扩增子有可能包含与靶模板的组合。
扩增子可具有非常可变的长度,因为靶模板可从超出由特定的NAAT中采用的引物所限定的核酸区域的第一引发位点进行拷贝。一般说来,NAAT的关键特征将是提供一种方法,由此扩增子可对于由方法所用的另一引物变得可用,以便生成(经由重复扩增反应)将具有由所用引物限定的离散长度的扩增子。NAAT的关键特征又是提供一种方法,由此扩增子变得可由反向引物进一步引发以生成其他拷贝。对于一些NAAT,后代扩增子可基本上不同于第一代扩增子,具体说来,所形成的扩增子可以是第一代扩增子的多联体。
产生以直接来自线性靶模板的多联体形式的扩增子的方法包括LAMP(包括LAMP-STEM)、TRA、SEA及SMAP(后者是LAMP与SEA的混合型)。在每个情况下,多联体由涉及第一代扩增子的过程产生。因此,优选的是多核酸的合成使用选自由以下组成的组的NAAT进行:LAMP、TRA、SEA及SMAP。因此,在每个情况下,本发明与NAAT有关,NAAT提供一种或多种具有产生直接来自线性靶模板的多联体的能力的引物。
如所述的方法优选地用造成模板多联体的形成的NAAT进行。如本文所用的术语“多联体”是指具有基本上类似的核苷酸序列的多核酸,这些核苷酸序列在单股链中交替地连接。这些排列序列可以是彼此简单的重复、反向重复或其组合。此外,所述过程被视为是由下一代扩增子进行重复,以使得可形成更长更长的多联体。
适用于生成多联体的NAAT在本领域中是公知的并且一般包括“等温”扩增技术。这意味着多核酸的扩增不需要孵育温度的变化,相反于已知的热循环技术,如聚合酶链反应。例如,等温扩增方法包括例如SDA、LAMP、LAMP-STEM,如上所述,可与本文所述的方法联合使用。
因此,LAMP、TRA、SMAP及SEA的共同特征在于第一代扩增子依赖性引发,即当第一代扩增子用作引物本身时,不管是通过分子内事件抑或分子间事件,产生下一代扩增子,其在尺寸上大于第一代扩增子并且其在本质上是多联的。实际上,这是这些NAAT的特征:更长更长的扩增子从较短的扩增子生成以便用于茎引物的结合位点数目在扩增过程期间以指数方式增加且因此茎引物加速扩增的能力。对于在这些NAAT中生成多联体的引物的作用机制的认识有助于理解茎引物是如何发挥其作用的。此外,本领域技术人员了解造成多联体生成的机制将能够容易地鉴定可用于本发明方法中的其他合适的NAAT。
在本文所述的某些实施方案中,第一阶段扩增反应是等温核酸扩增反应。在某些实施方案中,第二阶段扩增反应是等温核酸扩增反应。在另外的实施方案中,第一阶段扩增反应和第二阶段扩增反应都是等温核酸扩增反应。在某些实施方案中,第一阶段和/或第二阶段扩增反应是基于LAMP的等温扩增反应。在一个优选实施方案中,第一阶段扩增是基于LAMP的等温扩增反应且第二阶段是基于LAMP-STEM的等温扩增反应,其中位点特异性引物加速扩增速率(相对于第一扩增反应),并且允许相对于3'错配引物,扩增产物的更早检测。
在某些实施方案中,除正向和反向引物结合区之外,靶模板还需要包含茎区域,所述茎区域需要具有足够长度以允许一种或多种茎引物(例如,位点特异性Stem引物或错配Stem引物)的结合,如本文所述。因此,优选的是茎区域具有以下长度:至少5个核苷酸、至少10个核苷酸、至少15个核苷酸、至少20个核苷酸、至少30个核苷酸、至少50个核苷酸、至少100个核苷酸、至少200个核苷酸、至少300个核苷酸或至少500个核苷酸。
WO0028082描述了环形成引物(LFP)的用途,其中LFP应理解为包含第一和第二区段,其中第一区段与模板上的引物结合区基本上互补且第二区段包含与由第一引物的第一区段生成的扩增子中的区域基本上互补的序列,以便第二区段能够形成环,并且提及NAAT除LFP之外还使用两种“外部引物”。这些引物的特征在于“第一外部引物”将3'结合至模板中的“F2”位点(即第一外部引物结合“F3”位点,图1)且“第二外部引物”将3'结合至第二LFP的结合区,“R2c”位点(即第二外部引物结合“R3c”位点,图1)。因此,这些引物不在扩增子的茎区域中结合,其位于LFP的引物结合位点的5'处。
LAMP中所用的引物在扩增子中生成单链环并且在本文中被称为“环形成引物”。如本文所用的环形成引物是指包含第一和第二区段的引物,其中第一区段与模板上的引物结合区基本上互补且第二区段包含与由第一引物的第一区段生成的扩增子中的区域基本上互补的序列以便第二区段能够形成环。环形成引物的一般结构示于图1中。由通过环形成引物引发靶模板产生的第一(及下一)代扩增子含有单链多核苷酸的环,其侧接有由反向重复序列的沃森-克里克碱基配对形成的双链多核苷酸。多核苷酸的单链环应理解为用于被议论中的NAAT所采用的另一引物结合,但并非特异性地由茎引物结合。
本发明的引物寡核苷酸可通过本领域中已知的任何方法制备,所述方法包括通过直接化学合成(参见,例如Ausubel等人,同上)。化学合成一般产生单链寡核苷酸,其可通过与互补序列杂交或通过使用单链作为模板用DNA聚合酶聚合而转化为双链DNA。本领域技术人员将认识到虽然DNA的化学合成可被限于约100个或更多个碱基的序列,但是可通过较短序列的连接获得更长的序列。
核酸延伸通过DNA聚合酶,例如热稳定的链置换(SD)DNA聚合酶来促进。因为热稳定性SD聚合酶,所以不需要热循环。可纳入置换或缓冲引物(F3和B3)以促进FIP和BIP引物的置换,并且允许互补DNA链的更有效的延伸。
正向和反向引物结合区之间的区域代表了确保形成扩增子的一部分但本身不会常规地提供任何引物结合位点的区域。此区域在本文中被称为扩增子的“茎区域”。结合至茎区域的引物在本文中被称为“茎引物”。茎引物可被定义为结合至茎区域的引物(图2)。它们可进一步被定义为结合正向链上的正向引物结合区的3'处的区域与反向链上的反向引物结合位点的3'处的区域的引物。应当理解,引物结合位点与茎引物的结合位点不会显著重叠。优选的是,引物结合位点与茎引物的结合位点完全不重叠。
在重叠引物结合区的上下文中的“显著地”意味着引物结合位点重叠小于10个核苷酸、小于9个核苷酸、小于8个核苷酸、小于7个核苷酸、小于6个核苷酸、小于5个核苷酸、小于4个核苷酸、小于3个核苷酸、小于2个核苷酸或小于1个核苷酸。优选的是,它们完全不重叠。Stem引物可又被定义为结合正向链上的正向引物结合区的3'处的区域和反向链上的反向引物结合位点的3'处的区域的引物,但其中引物结合区基本上不与任何分子内二级结构重叠,所述分子内二级结构作为由特定的NAAT(尤其是LFP)所采用的引物的直接结果生成。
Stem引物的使用显著地提高扩增速率。这具有以下明显优势:诊断测试例如可在较短时间内提供测试结果,这是诊断测试用户之间的共同价值。更快扩增的另一益处在于,这可以降低假阳性结果的可能性且因此提高测试的特异性。已观察到采用链置换聚合酶的NAAT变得越来越倾向于非特异性扩增,因为扩增所需的时间长度增加了。因而,更快的扩增也可产生更精确的结果。因此,茎引物的使用提高了NAAT如环介导的等温扩增(LAMP)的扩增速率,并且在对于给定靶模板的引物选择中提供更大的灵活性。
因此,在另一实施方案中,所述方法包括基于LAMP和LAMP-STEM中使用的等温方法的扩增技术的性能。环介导的等温扩增(LAMP)的一般方法示于图1中。简单说来,正向和反向环形成引物(被称为FIB和BIP引物)分别在靶(单链)核酸模板上包含例如F1c和F2、B1c和B2引发位点(图1a-b)。靶核酸可来自基因组DNA、cDNA、RNA。有时必需将双链核酸模板变性(经由加热、离子强度或溶剂条件)以允许引物结合至模板。
在如本文所述的某些方法中,进行第一阶段扩增(即“预扩增”)反应,例如LAMP反应。包括例如环形成引物和一种或多种置换引物的LAMP反应在相对缓慢速率下进行。LAMP反应导致被称为“哑铃”的单链扩增子的形成,所述单链扩增子包含茎或中间区域,侧接有由环形成引物生成的3'端和5'端上的环(图1c)。其他扩增周期导致“哑铃”扩增子的多联体的产生,所述多联体具有交替互补性以便环形成引物以及哑铃结构驱动另几轮的延伸。
在如本文所述的示例性扩增方法中,使用NAAT(例如LAMP方法)进行第一阶段等温扩增反应(即“预扩增步骤”)(即图1a-c),其包括正向和反向引物、FIP和BIP引物(分别包含F1c和F2、B1c和B2引发位点)、及置换引物(F3和B3)以扩增包含一个或多个SNP序列的靶核酸上的区域。包括例如LAMP生成的扩增子、缓冲和扩增试剂(例如dNTP)及环形成引物的反应混合物可直接用于如本文所述的示例性扩增方法的第二阶段中。
在本文所述的任何实施方案中,所述方法进一步包括在第一阶段和/或第二阶段扩增反应中加入至少一种置换或缓冲引物。
根据本发明合成或扩增核酸的方法受到催化用于互补链合成的链置换型反应的DNA聚合酶的支持。反应期间,还含有不一定需要链置换型聚合酶的反应步骤。然而,关于组成试剂的简化且从经济的角度来看,有利的是使用一种类型的DNA聚合酶。以下酶已知作为此类DNA聚合酶。此外,本发明中可利用这些酶的各种突变,只要它们兼备用于互补链合成的序列依赖性活性和链置换活性。本文中提及的突变包括仅具有产生酶所需的催化活性的结构的那些或通过例如氨基酸中的突变对催化活性、稳定性或热稳定性有修改的那些。用于所述方法中的示例性聚合酶包括Bst DNA聚合酶、Bca(外-)DNA聚合酶、DNA聚合酶I Klenow片段、Vent DNA聚合酶、Vent(外-)DNA聚合酶(缺乏核酸外切酶活性的Vent DNA聚合酶)、Deep Vent DNA聚合酶、Deep Vent(外-)DNA聚合酶(缺乏核酸外切酶活性的Deep Vent DNA聚合酶)、.PHI.29噬菌体DNA聚合酶、MS-2噬菌体DNA聚合酶、Z-Taq DNA聚合酶(Takara Shuzo Co.,Ltd.)、KOD DNA聚合酶(Toyobo Co.,Ltd.)。
在这些酶之中,Bst DNA聚合酶和Bca(外)DNA聚合酶是尤其需要的酶,因为它们具有一定程度的热稳定性和高催化活性。在一个优选实施方案中,本发明的反应可等温地进行,但因为解链温度(Tm)等的调整,并不总是可能利用酶稳定性所需的温度条件。因此,所需条件之一是:酶是热稳定的。虽然等温反应是可行的,但可进行热变性以提供核酸作为第一模板,且在此方面中,热稳定酶的利用还使得测定方案的选择变宽。
Vent(外-)DNA聚合酶是兼具链置换活性和高度热稳定性的酶。众所周知,涉及通过DNA聚合酶的链置换的互补链合成反应通过添加单链结合蛋白来促进(Paul M.Lizardi等人,Nature Genetics,19,225-232,1998年7月)。将此举应用于本发明,并且通过添加单链结合蛋白,可为预期促进互补链合成的效果。例如,T4基因32有效作为用于Vent(外-)DNA聚合酶的单链结合蛋白。
图2示出了第二阶段扩增反应的示例性实施方案,如本文所述的LAMP-STEM技术。在此实例中,第二阶段扩增反应进一步包含至少一个位点特异性引物(即位点特异性Stem引物),其与来自阶段一的扩增子中的位点特异性Stem引物结合区或序列退火或互补。在一个优选实施方案中,位点特异性Stem引物在其3'端具有与来自阶段一的扩增子中的目标核苷酸(例如SNP)互补的核苷酸。
在某些实施方案中,所述方法包括监测和比较第二阶段反应中的扩增速率。如果来自阶段一的扩增子中的位点特异性Stem引物结合区含有与位点特异性Stem引物的3'端互补的核苷酸,那么模板将在相对于错配引物(即,结合至与位点特异性Stem引物相同的位置但在其3'端具有不与扩增子互补的核苷酸的引物)的提高速率下被扩增。因为SNP-Stem引物与错配引物之间的差异扩增速率,所以有可能并行运行两个反应并比较速率。扩增产物在位点特异性Stem引物中相对于错配引物的更快速出现指示目标等位基因的存在。
环形成引物生成扩增子的稳定单链区域的能力对快速增殖其他扩增子来说是重要的并且代表了采用这些引物的技术的关键方面。这意味着多联扩增子可含有用于被讨论中的NAAT所采用的引物的许多新引发位点。在例如LAMP中,在扩增子中生成反向重复的环形成引物还提供扩增子的单链区域,它们本身可结合至并因此引发扩增子的进一步再拷贝且由此进一步增强扩增。在LAMP中,除了LFP以外还可使用另外的引物,这些引物同样结合至扩增子的这些单链区域以有助于进一步增强扩增(被称为环引物)。本发明的一方面在于,茎引物不结合至由环形成引物和/或环引物所生成的所述稳定单链环,但经由独特的机制促进扩增。
如本文所述的技术的LAMP-STEM组分可进一步包括另外的引物,例如,“环引物”(图3),其与由环形成引物生成的环内的区域退火。环引物可进一步提高LAMP扩增反应的速率。在本文所述的任何实施方案中,所述方法进一步包括添加至少一种环引物,所述环引物与扩增子的第一环或第二环中的区域互补。
在本文所述的任何实施方案中,第一阶段扩增反应通过加热步骤进行,其中将靶核酸模板和引物加热至大约95℃持续约1分钟至约30分钟,包括2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、2,5、26、27、28、29、30,包括其间的所有时间。在某些实施方案中,将靶核酸模板和引物加热至大约95℃持续约5分钟至约10分钟。
在本文所述的任何实施方案中,扩增反应(即第一阶段和/或第二阶段)在约50℃至约80℃的温度下进行。在某些实施方案中,扩增反应在约55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80℃的温度下进行。在某些实施方案中,扩增反应在约55℃至约65℃的温度下进行。
在本文所述的任何实施方案中,位点特异性引物是处于正向。在某些实施方案中,位点特异性引物是处于反向。在另外的实施方案中,正向和反向位点特异性引物都包括在反应中。
在本文所述的任何实施方案中,位点特异性核苷酸是包含在环形成引物、置换引物、位点特异性引物、环引物或其组合中的至少一个的3'端处。
在本文所述的任何实施方案中,引物或核苷酸试剂包含化学修饰。
根据上文,用于检测目标位点的示例性两阶段等温核酸扩增方法包括以下步骤:
A)进行第一阶段核酸扩增反应,其包括:
1)提供包含至少一个第一引物结合区的靶核酸模板及第一和第二环形成引物,其中所述靶核酸模板界定目标区域并且包含目标位点;
2)使包含第一和第二区段的第一环形成引物与靶模板退火,其中第一区段与模板上的第一引物结合区基本上互补且第二区段包含与第一引物中的另一区或由第一环形成引物的第一区段生成的扩增子中的区域基本上互补的序列,以便第二区段能在合适的条件下在扩增子中形成第一单链环;
3)在合适的条件下用具有链置换活性的聚合酶将第一环形成引物从其3'端开始延伸,以形成单链核酸分子,其中第一环形成引物的第二区段杂交到由第一环形成引物的第一区段生成的扩增子中的区域以形成具有第一环形成引物的5'端的第一单链环;
4)使包含第一和第二区段的第二环形成引物与来自(3)的扩增子退火,其中第一区段与来自(3)的扩增子上的第二环形成引物结合区基本上互补,且第二区段包含与第二环形成引物中的另一区或由第二环形成引物的第一区段生成的扩增子中的区域基本上互补的序列,以便第二区域能够在扩增子中形成第二单链环;
5)在合适的条件下用具有链置换活性的聚合酶将第二环形成引物从其3'端开始延伸,以形成单链核酸分子,其中第二环形成引物的第二区段杂交到扩增子中的区域以形成具有第二环形成引物的5'端的第二单链环;
6)重复步骤A2-5,且由此扩增包含目标位点的两个环形成引物之间的核酸模板区域,其中形成包含扩增的核酸(初级扩增子)及第一和第二环形成引物的混合物;和
B)进行第二阶段扩增反应,其包括:
1)提供来自步骤A6的混合物,并且分成多个反应,其中将至少一个位点特异性Stem引物纳入至少一个所述反应中,所述引物与初级扩增子中的位点特异性引物结合区(位点特异性目标区域)基本上互补,且其中至少一个其他反应不包含二级引物;
2)将Stem引物、及第一和第二环形成引物与初级扩增子退火,并且在合适的条件下用具有链置换活性的聚合酶将它们从其3'端开始延伸;
3)重复步骤B2,且由此进一步扩增初级扩增子;以及
4)实时检测并比较位点特异性Stem引物的扩增速率和没有二级引物的反应中的扩增速率,其中位点特异性Stem引物相对于其他反应的扩增速率的提高指示目标位点在扩增核酸中的存在,且其中较慢或类似的速率指示目标位点在扩增核酸中的不存在。
在某些实施方案中,第二阶段扩增反应在相对于第一的提高的速率下进行。
在某些实施方案中,多个反应包括近似相等体积或量的来自第一阶段扩增反应的初级扩增子。
在某些实施方案中,步骤(B)(1)进一步包括将错配Stem引物纳入至少一个另外的反应中。在另外的实施方案中,步骤(B)(4)包括实时检测和比较位点特异性引物反应、错配引物反应及没有二级引物的反应的扩增速率,其中在位点特异性引物反应中相对于其他(以及第一阶段反应)的扩增速率的提高指示目标位点的存在。
如本领域技术人员应理解,在如本文所述的任何方面或实施方案中,所述方法可被修改以便包括任何所需数量的单独或离散的第二阶段反应,任何数量的所述第二阶段反应可分别不包括二级引物、包括位点特异性引物或错配引物。实际上,所述方法包括以下配置:其中相同或不同的位点特异性引物和/或相同或不同的错配引物在单独的反应中并行运行,并且全部都是同时且实时检测和比较。
当引物进一步含有第二区段时,所述第二区段包含与第一引物中的另一区段或由第一引物的第一区段生成的扩增子中的区域基本上互补的序列以使得第二区域能够形式环。“由第一引物(或第二引物)的第一区段生成的扩增子”是指当第一引物通过聚合酶延伸时生成的模板的第一拷贝。所述扩增子包括在其5'端的第一引物的序列。
在某些实施方案中,第二区段与引物所结合至的靶模板上的区域和/或扩增子基本上同一。这类引物在本文中被称为环形成引物。“基本上同一”意指第二区段具有至少70%、80%、90%、95%、99%或100%与模板上的区域和/或扩增子的同一性。还设想仅一部分第二区域显示出与靶模板上的区域的基本上同一性。不管是引物的全部抑或仅一部分第二区段显示与靶模板上的区域的基本上同一性,与靶模板和/或扩增子上的区域基本上同一的第二区段的区域在长度上是至少5个核苷酸、至少10个核苷酸、至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸、或甚至至少70个核苷酸。在本发明的此方面中,一旦引物的第一区段已延伸形成第一扩增子,第二区段便能够结合至同一链内的互补区域且由此形成环。
本发明方法可使用相同种类的正向和反向引物,例如环形成引物(LFP)、发夹引物等来实践。当提及“相同种类的引物”时,这意味着引物全部都是简单引物、LFP、LPP或发夹引物。术语“不同种类的引物”因此涉及两种或更多种引物的组合,其中引物中的至少一个与另外一个或多个引物不是相同种类。举例来说,当方法使用四个引物,其中三个是LFP且一个是LPP时,这些引物将被视为是不同种类的。因此,还设想使用并非相同种类的正向和反向引物。举例来说,可使用正向引物,其是LFP与反向引物的组合,所述反向引物是LPP或发夹引物。还可能将LFP或发夹引物与简单引物组合,只要引物组合造成多联体的形成。当用于扩增的NAAT采用多于一个(即两个或更多个)正向和/或反向引物时,还可能在同一引物结合位点上组合相同或不同种类的引物。在本发明的一方面中,两个或更多个正向和/或反向引物全部是LFP。合适的引物组合将为本领域技术人员显而易见。举例来说,本领域技术人员显而易见的是,全部是简单引物的正向和反向引物的组合未必能提供保证多联体形成的机制且因此这种组合不适用于本发明中。
应理解,一般说来,正向和反向引物或引物组作用于靶模板的不同链。此外,引物(或每组引物之一)将用于划定所拷贝和再拷贝的原始多核苷酸的区域。因此,指数式扩增需要至少两个引物结合区、正向引物结合区及反向引物结合区之间活性的联合(图1)。正向和反向引物结合区各自可包含用于引物的单一结合位点,由此位点在相反的有义链上,即一个引物结合位点在“正向链”上,一个在“反向链”上(如图1所示)。正向和反向引物区域还可包含用于两个或更多个引物各自的结合位点,其中多于两个引物被特定的NAAT所采用。在此情况下,有可能在正向和/或反向引物结合区域中的两个或更多个引物结合位点都位于靶模板和/或扩增子的相同链上或靶模板和/或扩增子的不同链上。
如在本文所述的某些方法中使用的Stem引物可定位在正向和反向引物结合区之间的任何位置处,只要一种或多种茎引物的一个或多个结合位点不明显地与正向或反向结合位点重叠。应理解的是,在采用LFP的情况下,当LFP是正向引物时,正向引物结合区不仅包括F2位点(即正向引物结合区),而且还包括F1位点(即与LFP的第二区段基本上同一的正向链上的区域),并且当LFP是反向引物时,反向引物结合区不仅包括R2c位点(即反向引物结合区),而且还包括R1c位点(即与LFP的第二区段基本上同一的反向链上的区域;图1)。以此方式,当采用两个LFP(如在LAMP和TRA中)时,茎引物可定位在R1(c)与F1(c)位点之间的任何位置处;当在特定的NAAT中采用单一LFP时,茎引物可结合在R1(c)或F1(c)位点与由非LFP占据的另一个引物结合区之间。
有可能仅采用一个茎引物,其结合正向或反向多核苷酸链(如图2所示)。或者,可使用两种或更多种茎引物,其可结合至扩增子的链或相同的链。本发明方法可用一个、两个、三个、四个或更多茎引物实践,所述茎引物可以任何空间组合使用并且可结合反向或正向链,只要茎引物的结合位点不显著地与正向或反向引物结合区重叠或完全不重叠。茎引物可进一步结合至茎区域内的任何部分。因此,一个或多个茎引物可具有密切靠近正向或反向引物结合区的结合位点。“密切靠近”意味着茎引物的结合区与正向/反向引物结合区相隔不超过10bp、50bp、100bp、200bp、300bp、400bp、500bp、600bp、700bp、800bp、900bp或1000bp。
在某些实施方案中,茎引物在长度上可以是至少5个核苷酸、至少10个核苷酸、至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸、至少70个核苷酸、至少80个核苷酸或至少90个核苷酸。茎引物可以是简单引物。然而,还设想使用茎引物,其为LFP、发夹引物、LPP、嵌合引物或其他衍生物。当使用多于一种茎引物时,茎引物可以是相同种类的或者可以是不同种类引物的组合。
存在“简单引物”、LFP、发夹引物、含有RNA的引物、含有切口酶位点的引物及其他新型引物的许多种可能的组合,这些引物可以新型组合形式使用以生成在相应的NAAT方法中概述的方法的衍生物。当所述组合产生生成能够自身复制以生成更长多联体的多联扩增子的方法时,茎引物预期是适用的。
在某些实施方案中,位点特异性Stem引物在其3’端包含与扩增的核酸模板或扩增子中的目标核苷酸互补的核苷酸。在又一些实施方案中,错配Stem引物包含不与扩增的核酸模板或扩增子中的目标核苷酸互补的3'端核苷酸。
在某些另外的实施方案中,互补或位点特异性Stem引物可将检测具体类型和量的靶模板所需的时间与其中不添加一种或多种stem引物或错配stem引物的对照反应相比减少至少1分钟、至少2分钟、至少3分钟、至少5分钟、至少10分钟、至少20分钟、至少30分钟或至少60分钟。
Stem引物经由与发生于正向和反向结合区的过程的联合用于提高采用LFP的方法的扩增速率并且由于已经在文献中教导,LAMP方法具有为所采用的LFP分隔正向和反向结合位点的核苷酸数目的上限(Notomi等人Loop-mediated isothermal amplification of DNA,Nucleic Acids Research,(2000)第28卷,第12期,e63),茎引物的使用明显可允许正向和反向结合位点在序列中比先前可行的相隔更远(尤其是如果采用若干种茎引物的话)。当需要展示序列的两个区域一起存在于多核苷酸上,但其中两个区域之间的距离太远以致不允许每个相应区域有效地用作本文所述的NAAT中的正向和反向结合区时,这可具有很大益处。
由于茎引物的使用可允许正向和反向结合区比其不存在时相隔远得多并且仍允许有效扩增,所以可确定两个独特位点在多核苷酸上的存在。因此,本发明提供一种扩增多核酸的方法,其中正向和反向引物结合区间隔一定距离以使得多核酸的合成可仅在一种或多种茎引物的存在下发生。此距离可用实验方法通过并行进行两个单独的NAAT来定义,其中NAAT、所用的试剂和扩增条件是相同的,例外的是一种或多种茎引物被添加到一个反应而不是另一个中。当多核酸的合成仅在一种或多种茎引物的存在下发生时,引物结合位点被认为相隔一定距离以使得多核酸的合成仅在一种或多种茎引物的存在下发生。
茎引物可排外地含有天然存在的核酸。然而,还设想利用含有修饰的碱基的引物。这类修饰的碱基的实例包括但不限于N4-甲胞嘧啶、肌苷、核苷酸(ribocleotide)、荧光碱基、可光分解的碱基或通用碱基。还设想使用已用一个部分标记的核酸,该部分允许茎引物和/或标记的茎引物所结合至的扩增子被检测。例如,核酸可被荧光标记。茎引物替代地可用捕获部分(例如生物素)标记。
重要的是,茎引物不直接负责扩增子的指数式扩增,其是由结合至正向和反向引物结合位点的引物介导,但仅提高扩增的速率。这是因为茎引物被认为针对由特定的NAAT采用的其他引物的扩增产物起作用。因此,茎引物藉由提高由正向和反向引物介导的反应的扩增速率起作用。这示于图2中,其中可见茎引物引发并从靶模板延伸,靶模板的部分拷贝仅含有正向引物结合区或反向引物区,而不是两个都含。因此,从茎引物生成的初级扩增子不允许交互拷贝且因此不能促进靶模板的指数式扩增。相同的论点适用于茎引物拷贝由被特定的NAAT所采用的其他引物生成的初级扩增子并且类似地针对第一代扩增子。
并且,仅预期茎引物显著地提高靶模板的扩增速率,如果下一代扩增子(即,第一代扩增子的进一步拷贝(以及这些拷贝的拷贝))在本质上是多联体的话。茎引物作用于多联体的要求是从以下要求得出:对于促进指数式扩增的特定多核酸,其必须含有能够充当正向和反向引物结合区的区域。多联体结构经由茎引物的拷贝可产生多核苷酸拷贝,其兼备正向和反向引物结合位点,而拷贝非多联体结构则不是。因此,茎引物的使用将对造成多联体形成的扩增方法有益处。
如本文所述的方法很适合与等温核酸扩增方法一起使用,使得其它们对易于进行、有效、稳定且可再生。所述方法的一个益处在于,它们允许所需靶核酸(例如,遗传突变、SNP、病原体感染等)在样品(包括复杂混合物)中的快速鉴定。快速扩增当然意味着需要较少时间来鉴定靶标遗传元件的存在或不存在,且因此,本方法提供一种用于现场护理基因检测和诊断的便利手段。
术语“基本上互补”意味着第一区段在通常用于NAAT期间的条件下具有足以结合至模板和/或扩增子上的引物结合区的互补性。此要求引物的第一区段具有至少70%、80%、90%、95%、99%或100%与模板上的引物结合区的互补性。引物的第一区段在长度上可以是至少5个核苷酸、至少10个核苷酸、至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸、或甚至至少70个核苷酸。
在本文所述的任何实施方案中,第一或第二阶段引物可包含核酸内切酶限制位点、或用于切口酶的识别元件。
在本文所述的任何实施方案中,所述扩增反应可包括包含第一和第二区段的发夹引物,其中所述第一区段与模板上的引物结合区基本上互补且第二区段包含与引物中的另一区基本上互补的序列;
在本文所述的任何实施方案中,扩增反应可包含环提供引物,该引物包含发夹引物,其中反向重复序列通过接头区隔开。
在本文所述的任何实施方案中,扩增反应可包含嵌合引物。
在本文所述的任何方面或实施方案中,第一阶段扩增反应可在包括与一个或多个另外的容器或室流体连通的通道的容器或室中进行,所述另外的容器或室包含用于进行第二阶段扩增反应的引物(即位点特异性引物、位点特异性Stem引物;错配引物、错配Stem引物等)。在又一些实施方案中,第一阶段反应室包括与一个或多个另外的容器或室单向流体连通的通道,所述另外的容器或室包含用于进行第二阶段扩增反应的引物。举例来说,如图4中所示,第一阶段反应在与用于进行第二阶段扩增反应的多个另外的室流体连通的中央室中进行。在一个优选实施方案中,将来自第一阶段扩增反应的反应混合物自动并同时引入另外的室中,所述反应混合物包含用于进行第二阶段反应的引物。
在一个优选实施方案中,近似相等量或体积的第一阶段反应混合物经由例如离心力被从中心室自动地引入到轴向排列的另外的室中。在某些实施方案中,所述方法包括大致同时进行多个单独的或离散的第二阶段扩增反应。在某些另外的实施方案中,离散反应包含相同或不同的位点特异性引物。在又一些实施方案中,离散反应包含多个位点特异性引物或位点特异性引物的组合(即“多重反应”)。
在本文所述的任何方面或实施方案中,每个第二阶段反应体积可以是约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100μl或更大。在一个优选实施方案中,每个相应的第二阶段反应体积是8μl。
在某些实施方案中,本发明提供一种用于检测和比较核酸扩增的方法,所述方法包括:提供第一阶段反应室;在第一阶段反应室中进行如本文所述的第一阶段预扩增反应;将一定量或体积的第一阶段预扩增反应直接引入到多个第二阶段反应室中,其中至少一个第二阶段反应室包含位点特异性引物,且至少一个其他第二阶段反应室包含错配引物;以及在每个第二阶段反应室中进行如本文所述的第二阶段扩增反应;并且实时检测和比较每个反应的扩增速率,其中在位点特异性引物中相对于错配引物反应的更快扩增速率指示目标位点的存在。
在本文所述的任何方面或实施方案中,第一阶段扩增反应可包含位点特异性引物,以便第一阶段预扩增反应对于特定的目标位点有选择性,并且只有当那个位点或区域存在于样品中时模板的快速扩增才在第二或稍后阶段扩增反应中进行。
在本文所述的任何方面或实施方案中,第二阶段(或稍后阶段)扩增反应可包含多个位点特异性引物(即“多重反应”)。通过使用差异性标记的位点特异性寡核苷酸,可在同一反应内检测和比较(即多重)不同的扩增产物。
虽然若干方面和实施方案涉及两阶段扩增方案,但本发明不受限于此。实际上,本文所述的方法是建立在以下惊人发现上:目标特异性位点或序列在靶核酸区域中的存在可通过位点特异性或序列特异性(即互补)引物相对于错配引物的较慢扩增反应速率的提高的扩增速率来检测,所述错配引物(而对于错配碱基)与相同靶区域退火。因此,可进行任何数目的另外扩增步骤,例如3、4、5、6、7、8、9个等,且因此,可检测任何数目的目标位点、区域或序列。类似地,关于每个待进行的相应位点特异性引物反应,可进行平行错配引物反应并且监测两个反应的扩增速率。
本领域技术人员将知晓,除了扩增所需的引物之外,NAAT还将需要进一步的试剂以便合成多核酸。本领域技术人员将显而易知所需的试剂,但一般包括合适的缓冲剂、dNTP、聚合酶等。
如本领域技术人员将了解,在添加用于进行所讨论的NAAT的所有必需组分之后,必须提供合适的条件用于合成多核酸。举例来说,这可通过提供合适的孵育温度而实现。扩增优选地在等温条件下发生。这意味着在扩增期间,温度保持恒定。“恒定”意指温度变化不超过+/-10℃。然而,包括扩增过程期间单一温度变化大于10℃、两个温度变化大于10℃、三个温度变化大于10℃、四个温度变化大于10℃或五个温度变化大于10℃的方法也在本发明的范围内。
另一方面,本发明提供一种两阶段等温核酸扩增和检测方法,所述方法包括以下步骤:
a.提供包含多联体化的扩增子的LAMP扩增的核酸模板,其中所述扩增子是由以下形成:(i)包含位于3'末端处的第一区域的3'端部分,该第一区域在合适的条件下与第一互补区退火以形成第一环;和(ii)包含位于5'末端处的第二区域的5'端部分,该第二区域在合适的条件下与第二互补区退火以形成第二环;
b.将来自(a)的一部分核酸模板与以下混合:(i)包含至少一种位点特异性Stem引物的反应混合物,所述引物与第一和第二引物结合区之间的目标位点或区域基本上互补,其中位点特异性引物在其3'端处包括与模板中的目标核苷酸互补的核苷酸,和(ii)不包含二级引物的反应混合物;
c.使来自(b)的引物与核酸模板退火;
d.在合适的等温条件下用具有链置换活性的聚合酶从3'端开始延伸引物;以及
e.重复步骤c-d,且由此快速地扩增核酸模板,并且实时检测和比较反应(b)(i)相对于反应(b)(ii)的扩增速率,其中在反应(b)(i)中相对于反应(b)(ii)的扩增速率的提高指示存在目标位点。
在某些实施方案中,每个反应混合物包括大致相等体积或量的核酸模板。
在某些实施方案中,步骤(b)进一步包含将来自(a)的核酸模板的一部分混合到(iii)包含错配Stem引物的反应混合物中。在另外的实施方案中,步骤(e)包括实时检测和比较反应(b)(i)、(b)(ii)及(b)(iii)的扩增速率,其中在反应(b)(i)中相对于反应(b)(ii)和(b)(iii)的扩增速率的提高指示存在目标位点。
在本文所述的任何方面或实施方案中,所述方法进一步包括实时检测扩增子形成的步骤。在某些实施方案中,扩增反应混合物包含荧光标记的dNTP、荧光DNA嵌入染料、化学发光、电化学或其他报道系统作为实时追踪扩增程度的手段。因此,在某些实施方案中,通过测量荧光的增加实时监测扩增子的形成。可通过本领域技术人员已知的方法检测根据本发明的多核酸的扩增。合适的方法包括但不限于使用荧光嵌入染料、荧光引物或探针、浊度测量、电化学探针、生物发光信号及化学发光探针。
多核酸的扩增可使用实时方法来检测,即当多核酸扩增时可对其进行检测的方法。这类检测系统的实例包括但不限于荧光(例如,在扩增期间添加的荧光探针)、生物发光信号及电化学探针。一方面,将引物本身用可检测的部分,例如荧光标记、化学发光标记或电化学标记进行标记,所述可检测的部分允许检测一种或多种引物所结合至的扩增子。因此,茎引物在形成NAAT的多联体中的进一步效用可为用于荧光、化学发光或电化学报道系统中的探针作为实时追踪扩增程度的手段。其他合适的报道系统将为本领域技术人员显而易见。Stem引物可具有作为含有例如LFP或发夹引物的引物的探针的益处,因为不需要它们来生成可能影响某些类型探针的扩增子中的反向重复序列。或者,扩增产物可使用终点测量来检测,即,在多核酸扩增已经完成之后进行的测量。
多核酸的扩增也可通过NAAT检测中采用的其他检测方法来检测。合适的实例包括但不限于基因阵列、侧流条、电泳、质谱法和声波检测。
在一个实施方案中,实时生物发光测定(BART)报道系统被用于检测多核酸的合成。此系统详细地描述于WO2004/062338和WO2006/010948中,这些文献以引用的方式并入本文。BART是为等温NAAT设计的报道系统的一个实例,其由样品得到单一类型的信号:生物发光信号。BART利用无机焦磷酸的萤火虫荧光素酶依赖性检测:此当使用NAAT扩增‘靶’序列时大量地产生。因而,分子诊断可用BART仅通过在均相测定中测量从封闭管发射的光来实现。BART是用若干不同的NAAT证实,在50-63℃之间操作。BART报道系统是追踪NAAT的扩增速率的尤其有效手段,因为光输出表示扩增瞬时速率的量度(而例如荧光输出展示信号的积累且因此测量值必须被差分以获得扩增速率)。
BART联合LAMP用于检测特定的靶DNA分子的稀释系列。注意到样品中的靶DNA的量减少,达到最大光增加的时间的滞后期(其与达到最大扩增的滞后期成比例)延长。换言之,达到与BART中的阳性样品有关的特征性光峰值的时间增加,与样品中的靶多核酸的量成反比。强调指出当实例利用BART报道系统时,本发明不限于BART的使用且同样适用于方法,如荧光、浊度、其他分光技术或电化学测量方法,不管这些方法是否用于扩增的实时测量或终点测量中。
优选地,本发明的方法在密封容器中进行。这具有很大效用,因为其降低或甚至防止样品变得被污染的可能性。此外,其降低或甚至防止实验室变得被污染的可能性。这是尤其重要的,因为如果甚至模板多核酸或扩增子的一个拷贝逃逸到实验室中,这可潜在地污染其他待测试的样品并且得到假阳性结果。因此,防止污染的能力特别重要,其中本发明方法被用于诊断应用中。
另一方面,本发明提供用于确定具体的多核酸序列是否存在于核酸样品或生物体遗传密码中的方法。举例来说,所述方法可用于确定模板核酸所来源于的核酸是否已被遗传修饰,用于检测与特定的非遗传修饰的植物品种或遗传修饰的植物有关的DNA,用于检测与动物的谱系品种有关的DNA或用于医学或兽医学诊断应用,如遗传测试或法医学。
在本文所述的任何实施方案中,靶核酸模板可包含基因组DNA、cDNA或RNA或其片段,来自病毒、植物、微生物、真菌、支原体、单细胞生物体、或多细胞生物体,例如哺乳动物,如人类。在某些实施方案中,基因组DNA来自于病原性病毒或微生物,例如细菌或支原体。
因此,另一方面,本发明提供用于诊断应用的方法。具体说来,所述方法允许鉴定和量化患者及其他样品中的生物体。本发明的方法还适用于检测突变、遗传疾病、或单核苷酸多态性(SNP)。本发明的方法还适用于检测病原性和非病原性微生物或病毒。
所述生物体可以是任何微生物,如病毒、细菌、支原体及真菌。微生物可以是病原性的,但其也可以是非病原性微生物。微生物也可以是遗传修饰的生物体(GMO)。此外,本发明方法可用于鉴定遗传修饰的作物和动物,用于检测疾病状态;用于预测疗法的不良反应;并且还用于预测疾病状态易感性。
例如,在一个实施方案中,本发明提供一种检测目标核酸的存在或诊断疾病的两阶段方法。在某些实施方案中,本文所述的方法可用于实时快速鉴定微生物,如病毒、细菌、支原体、真菌、或遗传疾病、突变、SNP,其中所述方法包括:由待测试的受试者提供核酸样品(例如患者样品),进行如本文所述的两阶段扩增反应,以及实时检测和比较位点特异性引物扩增的扩增速率和错配引物扩增速率,其中位点特异性引物扩增速率相对于错配引物扩增速率的提高指示存在目标特异性位点、区域或核苷酸,例如,与遗传疾病、突变、SNP、病毒或微生物(例如细菌)中的至少一种有关的位点、区域或核苷酸。
在某些实施方案中,所述微生物是细菌。在某些实施方案中,所述细菌是选自由以下组成的组的属的成员:芽孢杆菌属、巴尔通氏体属、博代杆菌属、疏螺旋体属、布鲁氏杆菌、弯曲杆菌属、衣原体属、嗜衣体属、梭状芽孢杆菌、棒状杆菌属、肠球菌属、埃希氏杆菌属、弗朗西斯氏菌属、嗜血杆菌属、军团菌属、钩端螺旋体属、李斯特菌属、分支杆菌属、支原体、奈瑟氏菌属、假单胞菌属、立克次氏体属、沙门氏菌属、志贺氏菌属、葡萄球菌属、链球菌属、密螺旋体属、尿素原体、弧菌属以及耶尔森氏鼠疫杆菌属(Yershinia)。
在某些实施方案中,所述细菌是由以下组成的组的成员:炭疽杆菌、蜡样芽孢杆菌、韩瑟勒巴通氏菌、五日热巴尔通体、百日咳杆菌、伯氏疏螺旋体、伽氏疏螺旋体、埃氏疏螺旋体、回归热螺旋体、流产布鲁氏菌、犬布鲁氏菌、马尔他布鲁氏菌、猪布鲁氏菌、空肠弯曲杆菌、肺炎衣原体、沙眼衣原体、鹦鹉热嗜衣原体、肉毒杆菌、艰难梭菌、产气荚膜梭菌、破伤风杆菌、白喉棒状杆菌、粪肠球菌、屎肠球菌、大肠杆菌、土拉弗朗西斯菌、流感嗜血杆菌、幽门螺杆菌、嗜肺军团菌、肾脏钩端螺旋体、圣地罗西钩端螺旋体、韦氏钩端螺旋体、野口钩端螺旋体、单核细胞增多性李氏杆菌、麻风分枝杆菌、结核分枝杆菌、溃疡分枝杆菌、肺炎支原体、淋病奈瑟氏菌、脑膜炎奈瑟菌、绿脓假单胞菌、立克次氏体、伤寒沙门氏菌、鼠伤寒沙门氏菌、宋内氏痢疾杆菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、无乳链球菌、链球菌肺炎、酿脓链球菌、苍白密螺旋体、解脲脲原体、霍乱弧菌、鼠疫耶尔森氏菌、小肠结肠炎耶尔森氏菌以及假结核病耶尔森氏菌。
在某些实施方案中,靶核酸模板来自于结核杆菌(MTB或TB)。在某些另外的实施方案中,靶核酸模板来自于rpoB基因,该基因来自MTB。在另外其他实施方案中,靶核酸模板是rpoB13.5F6。
在某些实施方案中,所述病毒是选自由以下组成的组的科的成员:腺病毒科、疱疹病毒科、乳头瘤病毒科、多瘤病毒科、痘病毒科、肝病毒科、细小病毒科、星状病毒科、杯状病毒科、小核糖核酸病毒科、冠状病毒科、黄病毒科、披膜病毒科、肝炎病毒科、逆转录病毒科、正粘病毒科、砂粒病毒科、布尼亚病毒科、丝状病毒科、副粘病毒科、弹状病毒科以及呼肠孤病毒科。
在某些实施方案中,所述病毒是选自由以下组成的组的成员:腺病毒、1型单纯性疱疹、2型单纯性疱疹、水痘-带状疱疹病毒、埃-巴二氏病毒、人巨细胞病毒、8型人疱疹病毒、人乳头状瘤病毒、BK病毒、JC病毒、天花、乙型肝炎、人博卡病毒、细小病毒B19、人星状病毒、诺瓦克病毒、柯萨奇病毒、甲型肝炎病毒、脊髓灰质炎病毒、鼻病毒、重度急性呼吸综合征病毒、丙型肝炎病毒、黄热病病毒、登革热病毒、西尼罗病毒、风疹病毒、戊型肝炎病毒、人免疫缺陷病毒(HIV)、流感病毒、瓜纳里托病毒、胡宁病毒、拉沙病毒、马丘波病毒、萨比亚病毒(Sabiávirus)、克里米亚-刚果出血热病毒、埃博拉病毒、马伯格氏病毒、麻疹病毒、腮腺炎病毒、副流感病毒、呼吸道合胞病毒、人偏肺病毒、亨得拉病毒、尼帕病毒、狂犬病病毒、丁型肝炎、轮状病毒、环状病毒、科罗拉多壁蝨热病毒以及版纳病毒。
另一方面,提供一种用于根据本发明的方法中的试剂盒。优选地,所述试剂盒包含为实践本文所述的方法所必需的所有组分,包括配对的位点特异性与错配引物。在某些方面中,所述试剂盒包含待测试的靶多核酸、和/或用于制备本文所述的方法中的所纳入的生物样品的试剂。
用于根据本发明方法中的试剂盒优选地包含多核酸聚合酶、用于核酸聚合酶的底物以及适用于如之前所述的靶多核酸的等温扩增的引物。更优选地,所述试剂盒进一步包含缓冲试剂,如镁离子来源;或在本领域中已知改善NAAT性能的添加剂如甜菜碱或已知改善试剂盒试剂的保质期的添加剂如海藻糖或已知帮助保存试剂的添加剂如叠氮化钠。或者,用于根据本发明方法中的试剂盒可仅包含这些组分中的一些和/或另外的组分。已从试剂盒中省略的样品及任何其他组分随后可在使用期间添加到试剂盒中。
优选地,试剂盒的组分中的至少一种呈冻干形式或适于储存在试剂盒中的另一种形式。更优选地,试剂盒的所有组分都呈冻干形式或一种或多种适于储存的其他形式。这种其他形式包括其中已添加稳定因子的组分和/或含有试剂盒的组分的冷藏或冷冻主体混合物。
另一方面,本发明提供一种治疗或预防疾病的方法,所述方法包括对患者样品进行如本文所述的两阶段核酸扩增,且其中如果患者对于与疾病或感染有关的目标位点的存在测试呈阳性,那么用有效量的以下适当治疗剂或生物活性剂治疗或施用于患者:例如抗生素、抗癌剂、抗炎药、抗微生物剂、抗病毒剂、抗真菌剂、抗精神病药等。术语“生物活性剂”用于描述具有生物活性以帮助实现预定的治疗、抑制和/或预防/防治的试剂。如本文所用的术语“治疗(treat/treating/treatment)”是指向患者提供益处的任何作用,包括任何疾病状态或病状的治疗。
可使用根据本发明的化合物治疗的疾病状态或病状包括例如哮喘、自身免疫疾病如多发性硬化症、各种癌症、纤毛病变(ciliopathies)、腭裂、糖尿病、心脏病、高血压、炎性肠病、智力迟钝、心境障碍、肥胖、屈光不正、不育症、Angelman综合征、卡纳万氏病、腹腔病、进行性腓骨肌萎缩(Charcot-Marie-Tooth disease)、囊性纤维化、杜氏肌营养不良、血色病、血友病、格来弗德氏综合征、神经纤维瘤病、苯丙酮酸尿症、多囊肾病、(PKD1)或4(PKD2)普-威综合征(Prader-Willi syndrome)、镰刀形红细胞病、泰-萨克斯病(Tay-Sachs disease)、特纳氏综合征(Turner syndrome)。
可由本发明化合物治疗的其他疾病状态或病状包括阿尔茨海默氏病、肌萎缩性侧索硬化(Lou Gehrig病)、神经性厌食、焦虑症、动脉粥样硬化、注意力缺陷多动障碍、孤独症、双相障碍、慢性疲劳综合征、慢性阻塞性肺病、克罗恩氏病、冠心病、痴呆、抑郁症、1型糖尿病、2型糖尿病、癫痫、格林巴利综合征、肠易激综合征、狼疮、代谢综合征、多发性硬化症、心肌梗塞、肥胖症、强迫症、恐慌症、帕金森氏病、牛皮癣、类风湿性关节炎、结节病、精神分裂症、中风、闭塞性血栓血管炎、图雷特综合征、血管炎。
可由本发明化合物治疗的另外其他疾病状态或病状包括无血浆铜蓝蛋白、II型软骨成长不全、软骨发育不全、塔头畸形、2型戈谢病、急性间歇性卟啉病、卡纳万氏病、腺瘤性结肠息肉病、ALA脱水酶缺乏症、腺苷酸琥珀酸裂解酶缺乏症、肾上腺性变态综合征、脑白质肾上腺萎缩症、ALA-D卟啉症、ALA脱水酶缺乏症、尿黑酸尿、亚历山大病、黑尿症、α1-抗胰蛋白酶缺乏症、α-1蛋白酶抑制因子、肺气肿、肌萎缩性侧索硬化、阿尔斯特伦综合征(syndrome)、亚历山大病、釉质生长不全、ALA脱水酶缺乏症、安德森-法布里病(Anderson-Fabry disease)、雄激素不敏感综合征、贫血弥漫性体血管角质瘤、视网膜血管瘤(希林二氏病)阿佩尔氏综合征(Apert syndrome)、蜘蛛脚样指(马凡综合征)、史蒂克勒氏综合征(Stickler syndrome)、先天性多发性关节松弛(爱-唐综合征#arthrochalasia型)共济失调毛细血管扩张、雷特氏综合征(Rett syndrome)、原发性肺动脉高压、山霍夫氏病(Sandhoff disease)、II型神经纤维瘤病、贝尔-史蒂文森皮肤回状头皮综合征(Beare-Stevenson cutis gyrata syndrome)、地中海热、家族性本杰明综合征、β地中海贫血、双侧听神经纤维瘤病(II型神经纤维瘤病)、凝血因子V莱顿血栓形成倾向、色素失调症(色素失禁症)、布卢姆综合征、X连锁铁粒细胞性贫血、Bonnevie-Ullrich综合征(特纳氏综合征)、布尔尼维利病(结节性硬化症)、朊病毒病、Birt–Hogg–Dubé综合征、脆骨病(成骨不全)、广泛性拇指-拇趾综合征(鲁宾斯坦-泰比综合征)、青铜色糖尿病/青铜色肝硬化(血色沉着病)、延髓肌肉萎缩(肯尼迪病)、Burger-Grutz综合征(脂蛋白脂肪酶缺乏症)、CGD慢性肉芽肿病、弯肢发育异常(Campomelic dysplasia)、生物素酶缺乏症、心肌病(努南综合征)、猫叫综合征(Cri du chat)、CAVD(先天性输精管缺如)、凯勒心面综合征(CBAVD)、CEP(先天性红血球缺紫质症)、囊性纤维化、先天性甲状腺功能低下、软骨营养障碍综合征(软骨发育不全)、耳鼻-脊柱-骨骺发育异常(otospondylomegaepiphyseal dysplasia)、累-纳氏综合征(Lesch-Nyhan syndrome)、半乳糖血症、埃勒斯-当洛二氏综合征(Ehlers-Danlos syndrome)、致死性发育异常、卡芬-劳瑞二氏综合征(Coffin-Lowry syndrome)、科克因综合征(Cockayne syndrome)、(家族性腺瘤性息肉病)、先天性红血球缺紫质症、先天性心脏病、高铁血红蛋白血症/先天性高铁血红蛋白血症、软骨发育不全、X联锁铁粒细胞性贫血、结缔组织病、异常面容综合征、库利氏贫血(β地中海贫血)、铜贮积病(威尔森氏症)、铜转运病(门克斯病)、遗传性粪紫质增多症、多错构瘤综合征(Cowden syndrome)、颅面构音障碍(克鲁宗综合征(Crouzon syndrome))、克雅二氏症(Creutzfeldt-Jakob disease)(朊病毒病)、科克纳氏综合征、多错构瘤综合征、库-巴-思三氏综合征(Curschmann-Batten-Steinert syndrome)(肌强直性营养不良)、贝尔-史蒂文森皮肤回状头皮综合征、原发性高草酸尿、脊椎干骺端发育不良(斯特拉德威克型(Strudwick type))、肌肉萎缩症、杜乡和贝克尔型(Duchenne and Becker types)(DBMD)、乌谢尔综合征(Usher syndrome)、包括德-格罗乌稀综合征(de Grouchy syndrome)和代-索二氏综合征(Dejerine-Sottas syndrome)在内的神经退行性疾病、发育障碍、远端脊肌萎缩症V型、雄激素不敏感综合征、弥漫性球样体硬化(克拉伯病(Krabbe disease))、狄乔治综合征(Di George's syndrome)、二氢睾酮受体缺陷、雄激素不敏感综合征、唐氏综合征、侏儒症、红细胞生成性原卟啉病、红细胞5-氨乙酰丙酸合成酶缺乏症、红细胞生成性卟啉病、红细胞生成性原卟啉病、红细胞生成性尿卟啉病、弗里德棘希氏共济失调(Friedreich's ataxia)、家族性阵发性多浆膜炎、迟发性皮肤卟啉病、家族性压力敏感神经病、原发性肺动脉高压(PPH)、胰腺纤维囊肿病、脆性X综合征、半乳糖血症、先天性脑病、巨细胞性肝炎(新生儿血色素沉着症)、格-斯二氏综合征(弹性假黄瘤)、根达病(先天性红血球缺紫质症)、血色病、海尔格伦综合征、镰状细胞性贫血、血友病、肝红细胞生成性卟啉病(HEP)、希林二氏病(希林二氏病(von Hippel-Lindau disease))、亨廷顿舞蹈病、早年衰老综合征(郝-吉二氏综合征)、雄激素过多症、软骨发育不良、低色性贫血、包括X联锁的严重联合免疫缺陷的免疫系统病症、Insley-Astley综合征、杰克逊-外斯综合征(Jackson-Weiss syndrome)、朱伯特综合征(Joubert syndrome)、累-纳氏综合征、杰克逊-外斯综合征、包括高草酸尿在内的肾病、格来弗德氏综合征(Klinefelter's syndrome)、克尼斯克发育不良(Kniest dysplasia)、腔隙性痴呆、Langer-Saldino软骨成长不全、共济失调毛细血管扩张、林奇综合征(Lynch syndrome)、赖氨酸羟化酶缺乏症、马查多-约瑟夫病(Machado-Joseph disease)、包括克尼斯克发育不良在内的代谢障碍、马凡综合征、运动障碍、莫瓦特-威尔逊综合征(Mowat-Wilson syndrome)、囊性纤维化、穆鲁克综合征(Muenke syndrome)、多发性神经纤维瘤病、南希-英斯利综合征(Nance-Insley syndrome)、南希-斯威尼软骨发育不良(Nance-Sweeney chondrodysplasia)、尼-皮二氏病、诺亚克综合征(Pfeiffer综合征)、奥斯勒-韦伯-朗迪病(Osler-Weber-Rendu disease)、黑斑息肉病(Peutz-Jeghers syndrome)、多囊肾病、多骨性纤维性结构不良(McCune-Albright综合征)、黑斑息肉病、普-拉-威综合征、血色沉着病、原发性高尿酸血综合征(累-纳氏综合征)、原发性肺动脉高压、原发性老年性退行性痴呆、朊病毒病、郝-吉二氏综合征(郝-吉二氏综合征(Hutchinson Gilford Progeria Syndrome))、进行性舞蹈病、慢性遗传性(亨廷顿)(亨廷顿舞蹈病)、进行性肌萎缩、脊髓性肌萎缩、丙酸血症、原卟啉病、近端肌强直性营养不良、肺动脉高压、PXE(弹性假黄瘤)、Rb(成视网膜细胞瘤)、神经纤维瘤病(I型神经纤维瘤病)、复发性多浆膜炎、视黄醇病、成视网膜细胞瘤、雷特氏综合征、3型RFALS、雷克综合征(Ricker syndrome)、里-代二氏综合征(Riley-Day syndrome)、鲁-雷综合征(Roussy-Levy syndrome)、具有发育迟缓和黑棘皮病的重度软骨发育不全(SADDAN)、李-佛美尼综合征(Li-Fraumeni syndrome)、肉瘤、乳腺、白血病和肾上腺(SBLA)综合征、结节状硬化(结节性硬化)、SDAT、SED先天性(先天性脊椎骨骺发育不良)、SED斯特拉德威克(脊椎干骺端发育不良,斯特拉德威克型)、SEDc(先天性脊椎骨骺发育不良)SEMD、斯特拉德威克型(脊椎干骺端发育不良,斯特拉德威克型)、腭心面综合征(Shprintzen syndrome)、皮肤色素沉着症、史-伦-奥三氏综合征、南非遗传性卟啉症(混合型卟啉病)、婴儿发病的上行遗传性痉挛性麻痹、语言和沟通障碍、鞘脂沉积病、泰-萨克斯病、脊髓小脑性共济失调、史蒂克勒氏综合征、中风、雄激素不敏感综合征、四氢生物蝶呤缺乏症、β地中海贫血、甲状腺疾病、腊肠样神经病(遗传性压力易感性神经病)、特-柯二氏综合征(Treacher Collins syndrome)、X三体综合征(triple X syndrome)、21三体(唐氏综合征)、X三体(Trisomy X)、VHL综合征(脑视网膜血管瘤病(von Hippel-Lindau disease))、视力损害和失明(阿尔斯特伦综合征)、成骨不全症(Vrolik disease)、瓦登伯革氏综合征(Waardenburg syndrome)、Warburg Sjo Fledelius综合征、Weissenbacher-Zweymüller综合征、沃夫-贺许宏氏综合征(Wolf-Hirschhorn syndrome)、沃尔夫周期性疾病、Weissenbacher-Zweymüller综合征及着色性干皮病等。
术语“癌症”是指导致癌性或恶性赘生物的形成和生长的病理过程,即通过细胞增殖而生长的异常组织,经常生长得比正常更快并且在引发新生长的刺激停止之后继续生长。恶性赘生物展示结构组织和与正常组织的机能协调的部分或完成缺乏并且大多数侵袭周围组织,转移到若干部位,并且可能在试图除去之后复发并导致患者死亡(除非经过适当治疗)。如本文所用,术语瘤形成用于描述所有癌性疾病状态并且包括或涵盖与恶性造血、腹水及实体肿瘤有关的病理过程。可通过本发明化合物单独或与至少一种另外的抗癌剂组合治疗的示例性癌症包括鳞状细胞癌、基底细胞癌、腺癌、肝细胞癌及肾细胞癌;膀胱癌、肠癌、乳腺癌、子宫颈癌、结肠癌、食道癌、头癌、肾癌、肝癌、肺癌、颈癌、卵巢癌、胰腺癌、前列腺癌及胃癌;白血病;良性和恶性淋巴瘤,尤其是伯基特氏淋巴瘤和非何杰金氏淋巴瘤;良性和恶性黑色素瘤;骨髓增生性疾病;肉瘤,包括尤因氏肉瘤、血管肉瘤、卡波济氏肉瘤、脂肪肉瘤、肌肉瘤、外周神经上皮瘤、滑膜肉瘤、神经胶质瘤、星形细胞瘤、寡树突神经胶细胞瘤、室管膜瘤、恶性胶质瘤、神经母细胞瘤、节细胞神经瘤、神经节神经胶质瘤、成神经管细胞瘤、松果体细胞瘤、脑膜瘤、脑膜肉瘤、纤维神经瘤及许旺氏细胞瘤;肠癌、乳腺癌、前列腺癌、子宫颈癌、子宫癌、肺癌、卵巢癌、睾丸癌、甲状腺癌、星形细胞瘤、食道癌、胰腺癌、胃癌、肝癌、结肠癌、黑色素瘤;癌肉瘤、何杰金氏病、韦尔姆斯氏瘤(Wilms'tumor)以及畸胎癌。可使用本发明化合物治疗的另外的癌症包括例如T细胞系急性淋巴母细胞性白血病(T-ALL)、T细胞系成淋巴细胞性淋巴瘤(T-LL)、外周T细胞淋巴瘤、成人T细胞白血病、Pre-B ALL、Pre-B淋巴瘤、大B细胞淋巴瘤、伯基特氏淋巴瘤、B细胞ALL、费城染色体阳性ALL及费城染色体阳性CML。
术语“抗癌剂”用于描述抗癌剂。这些试剂包括例如依维莫司、曲贝替定、白蛋白结合型紫杉醇、TLK 286、AV-299、DN-101、帕唑帕尼、GSK690693、RTA 744、ON 0910.Na、AZD 6244(ARRY-142886)、AMN-107、TKI-258、GSK461364、AZD 1152、恩扎妥林(enzastaurin)、凡德他尼、ARQ-197、MK-0457、MLN8054、PHA-739358、R-763、AT-9263、FLT-3抑制剂、VEGFR抑制剂、EGFR TK抑制剂、极光激酶抑制剂、PIK-1调节剂、Bcl-2抑制剂、HDAC抑制剂、c-MET抑制剂、PARP抑制剂、Cdk抑制剂、EGFR TK抑制剂、IGFR-TK抑制剂、抗HGF抗体、PI3激酶抑制剂、AKT抑制剂、mTORC1/2抑制剂、JAK/STAT抑制剂、检查点-1或2抑制剂、局灶性粘附激酶抑制剂、Map激酶(mek)抑制剂、VEGF捕获剂抗体、培美曲塞、埃罗替尼、达沙替尼、尼洛替尼、达卡替尼、帕尼单抗、氨柔比星、奥戈伏单抗、Lep-etu、洛拉曲塞、azd2171、巴巴布林(batabulin)、奥法木单抗、扎木单抗(zanolimumab)、edotecarin、倒地拱素、鲁比替康、替米利芬、奥利默森、ticilimumab、易普利单抗、棉酚、Bio 111、131-I-TM-601、ALT-110、BIO 140、CC 8490、西仑吉肽、吉马替康、IL13-PE38QQR、INO 1001、IPdR1KRX-0402、硫蒽酮、LY317615、neuradiab、vitespan、Rta 744、Sdx 102、他仑帕奈、阿曲生坦、Xr 311、罗咪酯肽、ADS-100380、舒尼替尼、5-氟尿嘧啶、伏立诺他、依托泊苷、吉西他滨、阿霉素、阿霉素脂质体、5'-脱氧-5-氟尿苷、长春新碱、替莫唑胺、ZK-304709、seliciclib;PD0325901、AZD-6244、卡培他滨、L-谷氨酸、N-[4-[2-(2-氨基-4,7-二氢-4-氧代-1H-吡咯并[2,3-d]嘧啶-5-基)乙基]苯甲酰基]-、二钠盐、七水化物、喜树碱、PEG标记的依立替康、他莫昔芬、柠檬酸托瑞米芬、阿那曲唑、依西美坦、来曲唑、DES(己烯雌酚)、雌二醇、雌激素、结合雌激素、贝伐单抗、IMC-1C11、CHIR-258);3-[5-(甲基磺酰基哌啶甲基)-吲哚基-喹诺酮、瓦他拉尼碱、AG-013736、AVE-0005、醋酸性瑞林、醋酸亮丙瑞林、双羟萘酸曲普瑞林、醋酸甲羟孕酮、己酸羟孕酮、乙酸甲地孕酮、雷洛昔芬、比卡鲁胺、氟他胺、尼鲁米特、乙酸甲地孕酮、CP-724714;TAK-165、HKI-272、埃罗替尼、拉帕替尼、卡奈替尼、ABX-EGF抗体、爱必妥、EKB-569、PKI-166、GW-572016、艾那法尼(Ionafarnib)、BMS-214662、替吡法尼;氨磷汀、NVP-LAQ824、辛二酰苯胺异羟肟酸(suberoyl analide hydroxamic acid)、丙戊酸、曲古抑菌素A、FK-228、SU11248、索拉非尼、KRN951、氨鲁米特、arnsacrine、阿那格雷、L-天冬酰胺酶、卡介苗(BCG)疫苗、阿霉素、博来霉素、布舍瑞林、白消安、卡铂、卡莫司汀、氮芥苯丁酸、顺铂、克拉屈滨、氯膦酸盐、环丙孕酮、阿糖胞苷、氮烯唑胺、放线菌素、柔红霉素、己烯雌酚、表柔比星、氟达拉滨、氟氢可的松、氟烃甲基睾丸素、氟他胺、格列卫、吉西他滨、羟基脲、伊达比星、异环磷酰胺、伊马替尼、亮丙瑞林、左旋四咪唑、洛莫司汀、氮芥、美法仑、6-巯基嘌呤、美司钠、氨甲蝶呤、丝裂霉素、米托坦、米托蒽醌、尼鲁米特、奥曲肽、奥沙利铂、帕米膦酸二钠、喷司他丁、普卡霉素、卟菲尔钠、甲基苄肼、雷替曲塞、利妥昔单抗、链脲霉素、替尼泊苷、睾酮、沙利度胺、硫鸟嘌呤、硫替派、维甲酸、长春地辛、13-顺式-视黄酸、苯基丙氨酸氮芥、尿嘧啶氮芥、雌氮芥、六甲蜜胺、氟尿苷、5-脱氧尿苷、阿糖胞苷、6-硫基嘌呤、脱氧柯福霉素、钙三醇、戊柔比星、光神霉素、长春花碱、长春瑞滨、拓扑替康、雷佐生、马立马司他、COL-3、癌立消、BMS-275291、角鲨胺、内皮抑素、SU5416、SU6668、EMD121974、白介素-12、IM862、制管张素、vitaxin、屈洛昔芬、idoxyfene、螺甾内酯、非那雄胺、甲腈咪胍、曲妥单抗、地尼白介素(denileukin diftitox)、吉非替尼、硼替佐米(bortezimib)、紫杉醇、无克列莫佛的紫杉醇、多西他赛、epithilone B、BMS-247550、BMS-310705、屈洛昔芬、4-羟基他莫昔芬、哌喷昔芬、ERA-923、阿佐昔芬、氟维司群、阿考比芬、拉索昔芬、艾多昔芬、TSE-424、HMR-3339、ZK186619、拓扑替康、PTK787/ZK 222584、VX-745、PD 184352、雷帕霉素、40-O-(2-羟基乙基)-雷帕霉素、替西罗莫司、AP-23573、RAD001、ABT-578、BC-210、LY294002、LY292223、LY292696、LY293684、LY293646、渥曼青霉素、ZM336372、L-779,450、PEG-非格司亭、达贝泊汀、促红细胞生成素、粒细胞集落刺激因子、唑来膦酸盐(zolendronate)、强的松、西妥昔单抗、粒细胞巨噬细胞集落刺激因子、组氨瑞林、聚乙二醇化干扰素α-2a、干扰素α-2a、聚乙二醇化干扰素α-2b、干扰素α-2b、阿扎胞苷、PEG-L-天冬酰胺酶、来那度胺、吉妥单抗、氢化可的松、白介素-11、右雷佐生、阿来组单抗、全反式维甲酸、酮康唑、白细胞介素-2、甲地孕酮、免疫球蛋白、氮芥、甲基强的松龙、替伊莫单抗、雄激素、地西他滨、六甲蜜胺、蓓萨罗丁、托西莫单抗、三氧化二砷、可的松、editronate、米托坦、环孢菌素、柔红霉素脂质体、Edwina-天冬酰胺酶、锶89、卡索匹坦、奈妥吡坦、NK-1受体拮抗剂、帕洛诺司琼、阿瑞匹坦、苯海拉明、羟嗪、灭吐灵、氯羟安定、阿普唑仑、氟哌丁苯、达哌啶醇、屈大麻酚、地塞米松、甲基强的松龙、丙氯拉嗪、格拉司琼、昂丹司琼、多拉司琼、托烷司琼、乙二醇化非格司亭、促红细胞生成素、阿法依泊汀(darbepoetin alfa)、达依泊汀α及其混合物。
术语“抗病毒剂”包括例如核苷逆转录酶抑制剂(NRTI)、其他非核苷逆转录酶抑制剂(即不代表本发明的那些)、蛋白酶抑制剂、融合抑制剂,其示例性化合物尤其可包括例如3TC(拉米夫定)、AZT(叠氮胸苷)、(-)-FTC、ddI(去羟肌苷)、ddC(扎西他宾)、阿巴卡韦(ABC)、替诺福韦(PMPA)、D-D4FC(Reverset)、D4T(司他夫定)、Racivir、L-FddC、L-FD4C、NVP(奈韦拉平)、DLV(地拉韦啶)、EFV(依法韦仑)、SQVM(甲磺酸沙奎那韦)、RTV(利托那韦)、IDV(茚地那韦)、SQV(沙奎那韦)、NFV(奈非那韦)、APV(安普那韦)、LPV(洛匹那韦)、融合抑制剂如T20、尤其fuseon及其混合物,包括目前在临床试验或开发中的抗HIV化合物。
可使用的其他抗HIV试剂包括例如其他NNRTI(即,除根据本发明的NNRTI以外),可选自由以下组成的组:奈韦拉平(BI-R6-587)、地拉韦啶(U-90152S/T)、依法韦仑(DMP-266)、UC-781(N-[4-氯-3-(3-甲基-2-丁烯氧基)苯基]-2甲基3-呋喃硫代甲酸硫羰胺)、依曲韦林(TMC125)、曲韦定(Ly300046.HCl)、MKC-442(乙米韦林,coactinon)、HI-236、HI-240、HI-280、HI-281、利匹韦林(TMC-278)、MSC-127、HBY 097、DMP266、黄芩苷(TJN-151)ADAM-II(3’,3’-二氯-4’,4”-二甲氧基-5’,5”-双(甲氧羰基)-6,6-二苯基己烯酸甲酯)、3-溴-5-(1-5-溴-4-甲氧基-3-(甲氧羰基)苯基)庚-1-烯基)-2-甲氧基苯甲酸甲酯(烯基二芳基甲烷类似物,Adam类似物)、(5-氯-3-(苯基亚硫酰基)-2’-吲哚甲酰胺)、AAP-BHAP(U-104489或PNU-104489)、Capravirine(AG-1549,S-1153)、阿替韦啶(U-87201E)、金精三羧酸(SD-095345)、1-[(6-氰基-2-吲哚基)羰基]-4-[3-(异丙基氨基)-2-吡啶基]哌嗪、1-[5-[[N-(甲基)甲基磺酰基氨基]-2-吲哚基羰基-4-[3-(异丙基氨基)-2-吡啶基]哌嗪、1-[3-(乙基氨基)-2-[吡啶基]-4-[(5-羟基-2-吲哚基)羰基]哌嗪、1-[(6-甲酰基-2-吲哚基)羰基]-4-[3-(异丙基氨基)-2-吡啶基]哌嗪、1-[[5-(甲基磺酰氧基)-2-吲哚基)羰基]-4-[3-(异丙基氨基)-2-吡啶基]哌嗪、U88204E、双(2-硝基苯基)砜(NSC 633001)、胡桐内酯A(NSC675451)、胡桐内酯B、6-苄基-5-甲基-2-(环己氧基)嘧啶-4-酮(DABO-546)、DPC 961、E-EBU、E-EBU-dm、E-EPSeU、E-EPU、膦甲酸钠(Foscavir)、HEPT(1-[(2-羟基乙氧基)甲基]-6-(苯硫基)胸腺嘧啶)、HEPT-M(1-[(2-羟基乙氧基)甲基]-6-(3-甲基苯基)硫代)胸腺嘧啶)、HEPT-S(1-[(2-羟基乙氧基)甲基]-6-(苯硫基)-2-硫代胸腺嘧啶)、海棠果素P、L-737,126、米歇尔胺A(NSC650898)、米歇尔胺B(NSC649324)、米歇尔胺F、6-(3,5-二甲基苄基)-1-[(2-羟基乙氧基)甲基]-5-异丙基尿嘧啶、6-(3,5-二甲基苄基)-1-(乙氧基甲基)-5-异丙基尿嘧啶、NPPS、E-BPTU(NSC648400)、奥替普拉(4-甲基-5-(吡嗪基)-3H-1,2-二硫杂环戊二烯-3-硫酮)、N-{2-(2-氯-6-氟苯乙基]-N’-(2-噻唑基)硫脲(PETT Cl、F衍生物)、N-{2-(2,6-二氟苯乙基]-N’-[2-(5-溴吡啶基)]硫脲{PETT衍生物)、N-{2-(2,6-二氟苯乙基]-N’-[2-(5-甲基吡啶基)]硫脲{PETT吡啶基衍生物)、N-[2-(3-氟代呋喃基)乙基]-N’-[2-(5-氯吡啶基)]硫脲、N-[2-(2-氟-6-乙氧基苯乙基)]-N’-[2-(5-溴吡啶基)]硫脲、N-(2-苯乙基)-N'-(2-噻唑基)硫脲(LY-73497)、L-697,639、L-697,593、L-697,661、3-[2-(4,7-二氟苯并噁唑-2-基)乙基}-5-乙基-6-甲基(吡啶-2(1H)-硫酮(2-吡啶酮衍生物)、3-[[(2-甲氧基-5,6-二甲基-3-吡啶基)甲基]胺]-5-乙基-6-甲基(吡啶-2(1H)-硫酮、R82150、R82913、R87232、R88703、R89439(洛韦胺)、R90385、S-2720、舒拉明钠、TBZ(噻唑并苯并咪唑,NSC 625487)、噻唑并异吲哚-5-酮、(+)(R)-9b-(3,5-二甲基苯基-2,3-二氢噻唑并[2,3-a]异吲哚-5(9bH)-酮、替韦拉平(R86183)、UC-38及UC-84等等。
抗微生物剂包括例如抗生素。在某些实施方案中,抗微生物剂是抗肺结核药物,尤其例如吡嗪酰胺或苯甲酰胺、pretomanid及贝达喹啉。
实施例
在整个本申请中引用的所有参考文献、专利、申请中的专利申请和公布的专利的内容以引用的方式清楚地并入本文中。以上描述的组合物和方法进一步参考以下附图和随附描述举例说明。
图6示出了由于在Stem引物中的错配碱基所致的对扩增速率的影响。(a)左图例示了包含3’端错配的Stem引物,其代表对目标SNP无特异性的引物。3'错配诱导扩增反应中对比匹配的或位点特异性SNP Stem引物(“SNP-Stem引物”)的延迟。扩增速率的提高例示于右图中,其中虚线表示达到荧光最大斜率(tmax1)之时的最早时间(t),且ΔCt1表示SNP-Stem引物与3'端错配Stem引物之间的至tmax的时间滞后。(b)右图例示了如本文所述的另一实施方案,其中Stem引物(SNP-Stem引物和3'端错配引物)在其序列中含有另一个碱基对错配。第二错配向扩增的右侧(即,减小速率)移位(ΔCt2)并且延迟至tmax2的时间。
图7使用Bio-Rad CFX实时PR仪器展示处理后的荧光迹线,其示出了匹配的Stem引物(即,SNP-Stem引物)LAMP反应(n=4)和错配的Stem引物LAMP反应(n=4)。将反应保持在65℃下并且每个循环由每15秒的荧光测量组成。在48孔微板中在冰上组装反应系统。该溶液由以下组成:约200个拷贝的MTB基因组DNA/反应、20mM Tries pH 8.8、10mM硫酸铵、50mM KCl、和2.0mM硫酸镁、0.1%NP-40、1x EVAgreen染料、Bst DNA聚合酶及1.4mM dNTP。
图8示出了根据如本文所述的示例性方法所观察到的提高的扩增速率。(a)提供示出了位点特异性Stem引物反应的匹配的Stem引物反应(浅迹线)和错配的Stem引物反应(深迹线)的原始迹线。(b)量化周期(Cq;参见Hellemans等人,2007)是从拟合的原始迹线起计算作为最大斜率点。将匹配引物的Cq连同错配的Stem引物(深色点)和无Stem引物的LAMP(“哑铃”)反应(开环)一起绘图(淡色点)。第一LAMP反应(在第一室中进行)的混合物含有约200个拷贝的MTB基因组DNA,在AMP缓冲液(20mM Tris pH 8.8、10mM硫酸铵、50mM KCl、及3.4mM硫酸镁、0.1%NP-40、1x EVAgreen染料、Bst DNA聚合酶和1.4mM dNTP)的溶液中。将溶液引入65℃下的第一室中,并且孵育5分钟,之后直接自动地分布,且同时引入许多第二反应室中。将rpoB基因的LAMP引物在第一反应室中干燥并支持LAMP扩增。
加速的Stem引物在第二反应室中干燥并且在MTB rpoB基因的D435耐药性突变的3'端处完全匹配(代表SNP-Stem引物)或错配。作为阴性对照,若干第二反应室不含Stem引物并且显示无加速扩增。第二反应室中的扩增通过直接测量由EVAgreen染料嵌入到双链扩增的DNA中所引起的荧光增加来检测。连续地监测荧光反应持续150个周期,每个周期15秒时间。
表1.rpoB STEM-LAMP测试。
示例性实施方案
在一个实施方案中,本发明提供一种两阶段核酸扩增和实时检测方法,所述方法包括:a.提供包含靶核酸模板和至少一种引物的组合物,所述引物与所述靶核酸模板在靠近待扩增的目标区域处退火;b.进行第一核酸扩增反应以扩增所述目标区域,由此形成初级扩增子;c.将(b)分成至少两个二级反应,并且位点特异性二级引物包括在至少一个所述反应中,所述位点特异性二级引物与可存在于初级扩增子内并界定目标区域内的目标位点的位点特异性引物结合位点互补;d.仅在位点特异性引物结合位点与位点特异性引物互补时进行第二核酸扩增反应(第二阶段反应),由此加速目标区域的扩增;以及e.检测并比较所述至少两个二级反应的实时扩增速率,其中在具有二级引物的反应中提高的相对扩增速率指示存在与二级引物互补的目标位点。
在本文所述的任何实施方案中,步骤(a)包括正向和反向环形成引物。在本文所述的任何实施方案中,步骤(a)包括正向和反向置换引物。
在本文所述的任何实施方案中,第一核酸扩增是等温核酸扩增反应。在本文所述的任何实施方案中,第二核酸扩增是等温核酸扩增反应。
在本文所述的任何实施方案中,第一和/或第二等温核酸扩增反应是LAMP或LAMP-STEM。
在本文所述的任何实施方案中,初级扩增子是多联体。
在本文所述的任何实施方案中,位点特异性引物包含与突变、单核苷酸多态性(SNP)、等位基因或扩增子上的生物标记物互补的3’端核苷酸。
在本文所述的任何实施方案中,所述方法包括将(b)分成至少一个另外的二级反应,其中所述另外的二级反应包括错配的二级引物。在本文所述的任何实施方案中,所述错配引物包含3’端核苷酸错配或与不同于位点特异性引物的等位基因、突变或多态性互补的3’端核苷酸。
在本文所述的任何实施方案中,步骤(e)包括实时检测和比较所有二级反应的扩增速率,其中与其他两个反应相比提高的相对扩增速率指示存在与二级引物互补的目标位点。
在本文所述的任何实施方案中,所述突变、SNP或生物标记物对遗传疾病、微生物或病毒有特异性。
在本文所述的任何实施方案中,进行第二核酸扩增反应的步骤包括在荧光标记或染料存在下的扩增,由此标记扩增产物。在本文所述的任何实施方案中,实时检测和比较扩增速率的步骤包括检测和比较来自每个反应的荧光信号。
在本文所述的任何实施方案中,在第一扩增反应之前,将引物和模板加热至大约95℃的温度持续约1分钟至约15分钟。在本文所述的任何实施方案中,第一和第二扩增反应在约55℃至约65℃的温度下进行。
在本文所述的任何方法中,第一扩增反应在第一反应室中进行,所述第一反应室包括与多个第二反应室单向流体连通的通道,且其中步骤(c)包括将近似相等体积的(b)经由所述通道从第一反应室运送到第二反应室。
在本文所述的任何实施方案中,如权利要求1所述的方法,其中扩增反应的相对反应速率满足以下条件:第二阶段扩增反应+位点特异性引物>>第一阶段扩增反应+错配引物>/≈第一阶段扩增反应。
在本文所述的任何实施方案中,如权利要求1所述的方法,其中第二阶段位点特异性或互补引物扩增反应的Cq比第二阶段错配引物扩增反应快至少25%。
在另一实施方案中,本发明还提供一种用于诊断或检测疾病或感染的两阶段等温核酸扩增方法,所述方法包括:a.提供包含来自患者的核酸样品和至少一种引物的组合物,所述引物在靠近待扩增的目标区域处与靶核酸模板退火;b.进行第一等温核酸扩增反应以扩增所述目标区域,由此形成初级扩增子;c.将(b)分成至少两个反应,并且位点特异性二级引物包括在至少一个所述反应中,所述位点特异性二级引物与可存在于初级扩增子上并界定指示疾病或感染的目标位点的位点特异性引物结合区互补;d.进行第二等温核酸扩增反应,由此扩增所述目标区域;e.实时检测和比较所述二级反应的扩增速率,其中相对于其他在位点特异性二级引物反应中的提高的扩增速率指示存在所述目标位点;以及f.诊断患者患有或不患有对应于所述目标位点的疾病或感染。
在本文所述的任何实施方案中,靶核酸模板来自于微生物或病毒。在本文所述的任何实施方案中,靶核酸模板来自于结核杆菌(MTB或TB)。
在本文所述的任何实施方案中,目标位点是在rpoB基因中。在本文所述的任何实施方案中,目标位点是在rpoB基因中的SNP。
在本文所述的任何实施方案中,所述方法包括通过施用有效量的适用于治疗所述疾病或感染的治疗剂来治疗经测试对目标位点呈阳性的患者的步骤。在本文所述的任何实施方案中,所述治疗剂是抗肺结核治疗剂。
在另一实施方案中,本发明提供一种两阶段核酸扩增和实时检测方法,所述方法包括:a.提供包含靶核酸模板和至少一种引物的组合物,所述引物与所述靶核酸模板在靠近待扩增的目标区域处退火;b.进行第一核酸扩增反应以扩增所述目标区域,由此形成初级扩增子;c.将(b)分成至少三个二级反应,并且位点特异性二级引物包括在至少一个所述反应中,所述位点特异性二级引物与可存在于初级扩增子内并界定目标区域内的目标位点的位点特异性引物结合位点互补,并且在目标位点处或附近退火但不与目标位点互补的错配二级引物包括在至少另一个所述反应中;d.仅在二级引物结合位点与位点特异性引物互补时进行第二核酸扩增反应(第二阶段反应),由此加速目标区域的扩增;以及e.实时检测并比较所述二级反应的扩增速率,其中在具有位点特异性二级引物的反应中提高的相对扩增速率指示存在与位点特异性二级引物互补的目标位点。
在本文所述的任何实施方案中,所述方法包括将(b)分成至少一个另外的二级反应,其中所述另外的二级反应包括错配的二级引物。在本文所述的任何实施方案中,所述错配引物包含3’端核苷酸错配或与不同于位点特异性引物的等位基因、突变或多态性互补的3’端核苷酸。
在本文所述的任何实施方案中,步骤(e)包括实时检测和比较所有二级反应的扩增速率,其中与其他两个反应相比提高的相对扩增速率指示存在与二级引物互补的目标位点。
在本文所述的任何实施方案中,所述方法包括将(b)分成至少一个另外的二级反应,所述二级反应包括第二位点特异性二级引物,所述第二位点特异性二级引物与可存在于初级扩增子内并界定目标区域内的第二目标位点的第二目标位点互补。本领域技术人员只需使用常规的实验便可以认识或能够确定诸多等同于本文所述的本发明的特定实施方案。这类等同方案旨在被以下权利要求书所涵盖。应当理解,本文所述的详细实施例和实施方案仅出于说明性目的作为实例给出,并且决不被视为限制本发明。其各种修改或变化将是本领域技术人员所能预见到的,并包含在本申请的精神和范围内,同时也在所附权利要求的保护范围内。例如,可以改变成分的相对量以优化预期效果,可添加另外的成分,和/或类似的成分可用来取代所述的一种或多种成分。与本发明的系统、方法及工艺有关的另外有利的特征和功能将由所附权利要求书显而易见。此外,本领域技术人员只需使用常规的实验便可以认识或能够确定诸多等同于本文所述的本发明的特定实施方案。这类等同方案旨在被以下权利要求书所涵盖。
参考文献
以下参考文献以引用的方式整体并入本文用于所有目的。
1.Notomi T,Okayama H,Masubuchi H,Yonekawa T,Watanabe K,Amino N,Hase T(2000).″Loop-mediated isothermal amplification of DNA″.Nucleic Acids Res.28(12):E63.doi:10.1093/nar/28.12.e63.PMC 102748.PMID 10871386.
2.US patent 6410278,Notomi T,Hase T,″Process for synthesizing nucleic acid″,published 2002-06-25,assigned to Eiken Kagaku Kabushiki Kaisha
3.Nagamine K,Hase T,Notomi T(2002).″Accelerated reaction by loop-mediated isothermal amplification using loop primers″.Mol.Cell.Probes 16(3):223-9.doi:10.1006/mcpr.2002.0415.PMID 12144774.
4.Mori Y,Nagamine K,Tomita N,Notomi T(2001).″Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation″.Biochem.Biophys.Res.Commun.289(1):150-4.doi:10.1006/bbrc.2001.5921.PMID 11708792.
5.Mori Y,Kitao M,Tomita N,Notomi T(2004).″Real-time turbidimetry of LAMP reaction for quantifying template DNA″.J.Biochem.Biophys.Methods 59(2):145-57.doi:10.1016/j.jbbm.2003.12.005.PMID 15163526.
6.Njiru ZK,Mikosza AS,Armstrong T,Enyaru JC,Ndung′u JM,Thompson AR(2008).″Loop-mediated isothermal amplification(LAMP)method for rapid detection of Trypanosoma brucei rhodesiense″.PLoS Negl Trop Dis 2(1):e147.doi:10.1371/journal.pntd.0000147.PMC 2238707.PMID 18253475.open access publication-free to read
7.Tomita N,Moiri Y,Kanda H,Notomi T(2008).″Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products″.Nat Protoc 3(5):877-82.doi:10.1038/nprot.2008.57.PMID 18451795.
8.Sen K,Ashbolt NJ(2011).Environmental microbiology:current technology and water application.Norfolk,UK:Caister Academic Press.ISBN 978-1-904455-70-7.
9.Macarthur G(2009).Global health diagnostics:research,development and regulation.Academy of Medical Sciences Workshop Report(PDF).Academy of Medical Sciences(Great Britain).ISBN 978-1-903401-20-0.
10.Geojith G,Dhanasekaran S,Chandran SP,Kenneth J(2011).″Efficacy of loop mediated isothermal amplification(LAMP)assay for the laboratory identification of Mycobacterium tuberculosis isolates in a resource limited setting″.J.Microbiol.Methods 84(1):71-3.doi:10.1016/j.mimet.2010.10.015.PMID 21047534.
11.Poon LL,Wong BW,Ma EH,Chan KH,Chow LM,Abeyewickreme W,Tangpukdee N,Yuen KY,Guan Y,Looareesuwan S,Peiris JS(2006).″Sensitive and inexpensive molecular test for falciparum malaria:detecting Plasmodium falciparum DNA directly from heat-treated blood by loop-mediated isothermal amplification″.Clin.Chem.52(2):303-6.doi:10.1373/clinchem.2005.057901.PMID 16339303.
12.Njiru ZK,Mikosza AS,Matovu E,Enyaru JC,Ouma JO,Kibona SN,Thompson RC,Ndung′u JM(2008).″African trypanosomiasis:sensitive and rapid detection of the sub-genus Trypanozoon by loop-mediated isothermal amplification(LAMP)of parasite DNA″.Int.J.Parasitol.38(5):589-99.doi:10.1016/j.ijpara.2007.09.006.PMID 17991469.
13.Curtis KA,Rudolph DL,Owen SM(2008).″Rapid detection of HIV-1 by reverse-transcription,loop-mediated isothermal amplification(RT-LAMP)″.J.Virol.Methods 151(2):264-70.doi:10.1016/j.jviromet.2008.04.011.PMID 18524393.
14.Sattabongkot J,Tsuboi T,Han ET,Bantuchai S,Buates S(2014).″Loop-mediated isothermal amplification assay for rapid diagnosis of malaria infections in an area of endemicityin Thailand″.J.Clin.Microbiol.52(5):1471-7.doi:10.1128/JCM.03313-13.PMID 24574279.
15.Francois P,Tangomo M,Hibbs J,Bonetti EJ,Boehme CC,Notomi T,Perkins MD,Schrenzel J(2011).″Robustness of a loop-mediated isothermal amplification reaction for diagnostic applications″.FEMS Immunol.Med.Microbiol.62(1):41-8.doi:10.1111/j.1574-695X.2011.00785.x.PMID 21276085.
16.Torres C,Vitalis EA,Baker BR,Gardner SN,Torres MW,Dzenitis JM(2011).″LAVA:an open-source approach to designing LAMP(loop-mediated isothermal amplification)DNA signatures″.BMC Bioinformatics 12:240.doi:10.1186/1471-2105-12-240.PMC 3213686.PMID 21679460.open access publication-free to read
17.Iseki H,Alhassan A,Ohta N,Thekisoe OM,Yokoyama N,Inoue N,Nambota A,Yasuda J,Igarashi I(2007).″Development of a multiplex loop-mediated isothermal amplification(mLAMP)method fot the simultaneous detection of bovine Babesia parasites″.J.Microbiol.Methods 71(3):281-7.doi:10.1016/j.mimet.2007.09.019.PMID 18029039.
18.Tanner NA,Zhang Y,Evans TC(2012).″Simultaneous multiple target detection in real-time loop-mediated isothermal amplification″.BioTechniques 53(2):81-9.doi:10.2144/0000113902.PMID 23030060.
19.US Patent Publication 2012/0157326.
20.US Patent 5,648,211.
21.Gandelman et al.,Loop-Mediated Amplification Accelerated by Stem Primers.Int.J.Mol.Sci.2011;12(12):9108-9124.
- 还没有人留言评论。精彩留言会获得点赞!
- 环介导等温扩增多重耐药基因oqxAB的检测引物、检测试剂盒及检测方法与制造工艺
- 一种气单胞菌的核酸等温扩增检测试剂盒及其检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 用于扩增细胞群的方法、试剂盒及装置与制造工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一种霍乱弧菌环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于检测番茄晚疫病菌的LAMP引物组合物和应用的制造方法与工艺
- 基于颜色判定的环介导等温扩增(LAMP)技术检测雪松疫霉根腐病菌的制造方法与工艺
- Sortase A介导的(S)‑羰基还原酶寡聚体高效催化(S)‑苯基乙二醇的合成的制造方法与工艺
- 用于旋转机器中的超导线圈的等温支承部和真空容器的制造方法与工艺
- 基于环介导等温扩增消光技术的转基因玉米MIR604检测方法与制造工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺
- 一套鉴定甘蔗上三种短体线虫的环介导等温扩增引物及其试剂盒的制造方法与工艺
- RNA扩增方法与制造工艺
- 用于扩增核酸样品的等温方法与制造工艺