人参糖蛋白及其制备方法与应用与流程
本发明涉及医药领域,具体地说,涉及人参糖蛋白及其制备方法与应用。
背景技术:
随着全球环境污染日趋严重,生活压力加大等因素的影响,少精、弱精症成为男性生育能力的一种常见疾病。近年来,有关治疗少、弱精症的研究进展迅速,现代医学对该病症的治疗主要从辅助技术入手,但其由于技术要求高,价格昂贵,成功率较低使其推广受限。而传统中医药在治疗这方面的病症显示出独特的优势。中医辩证强调少精症的发病机制是肾阳不足,肾气亏虚所致。临床治疗上分为5个病型:(1)肾气亏虚证,治法以补肾益精,强精助育为主,方药为黄精、菟丝子、淫羊藿等中药;(2)肾精匮乏证,治法以滋肾填精,益肾助育为主,方药为何首乌、枸杞、当归等中药;(3)脾胃虚弱证,治法以补中益气,生精助育为主,方药为人参、黄芪、白术等中药;(4)湿热蕴结证,治法清热利湿,益精助育为主,方药为石菖蒲、乌药等;(5)经络瘀阻证,治法以活血养血,行瘀通络,方药为桃仁、红花等。目前,市场上已有一些中成药如生精胶囊、健脑补肾丸、抗脑衰胶囊等,临床用于肾精不足引起的记忆力减退、少精弱精患者,显示出具有补肾健脑,补肾填精,益肾安神之功效。
人参为名贵中药,百草之王。具有大补元气、复脉固脱、补脾益肺、生津益血、安神益智功能。近年来,随着人们对人参多糖及复合物类化合物系统研究的不断深入,对人参糖蛋白的化学及生物活性有了新的认知。除了具有提高免疫的活性外,人参糖蛋白还具有多种生物活性,在神经退行性疾病方面具有明显的改善和治疗作用,在改善学习记忆功能、镇痛、镇静催眠等方面具有生物活性。人参中主要含有醇溶性皂苷和水溶性多糖两大类成分。一直以来,由于人参多糖类成分在生物活性方面的认知仅限于提高免疫力作用,使得在医药和保健食品领域的开发和利用受到限制。近年来,研究者对人参水溶性多糖及糖复合物进行了深入系统研究发现,人参糖蛋白在药用价值和医疗保健方面显示出独特的生物作用。通过动物实验证实,人参糖蛋白对神经退行性疾病具有明显的改善和治疗作用,显示出改善学习记忆功能、镇痛、镇静催眠的生物活性。通过细胞实验证实,其具有显著抑制β淀粉样蛋白(aβ25-35)诱导的细胞凋亡作用,具有潜在的神经细胞保护作用。并通过作用机制的探讨得出,人参糖蛋白可通过激活pi3k/akt信号转导通路对脑神经细胞进行保护,从而改善老年痴呆造成的学习记忆减退。
技术实现要素:
本发明的目的是提供人参糖蛋白及其制备方法与应用。
为了实现本发明目的,第一方面,本发明提供一种人参糖蛋白的制备方法,包括以下步骤:
(1)将人参干品粉碎成小块,加入8倍量的80%乙醇加热至70~80℃回流提取,过滤,药渣再用8倍量的80%乙醇回流提取,过滤,合并两次滤液,回收乙醇至浓缩液,浓缩液经大孔树脂d101分离,纯水洗脱,收集洗脱液,浓缩,得到醇提人参糖蛋白浓缩液;
(2)将步骤(1)经过两次醇回流后的人参药渣加纯水煎煮两次,第一次加人参药渣10倍量的水,煎煮2小时,过滤;第二次加人参药渣10倍量的水煎煮2小时,过滤,合并两次煎煮液,浓缩,得到水提人参糖蛋白浓缩液;将水提人参糖蛋白浓缩液与步骤(1)的醇提人参糖蛋白浓缩液合并,混合均匀,喷雾干燥,得到人参糖蛋白粗提物;
(3)取人参糖蛋白粗提物,加入适量纯水溶解,溶液经截留分子量3kda的中空纤维柱超滤,所得超滤液经浓缩后,用截留分子量100da的透析袋以纯水为透析液透析48小时,所得透析内液进行减压浓缩,冷冻干燥,即得粉末状的人参糖蛋白。
前述的方法,步骤(3)中减压浓缩时真空度为-0.02~-0.04mpa,浓缩温度为70~80℃。
第二方面,本发明提供按照上述方法制备的人参糖蛋白。其中中性糖含量占人参糖蛋白粉末总重的35%~55%,酸性糖含量占人参糖蛋白粉末总重的4%~8%,蛋白质含量占粉末总重的60~40%;重均分子量为9000-15400da;蛋白质部分由asp、glu、ser、his、gly、arg、thr、pro、ala、val、cys、met、ile、leu、phe、lys和tyr17种氨基酸组成;糖部分由半乳糖醛酸、葡萄糖(glc)、半乳糖(gal)和阿拉伯糖(ara)4种单糖组成;单糖之间以(1→4)-d-glc为连接主链,还含有一定量的(1→3,1→6)-d-glc,其主链glc上的分支点主要在2-o位上,分支点连接不同长度的侧链和非还原末端。
17种氨基酸占蛋白质的质量百分数分别为:asp(4.46~10.12%、glu(8.17~16.01%)、ser(1.09~4.69%)、his(1.05~7.11%)、gly(7.11~18.68%)、arg(29.14~39.17%)、thr(0.14~4.17%)、pro(6.12~13.14%)、ala(3.01~9.66%)、val(0.43~4.61%)、cys(0.15~2.17%)、met(0.11~1.19%)、ile(0.19~3.21%)、leu(0.14~2.16%)、phe(0.15~1.71%)、lys(0.94~4.11%)、tyr(9.09~1.19%)。
4种单糖的摩尔比:半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,其摩尔比为0.900~0.1020:1:0.2000~0.3000:0.2500~0.3500。
人参糖蛋白的gc-ms分析结果如表2所示。
第三方面,本发明提供所述人参糖蛋白在制备生精药物或组合物中的应用。
第四方面,本发明提供所述人参糖蛋白在制备具有睾丸靶向性的药物或组合物中的应用。
第五方面,本发明提供所述人参糖蛋白作为药物载体或药物递送系统的用途。
第六方面,本发明提供所述人参糖蛋白作为靶向睾丸的药物载体或药物递送系统的用途。
第七方面,本发明提供一种具有睾丸靶向性的药物或组合物,有效成分为所述的人参糖蛋白。
第八方面,本发明提供所述人参糖蛋白的以下任一应用:
1)用于提高生精障碍小鼠附睾内精子数;
2)用于提高生精障碍小鼠血清中睾酮的含量;
3)用于改善生精障碍小鼠睾丸生精小管内生精细胞层厚度的增加;
4)用于改善生精障碍小鼠睾丸生精小管内的生精细胞层横截面积的增加。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明以生晒人参为原料,分离获得人参3个不同组分,对环磷酰胺所致少、弱精症模型小鼠的生精及精子活率影响进行活性作用的筛选,实验结果表明,本发明提供的人参糖蛋白具有显著的提高生精障碍小鼠生精作用及精子活率作用。同时对试验小鼠血清中睾酮含量进行了测定,结果显示,人参糖蛋白可提高生精障碍小鼠血清中的睾酮含量。并通过试验小鼠睾丸的病理切片探讨其作用机制,结果表明,人参糖蛋白可通过改善生精障碍小鼠睾丸生精小管内生精细胞层厚度的增加及改善生精障碍小鼠睾丸生精小管内的生精细胞层横截面积的增加提高其生精障碍小鼠的精子总数和精子活率。
本发明通过荧光标记人参糖蛋白,示踪药物在动物体内的组织分布,进一步揭示药物的作用靶点,实验结果表明,本发明提供的人参糖蛋白主要在小鼠脑、睾丸、爪的组织中富集最多。进一步通过切片、染色显微镜下示踪药物在小鼠睾丸中的分布,证明其作用靶点,为今后以人参为原料开发新药、保健食品或食品提供了科学依据,进一步拓宽了人参的应用价值。
附图说明
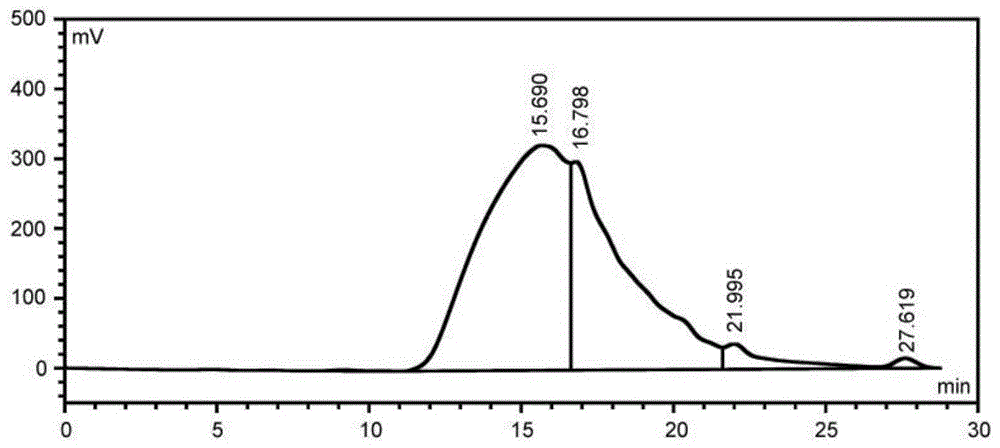
图1为本发明实施例3中人参糖蛋白的分子量分布图。
图2为本发明实施例7中不同组别小鼠精子的显微镜照片。
图3为本发明实施例8中不同组别小鼠睾丸组织切片的病理学显微镜照片。
图4为本发明实施例9中人参糖蛋白的紫外光谱图。
图5为本发明实施例9中人参糖蛋白的红外光谱图。
图6为本发明实施例10中小鼠各组织的荧光成像图。
图7为本发明实施例11中fitc+人参糖蛋白给药小鼠的睾丸组织切片的荧光显微镜照片。
具体实施方式
本发明主要提供以下几个方面的研究与结果:(1)以人参为原料,通过提取分离,制得人参水提物、人参总皂苷、人参糖蛋白样品。(2)利用现代仪器和方法对其人参糖蛋白进行了化学表征。(3)利用环磷酰胺造雄性小鼠肾虚少精、弱精模型,试验分为正常组、阳性药组、3个试药组(人参水提物组、人参总皂苷组、人参糖蛋白组),给药28天后,取小鼠两侧附睾精液,分析精子总数,经统计学分析结果表明,造模后精子数量明显下降(与正常组比较,p<0.01),阳性药、人参水提物、人参糖蛋白组能明显提高生精障碍小鼠精子数量(与模型组比较,p<0.05),且人参糖蛋白效果优于人参水提物。并对与生精相关的小鼠脏器系数的影响进行了考察,结果表明,睾丸系数、前列腺+贮精囊系数、包皮腺系数、提肛肌系数均无明显影响。(4)对试验小鼠血清中睾酮含量的影响进行了考察,结果表明,试验小鼠血清中睾酮含量(与模型组比较,p<0.05),阳性药组、人参水提物、人参糖蛋白给药组小鼠血清中睾酮含量显著升高(p<0.05或p<0.01)。(5)小鼠睾丸组织病理学检查结果表明,受试样品人参水提物、人参总皂苷、人参糖蛋白均能改善造模后小鼠睾丸内生精障碍。小鼠生精小管内生精细胞层增厚度与模型组比较p<0.01。小鼠生精小管内生精细胞层横截面所占面积增大与模型组比较p<0.01。(6)利用荧光标记技术,制备人参糖蛋白标记物,通过小鼠尾静脉注射,在整体动物成像设备下观察标记的人参糖蛋白小鼠体内分别情况,结果显示,标记的人参糖蛋白对小鼠的睾丸具有靶向性分布。荧光显微镜下观察小鼠睾丸切片,标记的人参糖蛋白在睾丸内生精小管内有较强荧光信号表达,主要集中在生精小管内生精细胞表面,说明人参糖蛋白可能穿过血睾屏障,进入生精小管内部,在生精细胞表面有大量富集。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
本发明中,“倍量”是指重量倍数。
以下实施例中使用的人参为生晒人参,购自吉林省抚松县万良镇人参市场。产地:吉林集安。
大孔树脂d101购自北京旭邦膜设备有限责任公司,商品型号:3k,填料规格:直径50cm×长150cm。中空纤维柱购自河北科恩环保科技有限公司,商品型号:d101,填料:苯乙烯型非极性共聚体。
实施例1试验样品的制备
1.1人参糖蛋白的制备
(1)取人参5kg,粉成碎块,加入8倍量的80%乙醇加热至70~80℃回流提取,过滤,药渣再用8倍量的80%乙醇回流提取,过滤,合并两次滤液,回收乙醇至浓缩液10l,浓缩液经大孔树脂d101分离,纯水洗脱,收集洗脱液,浓缩,得到醇提人参糖蛋白浓缩液10l;
(2)将步骤(1)经过两次醇回流后的人参药渣加纯水煎煮两次,第一次加人参药渣10倍量的水,煎煮2小时,过滤;第二次加人参药渣10倍量的水煎煮2小时,过滤,合并两次煎煮液,浓缩至10l,得到水提人参糖蛋白浓缩液;将水提人参糖蛋白浓缩液与步骤(1)的醇提人参糖蛋白浓缩液合并,混合均匀,喷雾干燥,得到人参糖蛋白粗提物;
(3)取人参糖蛋白粗提物100g,加入适量纯水溶解,溶液经截留分子量3kda的中空纤维柱超滤,所得超滤液经浓缩后,用截留分子量100da的透析袋以纯水为透析液透析48小时,所得透析内液进行减压浓缩(减压浓缩时真空度为-0.02~-0.04mpa,浓缩温度为70~80℃),冷冻干燥,即得粉末状的人参糖蛋白75g。
1.2人参水提物和人参总皂苷制备
人参水提物:
制备方法:取人参1kg粉成粗粉,加10倍量水煎煮两次,每次2小时,滤过,合并滤液,浓缩,干燥,得400g。
人参总皂苷:
制备方法:取人参1kg粉碎,加8倍量80%乙醇回流提取两次,每次2小时,滤过,合并提取液液,回收乙醇至浓缩液,浓缩液通过d101树脂柱,先以水洗脱至无色,继以80%乙醇洗脱,收集醇洗脱液,浓缩,干燥,得36g。
实施例2试验样品的理化性质分析
2.1人参糖蛋白理化性质的测定
采用苯酚-硫酸法,葡萄糖为标准品,测定人参糖蛋白中性糖含量;采用间羟基联苯法,葡萄糖醛酸为标准品,测定人参糖蛋白酸性糖含量;采用lowry法,以牛血清蛋白为标准品,测定人参糖蛋白中蛋白质含量。结果如表1所示。
2.2人参水提物和人参总皂苷理化性质
(1)人参水提取中总糖含量测定
对照品溶液的制备:精密称取105℃干燥至恒重的葡萄糖对照品10mg,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1ml中含葡萄糖100μg)。
供试品溶液制备:精密称取供试品15mg,加水100ml溶解。
标准曲线的制备:精密吸取对照品溶液0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置具塞试管中,各加水至1.0ml,再加3%苯酚水溶液1.0ml,摇匀,快速加入硫酸4.5ml,摇匀,放至室温,以0管为空白,照分光光度法(中国药典2015年版,四部,通则0401),在490nm波长处测定吸收度,以葡萄糖μg数对应的吸收度,计算回归方程。
测定法:精密吸取供试品溶液1ml,照标准曲线制备项下自“再加3%苯酚溶液1.0ml”起,依法操作,测定吸收度,由回归方程计算总糖含量。
(2)人参总皂苷测定
对照品溶液的制备:精密称取人参皂苷re对照品10mg,置10ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
供试品溶液制备:精密称取供试品100mg,加甲醇25ml溶解并稀释至刻度,摇匀,即得。
标准曲线的制备:精密吸取对照品溶20μl、40μl、80μl、120μl、160μl、200μl,分别置具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5ml,置60℃恒温水浴上充分混匀后加热15分钟,立即用冷水冷却2分钟,加入77%硫酸溶液5ml。摇匀,以试剂作空白,消除气泡后照分光光度法(中国药典2015年版,四部,通则0401),在540nm波长处测定吸收度,以吸光度为纵坐标,以浓度为横坐标,绘制标准曲线,计算回归方程。
测定法:精密吸取供试品溶液100μl,照标准曲线制备项下自“置于具塞试管中”起,依法操作,测定吸收度,由回归方程计算供试品总皂苷含量,计算结果乘以0.84,即得。上述测定结果如表1所示。
表1样品理化性质测定结果
实施例3人参糖蛋白分子量的测定
采用hplc法,以l-色氨酸、碳酸酐酶、蛋白酶抑制剂、维生素b12、细胞色素c制作标准曲线,用gpc软件计算分子量的分布。色谱条件如下:色谱柱:sepaxsrtsec-100hq凝胶色谱分析柱(8mm×300mm);流动相:ph7.0的磷酸盐缓冲液;流速:0.5ml/min;柱温:35℃;检测器:紫外280nm;进样量:10μl。结果如图1所示,人参糖蛋白的重均分子量为9000-1441da之间。
实施例4人参糖蛋白组成糖分析
将人参糖蛋白制备成1-苯基-3-甲基-5-吡唑啉酮(pmp)衍生物,再以各单糖(man、rha、gala、glc,gal、galnac)的pmp衍生物作为对照品,通过高效液相色谱法(hplc)分析其组成糖种类。色谱条件:色谱柱:diamonsil-c18分析柱(φ4.6mm×250mm,5μm);流动相:a:pbs(ph6.8):乙腈=85:15(体积分数),b:pbs(ph6.8):乙腈=6:4(体积比);流速:0.9ml/min;柱温:40℃;检测波长:250nm;进样量:10μl。结果显示,人参糖蛋白由半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。
4种单糖的摩尔比:半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,其摩尔比为0.1005:1:0.2512:0.3029。
实施例5人参糖蛋白氨基酸分析
以20种氨基酸作为对照品,采用hplc法测定其氨基酸组成。色谱条件如下:色谱柱:9eclipsexdb-c18柱(4.6mm×150mm);流动相:乙腈-水(55:45,v/v):ph7.2的磷酸盐缓冲液(3:7,v/v);流速:1ml/min;柱温:室温;检测器:紫外检测器;检测波长:254nm;进样量:20μl。结果表明,人参糖蛋白由17种氨基酸组成(占总蛋白的质量分数%):asp(6.37%)、glu(12.19%)、ser(2.11%)、his(3.43%)、gly(14.38%)、arg(37.17%)、thr(1.09%)、pro(10.06%)、ala(5.41%)、val(1.75%)、cys(0.29%)、met(0.17%)、ile(1.74%)、leu(0.53%)、phe(0.61%)、lys(2.22%)、tyr(0.48%)。fitc的荧光标记反应原理为:fitc的n=c=s基团和lys中的伯氨发生亲核反应,人参糖蛋白中lys的含量为2.22%,为fitc标记提供了必要条件。
实施例6人参糖蛋白糖苷键连接分析
实验方法:称取人参糖蛋白样品20mg,加入0.5ml脱水dmso,密封,搅拌过夜,加入0.5mlnaoh-dmso(naoh2g:dmso10ml)混悬液,密封,搅拌30min,加0.3ml碘甲烷,加入2ml水终止反应。加入3ml氯仿萃取,吹干氯仿层,加入2mol/l三氟乙酸1ml,密封,置121℃水解1.5小时,吹干。加甲醇1ml,吹干,加1mol/l氨水0.5ml,加硼氢化钠20mg,室温放置1.5小时,滴加冰醋酸至无气泡产生,吹干。加10%醋酸甲醇溶液1ml,吹干。置五氧化二磷保干器过夜,加0.5ml吡啶,1ml醋酸酐密封,置121℃烘箱中3小时,吹干,加1ml甲醇吹干,加3ml水溶解,加1ml氯仿萃取,氯仿层吹干。加丙酮溶解作为gc-ms测定,分析人参糖蛋白的糖苷键连接方式:单糖之间连接主要以(1→4)-d-glc为连接主链,含有一定量的(1→3,1→6)-d-glc,其主链glc上的分支点主要在2-o位上,支点连着不同长度的侧链和非还原末端。人参糖蛋白的gc-ms分析结果如表2所示。
表2人参糖蛋白gc-ms数据分析
实施例7人参糖蛋白提高生精障碍小鼠血清中睾酮含量及提高小鼠精子总数和精子活率实验
1.试验材料
1.1受试物:人参水提取物(样品1)、人参总皂苷(样品2)、人参糖蛋白(样品3);阳性对照药生精胶囊,0.4g×12粒,遵义廖元和堂药业有限公司,产品批号:20190509。
1.2试验动物:km小鼠,雄性,体重19-21g,辽宁长生生物技术股份有限公司,许可证号:scxk(辽)2015-0001,质量合格证编号:211002300054609。
1.3仪器
olympusbx51光学显微镜,日本olympus公司;
nis-elemntbr型图像分析系统,日本nikon公司;
bi2000图像分析仪,成都泰盟科技有限责任公司;
i30计数器,深圳市海天地科技有限公司。
1.4试药
环磷酰胺注射液注射用环磷酰胺,0.2g/瓶,进口药品注册号:h20160467,baxteroncologygmbh,产品批号:9e307a。
小鼠睾酮(t)elisa试剂盒,购自江苏绿叶生物科技有限公司。批号:2020-03,产品规格:96t。
生理盐水,石家庄四药有限公司,批号:1902183403。
甲醇,天津市富宇精细化工有限公司,批号:190713。
曙红b(伊红),山东西亚化学股份有限公司,批号:20191016。
2.试验方法
2.1组别及剂量设计
阳性药生精胶囊,临床用量0.4g/粒×12粒/人/日,折算成小鼠的等效剂量为0.7g/kg;
根据试验,样品1口服0.4g/kg、样品2口服0.4g/kg、样品3口服0.4g/kg。
2.2造模
取雄性小鼠若干只,留出14只小鼠腹腔注射0.9%氯化钠注射液(10.0ml/kg),作为正常对照组,其余小鼠腹腔注射环磷酰胺30mg/kg,每日1次,连续7天,建立小鼠少、弱精症模型。造模后,分别随机从正常对照组和造模小鼠中选4只,采集精液,铺板,固定,染色,显微镜下进行精子分析,若造模小鼠精子密度、精子活率及精子活动度均显著低于正常对照组小鼠,且精子奇形率显著高于正常组小鼠,则表明造模成功。
2.3分组、给药
将造模成功的小鼠,按体质量随机分为模型组、生精胶囊0.7g/kg组(阳性对照组)、样品1口服0.4g/kg组、样品2口服0.4g/kg组、样品3口服0.4g/kg组,另设一个正常对照组,每组10-12只。正常对照组和模型组小鼠灌胃等容体积纯净水,各受试药组小鼠分别灌胃相应药液,每日1次,连续给药28天。给药期间每周称体重一次。
2.4检测指标
2.4.1血清中睾酮含量测定
末次给药后1小时,从小鼠眼眶采血,将血样以3000转/min离心10min,分离血清,采用elisa法测定各试验小鼠血清中睾酮含量,具体操作按照试剂盒说明书进行。
2.4.2精液中精子总数、精子活率检查
精子的采集及铺板处理:给药结束次日取材,先称重、脱臼处死,打开腹腔,取出双侧睾丸,分离两侧附睾组织,放入提前预热至37℃1ml生理盐水的小平皿中,用眼科剪刀剪碎。静止5min,吸管吹打均匀。取悬液滴于细胞计数板中,立即计数精子总数,活精子总数,并计算活精率。
2.4.3脏器系数计算
取小鼠睾丸(双)、前列腺+贮精囊(双)、包皮腺(双)、提肛肌称重,分别计算睾丸、前列腺+贮精囊、包皮腺、提肛肌系数,单位均为mg/100gbw。
2.5统计学方法
采用spss17.0软件进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用t检验。p<0.05表示差异有统计学意义。
3.试验结果
3.1对血清中相关生化指标的影响
结果见表3。结果显示,造模后小鼠血清中睾酮含量明显降低(与正常组比较p<0.01),与模型对照组比较,口服生精胶囊、样品1、样品3均能明显提高精子数量(与模型组比较,p<0.05)。
表3样品对小鼠少、弱精症模型血清睾酮含量的影响(n=10)
注:与模型组比较,*p<0.05,**p<0.01。
3.2对精子数量及精子活率的影响
精子数量如图2所示。表4结果显示,造模后小鼠精子数量明显下降(与正常组比较,p<0.01),与模型对照组比较,口服生精胶囊、样品1、样品3均能明显提高精子数量(与模型组比较,p<0.05)。
表4样品对小鼠少、弱精症模型精子数量、精子活率的影响(n=10)
注:与模型组比较,*p<0.05,**p<0.01,***p<0.001
3.3对脏器系数的影响
表5结果显示,造模后睾丸系数、前列腺+贮精囊系数明显降低(与正常组比较,p<0.01),与模型对照组比较,口服生精胶囊、样品1、样品2、样品3对睾丸系数、前列腺+贮精囊系数均无明显影响(与模型组比较,p>0.05)。
表5样品对小鼠少、弱精症模型脏器系数的影响(n=10)
注:与模型组比较,*p<0.05,**p<0.01。
表6结果显示,造模后对包皮腺系数、提肛肌系数均无明显影响(与正常组比较,p>0.05),与模型对照组比较,口服生精胶囊、样品1、样品2、样品3对包皮腺系数、提肛肌系数均无明显影响(与模型组比较,p>0.05)。
表6样品对小鼠少、弱精症模型脏器系数的影响(n=10)
实施例8人参糖蛋白对小鼠睾丸组织病理学影响
1、仪器
leicarm2255型石蜡切片机,德国leica公司;
leicaeg1140石蜡包埋机,德国leica公司;
olympusbx51光学显微镜,日本olympus公司;
nis-elemntbr型图像分析系统,日本nikon公司;
bi2000图像分析仪,成都泰盟科技有限责任公司。
2、小鼠睾丸组织切片及染色
取实施例7实验用小鼠右侧睾丸组织,10%甲醛固定,将固定后组织横切,取0.5cm组织块石蜡包埋后进行5μm切片,苏木精伊红(he)染色,进行病理形态观察及测量小鼠睾丸生精小管内生精细胞层厚度(μm)和生精细胞层横截面的面积(μm2)。测量每只小鼠睾丸中12个生精小管内生精细胞层厚度,取平均值代表单只动物生精细胞层厚度;测量动物睾丸中5个类圆形生精小管切面内生精细胞层横截面的面积,取平均值代表单只动物生精细胞层横截面的面积。
he染色方法:新鲜组织用4%多聚甲醛溶液固定24小时,进行梯度乙醇脱水透明,石蜡包埋后进行切片处理,组织切片放于60℃烘箱中烘烤1小时,然后冷却至室温,密闭阴凉条件下,保存备用。
(1)脱蜡:组织切片浸入二甲苯中浸泡10min,更换二甲苯后再浸泡10min;
(2)梯度乙醇水化(100%、95%、90%、80%);
(3)自来水冲洗;
(4)苏木精染色:水化后的切片放入苏木精染液中浸5-20min,细胞核染成紫蓝色,自来水冲洗3-5min;
(5)1%盐酸酒精分化5-30s,自来水冲洗1-3min;
(6)弱碱性水溶液返蓝30-60s,自来水充分冲洗5-10min;
(7)伊红染色:充分水化后的切片直接入伊红染色液中,细胞质染成粉红色5-15min左右;
(8)梯度乙醇脱水(90%、95%、100%);
(9)二甲苯透明;
(10)中性树胶封片。
3、小鼠睾丸组织病理学检查结果
3.1病理形态观察结果如图3所示。
(1)正常组:睾丸生精上皮细胞排列具有层次,生精上皮距基底膜距离较厚,整体睾丸中各个生精小管内生精细胞所占面积较大,各级生精细胞数量丰富,精子分化形成过程中的各级细胞均易见,精子分化形成正常,生精小管腔内可见较多精子细胞及精子。
(2)模型组:睾丸生精小管上皮表现为生精障碍,生精小管内生精细胞层次与结构疏松,细胞排列紊乱,细胞层明显变薄(p<0.01);生精过程中的各级细胞受损,细胞分化停滞,无法完成精子生成过程中的分裂与分化进程,生精小管内见少量精子或未见精子;精子分化形成过程异常,生精细胞所占面积明显下降(p<0.01)。比较正常对照组,模型组睾丸内生精障碍。
(3)阳性药物组:睾丸生精小管上皮表现为生精障碍的程度得到有效缓解,生精小管内生精细胞层次增厚(p<0.01);生精过程中的各级细胞所占面积明显增加(p<0.01),细胞分化进程被药物推动,多见各级生精细胞,生精小管内精子数量增加;精子分化形成过程得到明显改善。比较模型组,阳性药物组睾丸内生精障碍得到有效改善。
(4)样品1组:睾丸生精小管上皮表现为生精障碍的程度得到有效缓解,生精小管内生精细胞层次增厚(p<0.01);生精过程中的各级细胞所占面积明显增加(p<0.01),细胞分化进程被药物推动,多见各级生精细胞,生精小管内精子数量增加,可见多个管腔内分布精子;精子分化形成过程得到明显改善。比较模型组,阳性药物组睾丸内生精障碍得到有效改善。
(5)样品2组:睾丸生精小管上皮表现为生精障碍的程度得到有效缓解,生精小管内生精细胞层次增厚(p<0.01);生精过程中的各级细胞所占面积明显增加(p<0.01),细胞分化进程被药物推动,多见各级生精细胞,改善生精细胞分化进程,管内精子数量增加;精子分化形成过程得到明显改善。比较模型组,阳性药物组睾丸内生精障碍得到有效改善。
(6)样品3组:睾丸生精小管上皮表现为生精障碍的程度得到有效缓解,生精小管内生精细胞层次增厚(p<0.01);生精过程中的各级细胞所占面积明显增加(p<0.01),细胞分化进程被药物推动,多见各级生精细胞,各级生精细胞数量增多,生精小管内精子数量增加;精子分化形成过程得到明显改善。比较模型组,阳性药物组睾丸内生精障碍得到有效改善。
3.2生精小管形态测量
采用日本尼康nis-elementbr科研级图片采集分析系统。测量每只小鼠睾丸中12个生精小管内生精细胞层厚度(μm),取平均值代表单只动物生精细胞层厚度;生精细胞层厚度反应生精细胞分化成熟程度,厚度值越高,生精细胞分化层级越高,生精细胞数量越多,精子生成及成熟进程越高。测量动物睾丸中5个类圆形生精小管切面内生精细胞层横截面的面积(μm2);生精细胞层横截面面积反应动物生精能力,生精细胞层横截面面积越高,生精细胞数量越多,生精能力越强,生成精子数量越多。采用spss17.0进行统计分析,统计结果见表7和表8。
结果表明,受试样品1、样品2、样品3均能改善小鼠造模后的睾丸内生精障碍。
表7小鼠生精小管内生精细胞层厚度测量结果统计表
注:与模型组比较,**p<0.01。
表8动物生精小管内生精细胞层横截面面积测量结果统计表
注:与模型组比较,**p<0.01。
实施例9人参糖蛋白的荧光标记
1.人参糖蛋白的标记与纯化
称取人参糖蛋白200mg,溶于10ml蒸馏水中,采用0.5mol/l的碳酸钠调节ph值至8.5,加入25mgfitc室温下避光反应过夜,将反应物用100da的透析袋进行透析,透析24小时。透析内液经sephadexg-75柱纯化,蒸馏水洗脱,流速1min/ml,每管5ml,共80管,利用苯酚-硫酸法在490nm处和紫外测定法280nm处分别间管检测,以管数为横坐标(x),吸光度(a)值为纵坐标(y),绘制折线图,多糖和蛋白洗脱峰重合,可以说明人参糖蛋白是糖与蛋白以共价键连接的成分。根据洗脱图形收集30-60管洗脱液,减压浓缩,冷冻干燥,得到人参糖蛋白-fitc72mg,收率为32%,避光保存。
2.uv光谱扫描
分别称取人参糖蛋白、人参糖蛋白-fitc、fitc各1.5mg,加入pbs缓冲液,配制成质量浓度为1.5mg/l的溶液,在波长200-800nm内进行紫外光谱扫描。结果如图4所示,人参活性糖肽在200-800nm区间无明显吸收峰,fitc在280nm、490nm处有明显吸收峰,人参糖蛋白-fitc在280nm、490nm处有吸收峰出现。说明实现了fitc对人参糖蛋白的荧光标记。
3.ir光谱扫描
分别称取人参糖蛋白1.085mg、人参糖蛋白-fitc1.1mg、fitc0.015mg和干燥的溴化钾450mg(按照人参糖蛋白的荧光取代度为1.435%计算),在玛瑙研钵中研磨、混匀,取适量的混合品放入压片模具中,在12mpa左右的压力下,经2min后,样品被压成半透明的薄片。将上述样品置于红外光谱仪中,在波数4000-400cm-1内进行红外光谱测定(扫描样品前需先压一个溴化钾空白片去除水和二氧化碳的干扰),结果如图5所示。人参糖蛋白在3600cm-1、2900cm-1、1600cm-1附近出现明显糖类物质专属吸收峰,表明人参糖蛋白中为糖类化合物。fitc在2050cm-1、1541cm-1、1508cm-1、1454cm-1、1117cm-1、849cm-1处出现明显专属吸收峰。分析吸收峰归属:2050cm-1为s=c=n-吸收峰,1541cm-1、1508cm-1、1454cm-1为苯环中c=c骨架吸收峰,1117cm-1为c-o-c吸收峰,849cm-1为苯环中c-h吸收峰;人参糖蛋白-fitc在2050cm-1处没有出现吸收峰,这是由于人参糖蛋白中伯胺与fitc结构中s=c=n-基团反应生成-nh-(s=c)-nh-基团所引起,同时在1400cm-1-1600cm-1区间、1117cm-1、849cm-1处吸收峰都明显增强,这些特征峰均来自fitc结构中c=c、c-o-c和c-h基团,进一步验证了fitc对人参糖蛋白的荧光标记。
4.荧光取代度测定
精密移取质量浓度为0.1220mg/l的fitc溶液0.2ml、0.4ml、0.6ml、0.8ml、1.0ml、1.2ml和1.4ml,分别加入7支锡箔纸包裹的刻度试管中,再加入pbs缓冲液定容至10ml。以pbs缓冲液为空白对照,依次测定各管的荧光强度。以fitc的质量浓度为横坐标(x)、荧光强度为纵坐标(y),绘制标准曲线,并计算回归方程。fitc的标准曲线回归方程为:y=22460x+29.479(r=0.9997),将人参糖蛋白-fitc样品配制成质量浓度为1.0201mg/l和2.5503mg/l的pbs缓冲液,测定其荧光强度为329.6和922.9,代入回归方程,计算人参糖蛋白的荧光标记物的荧光取代度为1.435%。
实施例10荧光标记的人参糖蛋白小鼠组织靶向性检测
1.小动物活体成像
取3只实施例7实验用小鼠,其中一只按照355mg/kg剂量尾静脉注射人参糖蛋白-fitc,一只按照1.25mg/kg的剂量尾静脉注射fitc,一只按照353.75mg/kg的剂量尾静脉注射人参糖蛋白。给药5min后,采用水合氯醛对小鼠进行麻醉(剂量为0.05mg/kg),待小鼠停止活动后,按照仰姿放入活体动物成像仪中,分别于20min、40min和70min拍摄小鼠全身荧光图,分析人参糖蛋白在裸鼠体内的分布情况,并根据荧光的增强和衰减的过程,探讨人参糖蛋白在小鼠体内的吸收代谢情况,动物活体成像拍摄步骤:打开激发器开关、主机开关、电脑软件,等待仪器预冷至-60℃,预冷指示灯由红色转为绿色,开始拍摄。拍摄条件:拍摄像素:2×2,fov:12,激发波长:480nm,发射波长:535nm,曝光时间:2s。结果如图6所示,图中最右侧的标尺指示荧光强度与颜色标记关系,小鼠身体的颜色显示该时刻小鼠体内荧光强度情况。从图中可以看出,人参糖蛋白在整体动物中没有荧光显色,说明人参糖蛋白自身不带有荧光性,给药后,人参糖蛋白-fitc在小鼠体内扩散,荧光强度呈现先上升后下降的变化趋势。20min左右小鼠脑、爪、腹部出现荧光,说明人参糖蛋白-fitc开始在小鼠组织中有分布,40min左右小鼠荧光达到最高值,说明药物达到峰值,其他组织中也有明显分布,70mim左右小鼠的荧光开始衰减,说明药物已经开始代谢。
实施例11小鼠睾丸组织切片荧光检测
为了进一步验证人参糖蛋白在小鼠睾丸靶向趋势,将实施例9中的小鼠各组织分别采集,将其置于-20℃冰箱中冻存20min后,将上述组织连续切片,置于载玻片上,放入动物荧光成像仪中,观察小鼠睾丸部荧光分布情况。拍摄步骤同实施例9。拍摄条件:拍摄像素:2×2,fov:10,激发波长:480nm,发射波长:535nm,曝光时间:2s。结果如图7所示,睾丸内生精小管内有较强荧光信号表达,主要集中在生精小管内生精细胞表面,说明人参糖蛋白可能穿过血睾屏障,进入生精小管内部,富集于生精细胞表面。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献:
[1]罗浩铭、陈英红、周婷婷、洪铁、姜瑞芝、王颖、杨晓虹、马莉,人参糖蛋白对小鼠学习和记忆能力的影响,吉林大学学报(医学版),2016,(03):439-445.
[2]王颖、陈英红、徐宏、姜瑞芝、罗浩铭,人参糖蛋白的结构及其镇静安眠作用研究,特产研究,2017,39(2):1-4,8.
- 还没有人留言评论。精彩留言会获得点赞!