一种温敏性细胞培养板及其制备方法与流程
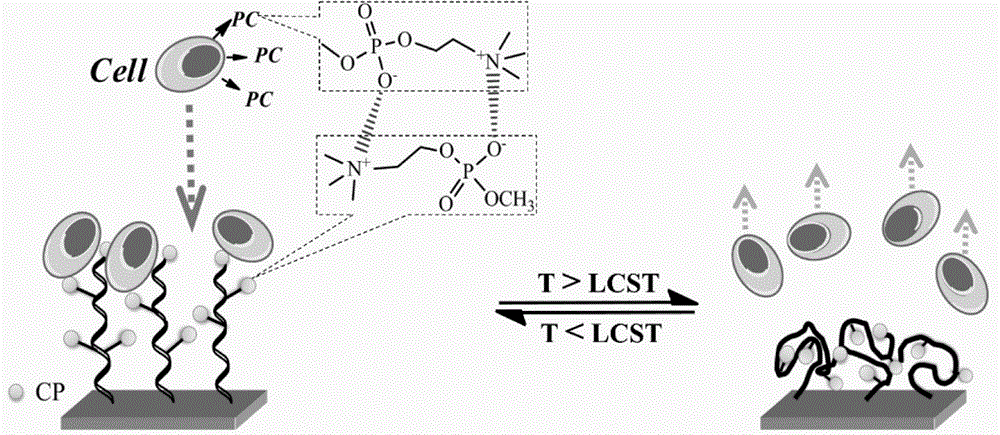
本发明属于生物医用材料技术领域,尤其涉及一种温敏性细胞培养板及其制备方法。
背景技术:
在众多组织工程研究中,细胞片工程被认为是最有效的组织重建技术之一。细胞片是一种类似组织的单层,已经成为再生医学的新工具,并已应用于人类临床研究,如细胞移植、组织修复等方面,具体来说,可以用于角膜重建、内镜黏膜下剥离后的食管溃疡治疗。
在传统技术中,细胞在硅板上培养后,采用胰蛋白酶或机械搅拌的方式分离细胞会导致细胞及细胞外基质的损伤,且胰蛋白酶会消化细胞间的结合物,使细胞相互分离,从而破坏细胞片的完整性,影响生物技能。
目前,为了避免细胞及细胞外基质的损伤,获取较为完整的细胞片,一般是在温敏性细胞培养板上进行细胞片培养。制备温敏性细胞培养板的主要方法是将温敏性聚合物接枝或涂覆到培养板上。当需要分离出细胞片时,将温度降低到临界溶液温度(lcst)以下,此时,温敏性聚合物分子处于伸展状态,其中的一些结构会与水分子形成氢键等,表现为亲水性,导致对细胞的黏附强度降低,从而释放细胞片,而当温度高于lcst时,温敏性聚合物分子链处于蜷缩状态,分子链之间的会生成氢键,表现为疏水性,利于细胞黏附。
目前,为了提升黏附细胞的性能,加快细胞生长,最主要的方式还是添加源于其他个体的黏着蛋白,而这种外援添加会使得细胞片在使用过程中产生免疫原性反应,并且介导细胞黏附的蛋白和吸附在材料表面的蛋白层的性质不断变化,这使得通过细胞黏附蛋白进行系统分析和精确调节细胞与材料表面黏附行为变得较为困难,且黏附期耗时较长。
经过检索,申请号为cn200610015326.7的发明专利公开了一种细胞培养和脱附用的智能膜及其制备方法。该发明公开的技术方案中采用丙烯酸(aac)与壳聚糖(cs)缩合反应得到含有具有反应活性的c=c的cs-aac大单体,然后与n-异丙基丙烯酰胺共聚制备温敏性智能膜,共聚的分子链的支链具有-conh键,从而促进细胞黏附。但是,该发明虽然通过在共聚物支链上引入-conh键,一定程度上解决了细胞黏附的问题,并具有较好的生物相容性,但是,在脱附过程中,并没有突破原有的技术模式,仍然是通过将温度降低到lcst以下,提升共聚物的亲水性,使细胞片脱附。
申请号为cn201210228270.9的发明专利公开了一种细胞片层智能脱附水凝胶及其应用。该发明公开的技术方案可以促进细胞黏附,避免传统的酶解法对细胞活性及功能等造成损伤,降低与传统组织工程相关的并发症,另外,当处于高温或低ph时,凝胶会发生亲、疏水性的变化,由于疏水基团起主导作用或酸根离子质子化,凝胶宏观表现为体积收缩,当处于低温或高ph时,凝胶体积膨胀,贴附在凝胶表面的细胞自动脱附。从本质上来说,仍然是通过细胞培养基质的亲水、疏水性能变化,进行脱、吸附。
总体来说,目前的技术方案均是采用加热或降温,使温度高于或低于lcst,从而使温敏性聚合物呈疏水、亲水性,进而吸附、脱附细胞的技术方案。需要有新的温敏性细胞培养板,以新的途径实现细胞的吸附、脱附。
技术实现要素:
为了解决背景技术中的问题,达到“给出一种新型温敏性细胞培养板”的目的,本发明给出了一种温敏性细胞培养板及其制备方法。
一种温敏性细胞培养板,以经过修饰的硅片作为基底,硅片表面连有含叠氮端基侧链的温敏性聚合物刷p(eo)4ma,胆碱磷酸通过点击反应修饰于p(eo)4ma侧链末端;
其中,p(eo)4ma以(eo)4ma为单体聚合得到。
进一步地,所述的硅片表面首先经过(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷的修饰,(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷为atrp反应的引发剂,引发(eo)4ma的聚合。
进一步地,所述的(eo)4ma的结构式为
一种温敏性细胞培养板的制备方法,包含如下步骤:
a.制备(eo)4ma;首先进行第一次反应,向干燥的单口烧瓶中依次加入四甘醇、三乙胺和四氢呋喃,随后将对甲苯磺酰氯溶于四氢呋喃并滴加到反应体系中,室温反应后,除去生成的沉淀,并用二氯甲烷作为萃取剂进行萃取,旋转蒸发除去二氯甲烷后向溶液中加入叠氮化钠和二甲基甲酰胺,在反应后,除去沉淀、进行二氯甲烷萃取、mgso4干燥,得到2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇,再进行第二次反应,向烧瓶中依次加入2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇、四氢呋喃、三乙胺,再将甲基丙烯酰氯滴加到反应体系中,室温反应后,除去沉淀、二氯甲烷萃取、mgso4干燥,得到(eo)4ma;
b.制备温敏性聚合物刷p(eo)4ma表面;将经过(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于无水乙醇中,并将(eo)4ma、1,1,4,7,10,10-六甲基三乙烯四胺、cubr溶于乙醇中,在无氧环境中反应之后取出硅片,用无水甲苯和无水甲醇冲洗硅片表面,得到温敏性聚合物刷p(eo)4ma表面;
c.制备胆碱磷酸修饰的温敏性细胞培养板;用甲醇的水溶液溶解胆碱磷酸、五水硫酸铜以及抗坏血酸钠盐,得到混合溶液,随后将步骤b中得到的温敏性聚合物刷p(eo)4ma表面浸入上述混合溶液中反应,移除反应液,用甲醇冲洗表面,得到胆碱磷酸修饰的温敏性细胞培养板。
进一步地,步骤a的第一次反应中,向干燥的单口烧瓶中依次加入1.0mol四甘醇、0.25mol-0.35mol三乙胺和50ml四氢呋喃,随后将0.2mol-0.5mol对甲苯磺酰氯溶于50ml四氢呋喃并滴加到反应体系中,室温反应12h;在旋转蒸发除去二氯甲烷后向溶液中加入0.25mol-0.28mol叠氮化钠和120ml二甲基甲酰胺,在70℃-80℃范围内反应24h;步骤a的第二次反应中,甲基丙烯酰氯滴加到反应体系后,室温反应12h;
步骤b中,将经过(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于10ml-15ml无水乙醇中,并将1.74mmol-3.48mmol(eo)4ma、0.028mmol-0.042mmol的1,1,4,7,10,10-六甲基三乙烯四胺、0.014mmol-0.029mmol的cubr溶于乙醇中,乙醇充当溶剂,对反应的影响较小,在无氧环境中保持45℃-50℃的温度反应2h-22h;
步骤c中,用10ml-15ml甲醇的水溶液溶解50mg-300mg胆碱磷酸、2mg-6mg五水硫酸铜以及5mg-15mg抗坏血酸钠盐,得到混合溶液,随后,将p(eo)4ma表面浸入上述混合溶液中,在40℃下反应24h。
进一步地,制备(eo)4ma的第二次反应中,按摩尔比,2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇:三乙胺:甲基丙烯酰氯=1:(1.5-3):1.2。
进一步地,步骤a中的对甲苯磺酰氯的滴加时间为2h-3h,在滴加过程中使用冰浴,滴加结束后,撤去冰浴,在常温下反应。
进一步地,步骤a中甲基丙烯酰氯滴加时间为2h-3h,在滴加过程中使用冰浴,滴加结束后,撤去冰浴,在常温下反应。
进一步地,步骤c中的甲醇水溶液中,甲醇与水的体积比为(4-5):1。
在本技术方案中,(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷的结构式为
在本发明的技术方案中,胆碱磷酸(cp)是一种两性离子单体,相对于细胞膜骨架结构上磷脂双分子层的极性头基-磷酸胆碱(pc),cp与其具有相同的化学基团,但是相反地连接结构,每个cp分子可以与pc形成两组
由于使用了侧链末端修饰有cp的p(eo)4ma,细胞的吸、脱附过程与在传统温敏性聚合物分子刷上的吸、脱附过程出现不同,侧链末端修饰有cp的p(eo)4ma的温敏性聚合物刷在温度低于lcst时,借助cp-pc相互作用迅速黏附细胞,从而加快细胞生长,由于有核细胞的细胞膜外表面均含有pc,因此,具有良好的通用性,另外,还可以通过调整cp的用量来精准调控细胞的黏附速率,在需要回收细胞片时,利用聚合物的热收缩来减少cp对细胞膜的可及度,从而快速释放细胞,使贴附在表面的细胞片自动分离,得到组织较完整、生理机能较好的细胞片。
与现有技术相比,本发明的有益效果是:
1、不再是利用传统的机械搅拌、胰蛋白酶或是温敏性聚合物的亲、疏水性基团的变化控制脱附,而是利用p(eo)4ma温敏性聚合物刷的热收缩,主动减少聚合物结构中的cp对细胞膜的可及度,使贴附在粘板表面的细胞片自动分离,从而得到较为完整的细胞片层;
2、使用了胆碱磷酸即cp修饰了p(eo)4ma侧链末端,能够显著加快细胞黏附,从而加快细胞生长;
3、细胞培养板对细胞的黏附强度可通过p(eo)4ma聚合物刷的分子量、接枝率以及cp使用量来调控。
附图说明
图1:一种调节细胞初始黏附和分离的细胞培养板的作用示意图。
图2:实施例2中制备得到的细胞培养板与空白硅片对红细胞吸附量随时间变化的曲线图。
图3:实施例2制备得到的细胞培养板表面分离的聚合物链段的pbs溶液(1mg/ml)的紫外透过率曲线图。
图4:使用实施例3制备的细胞培养板培养cho细胞两天后,从36℃升温至39℃后诱导细胞脱离的情况。
图5:实施例2、实施例3、实施例4制备的细胞培养板与空白硅片在10min内对红细胞黏附数量的对比图。
具体实施方式
对本发明进行解释说明,但并非对本发明的限制,在本发明的思路启示下得到的技术方案,均应纳入本专利的保护范畴。以下实施例中:(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷购自上海迈瑞尔化学技术有限公司,叠氮化钠和五水合硫酸铜购自国药集团化学试剂有限公司,抗坏血酸钠盐购自上海研生生化试剂有限公司,其他试剂均购自阿拉丁试剂(上海)有限公司。
实施例1
(1)向干燥的单口烧瓶中依次加入1.0mol四甘醇、0.3mol三乙胺(tea)和50ml四氢呋喃(thf),将0.5mol对甲苯磺酰氯溶于50ml四氢呋喃并滴加到反应体系中,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,室温反应12h;除去反应生成的盐沉淀,并用二氯甲烷(dcm)萃取。旋转蒸发除去dcm后,向溶液中加入0.28mol叠氮化钠和120ml二甲基甲酰胺(dmf),于70-80℃反应24h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇(a(eo)4)。在单口烧瓶中依次加入提纯得到的a(eo)4、thf和tea,将甲基丙烯酰氯滴加入反应体系,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,其中(eo)4n3、tea和甲基丙烯酰氯的摩尔配比为1:2:1.2,150ml的thf作为溶剂,室温反应12h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到(eo)4ma。
(2)将(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于10ml无水乙醇中,并将所述(eo)4ma1.74mmol,以及1,1,4,7,10,10-六甲基三乙烯四胺(hmteta)0.028mmol,cubr0.014mmol溶于上述乙醇中,在无氧环境中于45-50℃中反应2h。反应结束后,取出硅片,用无水甲苯和无水甲醇冲洗表面,得到p(eo)4ma温敏性聚合物刷表面。
(3)用10ml甲醇水溶液溶解50mg胆碱磷酸,2mg五水合硫酸铜和5mg抗坏血酸钠盐,其中,甲醇水溶液中甲醇与水的体积比为4:1,将所述p(eo)4ma聚合物刷表面浸入上述混合液中,于40℃反应24h;移除反应液,用甲醇冲洗表面,得到胆碱磷酸修饰的温敏性细胞培养板。
在进行细胞的黏附、脱附时,原理如图1所示。
实施例2
(1)向干燥的单口烧瓶中依次加入1.0mol四甘醇、0.35mol三乙胺(tea)和50ml四氢呋喃(thf),随后将0.3mol对甲苯磺酰氯溶于50ml的四氢呋喃并滴加到反应体系中,滴加时长3h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,室温反应12h;除去反应生成的盐沉淀,并用二氯甲烷(dcm)萃取。旋转蒸发除去dcm后,向溶液中加入0.28mol叠氮化钠和120ml二甲基甲酰胺(dmf),于70-80℃反应24h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇(a(eo)4)。在单口烧瓶中依次加入提纯得到的a(eo)4、thf、和tea,将甲基丙烯酰氯滴加入反应体系,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,其中(eo)4n3、tea和甲基丙烯酰氯的摩尔配比为1:3:1.2,150ml的thf作为溶剂,室温反应12h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到(eo)4ma。
(2)将(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于10ml无水乙醇中,并将所述(eo)4ma2.9mmol,以及1,1,4,7,10,10-六甲基三乙烯四胺(hmteta)0.035mmol,cubr0.022mmol溶于上述乙醇中,在无氧环境中于45-50℃中反应14h。反应结束后,取出硅片,用无水甲苯和无水甲醇冲洗表面,得到p(eo)4ma温敏性聚合物刷表面。
(3)用10ml甲醇水溶液溶解100mg胆碱磷酸,3mg五水合硫酸铜和7.5mg抗坏血酸钠盐,其中,甲醇水溶液中甲醇与水的体积比为5:1,将所述p(eo)4ma聚合物刷表面浸入上述混合液中,于40℃反应24h;移除反应液,用甲醇冲洗表面,得到胆碱磷酸修饰的温敏性细胞培养板。
在进行细胞的黏附、脱附时,原理如图1所示。如图2所示,本实施例得到的温敏性细胞培养板相比于空白硅板具有更高的细胞黏附效率。如图3所示,显示了本实施例制得的温敏性细胞培养板的表面分离的聚合物链段的pbs溶液(1mg/ml)的紫外透过率曲线图,两条曲线分别为从低温向高温加热、从高温向低温降温两个方向的过程,曲线图说明,在lcst以下时,聚合物刷是整体呈现舒展状态,以cp修饰的p(eo)4ma的聚合物刷呈现良好的紫外透过性质,当温度在lcst以上时,聚合物刷呈现不规则的收缩状态,使得紫外透过率降低。
实施例3
(1)向干燥的单口烧瓶中依次加入1.0mol四甘醇、0.25mol三乙胺(tea)和50ml四氢呋喃(thf),随后将0.2mol对甲苯磺酰氯溶于50ml的四氢呋喃并滴加到反应体系中,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,室温反应12h;除去反应生成的盐沉淀,并用二氯甲烷(dcm)萃取。旋转蒸发除去dcm后,向溶液中加入0.25mol叠氮化钠和120ml二甲基甲酰胺(dmf),于70-80℃反应24h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇(a(eo)4)。在单口烧瓶中依次加入提纯得到的a(eo)4、thf、和tea,将甲基丙烯酰氯滴加入反应体系,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,其中(eo)4n3、tea和甲基丙烯酰氯的摩尔配比为1:1.5:1.2,150mlthf作为溶剂,室温反应12h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到(eo)4ma。
(2)将(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于10ml无水乙醇中,并将所述(eo)4ma2.32mmol,以及1,1,4,7,10,10-六甲基三乙烯四胺(hmteta)0.028mmol,cubr0.014mmol溶于上述乙醇中,在无氧环境中于45-50℃中反应8h。反应结束后,取出硅片,用无水甲苯和无水甲醇冲洗表面,得到p(eo)4ma温敏性聚合物刷表面。
(3)用15ml甲醇水溶液溶解200mg胆碱磷酸,5mg五水合硫酸铜和12.5mg抗坏血酸钠盐,其中,甲醇水溶液中甲醇与水的体积比为5:1,将所述p(eo)4ma聚合物刷表面浸入上述混合液中,于40℃反应24h;移除反应液,用甲醇冲洗表面,得到胆碱磷酸修饰的温敏性细胞培养板。
在进行细胞的黏附、脱附时,原理如图1所示。
实施例4
(1)向干燥的单口烧瓶中依次加入1.0mol四甘醇、0.25mol三乙胺(tea)和50ml四氢呋喃(thf),将0.3mol对甲苯磺酰氯溶于50ml的四氢呋喃并滴加到反应体系中,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,室温反应12h;除去反应生成的盐沉淀,并用二氯甲烷(dcm)萃取。旋转蒸发除去dcm后,向溶液中加入0.25mol叠氮化钠和120ml二甲基甲酰胺(dmf),于70-80℃反应24h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到2-(2-(2-(2-叠氮乙氧基)乙氧基)乙氧基)乙醇(a(eo)4)。在单口烧瓶中依次加入提纯得到的a(eo)4、thf、和tea,将甲基丙烯酰氯滴加入反应体系,滴加时长2h,滴加过程中使用冰浴,滴加结束后,撤去冰浴,其中(eo)4n3、tea和甲基丙烯酰氯的摩尔配比为1:1.5:1.2,150mlthf作为溶剂,室温反应12h;除去盐沉淀、dcm萃取、mgso4干燥,提纯得到(eo)4ma。
(2)将(11-(2-溴-2-甲基)丙酰氧基)十二烷基三氯硅烷修饰过的硅片置于15ml无水乙醇中,并将所述(eo)4ma3.48mmol,以及1,1,4,7,10,10-六甲基三乙烯四胺(hmteta)0.042mmol,cubr0.029mmol溶于上述乙醇中,在无氧环境中于45-50℃中反应22h。反应结束后,取出硅片,用无水甲苯和无水甲醇冲洗表面,得到p(eo)4ma温敏性聚合物刷表面。
(3)用15ml甲醇水溶液溶解300mg胆碱磷酸,6mg五水合硫酸铜和15mg抗坏血酸钠盐,其中,甲醇水溶液中甲醇与水的体积比为4:1,将所述p(eo)4ma聚合物刷表面浸入上述混合液中,于40℃反应24h;移除反应液,用甲醇冲洗表面,得到胆碱磷酸修饰的温敏性细胞培养板。
在进行细胞的黏附、脱附时,原理如图1所示。
如图5所示,展示了实施例2、实施例3、实施例4制备的细胞培养板与空白硅片在10min内对红细胞黏附数量的对比图。可以看到,实施例2、实施例3、实施例4制备的细胞培养板在10min内对红细胞黏附数量总量均高于空白硅板,表明本发明公开的技术方案相对于传统技术方案是具备提升吸附效率的作用的,另外,实施例2、实施例3、实施例4制备的细胞培养板在10min内对红细胞的吸附效果也是有区别的,实施例4制备的细胞培养板的吸附效率最好,实施例3制备的细胞培养板的吸附效率次之,实施例2制备的细胞培养板的吸附效率较实施例3制备的细胞培养板弱一些,综合来看,cp的使用量是造成吸附效率出现差异的主要因素,而本领域技术人员还可以通过改变p(eo)4ma聚合物刷的分子量、接枝率来进行吸附效率的调控。
- 还没有人留言评论。精彩留言会获得点赞!