一种耐盐反硝化菌及其应用的制作方法
本发明涉及微生物
技术领域:
,特别涉及一种耐盐反硝化菌及其应用。
背景技术:
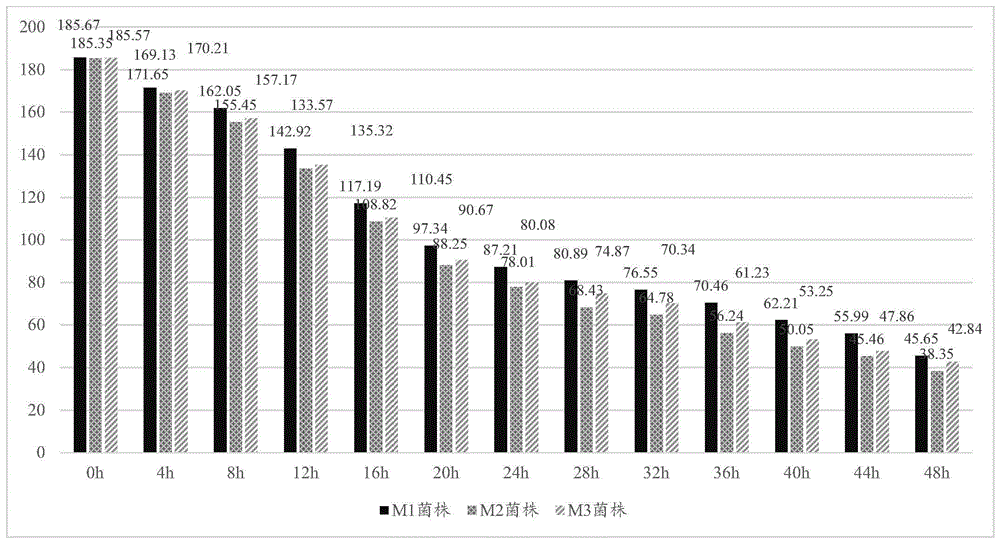
:生物脱氮是在不同种类的微生物的作用下,将有机氮和氨氮转化为氮气的过程。传统的生物脱氮一般包括氨化过程,硝化过程(nh4+→nh2oh→no2-→no3-)和反硝化过程(no3-→no2-→no→n2o→n2)3个过程。氨化过程是在氨化细菌的作用下,有机氮分解转化为氨态氮(nh4+-n)的过程,氨化过程是比较容易进行。硝化过程通常是由好氧型微生物完成的,在有氧的状态下,利用无机碳为碳源将nh4+转化为no2-直至氧化成no3-的过程。硝化过程一般情况下分成两个阶段:第一阶段是由亚硝化菌将氨氮转化为亚硝态氮;第二阶段由硝化菌将亚硝态氮转化为硝态氮。反硝化过程是在无分子态氧存在的条件下,反硝化细菌在无氧或厌氧条件下,厌氧微生物或兼性厌氧微生物利用硝态氮作为呼吸链的最终受体,还原成亚硝态氮、no和n2o直至n2的过程。反硝化过程一般情况下以有机物和碳源为供体,由异养、厌氧或兼性厌氧型微生物来完成。反硝化细菌多为异养、兼性厌氧,其中利用微生物进行原位或异位修复,因其简单和经济最受关注。生物反硝化即利用反硝化菌的作用,将硝态氮(亚硝态氮)转化为气态产物去除,被认为是最经济有效的脱氮方式。反硝化细菌种类分布广泛,从中分离出的有异养、好氧、兼性厌氧、嗜盐、耐盐等多种反硝化细菌,可用于不同的水处理工艺中。一些城镇生活污水具有低碳氮比(c/n,质量比)和盐度高的特点,国内外学者均期望通过获取耐盐型的能够在低碳氮比下进行高效反硝化的反硝化细菌来解处理这些城镇生活污水。技术实现要素:有鉴于此,本发明的目的是提出一种耐盐反硝化菌及其应用,该耐盐反硝化菌能够在低碳氮比和高盐度下进行高效反硝化。基于上述目的,本发明提供了一种耐盐反硝化菌,该菌株命名为cpytp-1,分类命名为松嫩假单胞菌(pseudomonassongnenensis),保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号,保藏日期为2019年8月22日,保藏编号为cgmccno.18409。本发明的耐盐反硝化菌的筛选方法:从厦门市生活污水处理厂厌氧沟和缺氧沟中采集污泥,污泥经浓缩后,以组织破碎仪轻微破碎,加入富集培养液体培养基中,在低温摇床上25℃厌氧培养,经梯度稀释和纯化培养,分离得到三株反硝化菌,分别命名为m1菌株、m2菌株和m3菌株;通过对这三株菌株进行反硝化、温度、盐度、ph、碳氮比和接种量试验,综合考虑这三株菌株的性能,发现m2菌株去除总氮能力最好,同时m3菌株具有最好的耐盐性。因此,选择m2和m3菌株作为原始出发菌株进行人工诱变;接着对m2和m3菌株进行原生质体紫外诱变后融合,筛选出菌株y1、y2和y3,通过对这三株菌株进行反硝化能力和耐盐性的测定,综合考虑这三株菌株的去除总氮能力和耐盐性,最终选择菌株y2;经16srrna基因比对,与松嫩假单胞菌(pseudomonassongnenensis)neau-st5-5(t)相似度最高,同源性为99.9%,命名为cpytp-1,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号,保藏日期为2019年8月22日,保藏编号为cgmccno.18409。试验结果表明,本发明的耐盐反硝化菌具有以下特性:(1)具有较好的耐盐性,可以耐4%的盐浓度。(2)在较低的碳氮比下有较好的去除总氮的能力,在碳氮比为2,接种量为10%,培养温度为25℃,ph7.5-8.5的条件下,菌株在耐受3%盐度和微氧的情况下在36小时内总氮去除率可达100%。(3)在相同的培养条件下,菌株在耐受3%盐度和有氧的情况下在48小时内的总氮去除率可达66.75%,菌株在厌氧条件下具有更好的去除总氮的能力,虽然在充分曝气好氧条件下,菌株去除总氮的能力有一定程度的降低,但也具有一定的去除总氮的能力,说明本发明的耐盐反硝化菌是兼性厌氧菌。(4)在碳氮比为2,接种量为10%,培养温度为25℃,ph7.5-8.5的条件下,菌株在耐受3%盐度和微氧的情况下在48小时内能够有效降解尼泊金甲酯。本发明的耐盐反硝化菌在常温和在微氧环境下,能够进行高效的反硝化作用,对环境条件没有过多要求,更容易适应环境。基于相同的发明构思,本发明还提供了上述的耐盐反硝化菌在含氮水体脱氮中的应用。在本发明的一些实施例中,所述含氮水体中含有尼泊金甲酯。在本发明的一些实施例中,所述含氮水体的含盐量0-4%。在本发明的一些实施例中,所述耐盐反硝化菌对含氮水体进行脱氮时的条件为:碳氮比(质量比)为2-3,接种量为8%-12%,培养温度为25℃-30℃,ph7.5-8.5。在此条件范围内,有耐受高盐度的情况下有较高的总氮去除率。在本发明的一些实施例中,所述耐盐反硝化菌对含氮水体进行脱氮时的条件为:碳氮比为2,接种量为10%,培养温度为25℃。在此最佳条件范围内,本发明的耐盐反硝化菌在36小时内总氮去除率可达100%。从上面所述可以看出,本发明的耐盐反硝化菌具有以下有益效果:本发明的耐盐反硝化菌是耐盐型的,且能够在低碳氮比和常温下进行高效反硝化,特别适用于碳氮比较低以及具有一定盐度的城镇生活污水处理过程中的脱氮,总氮去除率可达100%,总氮去除速度快速有效,在污水处理领域有广泛的应用前景。附图说明图1为m1菌株、m2菌株和m3菌株去除总氮能力的示意图;图2a为m1菌株在不同温度下去除总氮能力的示意图;图2b为m2菌株在不同温度下去除总氮能力的示意图;图2c为m3菌株在不同温度下去除总氮能力的示意图;图3a为m1菌株在不同含盐量下去除总氮能力的示意图;图3b为m2菌株在不同含盐量下去除总氮能力的示意图;图3c为m3菌株在不同含盐量下去除总氮能力的示意图;图4a为m1菌株在不同ph下去除总氮能力的示意图;图4b为m2菌株在不同ph下去除总氮能力的示意图;图4c为m3菌株在不同ph下去除总氮能力的示意图;图5a为m1菌株在不同c/n比下去除总氮能力的示意图;图5b为m2菌株在不同c/n比下去除总氮能力的示意图;图5c为m3菌株在不同c/n比下去除总氮能力的示意图;图6a为m1菌株在不同接种量下去除总氮能力的示意图;图6b为m2菌株在不同接种量下去除总氮能力的示意图;图6c为m3菌株在不同接种量下去除总氮能力的示意图;图7为不同浓度的氨苄青霉素钠对菌株m2和m3制备率和再生率的影响图;图8为氨苄青霉素钠的不同作用时间对菌株m2和m3制备率和再生率的影响图;图9为不同浓度的溶菌酶浓度对菌株m2和m3制备率和再生率的影响图;图10为溶菌酶的不同作用温度对菌株m2和m3制备率和再生率的影响图;图11为溶菌酶的不同作用时间对菌株m2和m3制备率和再生率的影响图;图12为y1菌株、y2菌株和y3菌株去除总氮能力的示意图;图13为y1菌株、y2菌株和y3菌株耐盐性的示意图;图14为y2菌株的遗传稳定性的示意图;图15为y2菌株去除尼泊金丁酯的示意图。具体实施方式为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。实施例1反硝化菌株的筛选1.材料与方法1.1分离源分离获取的细菌来源于厦门市生活污水处理厂的厌氧沟和缺氧沟中的污泥。1.2培养基(1)lb培养基:酵母浸膏5g/l,蛋白胨10g/l,nacl5g/l,ph7.0~7.2(若为固体则加入琼脂25g)。(2)富集培养液体培养基:ch3coona·3h2o6g,kno32.0g,mgso4·7h2o0.2g,k2hpo42.0g,双蒸水1000ml,ph7.2。(3)1%btb(溴百里酚蓝)-反硝化培养基:ch3coona·3h2o6g,kno32.0g,mgso4·7h2o0.2g,琼脂20g,1%-btb4ml,双蒸水1000ml,ph7.6。(4)分离纯化培养基:ch3coona·3h2o6g,kno32.0g,mgso4·7h2o0.2g,k2hpo42.0g,琼脂20g,ph7.2-7.6。上述培养基灭菌,冷却后在无菌条件下使用。1.3试剂(1)格里斯试剂ⅰ:0.5g对氨基苯磺酸溶于150ml30%醋酸;(2)格里斯试剂ii:0.5gα-萘胺加入50ml水煮沸后加入150ml30%醋酸;(3)奈氏试剂:①16gnaoh溶于50ml水中冷却;②7gki和10ghgi2溶于水,然后将此溶液在搅拌下徐徐注入氢氧化钠溶液中,用水定容至100ml。1.4反硝化菌株的富集、分离和纯化1.4.1反硝化菌株的富集培养采集的污泥经浓缩后,以组织破碎仪轻微破碎。取破碎后的污泥样品10g,加入装有100ml富集培养液体培养基的血清瓶中,加入灭菌的玻璃珠若干,在低温摇床上25℃培养若干天后取菌液,以格里斯试剂变红和奈氏试剂变棕褐色检验亚硝酸和氨的生成。同时测定培养基中no3--n浓度,当no3--n转化达90%以上,菌液用于细菌分离。1.4.2反硝化菌株的分离(1)取富集培养后获取的菌液,利用系列平板稀释划线的方法在分离纯化培养基上分离反硝化细菌。稀释系列菌液浓度为10-2、10-3、10-4、10-5、10-6、10-7、10-8,取其中10-4、10-5、10-6、10-7、10-8浓度菌液在培养皿上分别进行划线分离。每个菌液浓度划线3个平皿,将处理好的平皿放入厌氧培养罐内,置于25℃生化培养箱中培养数天,至培养皿上长出肉眼可见的菌落。(2)通过系列稀释法和平板划线法从富集后的菌液中分离反硝化细菌,并选取btb培养基上菌落周围出现蓝色晕圈的菌株进行多次纯化。在细菌培养过程中,将培养皿放入厌氧培养罐中,并在罐中加入焦性没食子酸保证缺氧环境,最后将厌氧罐放入生化培养箱中培养若干天。1.4.3反硝化菌株的纯化从上述培养皿中挑取单菌落,转接于纯化培养基上。每个单菌落挑取至少3个培养皿。接种后继续置于25℃生化培养箱中培养7d,至培养皿上长出肉眼可见的菌落,纯化多次。2.试验结果通过富集、筛选和纯化,得到三株反硝化菌,它们可以在以硝酸钾为唯一氮源,乙酸钠为唯一碳源的培养基中生长。三株反硝化菌分别命名为m1菌株、m2菌株和m3菌株。实施例2反硝化菌的生长代谢特性及其生物脱氮的研究1.1试验方法根据中华人民共和国国家环境保护标准hj636-2012,碱性过硫酸钾消解紫外分光光度法进行总氮的测定。反硝化液体培养基:ch3coona·3h2o6g,kno32g,kh2po40.5g,mgso40.25g,蒸馏水1000ml,调节ph值7.0~7.2,121℃灭菌20min(若为固体则加入琼脂20g)。1.1.1m1、m2和m3菌株的反硝化能力的研究m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。然后分别将5mlm1、m2和m3菌液接种到含有95ml反硝化液体培养基的血清瓶中。血清瓶中25℃下以120rmp培养48h,每隔4h定时取样,测定培养液中的总氮浓度。1.1.2温度对m1、m2和m3菌株的生长代谢的影响m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。然后分别将5mlm1、m2和m3菌液接种到含有95ml反硝化液体培养基的血清瓶中,分别控制培养温度为10℃、15℃、20℃、25℃、30℃和35℃,在血清瓶中以120rmp培养48h,定时取样,测定培养液中的总氮浓度。1.1.3盐度对m1、m2和m3菌株的生长代谢的影响m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。然后分别将5mlm1、m2和m3菌液接种到含有95ml反硝化液体培养基的血清瓶中,以nacl溶液控制盐度1.5%、2%和2.5%,血清瓶中25℃下以120rmp培养48h,定时取样,测定培养液中的总氮浓度。1.1.4ph对m1、m2和m3菌株的生长代谢的影响m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。然后分别将5mlm1、m2和m3菌液接种到含有95ml反硝化液体培养基的血清瓶中,以浓度为50mmol·l-1的mes(ph5.0-6.0),pipes(ph6.5-7.0),tricine(ph7.5-8.5),ches(ph9-10)调节培养基ph值。血清瓶中25℃下以120rmp培养48h,定时取样,测定培养液中的总氮浓度。1.1.5碳氮比(质量比)对m1、m2和m3菌株的生长代谢的影响m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。然后将5mlm1、m2和m3菌液接种到含有95ml反硝化液体培养基的血清瓶中,调整c/n(质量比)分别为1、1.5、2、3、4和5。血清瓶中25℃下以120rmp培养48h,定时取样,测定培养液中的总氮浓度。1.1.6接种量对m1、m2和m3菌株的生长代谢的影响m1、m2和m3菌株分别接种到富集培养液体培养基中,25℃下厌氧培养至对数期。按照接种量分别为5%、8%、10%、12%和15%分别将m1、m2和m3菌液接种到含有反硝化液体培养基的血清瓶中。血清瓶中25℃下以120rmp培养48h,定时取样,测定培养液中的总氮浓度。2.试验结果2.1m1、m2和m3菌株的反硝化能力的研究结果m1、m2和m3菌株的反硝化能力的研究结果见图1,由图1可知,48h厌氧处理过程中,m1、m2和m3菌株均表现出较好的去除总氮能力,下降的趋势基本相同。在这三株菌株中,m2菌株的去除总氮能力最好,48h后可将总氮由185.24mg/l降低至38.35mg/l,m3菌株的去除总氮能力次之,48h后可将总氮由185.48mg/l降低至43.56mg/l,m1菌株的去除总氮能力相对较差,48h后可将总氮由185.37mg/l降低至48.73mg/l。2.2温度对m1、m2和m3菌株的生长代谢的影响图温度对m1、m2和m3菌株的生长代谢的影响图分别见图2a-图2c,由图2a-2c可知,48h厌氧处理过程中,在不同温度下,m1、m2和m3菌株均表现出较好的去除总氮能力,且25-30℃时去除总氮能力最好。在相同的温度下,去除总氮能力的排序为:m2菌株>m3菌株>m1菌株。2.3盐度对m1、m2和m3菌株的生长代谢的影响图盐度对m1、m2和m3菌株的生长代谢的影响图分别见图3a-图3c,由图3a-3c可知,48h厌氧处理过程中,m1、m2和m3菌株具有一定的耐盐性,在高盐条件下仍具有良好的总氮能力,在2%的含盐量情况下的去除总氮效果略好于2.5%的含盐量。在相同的含盐量下,去除总氮能力的排序为:m3菌株>m2菌株>m1菌株,即m3菌株具有最好的耐盐性。2.4ph对m1、m2和m3菌株的生长代谢的影响图ph对m1、m2和m3菌株的生长代谢的影响图分别见图4a-图4c,由图4a-4c可知,48h厌氧处理过程中,在不同ph下,m1、m2和m3菌株均表现出较好的去除总氮能力,且ph7.5-8.5时去除总氮能力最好。在相同的ph下,去除总氮能力的排序为:m2菌株>m3菌株>m1菌株。2.5碳氮比(质量比)对m1、m2和m3菌株的生长代谢的影响图c/n比对细菌的物质和能量代谢影响很大,也是影响生物脱氮的主要因素之一,c/n比过高会降低硝化反应速率,c/n比过低会抑制反硝化反应进行。碳氮比(质量比)对m1、m2和m3菌株的生长代谢的影响图分别见图5a-图5c,对比不同碳氮比的去除总氮能力可以看出,碳氮比为2时,m1、m2和m3菌株的去除总氮能力明显优于碳氮比为3时,与预期效果相当。当c/n比为1时,反硝化速率较低,说明碳源不足,也就没有足够的能源供菌体生长,菌的反硝化效率也较低。当c/n比为2时,反硝化速率较高,说明碳源充足,菌体的生长速度快,菌体的反硝化能力强。在相同的碳氮比下,去除总氮能力的排序为:m2菌株>m3菌株>m1菌株。2.6接种量对m1、m2和m3菌株的生长代谢的影响图接种量对m1、m2和m3菌株的生长代谢的影响图分别见图6a-图6c,由图6a-6c可知,48h厌氧处理过程中,在不同接种量下,m1、m2和m3菌株均表现出较好的去除总氮能力,且接种量为质量百分比8%-12%时去除总氮能力最好。在相同的接种量下,去除总氮能力的排序为:m2菌株>m3菌株>m1菌株。由上述内容可知,从自然环境中分离得到的反硝化菌是野生型菌株,虽具有较好的去除总氮能力和耐盐性,但还达不到工业要求。人工诱变技术可以使细菌的基因发生突变,使脱氮性能得以提高。因此,为了得到性状优良的菌株,可以通过诱变来获得。综合考虑m1、m2和m3菌株的性能,发现m2菌株去除总氮能力最好,同时m3菌株具有最好的耐盐性。因此,选择m2和m3菌株作为原始出发菌株进行人工诱变。实施例3原生质体诱变育种研究1.试验方法再生培养基:在lb培养基基础上,增加2%琼脂,1.5%聚乙烯吡咯烷酮,0.46mol/l蔗糖,0.02mol/lmgcl2。高渗培养基:在lb培养基上补加0.8mol/lnacl。1.1原生质体的制备与再生1.1.1种子菌悬液的制备分别挑取1环m2和m3菌苔接入10ml富集培养液体培养基中,25℃下厌氧培养至对数期。培养24h后转接入200ml新鲜培养基,培养至对数生长期收集细胞,得种子菌悬液。1.1.2菌体原生质体制备分别取种子菌悬液100ml,经氨苄青霉素钠(下称氨苄钠)、酶解液、渗透压稳定液处理,制备原生质体,并接种于lb培养基和再生培养基,25℃恒温培养2d,分别计数菌落数,计算原生质体的制备率与再生率。每次实验按氨苄钠处理浓度、处理时间、溶菌酶处理浓度、酶解温度、酶解时间的顺序设置1个变量,当这一变量确定后则把下一处理设为变量,且下一试验以上一步最佳结果为前提,所有试验重复2次。1.1.2.1氨苄钠预处理浓度控制氨苄钠终浓度分别为20μg/ml、40μg/ml、80μg/ml、100μg/ml、120μg/ml,处理8h,1μg/ml的溶菌酶在40℃下酶解30min。1.1.2.2氨苄钠预处理时间将氨苄钠预处理时间分别设为2h、4h、6h、8h、10h,1μg/ml的溶菌酶在40℃下酶解30min。1.1.2.3溶菌酶浓度控制溶菌酶酶解液终浓度分别为0.5μg/ml、1μg/ml、1.5μg/ml、2μg/ml、2.5μg/ml,40℃,酶解30min。1.1.2.4酶解温度将溶菌酶酶解温度分别设为37℃、38℃、39℃、40℃、41℃、42℃,酶解30min。1.1.2.5酶解时间将溶菌酶酶解时间分别设为15min、30min、45min、60min、75min。1.1.3原生质体的再生(1)分别取0.5ml种子菌悬液,用无菌蒸馏水稀释成10-7,10-8,10-9三个浓度梯度,取0.1ml涂布lb培养基,生长出的菌落数计为a。(2)取0.5ml原生质体悬浮液,分别用无菌蒸馏水和原生质体渗透压稳定液稀释成10-7,10-8,10-9三个浓度梯度。分别吸取0.1ml蒸馏水稀释液涂布lb培养基,生长出的菌落数计为b;吸取0.1ml原生质体渗透压稀释液涂布再生培养基,生长出的菌落数计为c。(3)每个稀释度做三个平行,于30℃恒温倒置培养2-3d,统计不同处理条件下的菌落数,根据公式计算原生质体的制备率与再生率。制备率(%)=(a-b)/a×100%再生率(%)=(c-b)/(a-b)×100%1.1.4原生质体保存分别根据原生质体制备率与再生率最优制备条件制备m2和m3原生质体,4000r/min离心10min,弃上清液,原生质体渗透压稳定液洗涤离心2-3次,加入适量原生质体保存液,得原生质体悬浮液。1.1.5原生质体诱变育种1.1.5.1原生质体紫外线诱变分别取原生质体悬浮液10ml,放入玻璃培养皿中(内放无菌转子),置于磁力搅拌器上。用紫外灯(照射距离30cm)照射,诱变时间分别为10s、20s、30s、60s、120s、240s。用黑布包裹诱变后的培养皿,放入暗处2h后,4000r/min离心10min,弃上清液,原生质体渗透压稳定液洗涤离心2-3次,加入适量原生质体保存液,得紫外诱变的原生质体悬浮液,4℃保存。1.1.5.2原生质体紫外诱变后融合取紫外诱变后的m2原生质体悬浮液和m3原生质体悬浮液各5ml,用peg作融合剂进行融合。融合条件:peg35%,时间5min,ph值7.5,0.01mol/lcacl2。融合后取1ml菌悬液接种到高渗cm平板上,在恒温25℃培养48h观察结果。上述平板在25℃下恒温培养48h后,挑出生长成熟的融合菌株,接种到再生培养基上,融合菌株在25℃下培养72h后。分别挑取1环保存的诱变菌落接种到25ml反硝化培养基或含有nacl的反硝化培养基中,30℃,120r/min摇床培养,进行优良菌株的筛选。2.试验结果2.1原生质体制备条件2.1.1氨苄钠预处理浓度的影响分别向培养24h的m2和m3菌悬液中添加不同浓度的氨苄钠处理8h,1μg/ml的溶菌酶40℃酶解30min。菌体原生质体制备率和再生率结果如图7所示。从图7可以看出,氨苄钠质量浓度为40-80μg/ml时,m2原生质体制备率呈上升趋势,当氨苄钠终浓度为80μg/ml时,原生质体制备率和再生率达到最高,分别为50.45%、10.3%,当终浓度为120-200μg/ml范围时氨苄钠药效达饱和,原生质体制备率和再生率呈降低趋势。氨苄钠质量浓度为40-120μg/ml时,m3原生质体制备率和再生率随浓度的升高而升高,当氨苄钠终浓度为120μg/ml时,原生质体制备率和再生率达到最高,分别为90.61%、31.45%,当终浓度为160-200μg/ml范围时氨苄钠药效达饱和,原生质体制备率和再生率开始降低。选择氨苄钠质量浓度分别为80μg/ml、120μg/ml处理m2、m2原生质体菌悬液。2.1.2氨苄钠预处理时间的影响向培养至对数生长中后期的m2和m3菌悬液中分别加入质量浓度为80μg/ml、120μg/ml的氨苄钠,分别处理2h、4h、6h、8h、10h,加入1μg/ml的溶菌酶,40℃,酶解30min。菌体原生质体制备率和再生率结果如图8所示。从图8可见,m2和m3在2-6h内,m2在2-4h内原生质体制备率和再生率随着氨苄钠作用时间的延长势;当氨苄钠作用6h时,m2和m3原生质体制备率和再生率达到最高,m2为45.35%、11.23%,m3为86.61%、29.45%。当氨苄钠对m2和m3菌株的原生质体作用8-10h,菌体原生质体制备率和再生率达显著降低。说明使用80μg/ml氨苄钠处理菌株m2作用8h以上,使用120μg/ml氨苄钠处理菌株m3作用8h以上,氨苄钠对菌体原生质体可能造成一定的伤害,影响其释放和再生。因此选择氨苄钠对菌株m2和m3最佳作用时间分别为6h、6h。2.1.3溶菌酶浓度的影响菌悬液经氨苄钠处理,原生质体渗透压稳定液洗涤离心,pbs缓冲液悬浮后,分别加入0.5μg/ml、1μg/ml、1.5μg/ml、2μg/ml、2.5μg/ml溶菌酶酶解液,40℃,酶解30min,菌体原生质体制备率和再生率结果如图9所示。从图9可以看出,溶菌酶质量浓度对菌体原生质体的形成和再生具有不同影响。当溶菌酶质量浓度为0.5~1μg/ml时,m2和m3原生质体产量和再生率随酶浓的增加而升高,m2原生质体制备率和再生率最高分别为48.45%、11.20%,m3原生质体制备率和再生率最高分别为68.42%、42.01%;当酶浓≥2μg/ml时,原生质体产量和再生率随浓度的增加而降低。因此选择质量浓度为1μg/ml、1μg/ml溶菌酶液分别对m2和m3菌悬液进行处理。2.1.4酶解温度的影响菌悬液经预处理,分别于37℃、38℃、39℃、40℃、41℃、42℃条件下,酶解30min,菌体原生质体制备率和再生率结果如图10所示。从图10可以看出,m2原生质体制备率和再生率在溶菌酶酶解温度为37-40℃时逐渐升高,在41-42℃范围时逐渐降低。当酶解温度为40℃时,m2原生质体制备率和再生率分别为49.78%、12.23%。m3原生质体制备率和再生率在37-38℃时逐渐升高,在39-42℃时逐渐降低。当溶菌酶酶解温度为38℃时,原生质体制备率达到最高72.62%,原生质体再生率达到最高43.01%。因此,m2和m3选择溶菌酶最佳酶解温度为40℃、38℃进行后续试验。2.1.5酶解时间的影响菌悬液经前处理,溶菌酶作用时间分别为15min、30min、45min、60min、75min,菌体原生质体制备率和再生率结果如图11。从图11可以看出,m2在酶解45min时原生质体制备率和再生率最高,分别为53.76%,13.57%。m3酶解30min时原生质体制备率和再生率最高,分别为95.62%,42.01%;酶解60min时原生质体制备率和再生率略有降低。m2原生质体再生率明显小于m3。2.2菌体原生质体制备最佳条件取m2菌悬液100ml经80μg/ml氨苄钠预处理6h,原生质体渗透压稳定液洗涤离心,pbs缓冲液悬浮后,加入1μg/ml溶菌酶酶解液,40℃条件下,酶解45min,原生质体渗透压稳定液洗涤,涂布固体培养基培养48h,原生质体制备率和再生率分别为58.2%,11.6%。m2原生质体制备最佳条件为:120μg/ml氨苄钠预处理6h,1μg/ml溶菌酶38℃条件下,酶解30min,原生质体制备率和再生率分别为96.3%和41.8%。2.3优良菌株筛选2.3.1菌体致死率与紫外诱变时间的关系根据大量已报道的紫外诱变研究结果发现,当致死率在70%-80%时,既能扩大变异的幅度,又能促进变异趋向正突变。在本实施例中,当致死率在70%-80%范围时,m2菌株和m3菌株照射时间分别为100s和150s,致死率分别是78.9%和71.3%。2.3.2优良菌株的筛选测量生出的单菌落的直径,根据直径大小分别挑取出三株直径较大的单菌落,分别标记为y1、y2和y3,分别接种到斜面培养基上,4℃保存。对菌株y1、y2和y3进行去除总氮能力的测定,将菌株y1、y2和y3分别接种到25ml反硝化培养基中,血清瓶中30℃,120r/min摇床培养48h,定时取样,测定培养液中的总氮浓度。结果见图12。从图12中可以看出,在相同的时间内,菌株y1和y2相对于原始出发菌株m2和m3,去除总氮能力均有不同程度的提高,其中菌株y1的去除总氮能力高于菌株y2;菌株y3相对于原始出发菌株m2和m3,去除总氮能力有降低。对菌株y1、y2和y3进行耐盐性的测定,利用在反硝化固体培养基中添加2%、3%、4%和5%的nacl浓度逐级筛选耐盐性较好的菌株,结果见表1。表1注:“+”代表菌株在含盐平板上正常生长,“-”代表菌株在含盐平板上生长受抑制或基本不生长由表1可知,2%盐浓度下菌株y1、y2和y3以及原始出发菌株m2和m3都能很好的生长,盐浓度达到3%,菌株y3和m2不能正常生长,盐浓度达到4%,只有菌株y2能很好生长,盐浓度达到5%,所有菌株都不能正常生长。因此,菌株y2具有最好的耐盐性,可以耐4%的盐浓度。将菌株y1、y2和y3分别接种到含有2%nacl的25ml反硝化培养基中,血清瓶中30℃,120r/min摇床培养48h,定时取样,测定培养液中的总氮浓度。结果见图13。从图13中可以看出,在相同的含盐量(2.5%nacl)下,菌株y2相对于原始出发菌株m2和m3,去除总氮能力有提高,而菌株y1和y3相对于原始出发菌株m3,去除总氮能力有降低,因此,菌株y2具有最好的耐盐性。综合考虑菌株的去除总氮能力和耐盐性,本实施例选择菌株y2进行下一步的研究。对菌株y2进行传代培养,传5代,每一代均在培养48h时取样,考察菌株y2在高含盐量(2.5%nacl)下的去除总氮能力见图14。从图14中可以看出,菌株y2去除总氮能力比较稳定,遗传稳定性较好。实施例4菌株y2的鉴定1.1生物学特性鉴定将培养得到的菌落划线在分离纯化培养基上,将上述菌株放入25℃的培养箱培养,当细菌生长到对数期时,革兰氏染色后于高倍镜下观察菌体形态。研究表明,菌株y2没有芽孢,为革兰氏阴性菌,其形态特征都为杆状。1.2生理生化特征鉴定对培养得到的y2菌株进行明胶水解、m-r试验、吲哚试验、v-p试验、过氧化氢酶、淀粉水解、葡萄糖和乳糖等测定,以了解其生理生化特征。培养得到的菌株的硝酸还原性、反硝化性鉴定方法见《常见细菌系统鉴定手册》。y1菌株的生理生化试验结果见表2。表2y2菌株的生理生化特征鉴定项目y2菌株菌体形态杆状革兰氏染色-芽孢-明胶水解-m-r试验-吲哚试验-v-p试验-过氧化氢酶+淀粉水解+葡萄糖-乳糖-注:“-”代表阴性反应,“+”代表阳性反应1.3分子生物学鉴定采样细菌基因组dna提取试剂盒进行y1菌株总dna的提取,采用通用引物对培养得到的y1菌株的16srrna进行pcr扩增(上海生工生物工程技术有限公司合成),正向引物:5’-agagtttgatcctggctcag-3’,反向引物:5’-aaggaggtgatccagccgca-3’。pcr反应体系为:超纯水33.5μl、10×extaq缓冲液5.0μl、dntp(10mmol/l)2.0μl、上游引物2.0μl、下游引物2.0μl、模板dna5.0μl、extaq酶0.5μl,共计50μl。pcr的反应程序为:98.0℃预变性5min;80℃暂停;94℃变性45s,55℃退火30s,72℃延伸50s,35个循环;72℃延伸10min。采用通用引物对纯化的y1菌株进行16srdna扩增,扩增产物用1%琼脂糖凝胶电脉检测,溴化乙锭染色,紫外凝胶成像观察。以dnamarker为参照,对比marker的亮带,菌株在1500bp处出现亮带,回收特异条带进行测序。经16srrna基因比对,与松嫩假单胞菌(pseudomonassongnenensis)neau-st5-5(t)相似度最高,同源性为99.9%,命名为cpytp-1,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号,保藏日期为2019年8月22日,保藏编号为cgmccno.18409。实施例5菌株y2对高盐度废水的处理本实施例按照实施例2中的方法对菌株y2的培养条件进行优化,不同碳氮比的优化结果见表3。表3不同碳氮比下菌株y2去除总氮的能力由表3可知,菌株y2在较低的碳氮比下有较好的去除总氮的能力,最佳碳氮比范围为2-3,且在碳氮比为2时,其去除总氮的能力最好,在较低的碳氮比和较高的碳氮比条件下其去除总氮能力均不如碳氮比为2时。本实施例还对菌株y2的接种量、培养温度和ph值进行优化,结果表明,菌株y2的最佳接种量范围为8%-12%,最佳培养温度范围为25℃-30℃。接着本实施例在最佳的培养条件下考察菌株y2对高盐度废水去除总氮的能力,最佳培养条件为:碳氮比为2,接种量为10%,培养温度为25℃,ph7.5-8.5。反硝化培养基中,nano2为唯一氮源,ch3coona为唯一碳源,nacl含量为3%,do<0.1mg/l,初始no2—n为100mg/l,结果见表4。表4菌株y2去除总氮的能力总氮(mg/l)菌株y20h10012h78.3524h49.3636h0由表4可知,在最佳培养条件下,菌株y2在耐受3%盐度和微氧的情况下在36小时内总氮去除率可达100%。实施例6菌株y2在有氧条件下对高盐度废水的处理本实施例中菌株y2的培养条件为:碳氮比为2,接种量为10%,培养温度为25℃,ph7.5。反硝化培养基中,nano2为唯一氮源,ch3coona为唯一碳源,nacl含量为3%,do>7.0mg/l,初始no2—n为100mg/l,结果见表5。表5菌株y2在有氧条件下去除总氮的能力总氮(mg/l)菌株y20h10012h84.4424h68.2436h50.2448h33.25由表5可知,在最佳培养条件下,菌株y2在耐受3%盐度和有氧的情况下在48小时内总氮去除率可达66.75%。即使在充分曝气好氧条件下,菌株y2也具有一定的去除总氮的能力。菌株y2在厌氧条件下具有更好的去除总氮的能力,虽然在充分曝气好氧条件下,菌株y2去除总氮的能力有一定程度的降低,但也具有一定的去除总氮的能力,这说明本实施例的菌株y2是兼性厌氧菌。实施例7菌株y2对高盐度废水中尼泊金甲酯的处理本实施例中菌株y2的培养条件为:碳氮比为2,接种量为10%,培养温度为25℃,ph8。反硝化培养基中,kno3为唯一氮源,ch3coona为唯一碳源,nacl含量为3%,do<0.1mg/l,初始尼泊金甲酯浓度为200mg/l,结果见表6和图15。其中,尼泊金甲酯的测定采用反相高效液相色谱法,色谱仪:agilent1100,色谱柱:c18柱,流动相:甲醇:水=70:30,流速:1.0ml/min,检测器:紫外检测器254nm。表6菌株y2去除尼泊金甲酯菌株y2菌株m2菌株m3菌株尼泊金丁酯(mg/l)尼泊金丁酯(mg/l)尼泊金丁酯(mg/l)0h20020020012h185.35172.35185.8024h157.24143.24163.6436h124.25113.25152.4548h92.2385.23150.45由表6和图15可知,原始出发菌株m2具有较好的降解尼泊金甲酯的能力,原始出发菌株m3具有较弱的降解尼泊金甲酯的能力,菌株y2相对于原始出发菌株m2,降解尼泊金甲酯的能力有所降低,由57.38%降低至53.88%,但降低的程度不大,依然能够有效降解尼泊金甲酯。这说明本实施例的菌株y2在耐受3%盐度和微氧的情况下在48小时内能够有效降解尼泊金甲酯。实施例8菌株y2在实际生活污水中的应用将菌株y2按照0.8%的投菌量(相对于悬浮固体的量)添加到厦门市某污水厂厌氧段污水中进行脱氮处理。进行水质为:总氮为22.34mg/l,化学需氧量113.71mg/l,25℃脱氮处理36h后,未投加菌株y的对照组总氮去除率为75.87%,投加菌株y2后总氮去除率为98%。与对照组相比,菌株y2可明显提高氨氮的去除效率。所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。本发明的实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1