一种β-烟酰胺单核苷酸的工艺制备方法与流程
本发明涉及化学合成领域,具体涉及一种β-烟酰胺单核苷酸的工艺制备方法。
技术背景
β-烟酰胺单核苷酸(nmn)是人体固有的物质之一,在人体细胞能量生成中扮演重要角色,它参与细胞内nad(烟酰胺腺嘌呤二核苷酸,细胞能量转化的重要辅酶)的合成,在细胞的能量代谢中起到关键的作用,同时被用于抗衰老研究,目前国外正对β-烟酰胺单核苷酸(nmn)的抗衰老效果和安全性进行人体临床试验。同时研究表明,β-烟酰胺单核苷酸(nmn)对胰岛素的分泌也能起到调节作用,对mrna的表达水平也有影响,因此β-烟酰胺单核苷酸(nmn)在医疗治疗领域有着广泛的应用前景。
目前文献报道的β-烟酰胺单核苷酸(nmn)的化学合成方法主要有三种。
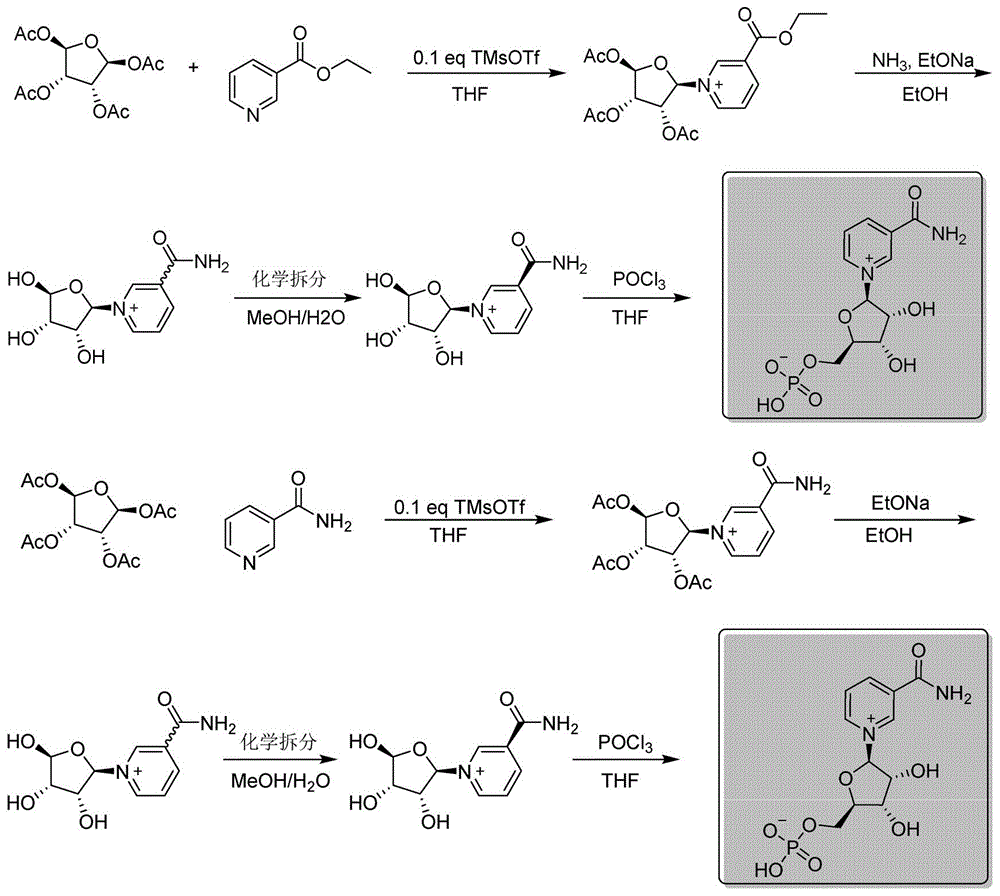
第一种方法:journalofmedicinalchemistry,2007,50,6458-6461;angewandtechemieinternationaledition,2004,43,4637-4640,以四乙酰核糖和烟酸乙酯为起始物料,经缩合、脱乙酰保护基、氨解、活性炭色谱分离和磷酸化等主要工艺步骤,其合成路线如下:
第二种方法:bioorganicandmedicinalchemistryletters2002,12,1135-1137,以四乙酰核糖和烟酰胺为起始物料,经缩合、脱乙酰保护基、活性炭色谱分离和磷酸化等主要工艺步骤,其合成路线如下:
第三种方法:公布号为cn109053838a的发明专利申请,公开了制备β-烟酰胺单核苷酸或β-烟酰胺单核糖的方法,具体公开了以四乙酰核糖和烟酸乙酯为起始物料,经缩合、脱乙酰保护基、磷酸化、氨解化等主要工艺步骤,其合成路线如下:
前两条路线存在收率低、反应纯化难、工艺放大难,中间体消旋体拆分和纯化都采用活性炭色谱分离、得到的β-烟酰胺单核苷酸质量不可控等问题,且都只能用于实验室极小规模的合成,第三条路线即公布号为cn109053838a的发明专利申请并没涉及到中间体手性拆分的过程,得到的中间体和产品均为消旋体,得到的最终产品β-烟酰胺单核苷酸中含有手性异构杂质在医疗治疗领域存在极大的安全性问题,不能应用于医疗治疗领域。
此外专利报道这种化合物的生物合成方法主要有一种,以核糖、烟酰胺、三磷酸苷二钠盐为原料,在缓冲溶液(磷酸缓冲盐溶液)中通过催化酶(糖激酶和烟酰胺核糖磷酸转移酶)作用(通过金属镁离子促使催化酶发生生物催化活性),最后通过过滤、大孔树脂吸附和重结晶得到β-烟酰胺单核苷酸(nmn),此方法提供了一种工业化批量生产β-烟酰胺单核苷酸(nmn)的方法,但目前可用于工业化应用的生物催化剂还太少;生物催化剂开发的周期较长;生物催化剂在反应介质中往往不稳定,易受热、受某些化学物质及杂菌的破坏而失活;稳定性较差,反应时的温度和ph范围要求较高,使用寿命较短等缺点。
目前β-烟酰胺单核苷酸(nmn)的获取一般只能通过实验室合成,在工业化批量生产的方法上有其局限性,一方面消旋体的分离纯化采用的是活性炭柱色谱分离的方法,成本极高且分离纯化的规模较小,限制了其工业化生产的可行性;另一方面在物料和试剂的选择方面,如缩合反应选用的催化剂用量较大,很容易残留到后续的产品中,而甲磺酸类物质属于基因毒性物质,对产品应用产生极大的安全性问题,里面用到的许多溶剂如1,2-二氯乙烷属于第一类溶剂,属于药物中严格控制的溶剂、1,4-二氧六环属于基因毒性物质等,限制了β-烟酰胺单核苷酸(nmn)在多个方面的推广。因此找到一种质量安全可控,适用于工业化批量生产的制备方法显得尤为重要。
技术实现要素:
为了解决现有技术中β-烟酰胺单核苷酸工业化批量生产可行性、制备得到β-烟酰胺单核苷酸的质量安全可控性和β-烟酰胺单核苷酸的结构鉴定的技术问题,本发明提供一种β-烟酰胺单核苷酸的工艺制备方法,包括包括以下步骤:
s1、缩合:以四乙酰核糖、烟酸胺或烟酸乙酯做为起始物料,在溶剂中经催化剂作用进行缩合反应得到含有烟酸乙酯三乙酰核苷或烟酰胺三乙酰核苷的溶液;
s2、氨解和脱保护:将步骤s1中含有烟酸乙酯三乙酰核苷的溶液先通入氨气进行氨解,再加入有机碱脱去乙酰基,含有烟酰胺三乙酰核苷的溶液直接加入有机碱脱去乙酰基,反应结束后经处理得到中间体烟酰胺核糖;
s3、化学拆分:中间体烟酰胺核糖为消旋体,在溶剂中经化学试剂拆分、重结晶、除盐后得到β-烟酰胺核糖;
s4、磷酸化:将步骤s3中经拆分得到的β-烟酰胺核糖在溶剂中经三氯氧磷磷酸化后,先经有机溶剂萃取除杂,除杂后的水层再过离子交换树脂除盐,最后水溶液冻干得到β-烟酰胺单核苷酸。
进一步的,所述步骤s1中:
a)催化剂为tmscl、tmsbr、tmsotf中的任意一种;
b)物料摩尔比,四乙酰核糖:烟酸胺或烟酸乙酯:催化剂为1:1:0.1~1:1.1:0.1;
c)反应溶剂为二氯甲烷、四氢呋喃、乙腈中任意一种;
d)溶剂与四乙酰核糖的体积质量比为3~5ml/g;
e)缩合反应温度为0℃~25℃,催化剂加入温度为0℃~5℃;
f)缩合反应时间以tlc监控四乙酰核糖消失为止,为12h~14h。
进一步的,反应结束后,控温0℃~5℃加入0.2~0.3当量的三乙胺用于完成破坏催化剂的淬灭反应。
进一步的,所述步骤s2中:
a)烟酸乙酯三乙酰核苷氨解温度为-5℃~5℃,氨解时间以tlc监控烟酸乙酯三乙酰核苷消失为止,为1h~1.5h;
b)脱保护的有机碱为乙醇钠或甲醇钠的中任意一种,溶剂为乙醇或甲醇,溶解后加入反应液中,溶剂与有机碱的体积质量比为10ml/g;
c)烟酸乙酯三乙酰核苷和烟酰胺三乙酰核苷与有机碱的摩尔比均为1:2~1:3;
d)烟酸乙酯三乙酰核苷和烟酰胺三乙酰核苷脱保护反应温度为-5℃~5℃;
e)烟酸乙酯三乙酰核苷脱保护反应时间以tlc监控烟酸乙酯三乙酰核苷消失为止,为1h~1.5h;烟酰胺三乙酰核苷脱保护反应时间以tlc监控烟酰胺三乙酰核苷消失为止,为1h~2h。
进一步的,反应完,反应液中先加入1mol/l盐酸淬灭多余的有机碱,控制ph为5~6,再加入甲基叔丁基醚、异丙醇和叔丁醇中任意一种搅拌析晶,析晶温度为-5℃~5℃。
进一步的,所述步骤s3中:
a)化学试剂为(s)-(-)-alpha-甲苄基异氰酸酯;
b)烟酰胺核糖与拆分化学试剂(s)-(-)-alpha-甲苄基异氰酸酯摩尔比为1:1~1:1.5;
c)溶剂为甲醇与水的混合溶剂,甲醇与水体积比为2:1~1:1,溶剂与烟酰胺核糖的体积质量比为10ml/g;
d)拆分条件:加热回流后冷却析晶,重复此操作3~4次。
进一步的,得到的β-烟酰胺核糖的(s)-(-)-alpha-甲苄基异氰酸酯盐用甲醇与水的混合溶剂再重结晶一次后,将其加入乙酸乙酯或二氯甲烷中,并加入1mol/l的氢氧化钠水溶液,剧烈搅拌后,除去有机层,水层采用离子交换树脂除盐后再冻干得β-烟酰胺核糖。
进一步的,所述步骤s4中:
a)β-烟酰胺核糖与三氯氧磷的摩尔比为1:1.5~1:2;
b)溶剂为四氢呋喃和乙腈中的任意一种;
c)溶剂与β-烟酰胺核糖的体积质量比为5~6ml/g;
d)反应温度为0℃~25℃,三氯氧磷加入温度为0℃~5℃;
e)反应时间以hplc监控β-烟酰胺核糖消失为止,为12h~16h。
进一步的,反应后处理,控制温度为-5℃~5℃,将反应液缓慢倒入常温水中先淬灭三氯氧磷,再将反应析出的固体用水溶解,加入乙酸乙酯,搅拌,除去乙酸乙酯层,水层采用离子交换树脂除盐后冻干得到β-烟酰胺单核苷酸。
本发明的有益效果是:
1、本发明以四乙酰核糖和烟酸胺或烟酸乙酯为起始物料,经缩合、脱乙酰保护基(氨解)、化学拆分和磷酸化等主要工艺步骤,通过优化工艺方法,提供了一种β-烟酰胺单核苷酸(nmn)工业化批量生产的制备方法;
2、本发明在原有工艺路线基础上做出改进,对所选物料和试剂、物料量的控制等方面做出优化,相对于原有制备工艺,使其具有操作简单、易工艺放大、收率较高、最终产品质量可控和安全性可控等的优点,具体包括:
(1)、化学拆分:脱保护后得到的中间体烟酰胺核糖为消旋体,需要进行拆分以得到单一构型的中间体和最终产品,原有工艺大都采用活性炭柱色谱分离或干脆不进行拆分,这导致成本极高、规模较小或不能应用于医疗治疗领域,本发明采用化学试剂进行拆分,提供了一种工业化批量生产的制备方法。
(2)、杂质控制:催化剂为三氟甲磺酸酯属于基因毒性杂质,基因毒性杂质属于药物应用中需要严格控制的杂质类型:
a)三氟甲磺酸酯用量控制在0.1当量;
b)缩合反应完后采用一定量的三乙胺淬灭三氟甲磺酸酯;
c)经多步处理(如重结晶、有机溶剂萃取、水溶液过离子交换树脂等操作)。
经以上优化后三氟甲磺酸酯残留到β-烟酰胺单核苷酸(nmn)中的可能性极低。
(3)、溶剂残留:溶剂选用避免一类高风险溶剂1,2-二氯乙烷和基因毒性杂质溶剂1,4-二氧六环等:
a)溶剂选用乙腈、二氯甲烷、乙酸乙酯、四氢呋喃、甲醇和乙醇等;
b)重结晶溶剂选用甲基叔丁基醚、异丙醇和叔丁醇;
c)拆分后得到的β-烟酰胺核糖和磷酸化后得到的β-烟酰胺单核苷酸(nmn)经处理后都存在于水溶液中,经离子交换树脂除盐后直接冻干,不涉及有机溶剂残留。
3、本发明对得到的β-烟酰胺单核苷酸(nmn)进行结构鉴定,并对谱图进行解析,确保得到的产品与β-烟酰胺单核苷酸的化学结构相符,结构正确。
a)氢谱与氢氢相关谱,主要包括:1hnmr、hcosy、noesy;
b)碳谱与碳氢相关谱,主要包括:13cnmr、dept135、hsqc、hmbc;
附图说明
图1为本发明β-烟酰胺单核苷酸的合成工艺路线图。
图2为本发明β-烟酰胺单核苷酸的结构鉴定相关谱图,(a)1hnmr-nmn;(b)13cnmr-nmn;(c)dept135-nmn;(d)hcosy-nmn;(e)hmbc-nmn;(f)hsqc-nmn;(g)noesy-nmn。
图3为本发明β-烟酰胺单核苷酸的结构图。
具体实施方式
下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域的技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。
本发明具体实施方式采用以下技术方案:如图1所示,包括以下步骤:
s1、缩合:以四乙酰核糖、烟酸胺或烟酸乙酯做为起始物料,在溶剂中经催化剂作用进行缩合反应得到含有烟酸乙酯三乙酰核苷或烟酰胺三乙酰核苷的溶液;其中
a)催化剂为tmscl、tmsbr、tmsotf中的任意一种;
b)物料摩尔比,四乙酰核糖:烟酸胺或烟酸乙酯:催化剂为1:1:0.1~1:1.1:0.1;
c)反应溶剂为二氯甲烷、四氢呋喃、乙腈中任意一种;
d)溶剂与四乙酰核糖的体积质量比为3~5ml/g;
e)缩合反应温度为0℃~25℃,催化剂加入温度为0℃~5℃;
f)缩合反应时间以tlc监控四乙酰核糖消失为止,为12h~14h。
反应结束后,控温0℃~5℃加入0.2~0.3当量的三乙胺淬灭反应(淬灭催化剂),得到烟酸乙酯三乙酰核苷或烟酰胺三乙酰核苷的溶液无需再进行处理可直接用于下一步反应。
s2、氨解和脱保护:将步骤s1中含有烟酸乙酯三乙酰核苷的溶液先通入氨气进行氨解,再加入有机碱脱去乙酰基,含有烟酰胺三乙酰核苷的溶液直接加入有机碱脱去乙酰基,反应结束后经处理得到中间体烟酰胺核糖;其中
a)烟酸乙酯三乙酰核苷氨解温度为-5℃~5℃,氨解时间以tlc监控烟酸乙酯三乙酰核苷消失为止,为1h~1.5h;
b)脱保护的有机碱为乙醇钠或甲醇钠的中任意一种,溶剂为乙醇或甲醇,溶解后加入反应液中,溶剂与有机碱的体积质量比为10ml/g;
c)烟酸乙酯三乙酰核苷和烟酰胺三乙酰核苷与有机碱的摩尔比均为1:2~1:3;
d)烟酸乙酯三乙酰核苷和烟酰胺三乙酰核苷脱保护反应温度为-5℃~5℃;
e)烟酸乙酯三乙酰核苷脱保护反应时间以tlc监控烟酸乙酯三乙酰核苷消失为止,为1h~1.5h;烟酰胺三乙酰核苷脱保护反应时间以tlc监控烟酰胺三乙酰核苷消失为止,为1h~2h。
反应完,反应液中先加入1mol/l盐酸淬灭多余的有机碱,控制ph为5~6,再加入甲基叔丁基醚、异丙醇和叔丁醇中任意一种搅拌析晶,析晶温度为-5℃~5℃;析晶出的固体里含有少量无机盐氯化钠和氯化铵,无需要除去。
s3、化学拆分:中间体烟酰胺核糖为消旋体,在溶剂中经化学试剂拆分、重结晶、除盐后得到β-烟酰胺核糖;其中
a)化学试剂为(s)-(-)-alpha-甲苄基异氰酸酯;
b)烟酰胺核糖与拆分化学试剂(s)-(-)-alpha-甲苄基异氰酸酯摩尔比为1:1~1:1.5;
c)溶剂为甲醇与水的混合溶剂,甲醇与水体积比为2:1~1:1,溶剂与烟酰胺核糖的体积质量比为10ml/g;
d)拆分条件:加热回流后冷却析晶,重复此操作3~4次。
得到的β-烟酰胺核糖的(s)-(-)-alpha-甲苄基异氰酸酯盐用甲醇与水的混合溶剂再重结晶一次后,加入有机溶剂(乙酸乙酯、二氯甲烷)中,加入1mol/l的氢氧化钠水溶液,剧烈搅拌后,除去有机层,水层采用离子交换树脂除盐后再冻干得β-烟酰胺核糖。
s4、磷酸化:将步骤s3中经拆分得到的β-烟酰胺核糖在溶剂中经三氯氧磷磷酸化后,先经有机溶剂萃取除杂,除杂后的水层再过离子交换树脂除盐,最后水溶液冻干得到β-烟酰胺单核苷酸;其中
a)β-烟酰胺核糖与三氯氧磷的摩尔比为1:1.5~1:2;
b)溶剂为四氢呋喃和乙腈中的任意一种;
c)溶剂与β-烟酰胺核糖的体积质量比为5~6ml/g;
d)反应温度为0℃~25℃,三氯氧磷加入温度为0℃~5℃;
e)反应时间以hplc监控β-烟酰胺核糖消失为止,为12h~16h。
反应后处理,控制温度为-5℃~5℃,将反应液缓慢倒入常温水中先淬灭三氯氧磷,再将反应析出的固体用水溶解,加入乙酸乙酯,搅拌,除去乙酸乙酯层,水层采用离子交换树脂除盐后冻干得到β-烟酰胺单核苷酸。
具体的
1、烟酸乙酯三乙酰核苷或烟酰胺三乙酰核苷的合成
a)烟酸乙酯三乙酰核苷的合成
2l三口瓶中依次加入四乙酰核糖(100g,328.68mmol)和四氢呋喃(300ml),室温搅拌溶解后,再加入烟酸乙酯(49.68g,328.68mmol),搅拌均匀,控温0℃~5℃,滴加三氟甲磺酸三甲基硅酯(tmsotf,7.3g,32.87mmol),滴加过程反应液放热,滴加完毕,自然升至室温反应12小时后取样进行tlc检测,tlc监控原料四乙酰核糖反应完全后,将反应液冷却,控温0℃~5℃,滴加三乙胺(6.65g,65.74mmol),滴加完毕,控温0℃~5℃搅拌1小时以确保tmsotf淬灭完全,停止搅拌,自然升至室温后得到含有烟酸乙酯三乙酰核苷的溶液,该溶液无需处理直接用于下一步反应。
b)烟酰胺三乙酰核苷的合成
2l三口瓶中依次加入四乙酰核糖(100g,328.68mmol)和四氢呋喃(300ml),室温搅拌溶解后,再加入烟酸胺(40.14g,328.68mmol),搅拌均匀,控温0℃~5℃,滴加三氟甲磺酸三甲基硅酯(tmsotf,7.3g,32.87mmol),滴加过程反应液放热,滴加完毕,自然升至室温反应12小时后取样进行tlc检测,tlc监控原料四乙酰核糖反应完全后,将反应液冷却,控温0℃~5℃,滴加三乙胺(6.65g,65.74mmol),滴加完毕,控温0℃~5℃搅拌1小时以确保tmsotf淬灭完全,停止搅拌,自然升至室温后得到含有烟酰胺三乙酰核苷的溶液,该溶液无需处理直接用于下一步反应。
2、烟酰胺核糖的合成
a)烟酰胺核糖的合成
控温-5℃~5℃向含有烟酸乙酯三乙酰核苷的溶液中通入氨气,反应液放热,通氨气约1小时后取样进行tlc检测,tlc监控烟酸乙酯三乙酰核苷反应完全后,停止通气,控温-5℃~5℃,滴加乙醇钠溶液(由44.73g乙醇钠溶解于447ml乙醇中制得),滴加过程反应液放热,滴加完毕,控温-5℃~5℃反应1小时后取样进行tlc检测,tlc监控烟酰胺三乙酰核苷反应完全后,控温-5℃~5℃滴加盐酸(约100ml)酸化反应液ph值为5~6,减压脱溶除去约2/3的溶剂,控温-5℃~5℃缓慢加入1l甲基叔丁基醚,加完,保持-5℃~5℃搅拌析晶1小时,过滤,滤饼室温下真空干燥得白色或浅灰色固体58.6g(含有少量氯化钠和氯化铵固体),前两步收率为74%。
b)烟酰胺核糖的合成
控温-5℃~5℃,向含有烟酰胺三乙酰核苷的溶液中滴加乙醇钠溶液(由44.73g乙醇钠溶解于447ml乙醇中制得),滴加过程反应液放热,滴加完毕,控温-5℃~5℃反应1小时后取样进行tlc检测,tlc监控烟酰胺三乙酰核苷反应完全后,控温-5℃~5℃滴加盐酸(约100ml)酸化反应液ph值为5~6,减压脱溶除去约2/3的溶剂,控温-5℃~5℃缓慢加入1l甲基叔丁基醚,加完,保持-5℃~5℃搅拌析晶1小时,过滤,滤饼室温下真空干燥得白色或浅灰色固体61.8g(含有少量氯化钠固体),前两步收率为78%。
3、β-烟酰胺核糖的合成
2l三口瓶中依次加入烟酰胺核糖(100g,414.56mmol)和甲醇/水的混合溶剂(1l,甲醇:水=2:1),室温加入(s)-(-)-alpha-甲苄基异氰酸酯(61.01g,414.56mmol),加热回流使其溶解后,自然冷却析出白色晶体,重复此操作三次,得到β-烟酰胺核糖的(s)-(-)-alpha-甲苄基异氰酸酯盐后,再用甲醇/水的混合溶剂(400ml,甲醇:水=2:1)重结晶一次得白色固体盐,将得到的固体盐加入乙酸乙酯(400ml)中,加入1mol/l的氢氧化钠水溶液(500ml),剧烈振荡萃取,除去乙酸乙酯层,水层再加入乙酸乙酯(250ml),搅拌,除去乙酸乙酯层,水层经离子交换树脂除盐后得β-烟酰胺核糖水溶液,β-烟酰胺核糖水溶液最后冻干得白色固体β-烟酰胺核糖42.2g,拆分收率为42%。
4、β-烟酰胺单核苷酸的合成
三口反应瓶中依次加入β-烟酰胺核糖(40g,465.82mmol)和四氢呋喃(200ml),冰浴降温至0℃~5℃,控温5℃以下缓慢滴加三氯氧磷(38.14g,248.73mmol),滴加过程放热,滴加完全,自然升至室温反应12小时后取样进行hplc检测,hplc监控β-烟酰胺核糖反应完全后,停止反应,控温0℃~5℃,将反应液缓慢倒入常温水(1l)中淬灭多余的三氯氧磷,反应析出的固体逐渐溶解,加完,加入乙酸乙酯(400ml),搅拌,除去乙酸乙酯层,水层再加入乙酸乙酯(200ml),搅拌,除去乙酸乙酯层,水层经离子交换树脂除盐后得β-烟酰胺单核苷酸水溶液,β-烟酰胺单核苷酸水溶液最后冻干得白色固体β-烟酰胺单核苷酸31.4g,收率为56%。
5、β-烟酰胺单核苷酸的结构鉴定,如图3所示,
表1β-烟酰胺单核苷酸的氢谱测定结果
解析:由图2(a)、(d)、(g)和表1可知,1hnmr共给出9组谱峰,这些谱峰的积分面积之比(由低场至高场)为1:1:1:1:1:2:1:1:1,共有10个质子,因为是以氘水做溶剂,活泼氢不出峰,与β-烟酰胺单核苷酸非活泼质子数相符,由化学位移值、偶合常数值和各种二维谱可知:
a:δ3.99(m,1h)和4.12(m,1h)为次甲基质子,由hcosy和noesy可知,彼此相关联,分别属于h10与h7;
b:δ4.27(m,1h)和6.05(m,1h)为次甲基质子,由hcosy和noesy可知,彼此相关联,分别属于h9与h8,δ4.39,4.46(d,j=28.8hz,2h)为亚甲基质子,由hcosy和noesy可知,与h8彼此相关联,属于h11;
c:δ8.14(m,1h)、8.81(m,1h)和9.12(m,1h)为次甲基质子,由hcosy和noesy可知,分别属于h2、h1和h3,h2分别与h1和h3彼此相关联;
d:δ9.28(s,1h)为次甲基质子,为单峰,由hcosy可知,属于h4。
表2β-烟酰胺单核苷酸的碳谱测定结果
解析:由图2(b)、(c)、(e)、(f)和表2可知,除溶剂峰外共有11组碳谱峰,β-烟酰胺单核苷酸分子中含11个碳原子,与碳谱峰相符合,根据氢谱归属的结果,并结合dept谱和各种二维谱可知:
a:结合dept135谱可知,本品含有1个仲碳,8个季碳;
b:δ64.12为仲碳,由hsqc谱可知,归属为c11;
c:δ70.90、δ77.66、δ87.32,87.27、δ99.90、δ133.99为叔碳,由hsqc和hmbc谱可知,分别归属为c10、c7、c9和c8;
d:δ128.50,δ139.80、δ142.42、δ145.91为叔碳,由hsqc谱和hmbc谱可知,分别归属为c2、c4、c3和c1;
e:δ133.86,δ165.79为季碳,由hsqc谱和hmbc谱可知,分别归属为c5、和c6。
至此所有碳氢信号均已归属,化学位移、裂分情况以及相关情况,核磁(nmr)数据与β-烟酰胺单核苷酸的化学结构相符。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其他修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!