制备二炔及其类似物的方法与流程
本发明属于精细化工产品催化合成领域,具体涉及一种制备二炔类化合物的方法。
背景技术:
炔基作为有机化学中最基本的反应单元之一,能参与多种类型的反应。而炔烃化合物亦由此被广泛应用于现代有机合成,药物化学,材料化学等领域(diederich.f.;stang.p.j.;tykwinski,r.r.acetylenechemistry:chemistry,biologyandmaterialscience.wiley-vch,weinheim.2005)。
相比于单一的炔烃而言,二炔可以同步或分步的提供2-4个碳原子参与反应,因此也具有更多的可设计性,在各类有机反应中得到广泛应用。其中1,3-二炔类化合物两个炔基共轭,这也使得它的结构和电性与单炔相比有所不同,因此也产生了不同的反应性。单炔基参与的反应可用来构建炔基取代的化合物,用于进一步修饰等(gevorgyan,v.;takeda,a.;yamamoto,y.j.am.chem.soc.1997,119,11313)。两个炔基都参与的反应则可被用于构建呋喃,吡咯,吡唑,噻吩,噻咯等各类有机杂环分子(shi,w.;lei,a-w.tetrahedronletters.2014,55,2763;kramer,s.;madsen,j.l.h.;rottlander,m.;skrydstrup,t.org,lett.2010,12,2758;wang,l.;yu,x.;feng,x.;bao,m.j.org.chem.2013,78,1693)。而1,4-二炔类化合物早在1950年开始,就被广泛用作多元不饱和脂肪酸及其衍生物的构筑单元(durand,s.;parrain,j.l.;santelli,m.j.chem.soc.,perkintrans.1,2000,253),当1,4-二炔的三号位碳原子连接有其他取代基时,也可用于构建吡咯,吡啶,呋喃以及呋喃酮等结构(wang,t.;shi,s.;hansmann,m.m.;hashmi,a.s.k.angew.chem.,int.ed.2014,53,3715;xu,y.l.;teng,q.h.;ma,x.l.molecules.2017,22,109;hsu,y.c.;hsieh,s.a.;li,p.h.;liu,r.s.chem.commun.2018,54,2114.),当1,4-二炔三位为亚甲基时,在金催化下与吡咯可通过两次氢芳基化反应构建环庚三烯并吡咯骨架结构(hamada,n.;yoshida,y.;oishi,s.;ohno,h.org.lett.2017,19,3875)。1,5-,1,6-二炔等除了用于杂环类骨架的构建外,还可以用于碳环及各类并多环骨架的构建(wurm,t.;bucher,j.;hashmi,a.s.k.angew.chem.,int.ed.2017,56,3364;yoshizaki,s.;shibata,y.;tanaka,k.angew.chem.,int.ed.2017,56,3590),同时,如果使用手性配体过度金属催化剂进行反应还可以构建手性环状骨架,而这也成为了许多天然产物,药物分子中间体合成的有效手段(kashima,k.;teraoka,k.;uekusa,h.;shibata,y.;tanaka,k.org.lett.2016,18,2170)。
由于各类二炔类化合物在有机合成中多样的应用,其合成方法一直受到有机化学家们的关注。1,3-二炔,尤其是不对称1,3-二炔是其中一类重要化合物,传统方法主要包括glaser-hay偶联以及cadiot-chodkiewicz偶联(siemsen,p.;livingston,r.c.;diederich,f.angew.chem.,int.ed.2000,39,2632;shi,w.;luo,y.;luo,x.;chao,l.;zhang,h.;wang,j.;lei,a.j.am.chem.soc.2008,130,14713)。但是cu或ni催化的glaser-hay偶联反应由于炔烃自偶联副反应的发生,往往需要一个炔烃大大过量;cadiot-chodkiewicz偶联反应则需要将一种端炔预先官能团化成炔基溴参与反应,而炔基溴类化合物并不稳定。近年来也有一些方法可以高效的合成不对称1,3-二炔,但又需要昂贵的金催化剂以及额外的配体(peng,h.;xi,y.;shi,x.j.am.chem.soc.2014,136,13174)。对于1,4-二炔,3位有氧,氮等杂原子取代基的化合物合成已经有了一些报道(qiu,y.f.;yang,f.;liang,y.m.j.org.chem.2013,78,12018)。而对于3位无取代的或是连接有烷基基团的1,4-二炔合成方法则多是来自于合成不饱和脂肪酸的路线,早期多采取炔丙基卤代物与炔基格式试剂进行反应,而这样不仅需要提前制备炔基格式试剂,对反应条件要求也较严格。随后也发展出了各类炔丙基化合物与炔基金属化物如炔基锂,炔基铝,炔基铜酸盐等的反应,有的反应也可以在铜催化下完成,但这些反应原子经济性依旧较低(tedeschi,c.;saccavini,c.;chauvin,r.j.organomet.chem.2003,670,151)。1992年,jeffery等报道了一个炔丙基卤化物与端炔偶联制备烷基3位无取代的1,4-二炔的方法,该方法使用了当量的cui/na2co3,并添加了[n-bu4n][cl]以提高产率,以此避免了用强碱性的烷基金属试剂拔炔氢,同时反应的原子经济性也得到了很大提高(jeffery,t.;gueugnot,s.;linstrumelle,g.tetrahedronlett.1992,33,5757)。而随后也有许多对该方法的改进并迅速应用到了不饱和脂肪酸,信息素等分子的合成中,不过当量甚至过量金属盐的使用仍是一个问题;其次上述方法多用于烷基1,4-二炔,芳基1,4-二炔的合成还亟需解决。由于以上各类方法中仍存在着不同问题,因此,开发一个更为便捷,高效,绿色的二炔合成技术成为人们探索的目标,这其中涉及两个问题:一是如何减少金属盐的使用使之更加绿色,二是如何将1,4-二炔的合成方法应用到芳基上,进行1,5-二芳基-1,4-二炔的构建。
技术实现要素:
本发明的目的是提供一种制备二炔及其类似物的方法。
本发明提供的制备式ⅰ,式ⅱ,式ⅲ所示化合物(也即二炔及其类似物)的方法,包括下述步骤:将式ⅳ所示炔丙基溴类化合物、式ⅴ所示炔烃化合物、碱及催化剂混匀进行反应,反应完毕得到式ⅰ所示化合物或式ⅱ所示化合物或式ⅲ所示化合物;
制备所述式ⅰ所示化合物,所述式ⅴ中,n=0;所述式ⅳ和式ⅴ中r1、r3独立的选自苯基、含取代基的苯基或杂环基;所述取代基优选p-甲基、o-甲基、m-甲基或4-氟,所述杂环具体可为噻吩基或吡咯基;所述式ⅳ中的r2为氢原子或烷基,所述烷基具体可为c1-c4烷基,优选为甲基。
制备所述式ⅱ所示化合物,所述式ⅴ中,n=0;所述式ⅳ中的r2为氢原子;当所述式ⅳ中r1为烷基,所述式ⅴ中r3为芳基时,1,3-二炔与r3相连,所述r1具体可为c1-c6烷基,优选乙基,r3优选苯基或4-氟苯基;当式ⅳ中r1为芳基,所述式ⅴ中r3为烷基或含取代基的烷基时,1,3-二炔与r1相连,所述r1优选苯基或4-me苯基,所述r3中的烷基为c1-c6烷基,r3优选苯基甲基、环己基或正丙基。
制备所述式ⅲ所示化合物,所述式ⅴ中,n=1或2或3;所述式ⅳ和式ⅴ中r1、r3独立的选自苯基或含取代基的苯基,所述取代基可选自p-甲基、o-甲基、m-甲基或4-氟;所述r1、r3优选为苯基;所述式ⅳ中的r2为芳基或烷基,所述芳基可为苯基,所述烷基具体可为c1-c4烷基,优选为甲基。
上述方法中,所述碱可选自下述至少一种:碳酸钾、磷酸氢二钾和磷酸钾,优选磷酸钾。
上述方法中,所述催化剂为一价铜催化剂,具体可为cui或cubr,优选cubr。
上述方法中,所述式ⅴ所示炔烃化合物投料摩尔用量为所述式ⅳ所示炔丙基溴类化合物的1.2-2倍;当制备所述式ⅰ所示化合物时,优选1.2倍或1.5倍,当制备所述式ⅱ和式ⅲ所示化合物时,优选1.2倍。
上述方法中,所述催化剂的投料摩尔用量为所述式ⅳ所示炔丙基溴类化合物的10%-20%,优选20%。
上述方法中,所述碱的投料摩尔用量为所述式ⅳ所示炔丙基溴类化合物的1.0-1.5倍,优选1.0倍。
上述方法中,所述反应在溶剂中进行,所述溶剂选自下述至少一种:1,2-二氯乙烷,n,n-二甲基甲酰胺或n.n-二甲基乙酰胺,优选n,n-二甲基乙酰胺。
上述方法中,所述反应在惰性气氛中进行,所述惰性气氛如氮气。
上述方法中,所述反应步骤中,温度为40-60℃,优选40℃;时间为16-20小时,优选16小时,具体反应时间可通过薄层色谱进行检测。
上述方法还包括:在反应完毕后,将反应体系按照常规方法进行分离提纯的步骤。优选的分离方法为:将反应之后的原液转移到分液漏斗中,转移时加适量乙酸乙酯冲洗反应管,以减少转移损失;向分液漏斗中加入适量饱和氯化铵水溶液,以乙酸乙酯萃取三次,合并有机相;用无水硫酸镁进行干燥,过滤;随后浓缩有机相,加入适量100-200目硅胶,干法上柱;用石油醚/乙酸乙酯混合溶液进行洗脱,石油醚/乙酸乙酯的比例视反应物和产物的极性不同而不同,需要通过薄层色谱的结果进行估计,乙酸乙酯的体积分数一般为0-10%。收集包含产物ⅰ,ⅱ或ⅲ的溶液,减压浓缩除去溶剂后真空干燥,称重并计算产率。
对于固体产物,可以通过重结晶的方式来提高纯度,一般重结晶的方法:在样品中加入一定量二氯甲烷,使其恰好完全溶解,再向其中加入不良溶剂正己烷,让其缓缓挥发,可得到产物的单晶。
本发明提供的合成二炔及其类似物的方法,具有以下特点:(1)反应条件温和,产率中等到优秀,金属盐使用量大大减少,更加绿色,对环境更加友好。(2)反应普适性好,同样的条件基于不同底物可以得到1,4-二炔或是不对称1,3-二炔,在特殊底物下,还可用于制备芳基1,n-二炔。
附图说明
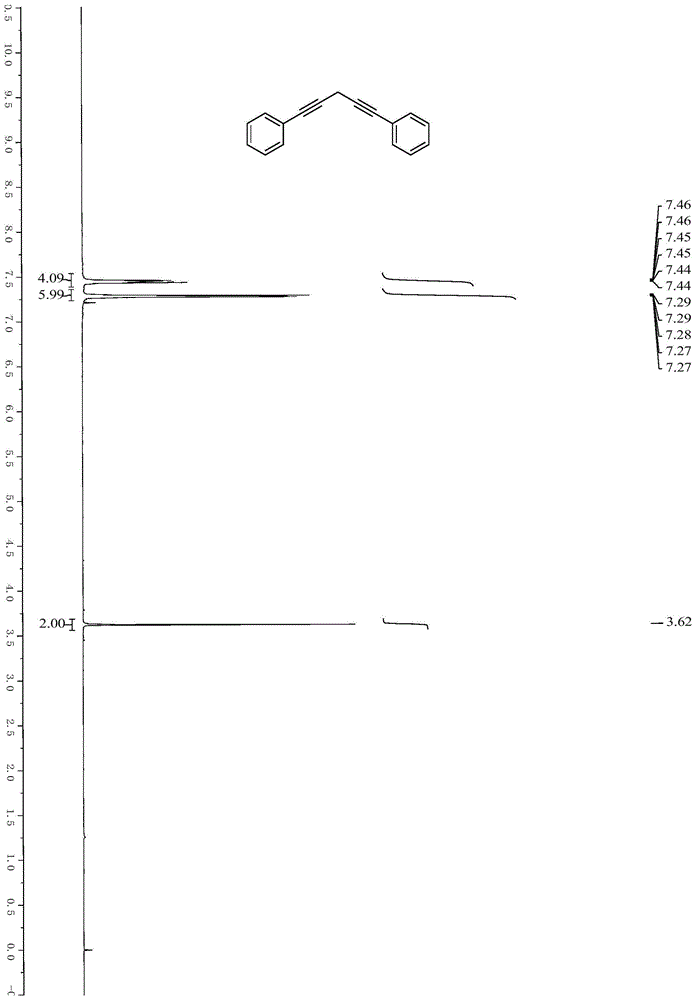
图1为实施例1所得目标产物的核磁共振氢谱图。
图2为实施例1所得目标产物的核磁共振碳谱图。
图3为实施例2所得目标产物的核磁共振氢谱图。
图4为实施例2所得目标产物的核磁共振碳谱图。
图5为实施例6所得目标产物的核磁共振氢谱图。
图6为实施例6所得目标产物的核磁共振碳谱图。
图7为实施例8所得目标产物的核磁共振氢谱图。
图8为实施例8所得目标产物的核磁共振碳谱图。
图9为实施例10所得目标产物的核磁共振氢谱图。
图10为实施例10所得目标产物的核磁共振碳谱图。
图11为实施例11所得目标产物的核磁共振氢谱图。
图12为实施例11所得目标产物的核磁共振碳谱图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此,凡在本发明的精神和原则之内所做的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用的原料(3-溴-1-丙炔基)苯及(3-溴-1-丁炔基)苯可按照下述方法制备得到:将三苯基膦(11mmol)溶解在1,2-二氯乙烷(30ml)中,随后在0℃下逐滴滴加溴素(11mmol),搅拌30min,溶液逐渐由黄色澄清变悬浊。随后将溶有3-苯基-2-丙炔-1-醇(10mmol)或者4-苯基-3-丁炔-2-醇(10mmol)的1,2-二氯乙烷溶液(5ml)逐滴滴加到悬浊液中,随着醇的滴加溶液又逐渐变得澄清,滴加完后此澄清溶液继续在0℃搅拌1h。然后加入环乙烷(60ml),此时会立即析出白色沉淀,然后在室温下再搅拌30min。随后将反应体系过滤并用环己烷洗涤,滤液浓缩后过柱子,纯石油醚即可冲出对应的炔丙基溴,产率90%以上。
下述实施例中所用的原料1-(3-溴-1-丙炔基)-4-甲基苯、1-(3-溴-1-丙炔基)-3-甲基苯、1-(3-溴-1-丙炔基)-2-甲基苯、1-(3-溴-1-丙炔基)-4-氟苯和2-(3-溴-1-丙炔基)噻吩可按照下述方法制备得到:在100ml圆底烧瓶中依次加入磁子,cui(10mg,0.053mmol),对应碘苯(4-甲基碘苯、3-甲基碘苯、2-甲基碘苯、4-氟碘苯、2-碘噻吩)(13.8mmol),并减压干燥。随后加入无水甲苯(14ml),哌啶(3.3ml,33mmol),炔丙醇(1.5ml)和二氯二三苯基膦钯(17mg,0.024mmol)。将反应置于氮气保护中,在35℃下反应14h,随后将反应液通过硅藻土过滤,旋干。然后将得到的粗产物进行柱层析分离,洗脱液为乙酸乙酯:石油醚(3:1),得到对应的炔丙基醇[3-(4-甲基苯基)-2-丙炔-1-醇、3-(3-甲基苯基)-2-丙炔-1-醇、3-(2-甲基苯基)-2-丙炔-1-醇、3-(4-氟苯基)-2-丙炔-1-醇、3-(2-噻吩基)-2-丙炔-1-醇],产率80以上。
将三苯基膦(11mmol)溶解在1,2-二氯乙烷(30ml)中,随后在0℃下逐滴滴加溴素(11mmol),搅拌30min,溶液逐渐由黄色澄清变悬浊。随后将溶有对应的炔丙基醇[3-(4-甲基苯基)-2-丙炔-1-醇、3-(3-甲基苯基)-2-丙炔-1-醇、3-(2-甲基苯基)-2-丙炔-1-醇、3-(4-氟苯基)-2-丙炔-1-醇、3-(2-噻吩基)-2-丙炔-1-醇](10mmol)的1,2-二氯乙烷溶液(5ml)逐滴滴加到悬浊液中,随着醇的滴加溶液又逐渐变得澄清,滴加完后此澄清溶液继续在0℃搅拌1h。然后加入环乙烷(60ml),此时会立即析出白色沉淀,然后在室温下再搅拌30min。随后将反应体系过滤并用环己烷洗涤,滤液浓缩后过柱子,纯石油醚即可冲出对应的炔丙基溴,产率90%以上。
实施例1、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色固体146.9mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率68%。图1和图2为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例2、合成1,5-二对甲基苯基-1,4-戊二炔
依次称取104.5mg1-(3-溴-1-丙炔基)-4-甲基苯(0.5mmol)、87mg对甲基苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色固体192.7mg,目标产物1,5-二对甲基苯基-1,4-戊二炔的分离产率83%。图3和图4为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例3、合成1,5-二邻甲基苯基-1,4-戊二炔
依次称取104.5mg1-(3-溴-1-丙炔基)-2-甲基苯(0.5mmol)、87mg2-甲基苯乙炔
(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体209.8mg,目标产物1,5-二邻甲基苯基-1,4-戊二炔的分离产率89%。
实施例4、合成1,5-二间甲基苯基-1,4-戊二炔
依次称取104.5mg1-(3-溴-1-丙炔基)-3-甲基苯(0.5mmol)、87mg3-甲基苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体214.7mg,目标产物1,5-二间甲基苯基-1,4-戊二炔的分离产率93%。
实施例5、合成1,5-二(4-氟-苯基)-1,4-戊二炔
依次称取106.5mg1-(3-溴-1-丙炔基)-4-氟苯(0.5mmol)、90mg4-氟苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到白色固体168.8mg,目标产物1,5-二(4-氟-苯基)-1,4-戊二炔的分离产率70%。
实施例6、合成3-甲基-1-(3-甲基苯基)-5-苯基-1,4-戊二炔
依次称取104.5mg(3-溴-1-丁炔基)苯(0.5mmol)、69.6mg3-甲基苯乙炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体222mg,目标产物3-甲基-1-(3-甲基苯基)-5-苯基-1,4-戊二炔的分离产率91%。图5和图6为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例7、合成1,5-二(2-噻吩)-1,4-戊二炔
依次称取100.5mg2-(3-溴-1-丙炔基)噻吩(0.5mmol)、81.1mg2-乙炔基噻吩(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体132.4mg,目标产物1,5-二(2-噻吩)-1,4-戊二炔的分离产率58%。
实施例8、合成1-苯基-1,3-己二炔
依次称取74mg1-溴-2-戊炔(0.5mmol)、61.2mg苯乙炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用石油醚/乙酸乙酯(100/0-95/5)做洗脱剂进行柱分离,得到无色油状液体139.6mg,目标产物1-苯基-1,3-己二炔的分离产率82%。图7和图8为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例9、合成1-(4-氟苯基)-1,3-己二炔
依次称取74mg1-溴-2-戊炔(0.5mmol)、72mg4-氟苯乙炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用石油醚/乙酸乙酯(100/0-95/5)做洗脱剂进行柱分离,得到无色油状液体171.3mg,目标产物1-(4-氟苯基)-1,3-己二炔的分离产率92%。
实施例10、合成1,6-二苯基-1,3-己二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、69.6mg3-苯基-1-丙炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体179.4mg,目标产物1,6-二苯基-1,3-己二炔的分离产率78%。图9和图10为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例11、合成3-甲基-1,6-二苯基-1,5-己二炔
依次称取104.5mg(3-溴-1-丁炔基)苯(0.5mmol)、69.6mg3-苯基-1-丙炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体170.8mg,目标产物3-甲基-1,6-二苯基-1,5-己二炔的分离产率75%。图11和图12为该实施例制备所得产品的核磁共振氢谱和碳谱,由图可知,该化合物结构正确。
实施例12、合成3-甲基-1,7-二苯基-1,6-庚二炔
依次称取104.5mg(3-溴-1-丁炔基)苯(0.5mmol)、78mg4-苯基-1-丁炔(0.6mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离,得到淡黄色油状液体175.7mg,目标产物3-甲基-1,7-二苯基-1,6-庚二炔的分离产率73%。
实施例13、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,60℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离。得到淡黄色固体77.7mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率54%。
对比例1、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml1,2-二氯乙烷。在氮气条件下将封管密封,100℃下搅拌16小时。反应结束后用纯石油醚做洗脱剂进行柱分离,得到淡黄色固体99mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率46%。
对比例2、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、69mgk2co3(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml1,2-二氯乙烷。在氮气条件下将封管密封,100℃下搅拌16小时。反应结束后用纯石油醚做洗脱剂进行柱分离,得到淡黄色固体73mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率30%。
对比例3、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、87mgk2hpo4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,40℃下搅拌16小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离。得到淡黄色固体103.7mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率48%。
对比例4、合成1,5-二苯基-1,4-戊二炔
依次称取97.5mg(3-溴-1-丙炔基)苯(0.5mmol)、76.5mg苯乙炔(0.75mmol)、14.4mgcubr(0.1mmol)、106mgk3po4(0.5mmol)于含磁性搅拌子的25ml封管中,加入2.5ml氮氮二甲基乙酰胺。在氮气条件下将封管密封,60℃下搅拌6小时。反应结束后加入饱和氯化铵溶液,乙酸乙酯萃取3次,合并有机相,干燥浓缩后用纯石油醚做洗脱剂进行柱分离。得到淡黄色固体77.7mg,目标产物1,5-二苯基-1,4-戊二炔的分离产率36%。
- 还没有人留言评论。精彩留言会获得点赞!