一种高产单鼠李糖脂的基因改造方法及其应用与流程
本发明涉及生物工程技术领域和鼠李糖脂生产应用领域,具体为用于铜绿假单胞菌高产单鼠李糖脂的基因改造方法,解决了现有方法通过异源表达rhlab基因合成单鼠李糖脂产量低和从常规鼠李糖脂产物中提取分离单鼠李糖脂操作繁琐等技术问题,为单鼠李糖脂的应用与研究奠定基础。
背景技术:
鼠李糖脂是主要由铜绿假单胞菌代谢合成的一种生物表面活性剂,因其表/界面活性高、安全无毒、临界胶束浓度低、可生物降解、稳定性高等优势,广泛应用于石油开采、环境污染修复、医药、食品、农业生防控制、堆肥等领域。鼠李糖脂是一系列同系物,由1到2个鼠李糖基和1到2个饱和或不饱和的不同碳链长度的脂肪酸链组成。据报道已发现的不同结构的鼠李糖脂分子有近60种。
根据鼠李糖脂分子中鼠李糖基的个数多少,将鼠李糖脂分为单鼠李糖脂和双鼠李糖脂。鼠李糖脂所含鼠李糖基的个数必然影响其理化活性,即单鼠李糖脂和双鼠李糖脂存在活性差异,应用潜力也不同。研究表明单鼠李糖脂与双鼠李糖脂相比具有更好的亲油特性和乳化活性。这使得单鼠李糖脂在提高疏水性有机污染物的生物可利用性、乳化携带驱油、石油乳化降粘等方面具有很大的应用优势。因此,单鼠李糖脂的生产制备具有重要应用价值。
现有技术方法通过将铜绿假单胞菌中合成单鼠李糖脂的鼠李糖脂合成酶ⅰ(rhlab)的编码基因rhlab在大肠杆菌等宿主中异源表达,虽然可以实现单鼠李糖脂的合成,但是单鼠李糖脂产量很低,约几百毫克每升。从野生型铜绿假单胞菌的鼠李糖脂产物中提取分离单鼠李糖脂操作繁琐、费时费力。如果敲除铜绿假单胞菌中催化单鼠李糖脂合成双鼠李糖脂的鼠李糖脂合成酶ⅱ(rhlc)的编码基因rhlc,将会使鼠李糖脂合成途径终止在单鼠李糖脂,将能够解决上述瓶颈问题。本发明以敲除rhlc基因的铜绿假单胞菌为生产菌,既实现了合成的鼠李糖脂全部为单鼠李糖脂,又实现了高产单鼠李糖脂,为单鼠李糖脂的应用与研究奠定了基础。
技术实现要素:
本发明的目的在于提供一种用于铜绿假单胞菌高产单鼠李糖脂的基因改造方法,有利于解决现有方法通过异源表达rhlab基因合成单鼠李糖脂产量低和从常规鼠李糖脂产物中提取分离单鼠李糖脂操作繁琐等技术问题,为单鼠李糖脂的应用与研究奠定基础。采用该方法可以定向、高效地构建高产单鼠李糖脂的铜绿假单胞菌工程菌。
为实现上述目的,本发明采用的技术方案为:
一种高产单鼠李糖脂的基因改造方法,该方法是以铜绿假单胞菌为出发菌株,以催化单鼠李糖脂合成双鼠李糖脂的鼠李糖脂合成酶ⅱ(rhlc)的编码基因rhlc为改造目标;包括以下主要步骤:1)根据铜绿假单胞菌的rhlc基因序列设计pcr引物;2)以铜绿假单胞菌基因组dna为模板,pcr扩增rhlc基因,克隆到pmd系列载体中,构建重组质粒pmd-rhlc;3)根据rhlc基因序列内部特有的酶切位点,酶切rhlc基因序列内部,纯化自连,构建rhlc基因内部序列缺失的新质粒pmd-∆rhlc;4)通过双酶切方法将∆rhlc片段插入到质粒pk18mobsacb中构建打靶质粒pk18-∆rhlc;5)打把质粒pk18-∆rhlc导入到铜绿假单胞菌内,在筛选压力作用下,质粒pk18-∆rhlc与铜绿假单胞菌染色体基因发生二次同源重组,获得敲除rhlc基因的铜绿假单胞菌敲除菌株;6)铜绿假单胞菌敲除菌株发酵生产验证,利用hplc-ms方法验证单鼠李糖脂产物,利用排油圈法测定单鼠李糖脂产量。
步骤1)所设计的铜绿假单胞菌的rhlc基因的pcr引物为c-f和c-r,引物序列如下
c-f:5'-ccgaagcttatgagcggcctgttccact-3',seqidno:1
c-r:5'-cttggaattcccggaagctacggacg-3'seqidno:2
上下游引物中分别引入在rhlc基因序列中没有、且在pk18mobsacb的多克隆位点(mcs)中含有的酶切位点(引物中划线部分),hindⅲ和ecorⅰ。
步骤2)pcr扩增rhlc基因的反应体系:10×pcrbuffer2.5μl,2.5mm的dntpmixture2μl,10μm的c-f和c-r引物各0.8μl,extaqpolymerase0.125μl,铜绿假单胞菌基因组dna1μl,补充pcr水至总体系25μl;反应条件:95℃预变性3min,35个循环:94℃变性1min、56℃退火30s、72℃延伸1min30s,72℃10min;pcr产物经1.2%琼脂糖电泳、试剂盒切胶纯化后,rhlc基因片段与pmd系列(18/19/20)tsimple载体进行at连接,构建重组质粒pmd-rhlc。
步骤3)利用限制性内切酶salⅰ试剂盒酶切质粒pmd-rhlc的rhlc基因内部序列,酶切产物经1.2%琼脂糖电泳、试剂盒切胶纯化后,自连,得到rhlc基因内部缺失400~500bp序列的新质粒pmd-∆rhlc。
步骤4)利用限制性内切酶hindⅲ和ecorⅰ试剂盒,双酶切质粒pmd-∆rhlc和铜绿假单胞菌的自杀性质粒pk18mobsacb,∆rhlc片段和pk18mobsacb质粒的双酶切产物经1.2%琼脂糖电泳、试剂盒切胶纯化后,连接,构建打靶质粒pk18-∆rhlc。
步骤5)打把质粒pk18-∆rhlc先转化到大肠杆菌s17-1感受态细胞中,构建重组大肠杆菌s17-1(pk18-∆rhlc),再通过接合转移方法将质粒pk18-∆rhlc导入到铜绿假单胞菌内;在氨苄青霉素、卡那霉素和蔗糖的筛选压力作用下质粒pk18-∆rhlc与铜绿假单胞菌染色体rhlc基因的同源序列发生二次同源重组,缺失内部序列的∆rhlc基因片段替换掉染色体上的rhlc基因,筛选获得rhlc基因被破坏的铜绿假单胞菌敲除菌株。
步骤6)铜绿假单胞菌敲除菌株经摇瓶发酵4~10天;收集0.2~1l无菌体发酵上清液,利用0.6~3l的乙酸乙酯萃取发酵液中鼠李糖脂产物,提取物溶解于10%乙腈水中,鼠李糖脂浓度300~1000mg/l,样品经0.45μm有机滤膜过滤;hplc-ms的相关参数:进样量5μl,乙腈水溶液线性梯度洗脱(10%乙腈水1min,乙腈的体积分数30min内从10%升到60%,60%乙腈20min,乙腈的体积分数5min内由60%降到10%),0.6ml/min流速,流出物经1:1分流后进入质谱系统,离子源温度120℃,负离子模式检测,质谱扫描范围50~1000m/z。取10μl的稀释10~100倍的发酵液滴在油膜上,根据排油圈直径与鼠李糖脂浓度的线性关系和发酵液的稀释倍数计算单鼠李糖脂产量。
发酵培养基配方为甘油30~60g,nano33~6g,酵母粉0.5~1.5g,kh2po43~5g,k2hpo43~5g,mgso40.4~1.0g,氯化钠0.5~2g去离子水1l。培养温度30~40℃、转速160~220rpm。
本发明进一步公开了用于高产单鼠李糖脂的基因改造方法在铜绿假单胞菌的基因改造和鼠李糖脂的生产、开发利用方面的应用,实验结果显示:本发明方法能够定向改造铜绿假单胞菌菌株,改造效率高、目标明确;利用本发明方法改造的铜绿假单胞菌敲除菌株合成的鼠李糖脂产物全部为单鼠李糖脂,并且产量高。
本发明主要解决了通过现有方法异源表达铜绿假单胞菌rhlab基因合成单鼠李糖脂产量很低,从常规鼠李糖脂产物中提取分离单鼠李糖脂操作繁琐、费时费力等问题。本发明以铜绿假单胞菌为出发菌株,以催化单鼠李糖脂合成双鼠李糖脂的鼠李糖脂合成酶ⅱ(rhlc)的编码基因rhlc为改造目标,获得鼠李糖脂产物全部为单鼠李糖脂的铜绿假单胞菌敲除菌株,主要的难点在于含rhlc基因上下游同源序列打靶质粒的构建。
本发明公开的一种高产单鼠李糖脂的基因改造方法的有益效果在于:
利用该方法改造铜绿假单胞菌,目标性强、改造效率高、工程菌稳定性好;利用本发明方法构建的铜绿假单胞菌敲除菌株,在不影响鼠李糖脂产量的同时,还能使合成的鼠李糖脂产物全部为单鼠李糖脂,从而实现高产单鼠李糖脂,为单鼠李糖脂的研究与应用奠定方法基础。
附图说明
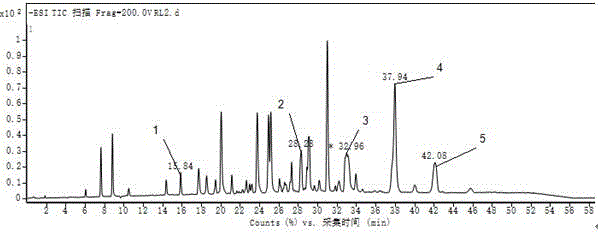
图1为实施例2中铜绿假单胞菌敲除菌株的鼠李糖脂产物hplc-ms分析结果;
图中出现的鼠李糖脂产物色谱峰信息如下表所示:
图2为实施例3中不同基因工程菌的单鼠李糖脂产量。
具体实施方式
结合下述具体实施例对本发明进行详细的说明,使本领域的普通技术人员更全面的理解本发明,但不以任何方式限制本发明。在如下实施例中,如无特殊说明,所用的材料和试剂均可从生化试剂材料公司购买到。
实施例1
本实施例中用于构建rhlc基因敲除的铜绿假单胞菌工程菌的培养基如下:
液体lb培养基:蛋白胨10g,酵母粉5g,nacl10g,去离子水1l,ph7.0。
lb琼脂培养基:蛋白胨10g,酵母粉5g,nacl10g,琼脂18g,去离子水1l,ph7.0。
1)铜绿假单胞菌的rhlc基因的pcr引物设计
从ncbi数据库中下载铜绿假单胞菌的rhlc基因序列,genbank序列号分别为:ae004091.2,cp000438.1,cp002496.1。根据下载的铜绿假单胞菌rhlc基因序列,利用primerpremier5软件设计rhlc基因的pcr引物,所设计的铜绿假单胞菌rhlc基因的pcr引物序列如下c-f:5'-ccgaagcttatgagcggcctgttccact-3',seqidno:1
c-r:5'-cttggaattcccggaagctacggacg-3',seqidno:2
上下游引物中分别引入在rhlc基因序列中没有、且在pk18mobsacb的多克隆位点(mcs)中含有的酶切位点(引物中划线部分),hindⅲ和ecorⅰ。
2)pcr扩增rhlc基因
取10ml的lb液体培养基在37℃、180rpm条件下培养鼠李糖脂高产菌株铜绿假单胞菌sg,培养12h后,取2ml培养液离心(10,000rpm,2min)收集菌体,利用细菌基因组提取试剂盒提取铜绿假单胞菌sg的基因组dna。以铜绿假单胞菌sg的基因组dna为模板,pcr扩增rhlc基因。反应体系:10×pcrbuffer2.5μl,2.5mm的dntpmixture2μl,10μm的c-f和c-r引物各0.8μl,extaqpolymerase0.125μl,铜绿假单胞菌sg基因组dna1μl,补充pcr水至总体系25μl;反应条件:95℃预变性3min,35个循环:94℃变性1min、56℃退火30s、72℃延伸1min30s,72℃10min。
3)构建重组质粒pmd-rhlc
pcr产物经1.2%琼脂糖电泳后,利用凝胶纯化试剂盒切胶纯化rhlc基因片段;利用extaq聚合酶pcr扩增后rhlc基因片段上的末端a碱基与pmd19-tsimple载体末端的t碱基进行at连接;连接液42℃热激60s转化大肠杆菌dh5α感受态细胞,转化液涂布含100mg/l氨苄青霉素的lb琼脂培养基平板,37℃培养18h;挑取阳性转化子接种到10ml含100mg/l氨苄青霉素的lb液体培养基中,在37℃、180rpm条件下培养12h,取4ml培养液离心(10,000rpm,2min)收集菌体,利用质粒提取试剂盒提取重组质粒pmd-rhlc。
4)构建rhlc基因内部序列缺失的新质粒pmd-∆rhlc
经序列分析rhlc基因内部存在2个salⅰ酶切位点,利用限制性内切酶salⅰ试剂盒酶切质粒pmd-rhlc,从rhlc基因内部切下493bp的序列,酶切后的pmd-rhlc片段经1.2%琼脂糖电泳后,利用凝胶纯化试剂盒切胶纯化pmd-rhlc酶切片段,利用t4dna连接酶使pmd-rhlc酶切片段自连,构建rhlc基因内部缺失493bp序列的新质粒pmd-∆rhlc;连接液42℃热激60s转化大肠杆菌dh5α感受态细胞,转化液涂布含100mg/l氨苄青霉素的lb琼脂培养基平板,37℃培养18h;挑取阳性转化子接种到10ml含100mg/l氨苄青霉素的lb液体培养基中,在37℃、180rpm条件下培养12h,取4ml培养液离心(10,000rpm,2min)收集菌体,利用质粒提取试剂盒提取重组质粒pmd-∆rhlc。
5)构建打靶质粒pk18-∆rhlc
利用限制性内切酶hindⅲ和ecorⅰ试剂盒,双酶切质粒pmd-∆rhlc和铜绿假单胞菌的自杀性质粒pk18mobsacb,∆rhlc片段和pk18mobsacb质粒的双酶切产物经1.2%琼脂糖电泳后,利用凝胶纯化试剂盒切胶纯化,利用t4dna连接酶连接纯化片段,构建打靶质粒pk18-∆rhlc;连接液42℃热激60s转化大肠杆菌dh5α感受态细胞,转化液涂布含100mg/l氨苄青霉素的lb琼脂培养基平板,37℃培养18h;挑取阳性转化子接种到10ml含50mg/l卡那霉素的lb液体培养基中,在37℃、180rpm条件下培养12h,取4ml培养液离心(10,000rpm,2min)收集菌体,利用质粒提取试剂盒提取重组质粒pk18-∆rhlc。
6)打把质粒pk18-∆rhlc导入到铜绿假单胞菌,筛选敲除rhlc基因的铜绿假单胞菌敲除菌株
打把质粒pk18-∆rhlc先42℃热激60s转化到大肠杆菌s17-1感受态细胞中,转化液涂布含50mg/l卡那霉素的lb琼脂培养基平板,37℃培养18h,筛选重组大肠杆菌s17-1(pk18-∆rhlc);将重组大肠杆菌s17-1(pk18-∆rhlc)与铜绿假单胞菌菌悬液以1:2比例混合,混合液转移到lb琼脂培养基中37℃培养12h,以接合转移方法将质粒pk18-∆rhlc导入到铜绿假单胞菌内;刮取平板上的菌苔至1ml的lb液体培养基中,稀释5倍,取150μl稀释液涂布含100mg/l氨苄青霉素和350mg/l卡那霉素的双抗lb琼脂平板,37℃培养24h;挑取阳性克隆10个,利用rhlc基因引物进行菌落pcr验证,反应体系和反应条件同“本实施例的2)”中所述,筛选得到单交换子菌株;制备单交换子菌悬液稀释106倍,取稀释液150μl涂布含100mg/l氨苄青霉素和50g/l蔗糖的lb琼脂平板,37℃培养24h,利用质粒pk18-∆rhlc上的蔗糖sacb基因筛选压力,诱导发生二次重组;挑取阳性克隆10个,利用rhlc基因引物进行菌落pcr验证,筛选敲除掉rhlc基因的铜绿假单胞菌敲除菌株sg∆rhlc。结果充分显示了本发明作为改造铜绿假单胞菌rhlc基因方法的高效性和可行性。
实施例2
应用本发明实施例1中的铜绿假单胞菌敲除菌株sg∆rhlc为发酵菌株,本实施例中所用的培养基如下:
液体lb培养基:蛋白胨10g,酵母粉5g,nacl10g,去离子水1l,ph7.0。
发酵培养基:甘油45g,nano33g,酵母粉1g,kh2po43g,k2hpo43g,mgso40.5g,氯化钠1g,去离子水1l,ph6.8。
取铜绿假单胞菌敲除菌株sg∆rhlc接种到10ml的lb液体培养基在37℃、180rpm条件下培养12h制备种子液,取种子液1ml接种到含有120ml发酵培养基的三角瓶中,设置5个平行实验,在37℃、180rpm条件下培养5d。
收集600ml的发酵液10,000rpm离心10min,去除菌体细胞,利用2mol/l的hcl溶液调整上清液ph至2.0;利用等体积(600ml)乙酸乙酯萃取上清液3次,收集有机相置于真空旋转蒸发仪(50℃,60rpm)中,得到浅黄色粘稠物体即为发酵液中鼠李糖脂的提取物。
鼠李糖脂提取物溶解于10%乙腈水中,鼠李糖脂浓度500mg/l,样品经0.45μm有机滤膜过滤后进行hplc-ms分析。hplc-ms的相关参数:进样量5μl,乙腈水溶液线性梯度洗脱(10%乙腈水1min,乙腈的体积分数30min内从10%升到60%,60%乙腈20min,乙腈的体积分数5min内由60%降到10%),0.6ml/min流速,流出物经1:1分流后进入质谱系统,离子源温度120℃,负离子模式检测,质谱扫描范围50~1000m/z。hplc-ms分析的结果如图1所示。
实施例2的结果(图1)表明,铜绿假单胞菌敲除菌株sg∆rhlc发酵生产的鼠李糖脂产物全部为单鼠李糖脂。结果充分显示了本发明作为铜绿假单胞菌生产单鼠李糖脂的基因改造方法的可靠性。
实施例3
比较不同基因工程菌株的单鼠李糖脂产量,本实施例中所用的培养基如下:
液体lb培养基:蛋白胨10g,酵母粉5g,nacl10g,去离子水1l,ph7.0。
发酵培养基:甘油45g,nano33g,酵母粉1g,kh2po43g,k2hpo43g,mgso40.5g,氯化钠1g,去离子水1l,ph6.8。
取合成单鼠李糖脂的3种基因工程菌,大肠杆菌dh5α(pbbr1-2rhl)、施氏假单胞菌dnb(pbbr1-2rhl)、铜绿假单胞菌sg∆rhlc的甘油管菌种,分别接种到10ml的lb液体培养基中,在37℃、180rpm条件下培养12h制备种子液,分别取种子液1ml接种到含有120ml发酵培养基的三角瓶中,每株菌发酵实验设置3个平行,在37℃、180rpm条件下培养5d。分别从各个三角瓶中取2ml发酵液10,000rpm离心5min,去除菌体细胞;铜绿假单胞菌sg∆rhlc的发酵液上清稀释32倍,大肠杆菌dh5α(pbbr1-2rhl)和施氏假单胞菌dnb(pbbr1-2rhl)的发酵液上清不做稀释处理。
取直径为90mm的培养皿放到毫米坐标纸上,加入30ml蒸馏水,再在培养皿中水面的中央滴20μl的粘度为20mpa∙s原油,在水面上形成一层油膜;取10μl的上述发酵液上清样品溶液滴到油膜中央,记录排油圈直径。根据排油圈直径(y,mm)与单鼠李糖脂浓度(x,mg/l)的线性关系(y=0.0632x+4.6484,r2=0.9939)和发酵液的稀释倍数计算单鼠李糖脂产量,结果如图2所示,利用本发明方法改造的铜绿假单胞菌sg∆rhlc的单鼠李糖脂产量达到15g/l,远超过铜绿假单胞菌rhlab基因异源表达的2株基因工程菌。
实施例3的结果(如图2)表明,利用本发明方法改造rhlc基因的铜绿假单胞菌sg∆rhlc能够高产单鼠李糖脂,有效解决了现有方法异源表达铜绿假单胞菌rhlab基因合成单鼠李糖脂产量低的技术问题。实施例3结果证明了本发明作为铜绿假单胞菌高产单鼠李糖脂的基因改造方法的可靠性和实用性。
sequencelisting
<110>曲阜师范大学
<120>一种高产单鼠李糖脂的基因改造方法及其应用
<160>2
<170>patentinversion3.5
<210>1
<211>28
<212>dna
<213>人工序列
<400>1
ccgaagcttatgagcggcctgttccact28
<210>2
<211>26
<212>dna
<213>人工序列
<400>2
cttggaattcccggaagctacggacg26
- 还没有人留言评论。精彩留言会获得点赞!