一种双通道区分检测GSH和H2Sn(n>1)的荧光探针的制作方法
本发明属于化学分析检测技术领域,具体涉及一种双通道同时区分检测gsh和h2sn(n>1)的荧光探针,以及该探针在检测gsh和h2sn(n>1)中的应用。
背景技术:
活性硫物种(rss)包括谷胱甘肽(gsh)和多硫化氢(h2sn,n>1),在人体的生理和病理过程中发挥着重要的调节作用。gsh作为一种抗氧化剂,可以保护细胞免受有害重金属,过氧化物和自由基引起的损害。它的水平异常会引起一些疾病,如骨质疏松症、心血管疾病和阿尔兹海默症等。h2sn(n>1)在调节各种生理过程(包括激活离子通道,转录因子和肿瘤抑制因子)方面表现出很高的效力。鉴于gsh和h2sn在氧化还原生物学中的重要性,非常需要为这些物种建立方便的检测方法。
荧光探针因其操作方便、无损检测、时空分辨率高等优点,已经成为生物硫醇检测的常用方法。近年来,已开发出多种用于检测gsh和h2sn(n>1)的荧光探针,但鲜有探针能够同时区分检测两者。chen等(analyticalchemistry,2017,89(23),12984-12991)报导了区分检测gsh和h2sn(n>1)的荧光探针,但该荧光探针发射波长较短,在蓝光和绿光区域。红光或近红外光具有很好的组织穿透性、较小的背景干扰性,而大斯托克斯位移能够减少自吸收和自发荧光的干扰以提高检测的灵敏度。目前,开发具有长波长发射和大斯托克斯位移,用于区分检测gsh和h2sn(n>1)的荧光探针仍是挑战。
技术实现要素:
为克服现有技术的不足,本发明目的之一是提供一种灵敏度高、选择性好,并具有红光发射和大斯托克斯位移的区分检测gsh和h2sn(n>1)荧光探针,目的之二是提供其制备方法。
本发明中的荧光探针,其分子结构如下:
本发明中的荧光探针通过以下反应制备,合成过程如下:
具体合成方法如下:将化合物4和化合物8溶于无水二氯甲烷中,再加入1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和4-二甲氨基吡啶。在氮气保护下,室温反应,得到粗产品,用硅胶柱层析进行分离提纯得到橙黄色固体产品,即探针。
本发明的荧光探针的检测机制如下:
荧光探针与gsh反应时,位点1被gsh的巯基取代,发射出绿色荧光。与h2sn反应时,先与探针位点1发生亲核取代反应,接着与位点2发生分子内环化反应,发射红色荧光。
h2s2是最简单的多硫化氢物质,且h2s2与其他多硫化氢(h2sn,n>2)间存在动态平衡。因此,本实验以h2s2为研究对象,选择na2s2作为h2sn的来源。
本发明的荧光探针为双波长激发型双通道区分检测探针,在检测gsh和na2s2时,需分别设置对应的激发波长。gsh相关测试激发波长设置为430nm,na2s2相关测试设置为560nm。
本发明的荧光探针与gsh反应后最大发射峰在530nm,与na2s2反应后最大发射峰在680nm。
本发明的荧光探针选择性好。探针分子的测试体系为ph为7.4的10mm的pbs缓冲溶液包含1.0mmctab,25℃下测试。在加入1.4倍当量谷胱甘肽(gsh)之后,在最大发射波长530nm处荧光强度增大了3倍。而在加入其它检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)后,荧光几乎没有增加。
本发明的荧光探针选择性好。探针分子的测试体系为ph为7.4的10mm的pbs缓冲溶液包含1.0mmctab,25℃下测试。在加入22倍当量过硫化钠(na2s2)后,在最大发射波长680nm处荧光强度增大了27倍。而在加入其它检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)后,荧光几乎没有增加。
本发明的荧光探针抗干扰能力较强,在其他检测物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)的存在下几乎不影响检测谷胱甘肽(gsh)和过硫化钠(na2s2)的效果。
本发明的荧光探针与分别加入1.4倍当量谷胱甘肽(gsh)作用后,荧光立即增强,在9min达到最大值。加入22倍当量过硫化钠(na2s2)后,荧光立即增强,在30min达到最大值。
本发明的荧光探针可以对谷胱甘肽(gsh)和过硫化钠(na2s2)分别进行定量检测。本发明的荧光探针线性较好,线性相关系数分别为:谷胱甘肽(gsh)r=0.9994,过硫化钠(na2s2)r=0.9945。
本发明的荧光探针具有很好的细胞膜穿透性,可以用于细胞内谷胱甘肽(gsh)和过硫化钠(na2s2)的检测。
本发明所述的探针ph应用范围较宽,从ph=7.0到ph=10.0均可检测。
本发明所述的探针分子对过硫化钠(na2s2)响应后具有红光发射,具有较大斯托克斯位移。斯托克斯位移分别为100nm和120nm。
附图说明
图1为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,与不同浓度谷胱甘肽(gsh)作用后的荧光光谱变化,横坐标为波长,纵坐标为荧光强度。
图2为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与谷胱甘肽(gsh)作用过程中530nm处荧光强度随浓度的线性关系,横坐标为浓度,纵坐标为荧光强度。
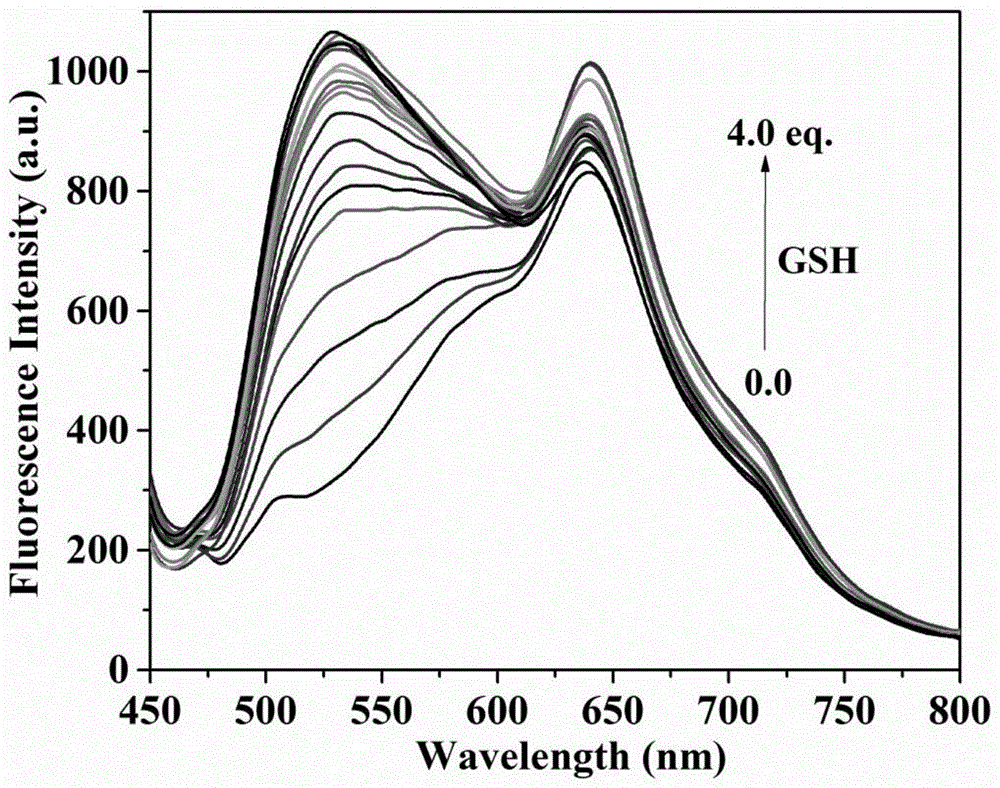
图3为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,与不同浓度过硫化钠(na2s2)作用后的荧光光谱变化,横坐标为波长,纵坐标为荧光强度。
图4为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与过硫化钠(na2s2)作用过程中680nm处荧光强度随时间的线性关系,横坐标为浓度,纵坐标为荧光强度。
图5为本发明的荧光探针的选择性,荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)与gsh和其他分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)作用后的荧光强度比值(iprobe+others/iprobe)柱状图。
图6为本发明的荧光探针的选择性,荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)与na2s2和其他分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)作用后的荧光强度比值(iprobe+others/iprobe)柱状图。
图7为本发明的荧光探针的抗干扰性,谷胱甘肽(gsh)与分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)共存时,与荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与谷胱甘肽(gsh)作用后的荧光强度比值(iprobe+others+gsh/iprobe+gsh)柱状图。
图8为本发明的荧光探针的抗干扰性,过硫化钠(na2s2)与分析物(nacl、kcl、cacl2、zncl2、mgcl2、naclo、na2s2o3、na2so3、nahso3、na2so4、na2s、h2o2、l-pro、l-ser、l-glu、dl-tyr、cys和hcy)共存时,与荧光探针在(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中与过硫化钠(na2s2)作用后的荧光强度比值(iprobe+others+na2s2/iprobe+na2s2)柱状图。
图9为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,探针与谷胱甘肽(gsh)作用过程中530nm处荧光强度随时间的变化,横坐标为时间,纵坐标为荧光强度。
图10为本发明的荧光探针(10.0μm)在pbs缓冲溶液(10mm,ph=7.4,1.0mmctab)中,探针与过硫化钠(na2s2)作用过程中680nm处荧光强度随时间的变化,横坐标为时间,纵坐标为荧光强度。
图11为本发明的荧光探针(10.0μm)在不同ph值的pbs缓冲溶液中,与谷胱甘肽(gsh)作用前后的荧光强度,横坐标为ph,纵坐标为荧光强度。
图12为本发明的荧光探针(10.0μm)在不同ph值的pbs缓冲溶液中,与过硫化钠(na2s2)作用前后的荧光强度,横坐标为ph,纵坐标为荧光强度。
图13为本发明的荧光探针检测raw264.7细胞内谷胱甘肽(gsh)与过硫化钠(na2s2)的共聚焦细胞成像。a1-a3为细胞在37℃时与探针(10.0μm)培育30分钟的成像效果。b1-b3为细胞在37℃时先与过硫化钠(na2s2)(220.0μm)培育15分钟,再与探针(10.0μm)培育30分钟的成像效果。c1-c3为细胞在37℃时先用n-乙基马来酰亚胺(1mm)预处理15分钟,再与探针(10.0μm)培育30分钟的成像效果。
图14为本发明的荧光探针检测raw264.7细胞中内源性过硫化钠(na2s2)的共聚焦细胞成像。a1-a3为细胞在37℃时先用脂多糖(lps)(1μg/ml)孵育8小时,再用nem(1mm)处理15分钟,然后与胱氨酸(200μm)一起孵育30分钟,最后与探针(10.0μm)一起孵育30分钟的成像效果。b1-b3为细胞在37℃时先用nem(1mm)处理15分钟,然后与胱氨酸(200μm)一起孵育30分钟,最后与探针(10.0μm)一起孵育30分钟的成像效果。
具体实施实例
实施例1:化合物2的合成
将间苯二酚(7.707g,70.0mmol)和化合物1(0.979g,3.5mmol)溶于10.0ml乙腈,将混合物在0℃下搅拌5分钟。将亚氯酸钠(1.112g,12.3mmol)和磷酸二氢钠(1.896g,15.8mmol;溶于1.5ml水中)加入到上述混合物中。在0℃下搅拌反应30分钟后,倒入50ml冰水中。用1mol/l盐酸溶液酸化混合物,形成大量黄色沉淀。抽滤洗涤后于真空下干燥,得到0.751g黄褐色固体为化合物2,产率:76.2%。
实施例2:化合物3的合成
将二苯基二硒醚(0.218g,0.7mmol)和硼氢化钠(0.034g,0.9mmol)溶于2.5ml无水乙醇。在氮气保护下,将混合物在室温搅拌反应10分钟,得到化合物3,无色透明溶液。本步产物无需纯化可直接用于下一步合成。
实施例3:化合物4的合成
将化合物2(0.180g,0.6mmol)溶于无水n,n-二甲基甲酰胺(5.0ml),并加入三乙胺(240.0μl,1.8mmol)作为缚酸剂。随后加入化合物3(0.110g,0.7mmol),在室温下搅拌反应20分钟。然后将混合物倒入50ml水中,并用二氯甲烷萃取,保留有机相。减压除去有机溶剂,得到0.243g橙色固体为化合物4,产率98.0%。
实施例4:化合物6的合成
称取化合物5(2.018g,12.6mmol)溶于15.0ml乙酸酐,搅拌均匀后加入丙二腈(1.413g,21.4mmol)。将溶液加热至140℃,反应10小时。反应结束后,使反应液冷却至室温后,加入30.0ml甲醇。升温至50℃搅拌反应30分钟。将反应混合物旋干溶剂,得到粗产物。粗产物用硅胶(100-200目)柱层析纯化,洗脱剂为石油醚/二氯甲烷(体积比:5/1)。得到1.031g橙色固体为化合物6,产率39.3%。
实施例5:化合物8的合成
将化合物6(0.937g,4.5mmol)和化合物7(0.611g,5.0mmol)溶于15.0ml甲苯作溶剂,搅拌均匀后,依次加入600.0μl乙酸和1.5ml哌啶。在氮气保护下,加热反应液至112℃回流,搅拌反应6小时。反应结束后,减压除去溶剂,得到粗产物。粗产物用硅胶(100-200目)柱层析纯化,洗脱剂为二氯甲烷/乙酸乙酯(体积比:10/1)。得到0.600g红色固体为化合物8,产率42.7%。
实施例6:探针的合成
分别称取化合物4(0.835g,2.0mmol)、化合物8(0.687g,2.2mmol)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.421g,2.2mmol)和4-二甲氨基吡啶(0.269g,2.2mmol)溶于5.0ml二氯甲烷。在氮气保护下,室温反应5小时。反应完成后,减压除去溶剂,得粗产物。粗产物用硅胶(100-200目)柱层析纯化,洗脱剂为二氯甲烷/乙酸乙酯(体积比:10/1)。得到0.745g橙色固体为探针,产率52.4%。
实施例7:探针分子检测细胞中半谷胱甘肽(gsh)与过硫化钠(na2s2)的应用
内源性gsh检测:将raw264.7细胞先与含探针(10μm)的pbs缓冲液一起孵育30分钟。用pbs缓冲液清洗细胞3次后,用激光共聚焦荧光显微镜进行细胞荧光成像实验。可以观察到绿色荧光信号,实现细胞内源性gsh的检测。
外源性na2s2检测:将raw264.7细胞先与含na2s2(220μm)的pbs缓冲液一起孵育15分钟。然后用pbs缓冲液漂洗细胞3次,与含探针(10μm)的pbs缓冲液孵育30分钟。用pbs缓冲液漂洗细胞3次,进行细胞荧光成像实验。可以观察到红色荧光信号,实现细胞内na2s2检测。
对照实验:先将raw264.7细胞用含n-乙基马来酰亚胺(nem,1mm)的pbs缓冲液预处理15分钟。随后用pbs缓冲液漂洗细胞3次,再与含探针(10μm)的pbs缓冲液孵育30分钟。最后,用pbs缓冲液漂洗细胞3次,进行细胞荧光成像实验。绿色通道和红色通道均无明显荧光信号。
实施例8:探针分子检测细胞中内源性过硫化钠(na2s2)的应用
内源性na2s2检测:将raw264.7细胞用含1μg/ml脂多糖(lps)的pbs缓冲液一起孵育8小时。然后,将细胞用pbs缓冲液漂洗3次,用含nem(1mm)的pbs缓冲液预处理15分钟。接下来,用pbs缓冲液漂洗细胞3次,与含胱氨酸(200μm)的pbs缓冲液一起孵育30分钟。最后,将细胞用pbs缓冲液漂洗3次,与含探针(10μm)的pbs缓冲液孵育30分钟。用pbs缓冲液漂洗细胞3次后,进行细胞荧光成像实验。可以观察到红色的荧光信号,实现内源性na2s2检测。
对照实验:将细胞先用含nem(1mm)的pbs缓冲液预处理15分钟。然后,用pbs缓冲液漂洗细胞3次,将细胞与含胱氨酸(200μm)的pbs缓冲液一起孵育30分钟。最后,用pbs缓冲液漂洗细胞3次,与含探针(10μm)的pbs缓冲液一起孵育30分钟。用pbs缓冲液漂洗细胞3次后,进行细胞荧光成像实验。无明显荧光信号产生。
- 还没有人留言评论。精彩留言会获得点赞!